2. 南京中医药大学附属医院,南京 210029
2. The Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029
灵菌红素(Prodigiosin)是由粘质沙雷氏菌、放线菌及海洋细菌等微生物产生的一种具有3个吡咯环骨架结构的生物碱类天然红色素[1-4],具有抑菌、免疫抑制、抗肿瘤、抗疟疾等广泛的生理活性[5-7],现已成为抗肿瘤药物研发的重要前体物质,相关药物研究已进入FDA临床Ⅱ期[8]。灵菌红素也广泛应用于传统染织品,具有良好的上染度和色牢度,染色织物对金黄色葡萄球菌和大肠杆菌具有的较高的抑菌率[9-12]。近年来,采用微生物发酵法生产灵菌红素已成为国内外研究的热点[13-14]。在研究过程中,研究人员发现以植物油脂为碳源,可以显著提高灵菌红素的产量,如Giri等[15]以花生粉的油脂加入培养基时,粘质沙雷氏菌产灵菌红素的产率有较显著提高。
中药资源产业化过程中产生的非药用部位及废弃药渣依然含有大量值得开发的资源性物质,任由其丢弃不仅浪费资源,且会导致一系列环境污染等问题。本课题组前期研究显示,在苦参药材生产过程中产生的大量苦参种子资源可作为提取苦参碱类生物碱资源性物质的重要原料,并建立了其提取纯化工艺[16]。但是提取完生物碱类成分的药渣等固废物因缺乏有效利用途径而废弃,造成资源浪费与环境污染[17]。对该类固废物进一步研究显示,其含有较高比例的脂肪油,是具有一定开发潜力的油脂原料。据此,本研究以提取生物碱类成分后所产生的苦参种子固废物油脂为原料,进行发酵生产灵菌红素工艺研究,以期为苦参种子固废物的资源化利用提供科学依据,为苦参资源产业的提质增效提供支撑。
1 材料与方法 1.1 材料筛选培养基((NH4)2SO4 0.03 g/L、尿素0.3 g/L、KH2PO4 0.2 g/L、苦参种子油5 g/L、MgSO4 0.1 g/L)、种子培养基(蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L)、酵母膏蔗糖培养基(酵母膏5 g/L,蔗糖5g/L,KH2PO4 0.2 g/L,NaCl 10 g/L)均为自制,其中(NH4)2SO4、尿素、KH2PO4、MgSO4以及NaCl购自国药集团化学试剂有限公司;蛋白胨、酵母膏、牛肉膏购自南京良纬生物科技有限公司。
苦参种子药渣为采用酸水提取工艺提取生物碱后所得,经烘干、粉碎、过60目筛后,自然压榨法制得种子油。样品置于4℃冰箱保存备用。花生油、橄榄油为市售自然压榨商品,样品置于4℃冰箱保存备用。
Waters ACQUITY UPLC系统(包括四元泵溶剂系统、在线脱气机和自动进样器,美国Waters公司);Waters Q-TOF Premier飞行时间质谱仪(美国Waters公司);BT125型电子天平(赛多利斯科学仪器有限公司);Milli-Q Advantage超纯水系统(美国Millipore公司);KQ-250E型超声波清洗器(昆山禾创超声仪器有限公司);Beckman Coulter Microfuge 16型离心机(美国贝克曼库尔特有限公司)。乙腈为色谱纯,购自德国默克公司;其他化学试剂均为分析纯,购自上海国药化学试剂公司。
1.2 方法 1.2.1 菌株的筛选与鉴定 1.2.1.1 菌株筛选采集自江苏南京某化工厂周边土壤,经过200目过筛,称取1 g土样于100 mL灭菌水中,37℃、120 r/min震荡6 h。混合菌液在以苦参种子油为唯一碳源的选择培养基上进行富集,37℃、培养48 h。吸取1 mL梯度稀释100倍、1 000倍、10 000倍涂布平板后,37℃条件下培养28 h,挑选红色单菌落于LB平板上划线分离纯化,获得单菌落,同时对纯化后的菌株进行液体发酵复筛。
1.2.1.2 菌株的鉴定对复筛后的菌株,进行形态学观察,同时进行16S rDNA鉴定,测序结果在NCBI中进行对比,并利用MEGA7.0软件绘制出该菌株的系统发育树。
1.2.2 斜面培养将菌株划线接种于LB斜面,30℃培养48 h。种子培养:每支斜面加5 mL无菌水,取1 mL接入种子培养基中,转速180 r/min,30℃条件下培养24 h。发酵培养:500 mL三角瓶中装入发酵培养基150 mL,按3%接种量接入种子培养液,转速180 r/min摇床培养。
1.2.3 发酵产物灵菌红素的分析供试品溶液的制备:精密量取发酵液1 mL 12 000 r/min离心分别收集沉淀和上清液。将沉淀和发酵液上清液分别精密加入10 mL和9 mL酸性甲醇(pH 2-3),震荡混匀,静置至沉淀基本无色,4 500 r/min离心5 min,合并提取液静置30 min,经0.22 μm的微孔滤膜滤过,取续滤液作为供试品溶液。
UPLC色谱条件:采用ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),以0.1%甲酸溶液(A)和乙腈(B)为流动相,梯度洗脱:0-12 min,5%-100% B;12-13 min,100%-100% B;13-20 min,100%-5% B。流速0.4 mL/min;柱温30℃;进样体积2 μL。检测波长:535 nm。
Q-TOF-MS/MS质谱条件:ESI+离子化模式;毛细管电压3.0 kV,离子源温度150℃,脱溶剂气温度550℃,脱溶剂气流量1 000 L/h,锥孔气流量50 L/h,碰撞气流量0.15 mL/min。
标准曲线的绘制:精密称取对照品灵菌红素,制成一定浓度的对照品储备液。甲醇稀释成不同浓度的对照品溶液(0.005-0.16 mg/mL),以峰面积为纵坐标Y,对照品溶液浓度为横坐标X,进行线性回归分析,绘制灵菌红素标准曲线。
1.2.4 菌体干重的测定将粘质沙雷氏菌L9接种于LB平板,培养24 h活化。取活化单菌落接种于LB液体培养基,30℃恒温,180 r/min摇瓶培养24 h。分别取发酵液0.5 mL、1 mL、1.5 mL、2 mL、2.5 mL、3 mL至10 mL已知重量的不同离心管中,用于检测吸光度以及菌体干重。用甲醇稀释至10 mL,离心,纯水重悬并再次离心,重复两次,收集沉淀。湿菌体于60℃烘干至恒重,得菌体干重(Dry cell weight,DCW)。将发酵液按照上述步骤离心收集沉淀,纯水稀释在λ600 nm处测试吸光度。
1.2.5 粘质沙雷氏菌L9发酵条件优化 1.2.5.1 发酵时间对菌体生长与灵菌红素产率的影响考察发酵时间对灵菌红素产率的影响,取50 mL酵母膏蔗糖培养基装入250 mL锥形瓶中平行三批次,加入已活化24 h种子液1 mL,以未接种的空白培养基做等量稀释作对照,30℃、180 r/min培养50 h,每隔4 h测定其灵菌红素产量,以发酵时间为横坐标,灵菌红素产量和菌体干重为纵坐标绘制曲线图。
1.2.5.2 不同碳源对灵菌红素产率的影响在酵母膏蔗糖培养基基础上分别选取葡萄糖、甘油、苦参种子油、花生油、橄榄油及可溶性淀粉替代蔗糖作为粘质沙雷氏菌L9发酵培养基的碳源,每种碳源添加5 g/L、10 g/L的浓度,平行三批次对碳源进行筛选,测量各发酵液的灵菌红素含量。
1.2.5.3 不同氮源对灵菌红素产率的影响在已优化的单因素基础上,分别选取牛肉膏、酵母膏、尿素及硫酸铵作为粘质沙雷氏菌L9发酵培养基的氮源,每种氮源添加5 g/L、10 g/L的浓度,平行三批次对氮源进行筛选,测量各发酵液的灵菌红素含量。
1.2.5.4 不同发酵温度对灵菌红素产率的影响在已优化的单因素基础上,选取28℃、30℃、32℃、34℃及37℃为L9菌株的发酵温度,测量灵菌红素的产量和菌体干重。
1.2.5.5 金属离子对对灵菌红素产率的影响在已优化的单因素基础上,分别选择Mg2+、Ca2+、Fe2+、Cu2+及Zn2+作为考察因素,测量不同浓度金属离子对于灵菌红素产量的影响。
2 结果 2.1 菌株筛选及鉴定从江苏南京某化工厂周边土壤中筛选得到5株能以苦参种子油为唯一碳源生长的菌株,其中1株(L9)长势最佳,挑选该菌株开展后续研究。
将L9菌株接种于LB培养基上30℃培养2 d,其在培养基上呈流动状蔓延,末端形成树杈状蔓延形状,并将培养基染成红色。该红色菌体生长迅速,24 h后菌落为圆形,表面湿润粘稠,有特殊臭味。通过将L9菌株的16 S rDNA基因序列与NCBI中已知的近源菌株进行多序列比对,利用MEGA7.0绘制系统发育树(图 1),结合形态特征,最终将L9菌株鉴定为粘质沙雷氏菌(Serratia marcescens L9),保藏于中国典型培养物保藏中心(CCTCC NO:M 2018694)。
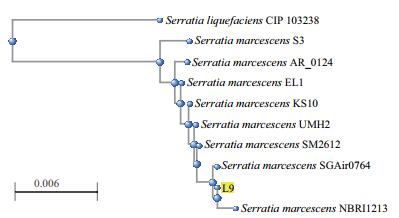
|
| 图 1 Serratia marcescens L9 16S rDNA 进化树分析 |
利用UPLC-Q-TOF-MS/MS对纯化后的发酵产物进行定性分析,结果(图 2)显示,其质谱分子量信息(324.2022)、碎片信息与文献报道预测值(324.2070)、碎片信息一致[18-19],可确定该样品为灵菌红素(Prodigiosin)。
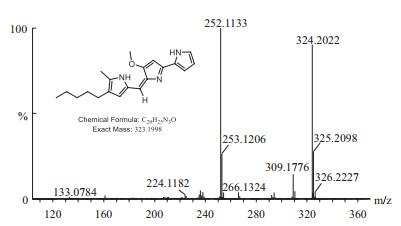
|
| 图 2 灵菌红素Q-TOF-MS/MS图谱 |
按1.2.3方法制备系列浓度的对照品溶液进样测定,并进行线性回归分析,计算相关系数。得回归方程为y=8.49×106 x-1.02×104,R2= 0.999 9(图 3-A),线性范围0.005-0.16 mg/mL。

|
| 图 3 线性关系考察 |
精密度试验:取灵菌红素对照品溶液,在上述色谱条件下重复进样6次,以其峰面积的相对标准偏差(RSD)来计算其精密度。结果显示灵菌红素的峰面积RSD为3.2%,表明该方法精密度良好。
重复性试验:按照1.2.3供试品溶液制备方法,取同一发酵样品制备供试品溶液平行6组,经检测分析,计算其含量及RSD。结果显示灵菌红素含量的RSD为2.1%,表明该方法重复性良好。
稳定性试验:取重复性试验中的一份供试品溶液,分别于0、4、8、12、24、48 h时注入液相色谱仪,计算灵菌红素峰面积,结果显示峰面积RSD为1.7%,表明供试品溶液在48 h内稳定性良好。
2.3.3 加样回收率试验取已知含量的灵菌红素粗品0.1 g,分别按已知含量的80%、100%、120%三个水平加入对照品,按1.2.3项下供试品溶液制备方法制备供试品溶液,注入液相色谱仪测定,计算加样回收率。结果显示灵菌红素的平均回收率为98.27%,RSD为2.9%,表明本方法准确性较好。
2.4 粘质沙雷氏菌L9菌体干重标准曲线的测定将菌体干重与吸光值OD600进行回归分析,结果显示(图 3-B)在0.235-0.795区间呈现良好的线性关系(y=3.306 x+0.599 2,R2=0.999 3)。
2.5 粘质沙雷氏菌L9发酵条件优化 2.5.1 发酵时间对菌体生长与灵菌红素产率的影响粘质沙雷氏菌L9菌株用酵母膏蔗糖培养基摇瓶发酵,以发酵时间为横坐标,灵菌红素产量和菌体干重为纵坐标绘制曲线图。结果(图 4)显示,30℃恒温,180 r/min培养下,菌株于接种后10 h左右进入对数生长期,于28-36 h达到最大值并进入稳定期,38 h后进入衰亡期。处于对数生长期时的菌体灵菌红素产量较低,菌体进入稳定期后大量合成,于38 h接种后达到最大值约为74.4 mg/L,超过42 h灵菌红素含量开始降低。
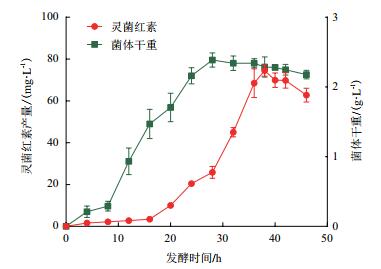
|
| 图 4 粘质沙雷氏菌L9菌株时间-生长曲线与灵菌红素产量 |
如图 5-A所示,增加蔗糖、甘油、花生油、橄榄油和苦参种子油均能提高灵菌红素产量,其中以添加苦参种子油的产率最高。添加苦参种子油到10 g/L时灵菌红素的产量可达到76.34 mg/L。

|
| 图 5 碳源、氮源、温度及金属元素对灵菌红素产量的影响 |
如图 5-B所示,L9菌株在牛肉膏做为氮源下能大量合成灵菌红素,当牛肉膏添加量为5-10 g/L时灵菌红素产量为40.64 g/L,酵母膏、蛋白胨作为氮源灵菌红素合成量较少,以硫酸铵或尿素为唯一氮源的情况下,L9菌株不能产生灵菌红素,生长基本停滞。
2.5.4 不同发酵温度对灵菌红素产率的影响如图 5-C所示,L9菌株在28℃时菌体干重最高,菌体生长最适宜。30℃时菌体干重略有下降但灵菌红素产量最高,温度高于32℃时菌体干重和灵菌红素产量逐渐降低,当温度达到37℃时灵菌红素的合成受到严重抑制。
2.5.5 金属离子对对灵菌红素产率的影响如图 5-D所示,L9菌株在镁离子和钙离子做为金属离子时可大量合成灵菌红素,且当钙离子浓度为0.25 g/L时灵菌红素产量达到最大值约为162.11 mg/L;亚铁离子、锌离子和锰离子为金属离子添加时灵菌红素合成量少,L9菌株几乎不能产生灵菌红素,生长基本停滞。
2.6 响应面法优化发酵培养基根据上述单因素试验结果,选择苦参种子油、牛肉膏和氯化钙做爬坡试验。苦参种子油浓度对灵菌红素产量的影响结果(图 6-A)表明,灵菌红素的产量随着苦参种子油的添加量增加而增高,并在10 g/L时达到最大,之后产量开始下降;牛肉膏浓度对灵菌红素产量的影响结果(图 6-B)表明,灵菌红素的产量随着牛肉膏的添加量增加而增高,并在5-10 g/L时达到最大,之后产量开始下降。氯化钙浓度对灵菌红素产量的影响结果(图 6-C)表明,灵菌红素的产量随着氯化钙的添加量增加而增高,并在0.25-0.5 g/L时达到最大,之后产量开始下降。

|
| 图 6 不同浓度苦参种子油、牛肉膏、氯化钙对灵菌红素产量的影响 |
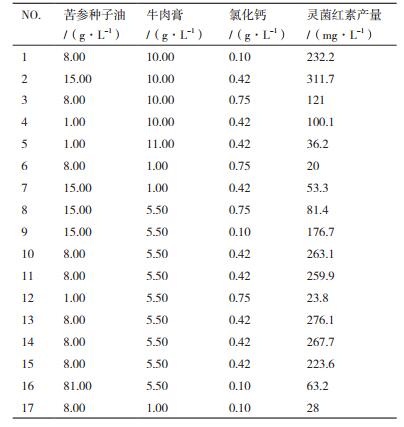
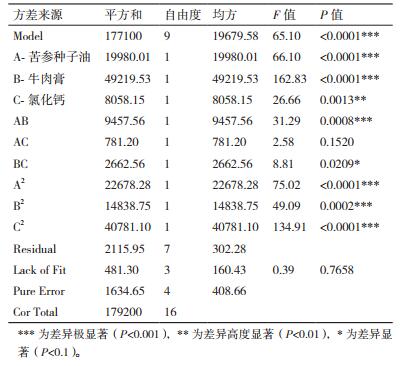
考察因素确定后,采用Design-Expert8.0.6中Box-Behnken法设计因素17组试验(表 1),结果见表 2。
通过Design-Expert8.0.6软件对表 2中的试验数据进行分析,经拟合得到L9菌株灵菌红素产量的多元回归模型:灵菌红素=258.08+49.98A+78.44B-31.74C+48.62AB-13.97AC-25.80BC-73.39A2-59.37B2-98.42C2。
回归模型的分析结果如表 3所示,整个模型的P < 0.001,表明该回归方程成立。失拟项值为0.765 8,大于0.05,不显著,表明此回归模型与试验数据拟合度高,试验误差小,可用该模型分析并预测L9发酵培养基中各主要因子对灵菌红素产量的影响。方差检验显示一次项中苦参种子油和牛肉膏的影响极为显著,氯化钙为高度显著。二次项均是极为显著,交互项中AB高度显著,BC为显著,表明各因素之间存在着交互作用。
对此回归模型进一步利用软件分析,可得各个因素相互作用的响应面立体图,见图 7。
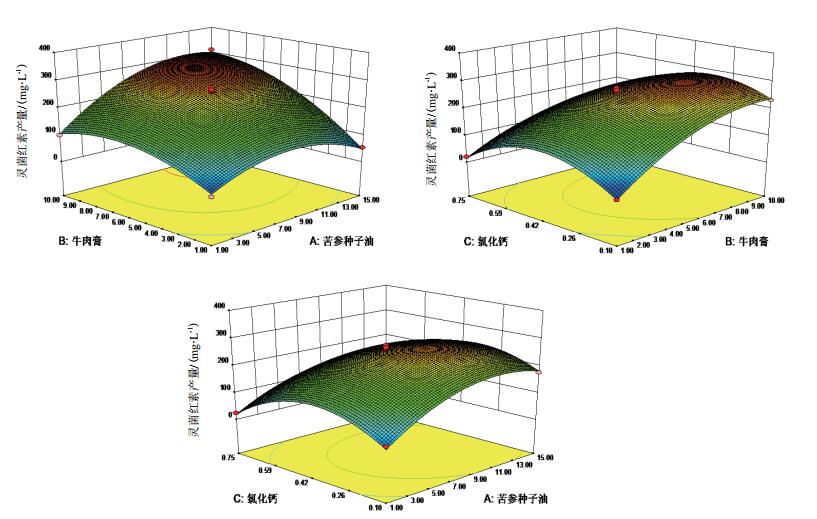
|
| 图 7 苦参种子油、牛肉膏和氯化钙对灵菌红素产量交互影响的响应面曲线分析 |
各因子响应面曲线显示交互作用显著,拟合面有最大值。结果显示,苦参种子油、牛肉膏和氯化钙的最佳浓度分别为12.93 g/L、9.47 g/L及0.3 g/L。经优化后的培养基称为苦参种子油培养基,在30℃条件下,180 r/min摇瓶发酵,灵菌红素产量最高,预测产量为332.37 mg/L。
2.7 验证试验为验证模型的准确性,采用优化的苦参种子油培养基进行发酵。结果显示,灵菌红素实际产量平均值为317.21 mg/L,与模型预测的最大响应值基本吻合,比优化前初始产率提高近3.2倍。
3 讨论有文献报道,温度对灵菌红素的合成具有显著影响,如粘质沙雷氏菌在低于20℃或高于37℃时基本不产生灵菌红素[20]。本试验中,单因素考察显示L9菌株在30℃时,灵菌红素产量最高,但37℃灵菌红素的产率显著下降。Kurbanoglu等[21]发现有机氮源较无机氮源更适合灵菌红素的生产,实验表明L9菌株在牛肉膏做为氮源下能大量合成灵菌红素,以硫酸铵或尿素为唯一氮源的情况下,L9菌株几乎不能产生灵菌红素,生长基本停滞。实验结果表明,金属离子对L9菌株灵菌红素的产量有较大影响,Fe2+、Cu2+、Zn2+对灵菌红素和菌体繁殖有抑制作用,Ga2+、Mg2+对灵菌红素的合成有明显的促进作用。据文献报道,灵菌红素合成的起始前体为脂肪酸或不饱和脂肪酸自氧化过程中产生的2-辛烯醛[22-23],实验结果表明粘质沙雷氏菌L9利用苦参种子油时灵菌红素产率最高。
目前,利用废弃物产灵菌红素已取得一定的成果,如Kurbanoglu等[21]利用农业废弃物羊角蛋白作为氮源,诱导粘质沙雷氏菌MO-1发酵生产灵菌红素,但灵菌红素最高产率仅为277.74 mg/L。在已优化发酵条件下,以橄榄油、花生油分别代替苦参种子油发酵生产灵菌红素的产率为237.33 mg/L、153.33 mg/L,显著低于苦参种子油发酵生产灵菌红素的产率317.21mg/L。橄榄油、花生油属于食用性油脂,其成本相对较高,而苦参种子油脂是苦参种子深加工过程产生的副产物,其廉价易得,且苦参种子副产物油脂中含有一定量的生物碱和黄酮类物质,这些物质是广谱的抗菌成分[24]。L9菌株在极端环境下依然可以耐受并高效利用油脂类成分产生高附加值的灵菌红素,由此可见L9菌株在利用苦参种子等富含油脂类中药废弃物产灵菌红素的过程中具有一定的应用前景。
4 结论综上所述,本研究成功筛选得到一株适宜于以中药副产物为原料产灵菌红素的粘质沙雷氏菌L9菌株,并以苦参种子副产物油脂作为唯一碳源发酵生产灵菌红素,优化获得其最佳培养基组成和培养条件,在有效处置苦参种子固废物的同时产生灵菌红素高附加值产品,为苦参资源的提质增效提供了科学依据,也为种子类药材深加工过程固废物的资源化利用提供了借鉴。
| [1] |
Stankovic N, Senerovic L, Ilic-Tomic T, et al. Properties and applications of undecylprodigiosin and other bacterial prodigiosins[J]. Applied Microbiology and Biotechnology, 2014, 98(9): 3841-3858. DOI:10.1007/s00253-014-5590-1 |
| [2] |
Bennett JW, Bentley R. Seeing red:the story of prodigiosin[J]. Advances in Applied Microbiology, 2000, 47: 1-32. DOI:10.1016/S0065-2164(00)47000-0 |
| [3] |
Nikodinovicrunic J, Mojic M, Kang Y, et al. Undecylprodigiosin conjugated monodisperse gold nanoparticles efficiently cause apoptosis in colon cancer cells in vitro[J]. Journal of Materials Chemistry B, 2014, 2(21): 3271-3281. DOI:10.1039/C4TB00300D |
| [4] |
Kim D, Kim JF, Yim JH, et al. Red to red- the marine bacterium Hahella chejuensis and its product prodigiosin for mitigation of harmful algal blooms[J]. Journal of Microbiology and Biotechnology, 2008, 18(10): 1621-1629. |
| [5] |
Kumar K, Kumar V. Prodigiosin alkaloids:recent advancements in total synthesis and their biological potential[J]. Royal Society of Chemistry Advances, 2015, 5(15): 10899-10920. |
| [6] |
Arivizhivendhan KV, Mahesh M, Boopathy R, et al. Antioxidant and antimicrobial activity of bioactive prodigiosin produces from Serratia marcescens using agricultural waste as a substrate[J]. Journal of Food Science and Technology, 2018, 55(7): 2661-2670. DOI:10.1007/s13197-018-3188-9 |
| [7] |
Wang Z, Li B, Zhou L, et al. Prodigiosin inhibits Wnt/β-catenin signaling and exerts anticancer activity in breast cancer cells[J]. Proceedings of the National Academy of Sciences, 2017, 113(46): 13150-13155. |
| [8] |
Goard CA, Schimmer A. An evidence-based review of obatoclax mesylate in the treatment of hematological malignancies[J]. Core Evidence, 2013, 8: 15-26. |
| [9] |
Ahmad WA, Ahmad WYW, Zakaria ZA, et al. Application of bacterial pigments as colorant[M]. Springer Berlin Heidelberg, 2011: 57-74.
|
| [10] |
Liu X, Wang Y, Sun S, et al. Mutant breeding of Serratia marcescens strain for enhancing prodigiosin production and application to textiles[J]. Preparative Biochemistry & Biotechnology, 2013, 43: 271-284. |
| [11] |
Alihosseini F, Ju KS, et al. Antibacterial colorants:characteriz-ation of prodiginines and their applications on textile materials[J]. Biotechnology Progress, 2010, 24(3): 742-747. |
| [12] |
Alihosseini F, Lango J, Ju KS, et al. Mutation of bacterium Vibrio gazogenes for selective preparation of colorants[J]. Biotechnology Progress, 2010, 26(2): 352-360. |
| [13] |
马连杰, 张慧, 杭晓宁, 等. 一株产红色素细菌的分离鉴定及色素性质研究[J]. 天然产物研究与开发, 2018, 30(10): 84-87. |
| [14] |
刘晓侠, 沈振忠, 胡星夏, 等. 一株红色素高产菌的鉴定、发酵及结构表征[J]. 药物生物技术, 2010, 17(3): 212-216. |
| [15] |
Giri AV, Anandkumar N, Muthukumaran G, et al. A novel medium for the enhanced cell growth and production of prodigiosin from Serratia marcescens isolated from soil[J]. BioMed Central Microbiology, 2004, 4(1): 1-10. |
| [16] |
翁泽斌, 段金廒, 郭盛, 等. 山西产苦参种子生物碱类化学成分分析及其资源化价值探讨[J]. 中国中药杂志, 2016, 41(17): 3265-3271. |
| [17] |
段金廒, 宿树兰, 郭盛, 等. 中药废弃物的转化增效资源化模式及其研究与实践[J]. 中国中药杂志, 2013, 38(23): 3991-3996. |
| [18] |
Daoust JY, Gerber N. Isolation and purification of prodigiosin from Vibrio psychroerythrus[J]. Journal of Bacteriology, 1974, 118(2): 756-757. DOI:10.1128/JB.118.2.756-757.1974 |
| [19] |
刘晓侠, 沈振忠, 胡星夏, 等. 一株红色素高产菌的鉴定、发酵及结构表征[J]. 药物生物技术, 2010, 17(3): 212-216. |
| [20] |
Siva R, Subha K, Bhakta D, et al. Characterization and enhanced production of prodigiosin from the spoiled coconut[J]. Applied Biochemistry & Biotechnology, 2012, 166(1): 187-196. |
| [21] |
Kurbanoglu EB, Ozdal M, Ozdal OG, et al. Enhanced production of prodigiosin by Serratia marcescens MO-1 using ram horn peptone[J]. Brazilian Journal of Microbiology, 2015, 46(2): 631-637. DOI:10.1590/S1517-838246246220131143 |
| [22] |
Williamson NR, Fineran PC, Leeper FJ, et al. The biosynthesis and regulation of bacterial prodiginines[J]. Nature Reviews Microbiology, 2006, 4(12): 887-899. DOI:10.1038/nrmicro1531 |
| [23] |
Harris AKP, Williamson NR, Slater H, et al. The Serratia gene cluster encoding biosynthesis of the red antibiotic, prodigiosin, shows species- and strain-dependent genome context variation[J]. Microbiology, 2004, 150(11): 3547-3560. DOI:10.1099/mic.0.27222-0 |
| [24] |
Chen Y, Chang SKC, Chen J, et al. Characterization of microbial community succession during vermicomposting of medicinal herbal residues[J]. Bioresource Technology, 2018, 249: 542-549. DOI:10.1016/j.biortech.2017.10.021 |