2. 贵州大学酿酒与食品工程学院,贵阳 550025;
3. 贵州科学院,贵阳 550001;
4. 贵州大学生命科学学院,贵阳 550025
2. College of Liquor and Food Engineering, Guizhou University, Guiyang 550025;
3. Guizhou Academy of Sciences, Guiyang 550001;
4. College of Life Science, Guizhou University, Guiyang 550025
磷是植物生长中不可缺少的大量元素,是农作物稳产高产的必要条件[1],然而土壤中磷元素主要以难溶性形式存在,作物可利用率低[2]。基于我国农业生产现状,迫切需要在现有磷矿资源水平上提高土壤中难溶性磷的利用效率,而解磷微生物是一类能够将土壤中难溶性的磷化合物转化成植物可吸收利用的可溶性磷的微生物[3]。现有报道中证明具有解磷能力的微生物包括细菌、真菌和放线菌等[4-8],其中以芽孢杆菌(Bacillus)、假单胞菌(Pseudo-monas)、固氮菌(Azotobacter)、洋葱伯克霍尔德菌(Burkhol-deria)、根瘤菌(Rhizobium)、慢生根瘤菌(Bradyrhizobium)等为主的解磷细菌的数量和种类较多,而解磷真菌则以曲霉属(Aspergillus)和青霉(Penicillium)等为主[9]。农业领域利用上述解磷微生物不仅可以提高磷素的转化率和利用率,实现作物产量的增产,还能减少传统磷肥施用过程因磷素流失对环境产生的污染,解磷微生物的研究对农业的可持续发展具有重要意义。
近年来,虽有大量的解磷微生物被分析筛选及鉴定,但大多都是一些非耐高温菌[4-8, 10],如果将它们应用于高温环境中,其生长和解磷能力往往会受到限制,最终导致其在农业生产应用中的可行性和广泛性受到极大的影响。所以,为解决高温环境中的农业生产以及环境修复等问题,需要挖掘出能适应高温环境的解磷微生物。在我国,耐高温解磷微生物主要从高温堆肥样品中分离筛选得到,同时也主要被应用于高温堆肥过程,如将筛选驯化后制成的耐高温解磷菌剂接种于含磷固体废弃物的好氧堆肥中,借耐高温解磷菌等多种微生物的作用促使堆肥快速腐熟,实现含磷固体废弃物的资源化利用[11-12]。因此,筛选更多具有耐高温能力的解磷菌,构建并完善极端解磷微生物的菌种资源库,不仅可以为高温条件下不同应用背景中磷的转化利用提供技术支撑,还可以缓解我国磷肥资源紧缺以及环境污染和生态破坏的压力,具有很好的社会和生态效益。
丢糟作为白酒生产中的主要有机废弃物,不但含有丰富的营养物质,还含有丰富的微生物菌群,是堆肥的理想原料[13]。本研究从农业生产的角度出发,通过选择性培养基定向筛选,从丢糟和磷尾矿的高温堆肥样品中分离筛选耐高温解磷微生物,并进行形态学及分子生物学鉴定和解磷能力比较,拟为适用于高温环境条件下解磷微生物菌剂的研制提供依据。
1 材料与方法 1.1 材料 1.1.1 筛选材料样品取自于以酒糟为主要原料,磷矿粉为辅料的高温堆肥反应堆(50℃-55℃),采集地点为贵州省发酵工程与生物制药重点实验室。
1.1.2 主要设备101-1AB电热恒温干燥箱:天津泰斯特仪器有限公司;YXQ-LS-75G立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;BMJ-250C培养箱:上海博讯实业有限公司医疗设备;JJ-CJ-IFD型超净工作台:苏州市金净净化设备科技有限公司;正置荧光显微镜:奥林巴斯Olympus;FA-2004N电子分析天平:上海菁海仪器有限公司;Heraeus Multifuge X3R大容量冷冻离心机:美国Thermo Fisher公司;721可见分光光度计:上海菁华科技仪器有限公司;PHS-3C型精密酸度计:上海大普仪器有限公司;PCR扩增仪:德国Jena;核酸电泳仪:德国Jena。
1.1.3 主要试剂细菌和真菌基因组DNA提取试剂盒购自上海生工生物工程有限公司。磷酸三钙、葡萄糖、氯化钠和琼脂等试剂均为国产分析纯。
1.1.4 主要培养基无机磷选择性固体培养基:葡萄糖10.0 g,Ca3(PO4)2 5.0 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,琼脂18 g,蒸馏水1 000 mL,pH 7.0-7.5。其中以Ca3(PO4)2作为磷源,需与其他药品分开灭菌后混合。
牛肉膏蛋白胨固体培养基(NA):蛋白胨10.0 g,牛肉膏3.0 g,氯化钠5.0 g,琼脂15 g,蒸馏水1 000 mL,pH 7.0-7.4。
马铃薯葡萄糖固体培养基(PDA):马铃薯浸粉5.0 g,葡萄糖20.0 g,琼脂14 g,蒸馏水1 000 mL,pH 5.8-6.2
上述培养基的配方中去掉琼脂即可制成对应的液体培养基。
1.2 方法 1.2.1 耐高温解磷菌的分离及纯化 1.2.1.1 初筛称取高温阶段(50-55℃)的堆肥样品10 g,装入有90 mL无菌水的三角瓶内摇匀后,将三角瓶置于50℃摇床中振荡培养30 min,作为母液。吸取1 mL样品母液于装有9 mL无菌水的无菌试管中,依次按照10-1,10-2,10-3,10-4,10-5,10-6的梯度进行稀释。取10-4,10-5,10-6三个梯度涂布于无机磷固体培养基上,每个梯度重复3次,作为平行。将涂布好的培养基放入恒温培养箱中于50℃培养,挑取单个菌落进行划线纯化培养后接种于斜面培养基并于4℃冰箱保存备用。
1.2.1.2 复筛将初筛得到的耐高温解磷细菌接种于装有50 mL牛肉膏蛋白胨液体培养基的100 mL的三角瓶中,置于30℃,180 r/min的摇床中振荡培养48 h,制备种子悬浮液,经镜检菌种量约1×107 CFU/mL。将初筛得到的耐高温解磷真菌接种于PDA斜面培养基上,置于30℃培养数天至菌落布满整个平板,加无菌水洗脱并用脱脂棉过滤,制备孢子悬浮液,经镜检孢子量约为1×107CFU/mL。
将种子悬浮液或孢子悬浮液以1%接种量接入无机磷液体培养基中,并以1%无菌水代替1%种子及孢子悬浮液接入作空白对照,重复3次,作为平行。置于50℃、180 r/min恒温振荡器中培养6 d后取出,10 000 r/min条件下离心5 min,上清液经0.45 μm滤膜过滤后采用钼锑抗比色法测定发酵上清液中的磷含量[14]。
1.2.2 解磷微生物的鉴定 1.2.2.1 形态学鉴定[15-16]将纯化好的斜面上的解磷细菌菌株分别点种在牛肉膏蛋白胨固体培养基上,30℃培养,2 d后观察单菌落特征,记录其颜色、形状、透明度、表面光泽度、边缘特征、隆起程度等特征。经革兰氏染色,在奥林巴斯Olympus正置荧光显微镜1 000×下观察菌体细胞形态。
将纯化好的斜面上的解磷真菌菌株分别点种在马铃薯葡萄糖固体培养基上,30℃培养箱中培养5-7 d不等,观察菌落形态学特征。制作玻片,将1滴乳酸石碳酸棉蓝染色液滴在干净的载玻片中央,用无菌挑针挑取少许菌丝或孢子,盖上盖玻片,在奥林巴斯Olympus正置荧光显微镜1 000×下观察观察菌体细胞形态。
1.2.2.2 分子生物学鉴定将活化后的解磷细菌菌株接入装有50 mL牛肉膏蛋白胨液体培养基的三角瓶中,置于30℃,180 r/min的摇床中振荡2 d。以细菌基因组提取试剂盒(上海生工生物工程有限公司)提取DNA。采用细菌16S rDNA通用上游引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和下游引物1492R(5'-GGTTACCTTGTTACGACTT-3')对解磷细菌进行PCR扩增。细菌PCR扩增体系为25 μL:细菌DNA模板2 μL,2×Taq PCR Master Mix 12.5 μL,上下游引物各1 μL,ddH2O 8.5 μL。细菌PCR反应程序:94℃预变性5 min后,94℃变性1 min,55℃退火1 min,72℃延伸2 min,35个循环,然后72℃延伸10 min。PCR产物进行1. 5%琼脂糖凝胶电泳检测。
将活化后的解磷真菌菌株接入装有50 mL马铃薯葡萄糖液体培养基的三角瓶中,置于30℃,160 r/min的摇床中振荡培养直至长出菌丝球后用纱布过滤,收集菌丝球,再用无菌滤纸吸干水分,用液氮研磨成粉末。以真菌基因组DNA提取试剂盒(上海生工生物工程有限公司)提取DNA采用真菌通用上游引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和下游引物ITS4(5'-TCCTCCGCTTATTGATATGC-3')对解磷真菌进行PCR扩增。真菌PCR扩增体系为25 μL:真菌DNA模板2 μL,2×Taq PCR Master Mix 12.5 μL,上下游引物各1 μL,ddH2O 8.5 μL。细菌PCR反应程序:95℃预变性2 min;95℃变性30 s,55℃退火33 s,72℃延伸2 min,33个循环;72℃延伸5 min。PCR产物进行1. 5%琼脂糖凝胶电泳检测。
DNA产物送上海生工生物工程有限公司测序,所得测序结果所得序列在NCBI数据库中进行BLASTn分析比对,选取同源性较高的菌株序列作为参照。
1.2.3 耐高温解磷菌的解磷特性 1.2.3.1 耐高温解磷菌的解磷曲线利用1.2.1.2所述方法制备细菌种子悬浮液和真菌孢子悬浮液,分别以1%接种量接入无机磷液体培养基中,并以1%无菌水代替1%种子及孢子悬浮液接入作空白对照,重复3次,作为平行。置于50℃、180 r/min恒温振荡器中培养7 d,每1 d取样5 mL,经10 000 r/min条件下离心5 min,上清液经0.45 μm滤膜过滤后用钼锑抗比色法检测各发酵液中的可溶性磷含量,绘制各耐高温解磷菌株的解磷曲线。
1.2.3.2 温度对耐高温解磷菌解磷量的影响将细菌种子悬浮液和真菌孢子悬浮液以1%的接种量接入无机磷液体培养基中,分别置于40、45、50、55、60℃下,置于180 r/min恒温振荡器中培养至其解磷量分别出现最大值的天数,并以1%无菌水代替1%种子及孢子悬浮液接入作空白对照,重复3次,作为平行。检测各发酵液中可溶性磷含量。
1.2.3.3 pH对耐高温解磷菌解磷量的影响将细菌种子悬浮液和真菌孢子悬浮液以1%的接种量接入pH值分别为5.0、6.0、7.0、8.0、9.0的无机磷液体培养基中,置于50℃、180 r/min恒温振荡器中培养至其解磷量分别出现最大值的天数,并以1%无菌水代替1%种子及孢子悬浮液接入作空白对照,重复3次,作为平行。检测各发酵液中可溶性磷含量。
2 结果 2.1 耐高温解磷菌株的分离筛选经初筛和复筛纯化后,从堆肥样品中分离纯化得到5株形态各异的耐高温解磷菌株,分别为耐高温解磷细菌GDB1和GDB2以及耐高温解磷真菌GDF1、GDF2和GDF3。
经50℃恒温摇床培养5 d后,通过钼锑抗比色法测定上述菌株的解磷能力,其解磷量范围在135.52-164.06 μg/mL,其中以GDF1的解磷量最大,为164.06 μg/mL。试验表明5株菌株在高温环境下均对磷酸钙有较强的溶解能力,且解磷能力在经历多次传代培养后并未出现减弱的情况。
2.2 耐高温解磷菌株的鉴定 2.2.1 耐高温解磷菌株的形态学鉴定结果
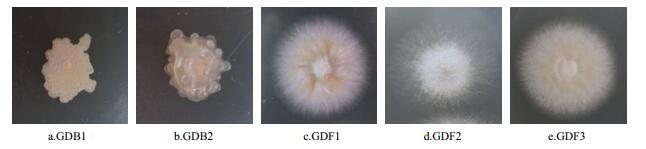
|
| 图 1 耐高温解磷微生物菌落形态 |

|
| 图 2 耐高温解磷微生物镜检图(×1 000) |
GDB1在NA培养基平板上,单菌落呈不规则圆形,颜色为灰白色或者略带一些黄色,表面不湿润粗糙,无光泽,有较多隆起、皱褶等;经革兰氏染色镜检显示,该菌株为革兰氏阳性(G+)杆菌。GDB2在NA培养基平板上,单菌落呈不规则圆形,颜色为灰白色,表面湿润且分泌较黏稠液体,有光泽,易挑起;经革兰氏染色镜检显示,该菌株为革兰氏阳性(G+)杆菌。GDF1在PDA培养基平板上,单菌落呈圆形,凸起絮状,菌落中心部分呈微黄色,菌丝为白色、质密,背面呈淡黄色;经石炭酸棉兰染色,显微镜结果清晰可见菌丝体和分生孢子,分生孢子梗呈瓶颈状,小型分生孢子较多,自侧生分生孢子梗产生,以链状着生于散生或聚生的孢子梗上,呈椭圆至卵圆形。
GDF2在PDA培养基平板上,单菌落呈圆形,绒毛状,生长初期菌落中心部分呈淡绿色,后期呈深绿色,且边缘泛白色,背面呈苍白色或淡黄色;经石炭酸棉兰染色,显微镜结果清晰可见分生孢子梗,各分枝顶端着生球形孢子囊,囊内产大量球形、椭圆形、壁薄、光滑的孢囊孢子。
GDF3在PDA培养基平板上,单菌落呈圆形,绒毛状,菌落中心部分呈白色,四周呈灰黄色,且边缘为乳白色,背面呈苍白色或淡黄色;经石炭酸棉兰染色,显微镜结果清晰可见分生孢子梗,不分枝的球形分生孢子的末端形成分生孢子链。
2.2.2 耐高温解磷菌株的分子学鉴定结果通过NCBI数据库,将测序得到的2株解磷细菌16S rDNA序列及3株解磷真菌ITS区域基因序列与其他菌株进行序列比对分析,再通过MEGA 5.0软件,将5株解磷微生物与其同属亲缘关系较近的模式菌株进行同源性分析并构建系统发育树,结果得到如图 3、4所示的系统发育树。
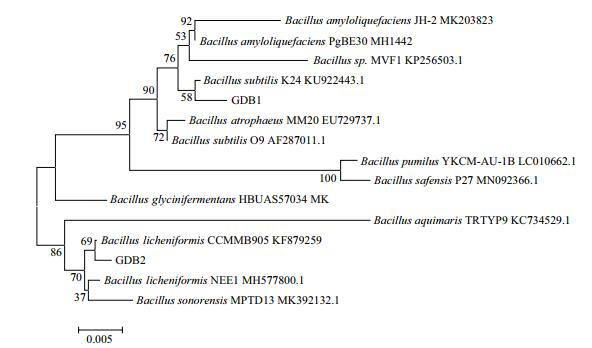
|
| 图 3 基于16S rDNA序列的解磷细菌GDB1和GDB2系统发育树 |
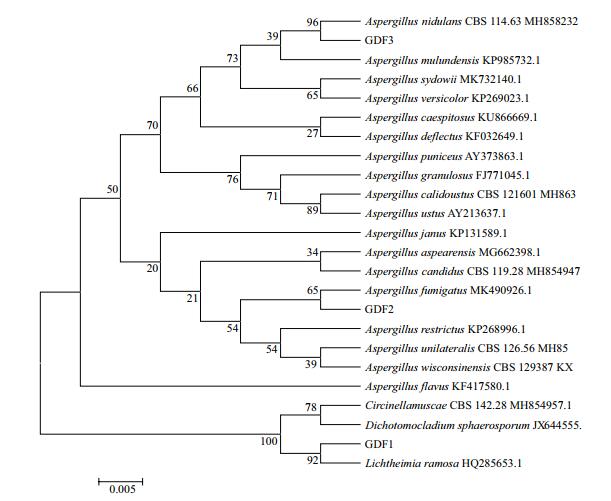
|
| 图 4 基于ITS序列的解磷真菌GDF1、GDF2和GDF3的系统发育树 |
结果发现GDB1与命名为KU922443的枯草芽孢杆菌(Bacillus subtilis)的同源性最高,其相似度为99.90%;GDB2与命名为KF158804的地衣芽孢杆菌(Bacillus licheniformis)同源性最高,其相似度为99.50%;结果发现GDF1与命名为MG458699的多枝横梗霉(Lichtheimia ramosa)同源性最高,其相似度为100.00%;GDF2与命名为MK732095的烟曲霉(Aspergillus fumigatus)同源性最高,其相似度为100.00%;GDF3与命名为MK299125的构巢曲霉(Aspergillus nidulans)同源性最高,其相似度为100.00%。根据比对结果[17-19],基本可判定各菌株的菌种名称。
结合菌落及菌株的形态特征及16S rDNA或ITS序列分析结果,分别将GDB1、GDB2、GDF1、GDF2及GDF3鉴定为枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、多枝横梗霉(Lichtheimia ramosa)、烟曲霉(Aspergillus fumigatus)及构巢曲霉(Aspergillus nidulans)。
2.3 耐高温解磷菌的解磷特性 2.3.1 耐高温解磷菌的解磷曲线本实验设计利用磷酸三钙为唯一磷源,在50℃高温下对其进行液态培养,采用钼锑抗比色法测定了不同耐高温解磷菌的解磷能力,并绘制解磷曲线(图 5)。
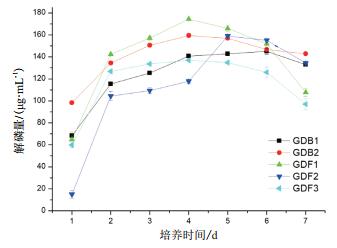
|
| 图 5 耐高温解磷菌解磷量的变化 |
如图 5所示,5株耐高温解磷菌在7 d液态培养过程中培养液内可溶性磷含量总体均呈先增加,后逐渐减少的变化趋势。5株耐高温解磷菌发酵液中的可溶性磷含量在0-2 d内均变化显著,分别迅速升高至115.26 μg/mL、134.48 μg/mL、142.26 μg/mL、104.37 μg/mL及126.83 μg/mL。然后随时间缓慢增加,GDB2、GDF1和GDF3发酵液中可溶性磷含量在第4天达到最高,分别为159.44 μg/mL、174.33 μg/mL和136.85 μg/mL。GDF2发酵液中可溶性磷含量在第5天达到最高,为158.90 μg/mL;GDB1发酵液中可溶性磷含量在第6天达到最高,为145.13 μg/mL。表 5说明各菌株达到最大解磷量的时间具有一定差异性,而这种变化主要来源于菌种种类的差异,不同菌株其生长代谢速率及其生长曲线是不同步的。当所有耐高温解磷菌发酵液中可溶性磷含量逐渐增加并达到最大值后,可溶性磷含量随培养时间的延长均有明显下降。
2.3.2 温度对耐高温解磷菌解磷量的影响温度是影响微生物生长繁殖的重要因素之一,主要表现在对细胞生长、代谢产物的形成、发酵液的物理性质和生物合成方向等方面。由图 6可知,随着温度的升高,各耐高温解磷微生物的解磷量均呈现先升高后降低的趋势。筛选得到的5株菌耐热范围较广,在40℃-60℃温度范围内均具有解磷能力,均在50℃时出现最佳解磷效果,GDB1为145.55 μg/mL,GDB2为159.77 μg/mL,GDF1为175.21 μg/mL,GDF2为160.52 μg/mL,GDF3为150.12 μg/mL。在某些温度范围条件下,发酵液中解磷量较高,说明此温度范围有利于菌株的解磷作用,其中以GDB2和GDF2的最适解磷温度范围最广,40℃-55℃下均有较好的解磷能力;GDF1和GDF3在55℃下也有一定的解磷量,而GDB1在55℃时的解磷量较50℃有明显下降,仅为62.52 μg/mL。5株菌在60℃时虽保持着一定解磷能力,但解磷量均出现大幅度下降,其中GDF1的解磷量最低,仅为29.53 μg/mL。该结果说明所筛的5株解磷微生物均属于耐高温微生物,可在高温环境下保持较好的解磷能力,且最适解磷温度均为50℃。

|
| 图 6 温度对耐高温解磷菌解磷量的影响 |
微生物的生长繁殖和生物合成通常都在一个最适的和最能耐受的pH范围,pH不仅影响微生物生物膜表面电荷的性质及通透性,而且还影响培养基中营养物质的离子化程度,因此不同初始pH值对耐高温解磷菌株解磷量的影响研究具有重要意义。由图 7可知,各耐高温菌株均对培养液pH值表现出较广泛的适应能力,初始pH值范围在4-9时都具有一定的解磷能力。随着初始pH值的升高,各耐高温解磷微生物的解磷量均呈现先升高后降低的趋势,其中GDB1、GDB2和GDF1在初始pH值为4-6时,解磷量大小与初始pH值高低呈正相关,在初始pH值为6.0时,解磷量达到最高,分别为163.36 μg/mL、179.49 μg/mL及191.22 μg/mL,当初始pH > 6.0时,解磷量大小与初始pH值高低呈负相关,在初始pH值为9.0时,解磷量低至91.47 μg/mL、138.81 μg/mL和137.48 μg/mL,说明这3株耐高温解磷微生物在实际应用中适用于偏酸性环境。然而,GDF2和GDF3在初始pH值为4-7时,解磷量随初始pH值的增加而增加,在初始pH值为7.0时,解磷量达到最高,分别为159.61 μg/mL及148.62 μg/mL,当初始pH > 7.0时,解磷量随初始pH值的增加明显下降,在初始pH值为9.0时,解磷量低至111.69 μg/mL和110.19 μg/mL,说明这2株耐高温解磷微生物在实际应用中适用于中性环境。

|
| 图 7 初始pH值对耐高温解磷菌解磷量的影响 |
目前,研究者们已从不同样品中分离得到多种具有耐高温能力的解磷微生物。Chang等[20]以生物质堆肥为分离样品,并经过一系列解磷实验得到具有耐高温解磷能力的3株细菌,斯密氏芽孢杆菌(Bacillus smithii,F18)、凝结芽孢杆菌(Bacillus coagulans,C45)及地衣芽孢杆菌(Bacillus licheniformis,A3);1株放线菌,Sphaerobacter thermophilus J57;1株真菌,烟曲霉(Aspergillus fumigatus,O4),其中斯密氏芽孢杆菌(Bacillus smithii,F18)在50℃下解磷量最高可达544.2 μg/mL。杨天学等[12]从添加磷矿粉的高温堆肥样品中分离筛选到2株具有较高解无机磷性能的耐高温解磷菌,分别为软化芽孢杆菌(Bacillus.Macerans)和巨大芽孢杆菌(Bacillus.Megaterium),在50℃下解磷量最高分别可达到263.8和242.0 μg/mL。目前所筛的耐高温解磷细菌多以芽孢杆菌属为主,本研究中所筛的枯草芽孢杆菌(Bacillus subtilis)GDB1和地衣芽孢杆菌(Bacillus licheniformis)GDB2也均属于该类,主要是因为芽孢杆菌能形成对环境温度具有很强抗性的芽孢,借助芽孢结构的“保护”机制使得高温解磷微生物在高温条件下也能进行正常的生长代谢。然而,耐高温解磷真菌以曲霉属的研究报道居多,本研究中所筛的烟曲霉(Aspergillus fumigatus)GDF2及构巢曲霉(Aspergillus nidulans)GDF3也均属于该类。
将本研究所筛菌株的解磷能力与对应菌株早期报道的解磷研究进行比较,结果如表 1所示。
由表 1可知,在相关解磷微生物的报道中,除多枝横梗霉(Lichtheimia ramosa)外,其余4株菌在非高温条件下均具有良好的解磷性能;而在高温极端环境下,所筛的5种解磷菌株中只有枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)和烟曲霉(Aspergillus fumigatus)解磷效果良好,构巢曲霉(Aspergillus nidulans)在高温条件下的解磷能力并未报道。多枝横梗霉(Lichtheimia ramosa)更是首次被证实为解磷微生物,且具有良好的耐受高温的能力,能作为耐高温解磷微生物进行深入研究。
目前有报道指出,传统的形态学及常用的16S rDNA鉴定对芽孢杆菌属(Bacillus sp.)的菌株而言,很难证实种水平上的鉴定,因为芽孢杆菌属(Bacillus sp.)内的部分菌种间无论是表型上还是同源性上都很类似,还需进一步鉴定。比如枯草芽孢杆菌(Bacillus subtilis)与其相近菌种就具有很高的同源性,目前己从枯草芽孢杆菌中分化出萎缩芽胞杆菌(Bacillus atrophaeus)等3个菌种及2个亚种[26]。为了对芽孢杆菌属(Bacillus sp.)进行进一步的研究分类,增加鉴定的准确性和可靠性,相继出现了很多方法,比如利用yya0基因在tetL的位置来区别鉴定解淀粉芽饱杆菌和枯草芽饱杆菌[26];扩增gyrB、rpoB等靶基因片段进一步对比同源性,以确定其种类[27-28]。本研究中所涉及的两株芽孢杆菌属(GDB1和GDB2)可于后期参照上述方法进行再次验证,增加鉴定的可靠性。
解磷曲线的绘制实验中,培养后期发酵液中可溶性磷含量出现不增反减的原因主要有两点,第一是随着培养时间的延长培养基中营养物质的消耗满足发酵动力学的变化规律,培养基内底物浓度下降至最低值,微生物生长代谢变缓,发酵液中可溶性磷含量不再增加;第二,微生物为满足自身生长代谢需要,将已转化为可溶性的有效磷作为底物消耗,用于核酸的合成等,以上两个因素导致发酵液中可溶性磷含量在发酵后期出现不增反减的现象[14]。
5株耐高温解磷菌中,以真菌GDF1的解磷能力最优,在发酵第4天达到174.33 μg/mL;细菌GDB1和GDF2的解磷能力次之,分别在发酵第4天达到159.44 μg/mL和在发酵第6天达到158.90 μg/mL。从结果来看,所筛的耐高温解磷细菌和解磷真菌在解磷能力上并无太大差异,与赵小蓉等[29]研究提及的解磷真菌比解磷细菌解磷效果显著的结果不一致,这可能是由于不同种属的不同菌株在高温条件限制下其解磷机制与普通条件下有所差异,比如酸解机制中由于高温导致代谢分泌的有机酸种类及浓度发生变化,从而对难溶性无机磷转化成可溶性磷的过程产生正向或负向的影响,最后导致上述结果。
本研究具有两个创新性的试验结果:第一,多枝横梗霉(Lichtheimia ramosa)是第一次被证实具有解磷能力,且可作为耐高温解磷微生物;第二,首次就构巢曲霉(Aspergillus nidulans)的高温解磷能力进行研究。本研究筛选获得的其他3株解磷微生物其高温解磷能力虽早有报道,但与已有文献相比,地衣芽孢杆菌(Bacillus licheniformis)GDB2和烟曲霉(Aspergillus fumigatus)GDF2在50℃时的解磷量最高分别可达159.44 μg/mL和158.90 μg/mL,该值较Chang等[20]所筛地衣芽孢杆菌(Bacillus licheniformis,A3)和烟曲霉(Aspergillus fumigatus,O4)在50℃下的最高解磷量80.2 μg/mL和11.6 μg/mL有明显提高。枯草芽孢杆菌(Bacillus subtilis)GDB1最高解磷量可达145.13 μg/mL,该解磷能力在芽孢杆菌属的耐高温解磷菌株[12, 30]中属良好水平。
本实验筛得的5株耐高温解磷菌最佳解磷能力均在150 μg/mL左右,除烟曲霉(Aspergillus fumigatus)是致病菌不宜作为应用于土壤的微生物外,其余4株均是具有较高解磷能力的菌种,可作为应用于高温环境下的新型微生物制剂的潜在原料,为推动耐高温解磷微生物的应用提供理论基础和技术支撑。
4 结论(1)本研究选取添加了磷尾矿粉和酒糟的高温堆肥样品为实验研究对象,成功从中分离筛选出5株耐高温解磷菌株。通过微生物形态学及分子生物学等技术和理论,初步鉴定菌株GDB1、GDB2、GDF1、GDF2及GDF3为枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、多枝横梗霉(Lichtheimia ramosa)、烟曲霉(Aspergillus fumigatus)及构巢曲霉(Aspergillus nidulans)。
(2)将所筛的5株耐高温解磷微生物置于以磷酸三钙为唯一磷源的无机磷液体培养基中,在50℃恒温条件下培养7 d,作其解磷曲线,测得GDB1、GDB2、GDF1、GDF2和GDF3的最大解磷量分别为145.13 μg/mL、159.44 μg/mL、174.33 μg/mL、158.90 μg/mL和136.85 μg/mL。
(3)本研究探讨了温度对耐高温解磷菌解磷量的影响,研究结果显示,5株耐高温解磷微生物温度耐受范围较广,在40℃-60℃之间均可生长,但在50℃时其解磷能力均达到最大值。
(4)通过初始pH对耐高温解磷菌解磷量的影响研究发现,当培养液初始pH值为6时,GDB1、GDB2和GDF1的解磷效果最佳,当培养液初始pH值为7时,GDF2和GDF3的解磷效果最好。
| [1] |
Liu Z, Li YC, Zhang S, et al. Characterization of phosphate-solubilizing bacteria isolated from calcareous soils[J]. Applied Soil Ecology, 2015, 96: 217-224. DOI:10.1016/j.apsoil.2015.08.003 |
| [2] |
Zeng Q, Wu X, Wen X. Identification and characterization of the rhizosphere phosphate-solubilizing bacterium Pseudomonas frederiksbergensis JW-SD2, and its plant growth-promoting effects on poplar seedlings[J]. Annals of Microbiology, 2016, 66(4): 1-12. |
| [3] |
Ram H, Malik SS, Dhaliwal SS, et al. Growth and productivity of wheat affected by phosphorus-solubilizing fungi and phosphorus levels[J]. Plant Soil & Environment, 2015, 61(3): 122-126. |
| [4] |
王样庭, 陈玲, 王陶, 等. 牛蒡根际土壤解磷菌的筛选、鉴定及生长特性[J]. 河南农业科学, 2018(10): 57-63. |
| [5] |
邵锴, 邱业先, 徐婧. 高效溶磷菌的筛选、鉴定及其溶磷特性[J]. 江苏农业科学, 2017, 45(8): 253-257. |
| [6] |
巩瑞红, 王小兵, 赵吉睿, 等. 荒漠草原植物根际溶磷细菌的分离鉴定及其溶磷能力的比较[J]. 北方农业学报, 2014(4): 6-9. DOI:10.3969/j.issn.1007-0907.2014.04.003 |
| [7] |
Ouahmane L, Thioulouse J, Hafidi M, et al. Soil functional diversity and P solubilization from rock phosphate after inoculation with native or allochtonous arbuscular mycorrhizal fungi[J]. Forest Ecology & Management, 2007, 241(1): 200-208. |
| [8] |
丛新华. 2株溶磷放线菌溶磷特性研究及抗病促生活性初探[D].长春: 吉林农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10193-1019811290.htm
|
| [9] |
Khan MS, Zaidi A, Musarrat J. Phosphate solubilizing microorga-nisms[M]. Springer International Publishing, 2014.
|
| [10] |
史发超, 殷中伟, 江红梅, 等. 一株溶磷真菌筛选鉴定及其溶磷促生效果[J]. 微生物学报, 2014, 54(11): 1333-1343. |
| [11] |
魏自民, 席北斗, 王世平, 等. 高温解磷菌对堆肥所添加难溶性磷素转化的试验研究[J]. 环境科学, 2008, 29(7): 2073-2076. DOI:10.3321/j.issn:0250-3301.2008.07.053 |
| [12] |
杨天学, 唐忠涛, 席北斗, 等. 耐高温解无机磷菌的筛选及初步鉴定[J]. 农业环境科学学报, 2009, 28(2): 393-397. DOI:10.3321/j.issn:1672-2043.2009.02.031 |
| [13] |
秦琴, 张芮瑞, 邱树毅, 等. 解磷生物有机肥堆肥条件的优化[J]. 河南农业科学, 2019, 48(5): 62-69. |
| [14] |
陈佳兴, 秦琴, 邱树毅, 等. 磷尾矿土壤中解磷细菌的筛选及解磷能力的测定[J]. 生物技术通报, 2018(6): 183-189. |
| [15] |
布瑞德. 伯杰士细菌鉴定手册[M]. 第八版. 北京: 科学出版社, 1984.
|
| [16] |
中国科学院微生物研究所. 常见与常用真菌[M]. 北京: 科学出版社, 1973.
|
| [17] |
孙珊, 黄星, 范宁杰, 等. 一株溶磷细菌的分离、鉴定及其溶磷特性研究[J]. 土壤, 2010, 42(1): 117-122. |
| [18] |
史改玲, 许女, 贾瑞娟, 等. 山西老陈醋源优良芽孢杆菌菌株的鉴定及筛选[J]. 中国酿造, 2018, 37(5): 22-27. |
| [19] |
张云霞, 雷鹏, 许宗奇, 等. 一株高效解磷菌Bacillus subtilis JT-1的筛选及其对土壤微生态和小麦生长的影响[J]. 江苏农业学报, 2016, 32(5): 1073-1080. DOI:10.3969/j.issn.1000-4440.2016.05.019 |
| [20] |
Chang CH, Yang SS. Thermo-tolerant phosphate-solubilizing microbes for multi-functional biofertilizer preparation[J]. Bioresource Technology, 2009, 100(4): 1648-1658. DOI:10.1016/j.biortech.2008.09.009 |
| [21] |
邢芳芳, 高明夫, 糕优优, 等. 大麦根际高效溶磷菌的筛选、鉴定及促生效果研究[J]. 华北农学报, 2016, 3: 252-257. DOI:10.7668/hbnxb.2016.S1.042 |
| [22] |
Gaind S, Gaur AC. Thermotolerant phosphate solubilizing microorganisms and their interaction with mung bean[J]. Plant & Soil, 1991, 133(1): 141-149. |
| [23] |
Biswas JK, Banerjee A, Rai M, et al. Potential application of selected metal resistant phosphate solubilizing bacteria isolated from the gut of earthworm(Metaphire posthuma)in plant growth promotion[J]. Geofisica International, 2018, 330: 117-124. |
| [24] |
Ogbo FC. Conversion of cassava wastes for biofertilizer production using phosphate solubilizing fungi[J]. Bioresource Technology, 2010, 101(11): 4120-4124. DOI:10.1016/j.biortech.2009.12.057 |
| [25] |
Bhattacharya SS, Barman S, Ghosh R, et al. Phosphate solubilizing ability of Emericella nidulans strain Ⅴ1 isolated from vermicompost[J]. Indian Journal of Experimental Biology, 2013, 51(10): 840-848. |
| [26] |
王军华.芽孢杆菌Q-12的鉴定及其抗菌活性物质的研究[D].大连: 大连理工大学, 2006. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y865034
|
| [27] |
中华人民共和国农业部. NY/T 2066-2011微生物肥料生产菌株的鉴别聚合酶链式反应(PCR)法[S]. 2011-09-01.
|
| [28] |
狄义宁, 刘鲁峰, 胡一凡, 等. 甘蔗内生菌B9的鉴定及其促生长机制和定殖能力的研究[J]. 中国土壤与肥料, 2019(3): 186-193. |
| [29] |
赵小蓉, 林启美, 李保国. 溶磷菌对4种难溶性磷酸盐溶解能力的初步研究[J]. 微生物学报, 2002, 42(2): 236-241. DOI:10.3321/j.issn:0001-6209.2002.02.017 |
| [30] |
赵霞.堆肥中耐高温解无机磷菌的初步研究[D].哈尔滨: 东北农业大学, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2235118
|





