2. 中国农业科学院农业资源与农业区划研究所 农业农村部农业微生物资源收集与保藏重点实验室,北京 100081
2. Key Laboratory of Microbial Resources Collection and Preservation, Ministry of Agriculture, Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081
辣椒(Capsicum annuum L.)为一年生或有限多年生草本植物,属于茄科辣椒属,富含维生素及氨基酸等营养物质,具有解热、镇痛、增加食欲、帮助消化、降脂减肥、预防肿瘤等功效。随着辣椒种植面积的不断扩大,连作现象十分普遍,长期连作使土壤从“细菌型”的高肥土壤转化成性质不良的“真菌型”土壤,土传病原菌日渐积累[1-2],导致辣椒病害加剧,严重影响辣椒产量,造成20%-50%,甚至高达70%的减产,已严重影响和制约辣椒产业发展[3]。目前辣椒病害的防治方法主要是使用化学药剂,长期使用化学试剂不但造成环境污染,而且威胁人畜健康[4]。研究表明生物防治具有绿色、安全、高效等特点,是最为理想的防治方法之一[5]。
植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)是一类生活在植物根际,能够促进植物生长、防治病害、增加作物产量的微生物统称[6]。PGPR数量巨大,种类繁多,不仅对植物有显著的促生长作用,对抑制土传病害发生、增强植物抗逆境胁迫能力、改善和维护土壤生态质量具有重要作用[7-9]。PGPR定殖到植物根际或进入植物体内后,可通过产抗生素、产水解酶、释放挥发性抑菌气体、诱导系统性抗性(ISR)、分泌铁载体、分泌植物激素、固氮等机理,有效抑制病原菌生长,克服土传病害及达到促生增产的功效[7, 10]。刘泽平等[11]从水稻根际土壤分离得到6株PGPR菌株,研究发现6株菌株均能产生生长素,其中LZP03、LZP05和LZP06具有较强促生能力。容良燕等[12]将PGPR菌株制成复合接种剂施于玉米田间,玉米株高、穗长、穗粗、单位面积穗数、穗粒数和经济产量均有提高,并能代替20%-30%化肥。蒋永梅[13]从辣椒等4种植物根际分离筛选了56株PGPR菌株,其中辣椒根际分离筛选出6株固氮菌和9株溶磷菌。吕雅悠等[14]用PGPR菌株A21-4灌根处理辣椒,发现实验组辣椒植株成株期茎粗、根系活力和叶绿素含量显著提高,辣椒果实的蛋白质、维生素C和硝态氮的含量也均有提高,且辣椒根系土壤的速效氮、磷、钾含量等显著提高。张杨等[15]利用具有产IAA和ACC脱氨酶能力的辣椒PGPR菌株研制成生物育苗基质,研究发现添加菌株的生物基质对辣椒苗有提高根系定殖和促幼苗生长的能力,且对移苗后的生长仍具有显著的促进作用并能有效在根系定殖。
本研究从江苏省徐州市丰县辣椒根际土壤中分离根际促生菌,研究其固氮、解磷、促生和抗病能力,旨在筛选高效优质的多功能根际促生菌,为辣椒根际促生菌作为生物肥料和生物农药的开发应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 土壤样品及病原菌来源供试土样:2018年8月采自江苏省徐州市丰县。将采集样品分别装入无菌纸袋中,带回实验室进行菌株分离。
供试病原菌:立枯丝核菌Rhizoctonia solani、辣椒疫霉菌Phytophthora capsici Leonian、辣椒炭疽菌Colletotrichum capsici bulterg和辣椒镰孢菌Fusarium oxysporum由中国农业微生物菌种保藏中心提供。
1.1.2 主要培养基牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂18 g,蒸馏水定容至1 L;马铃薯葡萄糖琼脂培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水定容至1 L;Ashby培养基:KH2PO4 0.2 g,MgSO4 0.2 g,NaCl 0.2 g,CaCO4 5 g,甘露醇10 g,CaSO4 0.1 g,琼脂15 g,蒸馏水定容至1 L,pH 7.0;PKO无机磷培养基:葡萄糖10 g,(NH4)2SO4 0.5 g,NaCl 0.2 g,KCl 0.2 g,FeSO4·7H2O 0.003 g,MnSO4 0.03 g,MgSO4·7H2O 0.03 g,酵母膏0.5 g,Ca3(PO4)2 5 g,琼脂20 g,蒸馏水定容至1 L,pH 6.8-7.0;孟金娜有机磷培养基:葡萄糖10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,蛋黄卵磷脂0.2 g,CaCO3 5 g,酵母膏0.4 g,琼脂20 g,蒸馏水定容至1 L,pH 7.0;Salkowski比色液:FeCl3 4.5 g,溶于10.8 mol/L浓H2SO4硫酸中,冷却后定容至1 L。
1.2 方法 1.2.1 PGPR菌株的分离纯化供试土样于2018年8月采自江苏省徐州市丰县生长的健康辣椒植株根际,将样品装入无菌纸袋中,带回实验室,4℃保存。取辣椒根际土10 g,放入带有玻璃珠的90 mL生理盐水中,180 r/min震荡30 min,梯度稀释后涂布于牛肉膏平板和Ashby平板上,置于28℃恒温培养箱培养,挑取形态不同菌落进一步纯化,纯化后转接至斜面,4℃保存备用。
1.2.2 PGPR菌株的鉴定 1.2.2.1 形态学鉴定将菌株接种于牛肉膏蛋白胨培养基,30℃培养,观察记录各细菌菌落形状、大小、颜色等特征,结合《伯杰细菌鉴定手册》(第八版)进行形态学鉴定。
1.2.2.2 分子生物学鉴定采用菌落PCR方法扩增16S rDNA。引物采用16S rDNA的通用引物,由上海生工合成,27f:5'-AGAGTTTGATCCTGGCTCAG-3',1492r:5'-TACGGTTACCTTGTTACGACTT-3',采用50 μL PCR反应体系进行PCR扩增。扩增产物测序由生物工程(上海)股份有限公司完成,通过NCBI数据库在线比对测序结果,构建系统发育树。
1.2.3 菌株特性测定 1.2.3.1 解磷特性测定采用透明圈法,将纯化的菌株分别点接至PKO无机磷培养基和孟金娜有机磷平板,每组3次重复,28℃培养14 d,测量解磷透明圈的直径与菌落直径,计算透明圈直径与菌落直径比值D/d和E/e。
1.2.3.2 分泌IAA能力测定将菌株接种于含L-色氨酸(100 mg/L)的液体培养基中,28℃、180 r/min避光震荡培养24 h,测定OD600值,计算菌体生长量。将菌悬液以10 000 r/min离心10 min后,取上清液加入等体积Salkowski比色液,避光静置30 min,测定其OD530值。计算菌浓度OD600值=1时,单位体积发酵液中IAA含量。
分别测定各浓度3-吲哚乙酸标准液OD530值,绘制IAA标准曲线,并在标准曲线上查出各菌株分泌IAA浓度。
1.2.3.3 抗病能力测定采用对峙培养法,将病原菌菌饼(直径5 mm)接种于PDA平板,将待测细菌点接至距病原菌3.5 cm处,以不接种细菌的平板为对照,每个处理重复3次。平板置于30℃下培养5-7 d,待对照组菌落长满全皿时,测量每个细菌的抑菌圈半径,计算其抑菌率。
抑菌率=(对照组病原菌菌落半径-处理组病原菌菌落半径)/对照组病原菌菌落半径×100%
2 结果 2.1 PGPR菌株的分离筛选从辣椒根际土中共分离到58株细菌,经进一步筛选,最终得到13株具有固氮功能的根际促生菌,其菌株编号分别为T22、N1、N3、N7、N8、N9、N12、N16、N26、N29、N30、N31、N32。
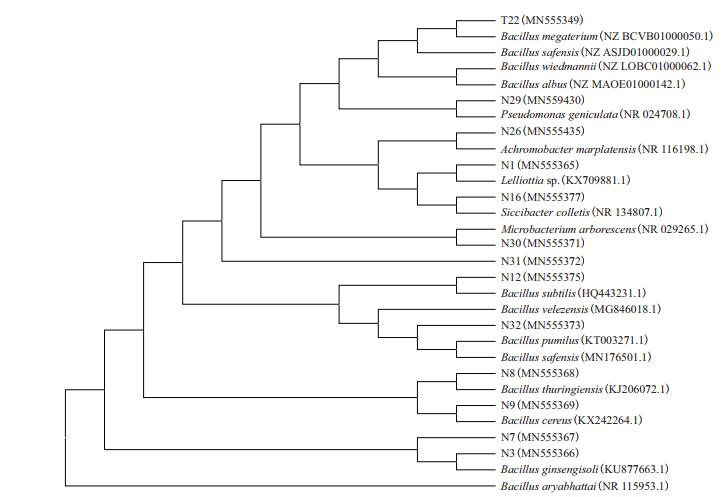
2.2 PGPR菌株的鉴定经16S rDNA序列BLAST比对,13株细菌中T22(MN555349)、N3(MN555366)、N7(MN555367)、N8(MN555368)、N9(MN555369)、N12(MN555375)和N32(MN555373)属于Bacillus,N29(MN559430)属于Pseudomonas,N1(MN555365)属于Lelliottia,N16(MN555377)属于Siccibacter,N26(MN555435)属于Achromobacter,N30(MN555371)属于Microbacterium,N31(MN555372)属于Paenibacillus。用MEGA7.0构建菌株的系统进化树见图 1。
|
| 图 1 基于16S rDNA序列构建的13株辣椒PGPR菌株的系统进化树 |
在13株辣椒PGPR菌中,有7株菌具有解有机磷能力,可以在孟金娜有机磷平板上形成透明圈,其中N1、N16和N30解有机磷能力显著高于其他菌株,能力最强的菌株为N16,D/d值为1.72±0.30(表 1)。
在13株辣椒PGPR菌中,有5株菌可解无机磷,可以在PKO无机磷平板上形成透明圈,其中N3菌株的解无机磷能力最强,E/e值为1.47(表 1)。
2.3.3 分泌IAA能力在13株PGPR菌株中,菌株N1、N16和N32具有产生IAA能力,其中N1菌株产IAA能力显著高于其他菌株,达到18.49 μg/mL(表 2)。
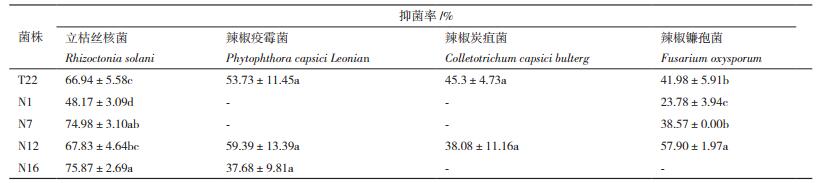
在13株PGPR菌株中,具有对辣椒病原菌拮抗能力的菌株5株,分别为T22、N1、N7、N12和N16。菌株T22和N12对被测4种辣椒病原菌均有拮抗效果,而菌株N1、N7和N16只对其中的两种病原菌具有拮抗效果。菌株T22对立枯丝核菌和辣椒疫霉菌的抑菌率均可达到50%以上;菌株N7和N16对立枯丝核菌的拮抗能力较好,抑菌率分别达到74.98±3.10%和75.87±2.69%;菌株N12对立枯丝核菌、辣椒疫霉菌和辣椒镰孢菌3种病原菌的拮抗能力均较强,抑菌率可达到55%以上(表 3)。
以往人们为追求辣椒增产而过分依赖化肥和农药,对环境和土壤造成较多负面影响,现在已经意识到生态环境与农业可持续发展的重要性,开始寻找化肥和农药的替代品。研究表明PGPR菌株具有固氮、溶磷、产生嗜铁素和分泌植物激素等能力,对植物生长具有促进作用[16]。徐姗姗[17]将PGPR菌液接种于烟草幼苗中,对烟草幼苗有显著的促生效果,也有学者将PGPR菌株制成菌肥作用于非宿主植物猫尾草和小黑麦上,猫尾草茎粗增加33.74%,小黑麦根平均直径和体积分别增加22.5%和152%,有明显的促生效果[18]。张英等[19]筛选优良牧草PGPR菌株,获得固氮菌71株、溶解无机磷菌株73株和溶解有机磷菌株78株。本研究筛选仅得到13株PGPR菌株,13株均具有固氮能力,7株可解有机磷,5株可解无机磷,分析原因可能是由于植物本身特性、不同地理气候、土壤理化性质等因素对根际微生物的数量产生的影响不同造成的[20-21]。徐伟慧等[22]在研究西瓜PGPR菌株分泌激素能力和菌株间拮抗作用中发现,12株PGPR均能分泌IAA,制成复合菌剂接种于西瓜幼苗,发现复合菌剂R2对西瓜幼苗根长、根表面积、根体积、根尖数和根部干重分别提高191.8%、302.4%、160.0%、206.5%和139.6%,具有明显的促生效应。本研究筛选到的PGPR菌株N1、N3和N16可分泌IAA,其中N1分泌IAA可达到18.49 μg/mL,说明这3株PGPR菌株对植物生长有潜在的促生能力。
研究发现在农业生产中使用PGPR菌株不仅能有效提高植物产量,PGPR菌株对植物病害还有较好的生防功能。李海云等[23]筛选获得的57株PGPR菌株中有固氮菌24株,溶磷菌33株,其中NCRP2菌株对小麦长蠕孢病菌Helminthosporium triticivulgaris、番茄早疫病菌Alternaria solani、黄瓜枯萎病菌F. oxysporum、马铃薯立枯丝核病菌R. solani、油菜菌核病菌Sclerotinias clerotiorum和玉米小斑病菌Bipolaria maydis均有抑制作用。Gowtham等[24]在温室实验中用PGPR菌株对辣椒种子进行预处理并接种病原菌C. truncatum,发现实验组抗病效果显著,其中B. amyloliquefaciens抗病率最高达到71%,且与对照组相比,PGPR菌株处理过的辣椒种子的发芽率、幼苗活力、株高、鲜重、干重和叶片数均有不同程度的提高。本研究13株PGPR菌种中T22、N3、N7、N8、N9、N12和N32都属于Bacillus,且T22、N7和N12都对病原菌有较强的拮抗能力,T22和N12对本实验中的4种病原菌均有拮抗功能,N7对R. solani的拮抗率高达74.98±3.10%。PGPR菌株绿脓假单胞菌SLC-2和枯草芽孢杆菌YJ20能有效拮抗9种病原真菌,抑制病原真菌菌丝和孢子的正常生长;两菌株处理感染尖孢镰刀菌的紫花苜蓿后,可以显著提高紫花苜蓿木质素、抗氧化酶活性(SOD、CAT、POD、PAL、LOX)以及病程相关蛋白含量(几丁质酶、β-1,3葡聚糖酶),提高紫花苜蓿抗病能力[25]。本研究中,菌株T22、N1、N7、N12和N16能有效拮抗4种辣椒病原真菌,抑制病原菌正常生长,表示这5株PGPR菌株对植物生长有潜在的抗病能力。
研究表明当PGPR菌株实际应用于作物时,其性能将会受到土壤、植物、气候、温度、土壤微生物等诸多因素影响,因此本研究中所得PGPR菌株还需要盆栽实验以进行进一步探究。
4 结论本试验从江苏省徐州市丰县辣椒根际土壤中分离筛选出13株PGPR菌,通过形态学特征及16S rDNA序列比对鉴定分别属于Bacillus、Pseudomonas、Lelliottia、Siccibacter、Achromobacter、Microbacterium和Paenibacillus;13株PGPR菌株均有固氮功能,其中7株可解有机磷,5株可解无机磷,3株具有分泌IAA能力,5株具有抗病能力。
| [1] |
袁龙刚, 张军林, 张朝阳, 等. 连作对辣椒根际土壤微生物区系影响的初步研究[J]. 陕西农业科学, 2006(2): 49-50. DOI:10.3969/j.issn.0488-5368.2006.02.026 |
| [2] |
王茹华, 周宝利, 张启发, 等. 嫁接对茄子根际微生物种群数量的影响[J]. 园艺学报, 2005, 32(1): 124-126. DOI:10.3321/j.issn:0513-353X.2005.01.030 |
| [3] |
袁龙刚, 张军林. 辣椒连作障碍的主要原因及其对策[J]. 中国农村小康科技, 2006(2): 32-33. DOI:10.3969/j.issn.1007-7774.2006.02.022 |
| [4] |
Bartlett DW, Clough JM, Godwin JR, et al. The strobilurin fungi-cides[J]. Pest Management Science, 2002, 58(7): 649-662. DOI:10.1002/ps.520 |
| [5] |
邱德文. 我国植物病害生物防治的现状及发展策略[J]. 植物保护, 2010, 36(4): 15-18. DOI:10.3969/j.issn.0529-1542.2010.04.004 |
| [6] |
胡江春, 薛德林, 马成新, 等. 植物根际促生菌(PGPR)的研究与应用前景[J]. 应用生态学报, 2004, 15(10): 1963-1966. DOI:10.3321/j.issn:1001-9332.2004.10.052 |
| [7] |
张亮, 盛浩, 袁红, 等. 根际促生菌防控土传病害的机理与应用进展[J]. 土壤通报, 2018, 49(1): 220-225. |
| [8] |
李交昆, 余黄, 曾伟民, 等. 根际促生菌强化植物修复重金属污染土壤的研究进展[J]. 生命科学, 2017, 29(5): 24-32. |
| [9] |
邱天, 张丽辉. 植物促生菌促进盐生环境植物生长的研究进展[J]. 北方园艺, 2017(24): 198-204. |
| [10] |
Vessey JK. Plant growth promoting rhizobacteria as biofertilizers[J]. Plant and Soil, 2003, 255(2): 571-586. DOI:10.1023/A:1026037216893 |
| [11] |
刘泽平, 王志刚, 徐伟慧, 等. 水稻根际促生菌的筛选鉴定及促生能力分析[J]. 农业资源与环境学报, 2017, 35(2): 119-125. |
| [12] |
荣良燕, 姚拓, 黄高宝, 等. 植物根际优良促生菌(PGPR)筛选及其接种剂部分替代化肥对玉米生长影响研究[J]. 干旱地区农业研究, 2013, 31(2): 59-65. DOI:10.3969/j.issn.1000-7601.2013.02.012 |
| [13] |
蒋永梅.四种植物根际促生菌筛选及生物菌肥效果研究[D].兰州: 甘肃农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10733-1017825084.htm
|
| [14] |
吕雅悠, 于迪, 丁方丽, 等. 促植物生长根际细菌A21-4对田间辣椒生长及根际土壤微生态环境的影响[J]. 中国生物防治学报, 2016(1): 86-92. |
| [15] |
张杨, 文春燕, 赵买琼, 等. 辣椒根际促生菌的分离筛选及生物育苗基质研制[J]. 南京农业大学学报, 2015, 38(6): 950-957. |
| [16] |
田婧, 李邵, 马宁, 等. 植物根际促生菌作用机理研究进展[J]. 安徽农业科学, 2016, 44(10): 1-2. DOI:10.3969/j.issn.0517-6611.2016.10.001 |
| [17] |
陈姗姗.植物根际促生菌(PGPR)的鉴定及其对植物生长的影响[D].重庆: 重庆师范大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10637-1018121188.htm
|
| [18] |
蒋永梅, 高亚敏, 姚拓, 等. 植物根际促生菌(PGPR)对非宿主植物猫尾草和小黑麦生长的促生作用[J]. 草业科学, 2018, 35(8): 1910-1918. |
| [19] |
张英, 刘育红, 李淑娟, 等. 4种优良牧草根际PGPR分布特征研究[J]. 黑龙江畜牧兽医, 2016(3): 133-136. |
| [20] |
罗菲, 汪涯, 曾庆桂, 等. 东乡野生稻根际可培养细菌多样性及其植物促生活性分析[J]. 生物多样性, 2011, 19(4): 476-484. |
| [21] |
谢建坤, 胡标林, 万勇, 等. 东乡普通野生稻与栽培稻苗期抗旱性的比较[J]. 生态学报, 2009, 30(6): 1665-1674. |
| [22] |
徐伟慧, 吕智航, 史一然, 等. 西瓜复合根际促生菌剂构建与促生效应研究[J]. 浙江农业学报, 2018, 30(5): 103-111. |
| [23] |
李海云, 蒋永梅, 姚拓, 等. 蔬菜作物根际促生菌分离筛选、鉴定及促生特性测定[J]. 植物保护学报, 2018, 45(4): 836-845. |
| [24] |
Gowtham HG, Murali M, Brijesh SS, et al. Plant growth promoting rhizobacteria-, Bacillus amyloliquefaciens, improves plant growth and induces resistance in chilli against anthracnose disease[J]. Biological Control, 2018, 126: 209-217. DOI:10.1016/j.biocontrol.2018.05.022 |
| [25] |
刘艳玲. PGPR抑制紫花苜蓿根腐病的作用研究[D].哈尔滨: 哈尔滨师范大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10231-1018016025.htm
|