木聚糖是植物细胞壁的重要组成成分。作为最常见的半纤维素, 它连接细胞壁中的木质素和纤维素, 是人类谷物来源食物的常见成分。木聚糖是自然界中除纤维素外第二丰富的可再生生物质多糖, 并广泛存在于硬木(15%-30%)、软木(7%-10%)和草本类植物中(低于30%)[1]。木聚糖的主链由木糖单元经β-1, 4-糖苷键连接而成, 而其支链结构由于来源的不同而有所差异。异质性木聚糖侧链的存在限制了β-1, 4-内切木聚糖酶和β-木糖苷酶与木聚糖的结合, 从而降低了木聚糖的可降解性。侧链的组成成分主要包括阿拉伯糖、乙酸、阿魏酸和4-甲基葡萄糖醛酸等。因此, 对于异质性木聚糖、尤其是如玉米糠类侧链结构极为复杂的异质性木聚糖, 侧链必须首先被相应的阿拉伯呋喃糖苷酶、乙酰酯酶、阿魏酸酯酶和α-葡萄糖醛酸酶降解, 才能使木聚糖主链发生有效的降解。木聚糖完全降解成单糖组分, 需要不同酶混合使用, 这包括内切-1, 4-β-木聚糖酶(EC3.2.1.8)、β-D-木糖苷酶(EC3.2.1.37)、α-L-阿拉伯呋喃糖苷酶(EC 3.2.1.55)、α-葡糖醛酸糖苷酶(EC 3.2.1.139)、乙酰木聚糖酯酶(EC 3.1.1.72)和阿魏酸酯酶(EC 3.1.1.73)[2]。
阿拉伯呋喃糖苷酶在木聚糖酶法解聚中的功能是从异质性阿拉伯葡萄糖醛酸木聚糖的木糖主链去除阿拉伯糖侧链。阿拉伯呋喃糖苷酶主要存在于4个不同的家族(GH43、GH51、GH54和GH62)[3], 它们使用反转(GH 43)或保留(GH 51、GH54)的机制来水解阿拉伯呋喃糖苷键。其中GH43家族的阿拉伯呋喃糖苷酶最为常见; 此家族的成员具有不同的底物特异性。根据底物特异性, 阿拉伯呋喃糖苷酶可分为3大类:(1)A型酶:仅对短链寡糖和pNP-α-L-阿拉伯呋喃糖苷有活性[4]; (2)B型酶:底物特异性更广, 能降解短寡糖和长多糖(如阿拉伯木聚糖和阿拉伯聚糖)[5]; (3)C型酶:主要对阿拉伯木聚糖有活性[6-8]。
由于阿拉伯糖侧链和木聚糖主链连接方式的不同, 即使对于降解阿拉伯木聚糖寡糖的阿拉伯呋喃糖苷酶, 还可以进一步依据它们是否仅从单取代的木糖残基(Ara-m)[9-11]或仅从双取代的木糖残基(Ara-d)中释放α-L-阿拉伯糖[12-15]来区分。例如, Ara-m是最常见的阿拉伯呋喃糖苷酶, 它们只降解单取代的阿拉伯呋喃糖苷键, 在所有GH家族中均能找到; 而从双取代的木糖主链切割α-(1→3)-连接的阿拉伯呋喃糖的酶则可被命名为Ara-d3, 表明该酶可对于双取代底物切割的特异性。同Ara-m阿拉伯呋喃糖苷酶相比, Ara-d型阿拉伯呋喃糖苷酶发现的非常少[16]。玉米糠富含异质性木聚糖, 其上有丰富的2, 3-双取代阿拉伯糖侧链, 一般的阿拉伯呋喃糖苷酶均不能将其降解, 因而阻碍了将其进行资源化利用。为了找到适于降解此类异质性木聚糖的新阿拉伯呋喃糖苷酶, 本研究从稻平脐蠕孢(Bipolaris oryzae)中克隆得到一个序列新颖的GH43家族酶基因BoAra43A, 将其进行重组表达和并进行了生化性质表征。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒稻平脐蠕孢(B. oryzae)由中国普通微生物菌种保藏管理中心保存, 编号CGMCC 3.13730。大肠杆菌(Escherichia coli)Trans1-T1用于质粒的构建和扩增、Transetta(DE3)用于重组蛋白的表达, 均购于北京全式金生物技术有限公司。pET-28a(+)质粒用于在大肠杆菌中表达重组蛋白。
1.1.2 试剂限制性内切酶Eco RI、Not I和Bgl II购于Thermo Scientific公司; 2× Phanta Max Master Mix, 2× ClonExpress Mix购于诺唯赞公司; 异丙基硫代-β-D-半乳糖苷(IPTG)购自北京索莱宝公司; 质粒小提试剂盒购于天根生物技术有限公司; 真菌基因组提取试剂盒和DNA纯化试剂盒购于Omega Bio-Tek公司; BSA蛋白定量试剂盒购自Thermo Scientific公司。对硝基苯基-α-L-阿拉伯呋喃糖苷(pNPA)购自Sigma公司。水溶性小麦阿拉伯木聚糖及32-α-L-arabinofuranosyl-(1, 5)-α-L-arabinotriose、23, 33-di-α-L-arabinofuranosyl-xylotriose(A2, 3XX)、23, 33-di-α-L-arabinofuranosyl-xylotetraose(XA2, 3XX)、32-α-L-Arabinofuranosyl-xylobiose(A3X)、33-α-L- plus 23-α-L-arabinofuranosyl-xylotetraose(XA3XX/XA2XX)mixture、33-α-L-arabinofuranosyl-xylotetraose(XA3XX)、23-α-L-arabinofuranosyl-xylotriose(A2XX)和arabinopentaose、22, 32-di-α-L-arabinofuranosyl-(1, 5)-α-L-arabinotriose plus 32-α-L-arabinofuranosyl-(1, 5)-α-L-arabinotetraose等寡糖均购于Megazyme公司。
1.1.3 培养基马铃薯培养基PD(Potato dextrose)用于活化稻平脐蠕孢的菌株, 购自VWR公司, 固体中加入2%琼脂。LB培养基用于大肠杆菌的培养, 其成分为:酵母浸粉0.5%, 蛋白胨1%, 氯化钠1%。
1.2 方法 1.2.1 α-L-阿拉伯呋喃糖苷酶基因BoAra43A的克隆将稻平脐蠕孢CGMCC 3.13730于28℃在PDB培养基中培养5-7 d, 过滤收集菌丝压干, 加入液氮速冻, 反复研磨破碎菌体, 参考说明方法使用真菌基因组提取试剂盒提取基因组DNA。通过BLAST分析, 从稻平脐蠕孢的基因组中分析发现一个GH43家族的酶, 经预测其可能有一个内含子, 因此设计引物(F1/R1和F2/R2, 表 1), 通过PCR扩增获得目的基因。扩增程序为:95℃预变性5 min; 95℃ 30 s, 62℃ 30 s, 72℃ 1 min 30 s, 共35个循环; 72℃ 10 min。将扩增得到的目的基因片段再经overlap PCR扩增得到全长基因, 纯化后连接pET-28a(+)载体, 进行测序。
将BoAra43A目的片段(已去除内含子和编码信号肽的部分)与pET-28a(+)载体连接, 转化Trans1-T1, 通过PCR和测序筛选获得重组表达质粒pET28a-BoAra43A。将表达质粒转化Transetta(DE3)感受态细胞, 涂布于含有卡那霉素和氯霉素的LB固体平板, 37℃培养12 h。挑取单克隆到50 mL LB培养基中过夜培养; 按2%接种量接入300 mL LB培养基, 37℃摇床培养至菌浓OD600达到0.6-0.8左右, 加入IPTG至终浓度为1 mmol/L, 16℃摇床继续培养16 h。菌液于12 000× g离心2 min收集菌体。用NTA20磷酸盐缓冲液(20 mmol/L Na2HPO4-NaH2PO4, 50 mmol/L NaCl, 20 mmol/L咪唑)重悬细胞, 超声破碎菌体, 离心收集上清。用镍亲和层析柱纯化重组蛋白BoAra43A:用含不同浓度梯度咪唑(NTA20、40、60、80、100、200、400和500)的缓冲液(20 mmol/L Na2HPO4-NaH2PO4, 50 mmol/L NaCl, 20 mmol/L-500 mmol/L咪唑)洗脱目的蛋白, 收集不同浓度梯度的洗脱液进行SDS-PAGE蛋白电泳检测纯度。合并纯化蛋白, 使用超滤管离心法将纯化后蛋白的缓冲液置换为20 mmol/L Tris-HCl, 150 mmol/L NaCl, pH 7.4。
1.2.3 底物特异性将0.5 μmol/L的酶和10 mg/mL的小麦阿拉伯木聚糖(WAX)、玉米糠(CX)、玉米糠碱提物(CX-NaOH)和200 μg/mL寡糖(9种), 2 mmol/L pNPA分别混合, 在50℃, pH 5.0的条件下孵育4 h, 对前3种多糖底物, 使用DNS法测定还原糖的释放; 对寡糖, 采用HPAEC-PAD的方法来测定酶活性; 对pNPA, 使用1 mol/L Na2CO3终止反应, 在OD405处测定吸光度值。
1.2.4 BoAra43A的最适温度、最适pH、热稳定性和pH稳定性测定最适温度:在pH5.0的条件下, 将0.5 μmol/L的酶和10 mg/mL的WAX底物混合, 于不同温度下(30-80℃)孵育20 min, 以DNS法测定释放的还原糖。最适pH:将0.5 μmol/L的酶和10 mg/mL的WAX底物在pH 2.0-12.0的不同缓冲液中混合, 于50℃反应20 min, 测定还原糖。所用缓冲液如下:0.2 mol/L甘氨酸-盐酸pH 2.0-3.0;0.2 mol/L磷酸氢二钠-柠檬酸pH 4.0-7.0;0.2 mol/L Tris-HCl缓冲液pH 8.0-9.0;0.2 mol/L甘氨酸-氢氧化钠缓冲液pH 10.0-12.0。热稳定性:将0.5 μmol/L的重组酶于pH 5.0分别在40℃、50℃和60℃处理1 h, 在不同时间点取样(0、10、30、45、60和120 min), 在50℃和pH 5.0条件下测定剩余酶活。pH稳定性:将酶首先在不同pH值的缓冲液中37℃处理1 h, 再在50℃和pH 5.0条件下测定剩余酶活。
1.2.5 比活力和动力学参数的测定1个酶活性单位(U)定义为在最适反应条件(pH 5.0, 50℃)下, 每分钟分解底物WAX生成1 μmoL阿拉伯糖所需的酶量; 酶的活性相对于酶量的比值即为酶的比活力(每毫克蛋白所含的酶活力单位)。对于动力学参数, 在50℃和pH 5.0条件下测定酶在不同浓度底物WAX(1-10 mg/mL)下的酶活, 利用米氏方程双倒数法(Lineweaver-Burk)作图并绘制曲线, 求出Km值和Vmax。
1.2.6 离子色谱分析水解产物对于小麦阿拉伯木聚糖, 将0.5 μmol/L的酶和10 mg/mL的底物混合, 在50℃、pH 5.0条件下反应4 h。对于寡糖类底物, 则将0.5 μmol/L的酶和200 μg/mL的底物混合, 同样条件下反应4 h。水解产物做适当稀释后进行离子色谱分析。具体为:底物为WAX的反应产物稀释100倍, 其他底物均稀释10倍。离子色谱仪器为赛默飞Chromeleon高效液相色谱分析系统, 色谱分离柱为CarboPacTM PA100(4.0×250 mm, 8.5 μm), 流动相A(超纯水), 流动相D(1 mol/L的NaOH); 梯度洗脱条件100% A洗脱4 min, 0-100% D洗脱16 min, 100% D洗脱6 min。
1.2.7 BoAra43A和PsAra43A的协同作用将0.5 μmol/L的BoAra43A和0.5 μmol/L的PsAra43A, 加入至450 μL的10 mg/mL玉米糠碱提物(CX-NaOH)中。协同作用测定了3种酶的添加方式, 即(1)同时加入两种酶, 在pH 5.0、50℃条件下一共反应4 h; (2)首先加入BoAra43A, 在pH 5.0、50℃条件下反应4 h, 之后置于100℃沸水中煮沸10 min终止反应, 再加入PsAra43A继续反应4 h; (3)首先加入PsAra43A, 在pH 5.0、50℃条件下反应4 h, 之后置于100℃沸水中煮沸10 min终止反应, 再加入BoAra43A继续反应4 h。通过DNS法测定所释放的还原糖并计算协同效应(Degree of synergy, DoS)。DoS定义为加入两种酶的反应中, 所产生的总还原糖与各单酶反应产生还原糖简单相加总和的比值。
1.2.8 碱提玉米糠木聚糖的制备制备步骤如下:(1)玉米淀粉加工副产物玉米麸皮100 g, 1:6(W/V)比例加入去离子水, 加热至90℃, 按(30 U/g)比例加入淀粉酶消化; (2)纱布过滤, 水洗3遍滤渣, 固形物置于恒温干燥箱50℃干燥; (3)粉碎机粉碎, 过50目筛; (4)按1:10(W/V)的比例加入1 mol/L的NaOH, 60℃恒温搅拌8 h; (5)自然冷却至室温, 1 mol/L HCl调节pH至6-7;(6)12 000×g离心20 min, 取上清液; (7)上清液与无水乙醇按照1:4的比例加入无水乙醇, 静置2 h, 获得沉淀物; (8)沉淀物在40℃条件下恒温干燥, 粉碎即得粗提玉米糠木聚糖。粗提玉米糠木聚糖得率为原料玉米糠质量的23%。
2 结果 2.1 BoAra43A基因的克隆与序列分析通过PCR从稻平脐蠕孢的基因组中扩增得到一条长1 593 bp的基因。生物信息学分析发现, 该基因编码长度为531个氨基酸的多肽且无信号肽。所编码的蛋白预测有3个N糖基化位点, 分别为Thr81、Thr138和Thr207;计算的蛋白分子量为57.85 kD, 等电点为8.69。BlastP比对结果显示BoAra43A属于GH43家族, 与来源于特异腐质霉的、已知能降解玉米糠侧链的阿拉伯呋喃糖苷酶HiAXHd3的一致性为63%(图 1)。通过序列比对分析, 结合对已报道的GH43家族阿拉伯呋喃糖苷酶的晶体结构分析发现, GH43家族中3个保守的催化残基在BoAra43A也存在, 分别为Asp46、Asp170和Glu218(图 1)。和阿拉伯木聚糖结合相关的残基在HiAXHd3中为His272、Asp291和Arg297, 在BoAra43A中, 相对应的残基也为His272、Asp291和Arg297(图 1)。这些保守氨基酸残基说明BoAra43A可能存在阿拉伯呋喃糖苷酶的活性。

|
| ▲:催化残基(红色); ■:和阿拉伯木聚糖互作的残基(黄色) 图 1 BoAra43A和特异腐质霉阿拉伯呋喃糖苷酶HiAXHd3的氨基酸序列比对 |
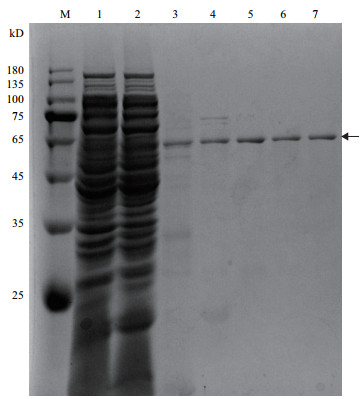
用镍柱纯化大肠杆菌中表达的重组蛋白, SDS-PAGE验证结果如图 2, 其表观分子量与理论值基本相符(箭头所指)。
|
| M:蛋白分子量标准; 泳道1:穿透峰; 2-7:洗脱收集液 图 2 重组蛋白BoAra43A的纯化 |
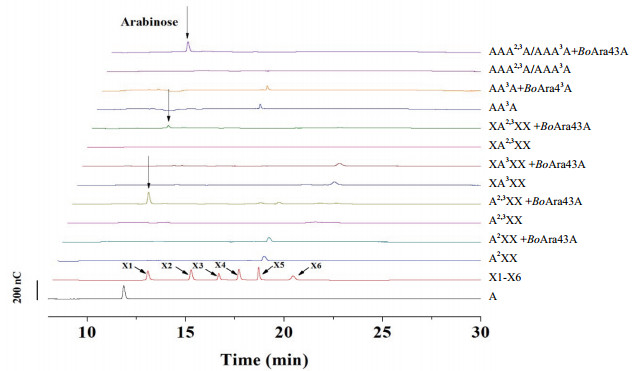
以10 mg/mL的小麦阿拉伯木聚糖、玉米糠和玉米糠碱提物(主要成分之一为木聚糖)作为底物, 在50℃、pH 5.0的条件下进行还原糖测定, 发现BoAra43A对3种底物均可测得一定活性, 其中对小麦阿拉伯木聚糖的活性最高。使用HPAEC-PAD分析(图 3)发现, 从3种底物中均只释放出阿拉伯糖为最终产物, 证明BoAra43A为阿拉伯糖呋喃糖苷酶。以pNPA为底物, 却未能检测到BoAra43A对其的相关活性。

|
| A:阿拉伯糖; X1-X6:木糖-木六糖; CX:玉米糠(含异质性木聚糖); CX-NaOH:碱抽提的玉米糠(含异质性木聚糖); WAX:小麦阿拉伯木聚糖。箭头所指处为阿拉伯糖 图 3 离子色谱分析BoAra43A降解多糖的反应产物 |
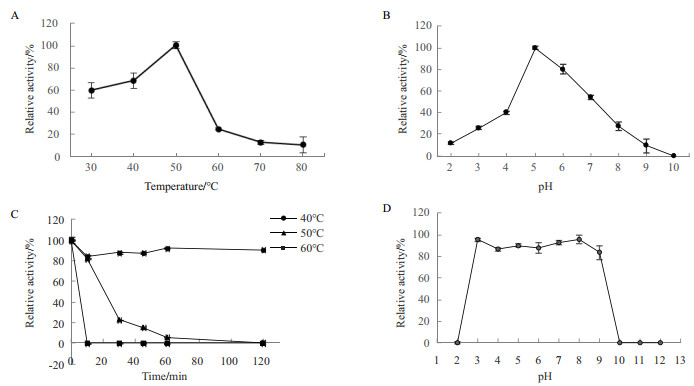
选择活性最高的小麦阿拉伯木聚糖为底物, 测得BoAra43A的最适温度为50℃, 在40℃仍有68%活性, 在30℃有60%活性。当孵育温度从50℃升为60℃, 酶活快速下降至25%, 并缓慢下降至80℃的12%(图 4-A)。BoAra43A的最适pH为5.0, 在pH 3.0时仍有20%活性, 在pH 7.0时有50%活性, 但在pH 2.0和9.0活性下降至几乎检测不到(图 4-B)。该酶在40℃和50℃温浴10 min均可保持85%左右的酶活性, 在60℃温浴10 min则基本丧失酶活力。在40℃保温2 h后, 阿拉伯呋喃糖苷酶BoAra43A还可保持80%酶活性。但在50℃温浴30 min只剩下20%左右的酶活性, 温浴1 h基本丧失酶活力(图 4-C)。在pH 2.0-12.0的范围内37℃保温1 h, BoAra43A均可以保持80%左右的酶活力(图 4-D)。对小麦阿拉伯木聚糖, BoAra43A的比活为191.21 U/mg, 动力学常数Km和kcat分别是9.54 mg/mL和1.043×10-3 s-1。
|
| A:最适温度; B:最适pH; C:热稳定性; D:pH稳定性 图 4 温度及pH对BoAra43A的影响测定 |
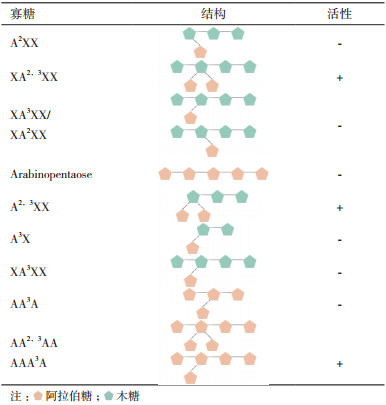
从上述对多糖的离子色谱分析表明, BoAra43A特异的从多糖中释放出阿拉伯糖。为了进一步分析其作用模式, 选取了9种含阿拉伯糖的寡糖作为底物同BoAra43A进行孵育, 并以离子色谱进行分析(图 5)。表 2是这9种含阿拉伯糖的寡糖的结构模式图及降解结果汇总。除了阿拉伯五糖, 这9种寡糖分别以木糖或阿拉伯糖聚合体作为主链, 但均带有阿拉伯糖的侧链, 阿拉伯糖侧链分别以α-(1→2)和α-(1→3)键和主链连接。结果表明, BoAra43A仅能与A2, 3XX、XA2, 3XX、AA2, 3AA/AAA3A这3种底物反应产生阿拉伯糖, 与A2XX、XA3XX和AA3A均不反应。这些结果(图 5)显示, BoAra43A只能特异识别侧链上具有双取代的寡糖, 且不论主链是木寡糖还是阿拉伯寡糖。虽然XA2, 3XX可以被降解而单取代的XA3XX不能被降解, 但从反应产物分析来看, BoAra43A和A2, 3XX反应后生成了A2XX, 和XA2, 3XX反应后并未生成XA3XX(图 5), 暗示该酶特异识别的有可能是双取代侧链上α-(1→3)连接的阿拉伯糖。
|
| A为阿拉伯糖; X1-X6为木糖-木六糖; A2, 3XX(23, 33-di-α-L-arabinofuranosyl-xylotriose)、XA2, 3XX(23, 33-di-α-L-arabinofuranosyl-xylotetraose)、AA2, 3AA(22, 32-di-α-L-arabinofuranosyl-(1, 5)-α-L-arabinotriose)均为2, 3-双取代阿拉伯糖侧链的寡糖。AAA3A(32-α-L-arabinofuranosyl-(1, 5)-α-L-arabinotetraose)、AA3A(32-α-L-arabinofuranosyl-(1, 5)-α-L-arabinotriose)、XA3XX(33-α-L-arabinofuranosyl-xylotetraose)和A2XX(23-α-L-arabinofuranosyl-xylotriose)为含单取代阿拉伯糖侧链的寡糖 图 5 BoAra43A降解寡糖底物的产物的离子色谱分析 |
PsAra43A是来源于Paenibacillus sp. Strain E18的GH43阿拉伯呋喃糖苷酶, 可能降解α-(1→2)或α-(1→3)的单取代阿拉伯糖侧链, 其作用模式不同于BoAra43A。该酶能降解小麦阿拉伯木聚糖, 但却对碱抽提的玉米木聚糖和脱淀粉玉米糠无任何活性。因此, 分别选取0.5 μmol/L的BoAra43A和PsAra43A和碱抽提后的玉米木聚糖进行反应。从图 6可看出, 在等比例BoAra43A和PsAra43A条件下, 同时加入两种酶, 或先加PsAra43A再加BoAra43A并未产生协同降解的作用; 但当先加入BoAra43A孵育4 h以去除2, 3-双取代上3号位的阿拉伯糖侧链后, 反应总体上释放的阿拉伯糖大大增强, 具强烈的协同作用(协同系数=1.34)。
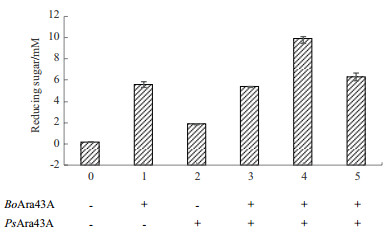
|
| 对于反应3、4和5, 其区别在于:反应3是两种酶同时加入; 反应4为先加入BoAra43A再加入PsAra43A;反应5先加入PsAra43A再加入BoAra43A 图 6 BoAra43A与PsAra43A协同降解碱抽提玉米木聚糖 |
农业生产过程中会产生大量废弃物, 如农作物收获时残留在农田内的农作物秸秆(包括玉米秸、高粱秸、稻草和小麦秸秆等)以及在农作物加工过程中产生的废弃物, 如米糠、麦麸和玉米糠(或称为玉米皮)等[16], 它们都属于可再生的生物质资源。然而由于植物纤维结构的复杂性, 使用糖苷水解酶来降解其中的一些生物质多糖效率还不高[17]。例如, 在生产生物燃料和生物基化学品时酶的成本是产品的主要成本之一; 而在养殖领域, 虽然添加饲料酶已成为提高饲料转化率和降低养殖成本的标准做法, 但玉米糠由于其极为复杂的侧链结构, 很少有酶能有效的将其降解, 因此阻碍了玉米中营养成分的释放和进一步将其资源化利用。
本研究从稻平脐蠕孢中克隆得到一个序列新颖的GH43家族阿拉伯呋喃糖苷酶基因BoAra43A, 并成功将该基因在大肠杆菌中进行了表达。分析发现, BoAra43A能降解小麦阿拉伯木聚糖、经预处理或未经处理的玉米糠木聚糖; 该酶只和寡糖如A2, 3XX、XA2, 3XX和AA2, 3AA/AAA3A进行反应, 反应产物均释放出阿拉伯糖; 该酶对所测定的侧链单取代的木寡糖没有任何的降解, 因此可以推断, BoAra43A所降解的键型为侧链双取代上3号位的糖苷键, 这与已报道的具降解双取代阿拉伯糖侧链的阿拉伯呋喃糖苷酶的性质一致。有意思的是, 对于具有这种糖苷键连接的寡糖, 不论主链是木寡糖还是阿拉伯寡糖均能被降解; 这可能是由于阿拉伯糖和木糖具有非常相似的分子结构, 因而BoAra43A的底物结合口袋可以容纳不同的寡糖主链。
目前, 发现能降解双取代阿拉伯糖侧链的阿拉伯呋喃糖苷酶还较少。此前发现的3个能够降解双取代阿拉伯木聚糖上的阿拉伯呋喃糖苷酶, 两个分别来自特异腐质霉和青春双歧杆菌的GH43酶, 其中又以特异腐质霉的阿拉伯呋喃糖苷酶HiAXHd3研究较多。另一个则来自于青春双歧杆菌的GH51家族酶AbfB[18]。来源于稻平脐蠕孢(Bipolaris oryzae)的BoAra43A为第3个来自GH43的阿拉伯呋喃糖苷酶, 可降解双取代阿拉伯木聚糖上3号位的阿拉伯糖。来源于特异腐质霉H. insolens的HiAXHd3的最适pH为6.7, 最适温度为53℃。来源于青春双歧杆菌GH43酶的最适pH为6.0, 最适温度为40℃。两个酶均不能降解pNPA, 可降解阿拉伯聚糖[12]。来源于青春双歧杆菌GH51的最适pH为6.0, 最适温度为30℃(以pNPA为底物检测), 可以水解pNPA, 但不能降解pNPX, 它在支链阿拉伯聚糖上有活性, 但在线性阿拉伯聚糖上几乎没有活性, 在阿拉伯聚糖上仅具有微弱的活性[18]。BoAra43A和HiAXHd3的氨基酸序列与HiAXHd3的一致性为63%, 与其他阿拉伯呋喃糖苷酶相比是最高的。与阿拉伯木聚糖结合相关的残基在HiAXHd3中为His272、Asp291和Arg297[14], 在BoAra43A中也有, 相对应的残基也为His272、Asp291和Arg297。这些保守氨基酸残基说明BoAra43A可能存在阿拉伯呋喃糖苷酶的活性。BoAra43A的最适温度为50℃, 最适pH为5.0;而HiAXHd3的最适温度为53℃, 最适pH为6.7。这两种酶分子量相近(HiAXHd3分子量为60.11 kD, BoAra43A为57.85 kD), 同源性也超过50%, 序列相似性可能与酶的底物特异性、最适温度和最适pH均有关[12]。重组酶HiAXHd3对人工合成的底物p-nitrophenyl-α-L-arabinofuranoside(pNPA)无活性[12]; 同样, 在BoAra43A上未能检测到针对pNPA的活性。
我们还测试了BoAra43A和PsAra43A在协同降解玉米糠来源的异质性木聚糖时的协同作用。PsAra43A是来源于芽孢杆菌的一个GH43家族的酶, 它可能特异识别、降解α-(1→2)或α-(1→3)连接的单取代阿拉伯糖侧链[15], 而BoAra43A降解的是双取代基团上的α-(1→3)阿拉伯呋喃糖残基。在等比例BoAra43A和PsAra43A条件下, 同时加入两种酶, 或先加PsAra43A再加BoAra43A并未产生协同降解的作用。但当先加入BoAra43A孵育一段时间以去除双取代的α-(1→3)-阿拉伯呋喃糖残基后, 最终反应释放出的阿拉伯糖大大增强, 证明两个酶之间具有强烈的协同作用(协同系数=1.34)。从酶的底物特异性可推断得出, 这种协同作用是通过BoAra43A从阿拉伯糖双取代的木聚糖中去除α-(1→3)连接的阿拉伯糖, 从而增加了可被PsAra43A降解的底物浓度。文献报道中PsAra43A从单取代侧链的α-(1→2)还是α-(1→3)的切割方式并未明确; 从本实验的数据中看来, PsAra43A可能是从单取代侧链的α-(1→2)连接而非α-(1→3)连接进行切割, 因此预先使用BoAra43A处理玉米糠木聚糖, 可以解除双取代侧链上α-(1→3)糖苷键对PsAra43A的空间位阻效应, 使得更多的酶能结合上底物并对其进行有效的降解。
4 结论本研究从稻平脐蠕孢中克隆、表达了一个新的阿拉伯呋喃糖苷酶BoAra43A, 它特异的从木寡糖或阿拉伯寡糖双取代的阿拉伯糖侧链上去除α-(1→3)-连接的阿拉伯糖, 并与PsAra43A在降解玉米糠木聚糖上表现出较强的协同性质。未来可以寻找和BoAra43A同时作用能协同降解玉米糠木聚糖的阿拉伯呋喃糖苷酶, 并对该酶的热稳定性和催化能力进行改造, 以更好地拓宽该酶的潜在应用价值。
| [1] |
雷钊, 尹达菲, 袁建敏. 阿拉伯木聚糖和阿拉伯低聚木糖的益生功能研究进展[J]. 动物营养学报, 2017, 29(2): 365-373. DOI:10.3969/j.issn.1006-267x.2017.02.001 |
| [2] |
Collins T, Gerday C, Feller G. Xylanases, xylanase families and extremophilic xylanases[J]. FEMS Microbiology Reviews, 2005, 29(1): 3-23. DOI:10.1016/j.femsre.2004.06.005 |
| [3] |
Henrissat B, Bairoch A. Updating the sequence-based classification of glycosyl hydrolases[J]. Biochemical Journal, 1996, 316(2): 695-696. DOI:10.1042/bj3160695 |
| [4] |
Pitson SM, Voragen AGJ, Beldman G. Stereochemical course of hydrolysis catalyzed by arabinofuranosyl hydrolases[J]. FEBS Letters, 1996, 398(1): 7-11. DOI:10.1016/S0014-5793(96)01153-2 |
| [5] |
Bourgois TM, Van Craeyveld V, Van Campenhout S, et al. Recombinant expression and characterization of XynD from Bacillus subtilis subsp. Subtilis ATCC 6051:A GH 43 arabinoxylan arabinofuranohydrolase[J]. Applied Microbiology and Biotechnology, 2007, 75(6): 1309-1317. DOI:10.1007/s00253-007-0956-2 |
| [6] |
Kormelink F, Searle-Van Leeuwen M, Wood T, et al. (1, 4)-β-D-arabinoxylan arabinofuranohydrolase:A novel enzyme in the bioconversion of arabinoxylan[J]. Applied Microbiology and Biotechnology, 1991, 35(2): 231-232. |
| [7] |
Kormelink F, Searl-Van Leeuwen M, Wood T, et al. Purification and characterization of a(1, 4)-β-D-arabinoxylan arabinofuranohydrolase from Aspergillus awamori[J]. Applied Microbiology and Biotechnology, 1991, 35(6): 753-758. |
| [8] |
Kellett LE, Poole DM, Ferreira L, et al. Xylanase B and an arabinofuranosidase from Pseudomonas fluorescens subsp. Cellulosa contain identical cellulose-binding domains and are encoded by adjacent genes[J]. Biochemical Journal, 1990, 272(2): 369-376. DOI:10.1042/bj2720369 |
| [9] |
Van Laere K, Beldman G, Voragen A. A new arabinofuranohydrolase from Bifidobacterium adolescentis able to remove arabinosyl residues from double-substituted xylose units in arabinoxylan[J]. Applied Microbiology and Biotechnology, 1997, 47(3): 231-235. |
| [10] |
Van Laere K, Voragen C, Kroef T, et al. Purification and mode of action of two different arabinoxylan arabinofuranohydrolases from Bifidobacterium adolescentis DSM 20083[J]. Applied Microbiology and Biotechnology, 1999, 51(5): 606-613. DOI:10.1007/s002530051439 |
| [11] |
Van den Broek LA, Lloyd RM, Beldman G, et al. Cloning and characterization of arabinoxylan arabinofuranohydrolase-d3(AXHd3)from Bifidobacterium adolescentis DSM 20083[J]. Applied Microbiology and Biotechnology, 2005, 67(5): 641-647. DOI:10.1007/s00253-004-1850-9 |
| [12] |
Sørensen HR, Jørgensen CT, Hansen CH, et al. A novel GH 43 α-L-arabinofuranosidase from humicola insolens:Mode of action and synergy with GH 51 α-L-arabinofuranosidases on wheat arabinoxylan[J]. Applied Microbiology and Biotechnology, 2006, 73(4): 850-861. DOI:10.1007/s00253-006-0543-y |
| [13] |
Mechelke M, Koeck D, Broeker J, et al. Characterization of the arabinoxylan-degrading machinery of the thermophilic bacterium Herbinix hemicellulosilytica—six new xylanases, three arabinofuranosidases and one xylosidase[J]. Journal of Biotechnology, 2017, 257: 122-130. DOI:10.1016/j.jbiotec.2017.04.023 |
| [14] |
McKee LS, Peña MJ, Rogowski A, et al. Introducing endo-xylanase activity into an exo-acting arabinofuranosidase that targets side chains[J]. Proceedings of the National Academy of Sciences, 2012, 109(17): 6537-6542. DOI:10.1073/pnas.1117686109 |
| [15] |
Shi P, Chen X, Meng K, et al. Distinct actions by Paenibacillus sp. strain E18 α-L-arabinofuranosidases and xylanase in xylan degradation[J]. Applied and Environmental Microbiology, 2013, 79(6): 1990-1995. DOI:10.1128/AEM.03276-12 |
| [16] |
史延通. 浅析我国农业生物质能开发利用现状及主要问题[J]. 吉林农业, 2011(5): 13. DOI:10.3969/j.issn.1003-8701.2011.05.004 |
| [17] |
郭月玲, 江海东, 张磊, 等. 我国主要能源植物及其开发利用的现状与前景[J]. 浙江农业科学, 2009(6): 1057-1062. DOI:10.3969/j.issn.0528-9017.2009.06.006 |
| [18] |
Lagaert S, Pollet A, Courtin CM, et al. β-xylosidases and α-L-arabinofuranosidases:Accessory enzymes for arabinoxylan degradation[J]. Biotechnology Advances, 2014, 32(2): 316-332. DOI:10.1016/j.biotechadv.2013.11.005 |