2. 洛阳市农林科学院, 洛阳 471023
2. Luoyang Academy of Agricultural and Forestry Sciences, Luoyang 471023
牡丹(Paeonia suffruticosa)是属于芍药科, 芍药属, 牡丹组的多年生落叶小灌木植物[1]。牡丹历史悠久, 牡丹可分为江南地区、中原地区、西南地区以及西北地区品种群。牡丹的观赏价值非常高, 其花朵艳丽多彩, 并且在医药和饮食方面的价值也备受关注[2-3]。大多数牡丹种植区位于山东省荷泽市, 河北省柏山市, 陕西省汉中市, 河南省洛阳市和四川省。据统计, 我国牡丹的种植面积大约在30 hm2[4]。
本研究对洛阳35个品种的牡丹利用ISSR进行分析。分子标记可以准确的反映出脱氧核糖核酸分子水平的遗传变异, 分子标记相对于生化标记、遗传标记、细胞标记这些传统的形态学标记来说有很多的优点, 如标记的数目多, 多态性高, 分布广泛, 没有环境限制等[5-6]。
简单重复序列间隔区(Inter-simple sequence repeats, ISSR)技术是以SSR的3'或5'端处连接上1-4个嘌呤或者嘧啶碱基之后作为引物, 然后对两侧具有反向排列的一段DNA序列PCR扩增, 然后再通过电泳和染色后, 根据是否有条带来分析不同植物间ISSR标记多态性[7-9]。AFLP和SSR技术是常见的牡丹遗传多样性分析技术, 侯小改等[10]用AFLP技术研究了30个来自不同地区的牡丹品种的遗传差异。陈杰等[11]对皖北的30个牡丹品种的利用SSR技术分析其遗传多样性。也有利用ISSR技术对四川地区、湖南地区、西南地区[12-14]的牡丹进行分析的报道, 而未见对洛阳地区不同品种牡丹进行ISSR遗传多样性分析的文章。因此, 本文将利用ISSR技术研究洛阳地区的35种牡丹的遗传多样性, 本文的目的在于为牡丹的合理利用以及牡丹资源管理奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试材料本实验所用的牡丹(表 1)均选自洛阳牡丹研究院, 选取有代表性的35种牡丹品种进行实验, 根据研究需要于2018年7-8月进行采摘。之后将采摘的牡丹存放于装有干燥硅胶的密封袋中备用。
1 mol/L的Tris-HCl(pH8.0)溶液; 氯仿; 异戊醇; 2% CTAB溶液; 3 mol/L的NaAC溶液; 0.5 mol/L EDTA(pH8.0)溶液; 冰酒精, β-羟基乙醇; 75%乙醇溶液; GoldView I型核酸染色剂; 1×TAE缓冲液; 2×Taq MasterMix混合液; 10×DNA loading buffer。
1.1.3 主要仪器SCIENTZ-48型高通量组织研磨器; SEDIG型梯度PCR仪; JA2003A型电子天平; K5500 Plus型超微量分光光度计; LX-200迷你离心机; TGL-16B台式离心机; Eppendorf AG型PCR仪; THZ-82A数显恒温振荡器; DYY-8C型电泳仪; 101-1AB型电热鼓风干燥箱; ChampChemi 610 Plus型全自动多色荧光及化学发光凝胶成像系统。
1.2 方法 1.2.1 牡丹DNA的提取本实验用改良的CTAB法提取DNA。我们将每种牡丹提取两组DNA选取浓度和纯度较好的进行实验。
取少量牡丹叶片放于2 mL印管, 然后放入一颗钢珠, 再将此印管放进组织研磨机中, 60 s后取出, 再加入1 000 µL 2%的CTAB溶液和8 µL β-羟基乙醇; 将印管放入水浴锅中65℃水浴1 h, 隔10 min倒置一次达到混匀的目的; 从水浴锅中取出后, 加入500 µL CI, 摇床摇10 min; 以12 000 r/min的转速常温离心10 min吸取上清液, 于1.5 mL离心管中; 再加入500 µL CI于1.5 mL离心管中, 摇床摇10 min; 12 000 r/min常温离心10 min吸取上清液约500 µL于1.5 mL离心管中; 加入二倍体积的冰酒精和1/10体积3 mol/L NaAC, 低温静置一晚上(-18℃); 保留白色球状物, 倒去溶液; 加600 µL 75%乙醇清洗两次。
清洗后5-10 min常温干燥DNA, 之后50℃烘干20 min左右; 加适量无菌水(50-100 µL)溶解DNA, 置于冰箱中冷藏。之后通过超微量分光光度计测定DNA的浓度与纯度, 过后将浓度与纯度较好(浓度在50 ng/mL左右)的DNA放入冰箱备用。
1.2.2 引物筛选及ISSR-PCR扩增任意选取6种牡丹品种的DNA用UBC公布的220种引物进行筛选, 进行初筛和复筛, 使用温度梯度模式选择合适的退火温度, 温度设定为45、50、55和59℃四个温度梯度, 最后筛选出12条能扩增出清晰条带的引物, 引物所用退火温度分别为50℃和55℃(表 2)。然后对牡丹样品进行ISSR-PCR扩增, PCR采用的是15 µL的体系, 经过多次实验后扩增体系选定的试剂是2×Taq MasterMix混合液(表 3)。经过反复试验确定最佳PCR扩增程序(表 4)。
PCR之后用电泳观察结果, 制备浓度为1%的胶。配胶之后, 将胶在电泳液中放置之后拿出以防加样孔中有气泡影响加样。第一个加样孔加入4 µL D2000 Ladder与1 µL Loadingbuffer混合液(将Ladder与Loadingbuffer放在手套上吹打以混匀)作为对照组, 之后的加样孔加入5 µL的扩增后的产物。电泳30-45 min(电压为120-130 V, 电流为100 mA), 在电泳完成后利用凝胶成像系统观察记录结果, 为后续实验做准备。
1.2.4 数据处理观察电泳图谱, 将无条带的位置记为0, 有条带记为1, 在excel表中列出0-1矩阵。再利用POPGENE32软件进行遗传分析, 使用软件计算多态位百分率、有效等位基因、Nei’s基因多样性、Shannon’s信息指数等[15]。使用NTSYSpc-2.10e得出UPGMA亲缘关系聚类图, 通过观察聚类图分析牡丹品种间的关系。
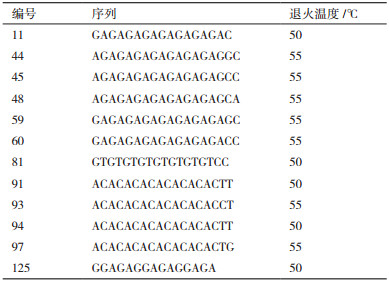
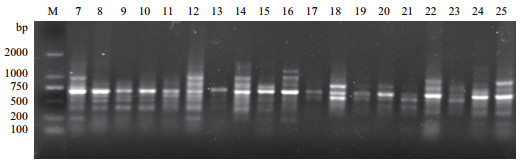
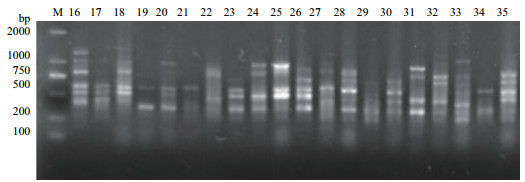
2 结果 2.1 ISSR扩增结果及多态性分析筛选出的12条引物扩增35种牡丹皆能产生清晰的条带(电泳结果图见图 1-图 3)。结果扩增出的130条条带中多态性的条带有125条, 多态性占比96.1%, 除97、93、91、60和48号引物外, 其余引物的多态性全部达到100%。其中97号引物的多态性比率为90%是最低的。而125号引物扩增出位点数最少(表 5)。表明12条引物的多态性良好, 35个牡丹品种的遗传多样性较丰富, 利用ISSR标记进行不同品种牡丹遗传多样性的分析是可行的。

|
| 图 1 11号引物的ISSR扩增图谱 |
|
| 图 2 45号引物的ISSR扩增图谱 |
|
| 图 3 59号引物的ISSR扩增图 |
将0-1矩阵从excel表中导入到popgene32, 对牡丹的多样性进行统计和计算分析, 结果平均Nei’s基因遗传多样性指数(He)为0.294 5, 最大值为0.418 7最小值为0.090 1, 平均Shannon信息指(H)为0.465 9, 最大值为0.609 5最小值为0.190 4。从上述得到的数据分析后得出35个牡丹品种遗传多样性丰富, 12条引物多态性良好。
2.3 牡丹的遗传关系聚类分析由12条引物对洛阳35个牡丹品种进行ISSR-PCR扩增获得的130个条带, 利用NTSYSpc-2.10e软件计算洛阳35个牡丹品种间的遗传相似系数, 遗传相似系数范围在0.553 8-1.0000之间, 其中遗传相似系数最小的为香玉和王红说明这两个品种亲缘关系较远。遗传相似系数最大的是璎珞宝珠和香玉的表示这两个品种亲缘关系较近。再根据遗传相似系数使用NTSYSpc-2.10e软件得到35种牡丹的UPGMA亲缘关系聚类图(图 4)。遗传相似系数以0.75为界, 能够将35个牡丹品种分为5类, 第1类包含5个品种可分为2个亚类, 第1亚类中包含3个品种, 依次为鹤顶红、文培紫和海棠争润。第2亚类包含2个品种为似荷连和锦袍红。第2类包含1个品种为银粉金鳞。第3类分为2个亚类第1亚类包括4个品种依次为大正之夸、皱叶红、迎日红和圣代。第2亚类包括金桂飘香、姚黄、朝阳红、红梅傲雪、绿蒂隐玉、紫兰魁、璎珞宝珠、香玉、红宝石和太阳。第4类分为2个亚类, 第1亚类包括CH5、王红、长枝英荣、映红、万花盛、玉楼点翠、大棕紫、景玉、花蝴蝶和蜂飞蝶舞。第2亚类包括佛门袈裟、海黄、雪桂和白王狮子。第5类的彩霞单独为一亚类。

|
| 图 4 洛阳35种牡丹的UPGMA亲缘关系聚类图 |
ISSR可以提供更多的基因组DNA信息是因为融合了SSR和RAPD的优点。因此, ISSR在分子标记、基因定位、亲缘关系分析、遗传多样性、辅助育种等方面已广泛应用[16]。ISSR标记技术对于牡丹来说具有很多优点, 其中包括多态性丰富、实验操作简单、重复性强、试验稳定性好[17-20]。因为ISSR分子标记技术优点众多所以本实验利用ISSR对不同品种的牡丹进行遗传多样性研究。用NTSYSpc-2.10e软件得出35个牡丹样品间的相似系数在0.533 8-1.0000之间, 其中遗传相似系数最小的为香玉和王红说明这两个品种的亲缘关系较远, 遗传相似系数最大是璎珞宝珠和香玉的说明这两个品种亲缘关系较近。
以遗传相似系数0.75为界, 能够将35个牡丹品种分为5类(代表品种如图 5), 第1类包含的5个品种分成了两个亚类, 第1亚类中包含3个品种, 依次为鹤顶红花为浅红色、文培紫花为紫色、海棠争润花为粉紫红色。第2亚类包含2个品种似荷连花色为粉紫色、锦袍红花色为紫红色。第2类包含银粉金鳞这一个品种花色深粉红色。第3类分为2个亚类第1亚类包括4个品种依次为大正之夸花为紫色、皱叶红花为浅红色、迎日红花为红色、圣代花为粉红色。第2亚类包括金桂飘香花为紫色、姚黄花为淡黄色、朝阳红花为粉红色、红梅傲雪花为粉色、绿幕隐玉花色初开为绿色盛开后为白色、紫兰魁花色为粉紫色、璎珞宝珠花为浅红色、香玉花初开浅粉色, 盛开洁白如玉、红宝石花为紫红色、太阳花大红色。第4类分为两个亚类, 第1亚类包括王红花为紫红色、CH5、长枝英荣、映红花为红色、万花盛花为浅红色、大棕紫花为紫红色、玉楼点翠花为白色、景玉花为白色、花蝴蝶花为红色、蜂飞蝶舞。第2亚类包括海黄花为黄色、佛门袈裟花为红色、白王狮子花为白色、雪桂花为白色。第5类的彩霞单独为一亚类, 花色为浅红色。由此可见, 35种牡丹并不一定按照花色进行分类, 只有亲缘关系较近时才会聚在一起。这一结果与安宗燕等[21]对紫斑牡丹品种的EST-SSR遗传多样性分析的结果一致。也与陈向明等[22]用RAPD技术对19个日本牡丹品种进行亲缘关系分析的结果一致。从研究后得出的结论和结果来看, ISSR技术是研究牡丹品种分类的理想工具之一。

|
| 图 5 聚类所得5大类牡丹代表品种图片 |
由于牡丹非常名贵, 牡丹的种质资源研究一直被人们所关注。因此牡丹的遗传多样性分析对于牡丹的种质资源管理是非常必要的。本研究采用改良的CTAB法以及PCR扩增从220条引物中筛选出12条引物, 多态性条带的占比为96.1%。用popgene32分析得出35种牡丹的平均Shannon信息指数H=0.465 9, 平均Nei's基因多样性指数He= 0.294 5, 说明35个牡丹品种遗传多样性丰富。利用NTSYS2.10e分析最后将35种牡丹分为5类。实验中的35种牡丹并不一定按照花色进行分类, 只有在亲缘关系较近时才会聚在一起。
| [1] |
陈法志, 陈镇, 戢小梅, 等. 油用牡丹种质资源及育种研究进展[J]. 江汉大学学报:自然科学版, 2019(2): 181-185. |
| [2] |
李潇云, 何彦超. 中国牡丹的传统利用价值及其当代文化创新[J]. 文教资料, 2016(24): 42-44. DOI:10.3969/j.issn.1004-8359.2016.24.020 |
| [3] |
何秀丽, 郑国生, 王宗正. 牡丹研究现状与进展[J]. 花木盆景(花卉园艺), 2006(2): 8-9. |
| [4] |
白喜婷, 朱文学, 罗磊, 等. 牡丹籽油的精炼及理化特性变化分析[J]. 食品科学, 2008(8): 351-354. DOI:10.3321/j.issn:1002-6630.2008.08.078 |
| [5] |
张俊卫, 包满珠. 分子标记在观赏植物分类中的应用阴[J]. 北京林业大学学报, 1998, 2: 85-89. DOI:10.3321/j.issn:1000-1522.1998.02.017 |
| [6] |
张应华, 刘荣, 许彬. 分子标记在蔬菜作物上的应用田[J]. 云南农业大学学报, 2002, 17(3): 287-289. DOI:10.3969/j.issn.1004-390X.2002.03.022 |
| [7] |
孙洪, 程静, 詹克慧, 等. ISSR标记技术及其在作物遗传育种中的应用[J]. 分子植物育种, 2005, 3(1): 123-127. DOI:10.3969/j.issn.1672-416X.2005.01.021 |
| [8] |
解新明, 卢小良. SSR和ISSR标记及其在牧草遗传与育种研究中的应用前景[J]. 草业科学, 2005, 22(2): 30-37. DOI:10.3969/j.issn.1001-0629.2005.02.008 |
| [9] |
朴红梅, 李万良, 穆楠, 等. ISSR标记的研究与应用[J]. 吉林农业科学, 2007, 32(5): 28-30. DOI:10.3969/j.issn.1003-8701.2007.05.008 |
| [10] |
侯小改, 尹伟伦, 李嘉珏, 等. 部分牡丹品种遗传多样性的AFLP分析[J]. 中国农业科学, 2006, 39(8): 1709-1715. DOI:10.3321/j.issn:0578-1752.2006.08.027 |
| [11] |
陈杰, 蔡健, 李浩, 等. 基于EST-SSR标记和表型性状的皖北部分牡丹品种遗传多样性分析[J]. 阜阳师范学院学报:自然科学版, 2018, 35(4): 37-42. |
| [12] |
童芬, 谢登峰, 曾心美, 等. 四川牡丹和圆裂四川牡丹遗传多样性的ISSR分析[J]. 西北植物学报, 2016, 36(10): 1968-1976. DOI:10.7606/j.issn.1000-4025.2016.10.1968 |
| [13] |
张旻桓, 金晓玲, 成仿云, 等. 湖南产牡丹遗传多样性的ISSR分析[J]. 中草药, 2016, 47(7): 1193-1198. |
| [14] |
李宗艳, 秦艳玲, 蒙进芳, 等. 西南牡丹品种起源的ISSR研究[J]. 中国农业科学, 2015, 48(5): 931-940. |
| [15] |
林立, 胡仲义, 王国明. 舟山群岛野生山茶种群遗传多样性的ISSR分析[J]. 植物遗传资源学报, 2013, 14(4): 594-599. |
| [16] |
宋振巧.丹参种质资源的遗传多样性研究[D].泰安: 山东农业大学, 2008.
|
| [17] |
Azevedo AL, Costa PP, Machado MA, et al. High degree of genetic diversity among genotypes of the forage grass Brachiaria ruziziensis(Poaceae)detected with ISSR markers[J]. Geneticsand Molecular Research, 2011, 10(4): 3530-3538. DOI:10.4238/2011.November.17.5 |
| [18] |
McGregor CE, Lambert CA, Greyling MM, et al. A comparativea ssessment of DNA fingerprinting techniques(RAPD, ISSR, AFLP and SSR)in tetraploid potato(Solanum tuberosum L.)germplasm[J]. Euphytica, 2012, 113(2): 135-144. |
| [19] |
Wolff K, Zietkiewicz E, Hofstra H. Identification of chrysanthemumcultivars and stability of DNA fingerprint patterns[J]. Theoretical and Applied Genetics, 1995, 91(3): 439-447. DOI:10.1007/BF00222971 |
| [20] |
钱韦, 葛颂, 洪德元. 采用RAPD和ISSR标记探讨中国疣粒野生稻的遗传多样性性[J]. 植物学报, 2000, 42(7): 741-750. DOI:10.3321/j.issn:1672-9072.2000.07.017 |
| [21] |
安宗燕, 唐红, 李婉茹. 基于EST-SSR的紫斑牡丹品种遗传多样性分析[J]. 分子植物育种, 2018, 16(20): 6744-6752. |
| [22] |
陈向明, 郑国生, 孟丽. 不同花色牡丹品种亲缘关系的RAPD-PCR分析[J]. 中国农业科学, 2002(5): 546-551. DOI:10.3321/j.issn:0578-1752.2002.05.016 |