2. 四川农业大学农学院, 成都 611130
2. College of Agronomy, Sichuan Agricultural University, Chengdu 611130
植物在生长过程中, 易遭受到土壤盐渍化的威胁, 造成其生长发育受阻, 严重时会导致植物的死亡[1]。研究表明, 高浓度的土壤盐分, 主要从离子毒害和渗透胁迫两个方面来危害植物的正常生长, 而位于植物细胞膜系统的Na+/H+逆向转运蛋白(Na+/H+ exchange or antiporter, NHX), 则是植物抵御盐胁迫的重要组分[2-5]。
NHX蛋白在植物中主要定位于质膜(Plasma membrane, PM)及细胞内部(Intra-cellular, IC), 后者又可分为定位于液泡膜及类囊体膜两类[2-3]。NHX蛋白的主要功能是参与植物的盐胁迫响应[1-5], 除此之外, 其还广泛参与了植物的生长发育过程, 如调控植物的生长、参与叶片及花的发育及花色形成等[2-3, 6-8]。盐胁迫下, 位于植物细胞膜系统的H+-ATPase和H+-PPase, 建立了跨膜的电化学势梯度, 并由此驱动NHX将细胞质内过多的Na+排出细胞或区域化到液泡中, 从而避免或减轻了Na+对植物细胞的伤害[2-5, 8]。
植物首先被发现的NHX基因, 是拟南芥的AtNHX1[9], 该基因被证明是拟南芥主要的抗旱与抗盐基因。随着分子生物学技术的不断进步以及植物NHX基因研究的不断深入, 越来越多的植物NHX基因被克隆出来, 并进行了功能分析, 如拟南芥、水稻、大麦、小麦、番茄、菊花、棉花等[1, 10-17]。
花烟草是属于茄科烟草属的一年生草本观赏花卉, 其花色种类繁多、花期较长, 是优美的花坛、花镜材料, 是我国许多城市重要的绿化美化材料。所以, 研究其NHX基因的定位、表达模式及功能等, 对于探索花烟草的生长发育以及响应逆境胁迫的机制具有重要意义。因此, 本研究利用同源克隆的方法, 克隆了一个花烟草的NHX基因, 并采用生物信息学方法初步分析了该基因及其编码蛋白的序列及结构特征。同时, 采用qRT-PCR的方法, 分析了该基因在多种非生物胁迫下的表达模式, 以期为花烟草NHX基因的功能研究奠定基础。
1 材料与方法 1.1 材料以花烟草(Nicotiana alata)为实验材料。
1.2 方法 1.2.1 植物材料的培养及非生物胁迫处理材料培养:挑选籽粒饱满且大小一致的种子, 用次氯酸钠溶液表面消毒后, 用无菌水清洗数次, 随后播种于MS培养基上, 并置于恒温培养室中生长(光照:16 h光/8 h暗; 温度:25℃)。
非生物胁迫处理及取材:待烟苗生长4周后, 取10株幼苗, 在液氮中速冻, 用于目的基因的克隆。同时, 挑选长势一致的烟苗, 分别进行低温(4℃)、干旱(5% PEG6000)、高盐(200 mmol/L)、低钾(10 μmol/L)、ABA(1 μmol/L)及H2O2(10 mmol/L)处理, 每个处理设3个重复, 每重复15株烟苗。在处理0 h、3 h、6 h、12 h、24 h后, 分处理、重复进行整株取样, 并置于液氮中保存, 用于总RNA的提取。
低钾MS培养基(钾离子终浓度为10 μmol/L)的配制, 参照张雪微等方法进行[18]。
此外, 分别取正常生长8周烟苗的根、茎、叶, 以及处于盛花期的烟花, 保存于液氮中, 用于目的基因的组织表达分析。
1.2.2 目的基因克隆总RNA的提取及反转录:采用Trizol法提取烟苗的总RNA[19], 然后, 参照cDNA合成试剂盒的方法, 进行反转录及cDNA合成。
目的基因的克隆:参照烟草的NHX基因序列, 利用Primer Premier 5软件设计PCR引物:NaNHX1-F:5'-GCCCATGGAACAAGAACAAGTAT-ATGA-3', NaNHX1-R:5'-GCCCTAACTAGGACAA-AACATTTG-3', 以合成的cDNA为模板进行PCR扩增。反应程序为:98℃ 5 min; 94℃ 30 s; 53℃ 30 s; 72℃ 2 min; 35个循环; 72℃ 10 min; 12℃终止。PCR反应体系为(25 μL):cDNA模板1 μL, Taq Buffer(10×)5 μL, 2.5 mol/L dNTP 2 μL, 正反引物各1 μL, Taq酶1 μL, ddH2O 14 μL。PCR反应结束后, 将产物进行凝胶电泳, 回收并纯化目的片段, 连接pEASY-Blunt Simple克隆载体, 转化Trans1-T1感受态细胞, 在含有氨苄青霉素抗性平板上筛选, 挑取阳性单克隆进行菌液PCR验证后, 送至上海生工生物工程技术有限公司测序。
1.2.3 生物信息学分析利用DNAMAN8软件对测序正确的序列进行分析, 并翻译成氨基酸序列。用ProtParam(http://web.expasy.org/protparam/)对其基本理化性质进行分析, 用ProtScale(http://web.expasy.org/protscale/)预测蛋白亲/疏水性。用CDD(http://smart.embl-heidelberg.de/)预测蛋白结构域。用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行亚细胞定位的预测分析, 用NetPhos3.1(http://www.cbs.dtu.dk/services/NetPhos/)预测磷酸化位点, 用SOPMA(https://npsa-prabi.ibcp.fr/)和Phyre2分别进行目的蛋白的二级结构和三级结构预测。利用NCBI Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线工具, 搜索同源基因, 并运用MEGA7软件构建系统进化树。
1.2.4 目的基因的组织表达及响应非生物胁迫的诱导表达分析引物设计:采用Primer Premier 5软件, 进行引物设计, 用于目的基因的组织表达及响应非生物胁迫的诱导表达分析。正向引物:NaNHX1-qF:5'-GCCTCTGAACCTATTGCC-3', 反向引物:NaNHX1-qR:5'-TGCCACGATAAAGGACTG-3';内参为花烟草18S rRNA, 引物序列为18S-F:5'-CCTACGCTCTGTATACATTAGC-3';18S-R:5'-GTGTTGAGTCAAATTAAGCCGC-3'。
目的基因的组织表达及受诱导表达分析:按上述方法提取样品的总RNA, 并进行反转录合成cDNA, 具体方法参见1.2.2。以花烟草18S rRNA为内参, 以cDNA为模板, 依据张雪薇等[18]的方法, 进行目的基因片段的qRT-PCR扩增, 并计算目的基因的表达量, 利用EXCEL软件做图。
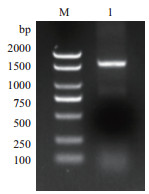
2 结果 2.1 目的基因的克隆以花烟草幼苗为材料提取总RNA, 反转录后进行PCR扩增, 用1%琼脂糖凝胶电泳, 在1 500 bp-2 000 bp之间有一条清晰明亮的条带(图 1)。条带经回收纯化后送样测序。将测序结果用DNAMAN8进行分析并翻译成蛋白序列。同时, 在NCBI(https://www.ncbi.nlm.nih.gov/orffinder/)网站上分析其ORF序列。结果(图 2)显示, 该基因ORF长度为1 599 bp, 编码532个氨基酸。
|
| M:DNA Marker; 1:目的基因片段 图 1 NaNHX1基因克隆 |
|
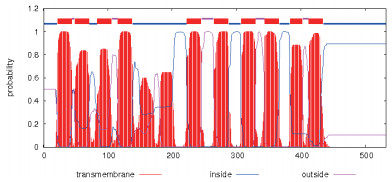
| 图 2 NaNHX1蛋白跨膜区分析 |
在NCBI上, 用BLAST对目的基因的CDS序列进行比对, 结果表明, 该基因与多个物种的NHX基因同源性较高。于是将目的基因命名为NaNHX1。
2.2 NaNHX1蛋白的生物信息学分析 2.2.1 理化性质分析采用Protparam在线软件, 对NaNHX1蛋白的理化性质进行了分析。结果显示, NaNHX1由532个氨基酸构成, 分子量为:58 442.43 Da; 理论pI为:5.66, 不稳定指数为:42.43, 可能为不稳定蛋白。其脂肪系数为98.80, 带负电荷的残基(Asp+Glu)总数为42个, 带正电荷的残基(Arg+Lys)总数为30个。该蛋白氨基酸组成中, 含量较高的氨基酸包括亮氨酸60个(Leu, 占11.3%)、丝氨酸52个(Ser, 占9.8%)、甘氨酸49个(Gly, 占9.2%), 半胱甘酸(Cys)和色氨酸(Trp)含量较低, 各占氨基酸总数的0.6%。
2.2.2 亲/疏水性分析利用ExPaSy网站的Prot-Scale, 选择Hphob./ Kyte & Doolittle算法, 对NaNHX1蛋白的亲/疏水性进行了分析。结果显示, NaNHX1蛋白序列中第424位氨基酸最高分值为3.667, 第513位氨基酸最低分为-2.811, 疏水性氨基酸个数总体上多于亲水性氨基酸个数, 且平均分值大于亲水性氨基酸。同时, NaNHX1蛋白的平均亲水系数(GRAVY)为0.424。由此可推测, NaNHX1蛋白属于疏水性蛋白。
2.2.3 跨膜结构预测为了明确NaNHX1是否为跨膜蛋白, 采用TMHMM Server(http://www.cbs.dtu.dk/services/TMHMM/)分析软件, 对NaNHX1的跨膜区进行了分析。从分析的结果可以看出, NaNHX1蛋白含有10个跨膜区, 分别位于第22-44、49-71、84-106、116-138、223-245、265-287、307-329、344-366、383-402及412-434位氨基酸(图 2)。因此, 可以推断, NaNHX1很可能是一个跨膜蛋白, 承担了花烟草的物质跨膜运输任务。
2.2.4 亚细胞定位分析利用PSORT软件, 对NaNHX1蛋白进行了亚细胞定位预测。结果表明, 该蛋白位于质膜(Plasma membrane)的可能性为60%, 位于叶绿体类囊体膜(Chloroplast thylakoid membrane)的可能性为44.3%, 位于高尔基体的可能性为40%, 位于内质网膜(Endoplasmic reticulum membrane)的可能性为30%。该预测结果说明, NaNHX1蛋白广泛存在于花烟草细胞的膜系统中, 可能参与了这些膜系统的物质跨膜运输。
2.2.5 磷酸化位点预测利用在线软件NetPhos3.1(http://www.cbs.dtu.dk/services/NetPhos/)对NaNHX蛋白进行了磷酸化位点预测。结果表明, NaNHX1蛋白可能含有34个丝氨酸(Ser)位点, 14个苏氨酸(Thr)位点, 4个酪氨酸(Tyr)位点。由此说明, NaNHX1蛋白能被激酶磷酸化, 从而参与花烟草的各种生理生化过程。
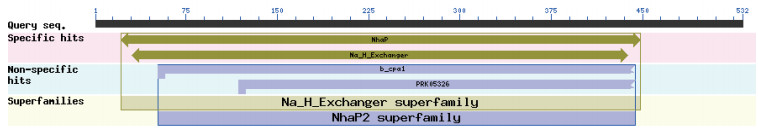
2.2.6 功能域与信号肽预测通过CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)网站, 对NaNHX1蛋白的保守功能域进行了预测。结果表明, NaNHX1蛋白的第52-444位氨基酸, 存在Na+/ H+超家族反向转运蛋白的典型保守结构域NhaP2(Na+/H+ Exchanger)(图 3), 说明NaNHX1蛋白可能行使着Na+/H+反向转运的功能。
|
| 图 3 NaNHX1蛋白功能域的预测 |
通过SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)软件, 对NaNHX1蛋白进行了信号肽预测, 结果表明, 该蛋白不含有信号肽。
2.2.7 二级结构预测与三级结构预测利用SOPMA及Phyre2在线软件, 对NaNHX1蛋白的二级与三级结构分别进行了预测。分析结果(图 4)表明, 在二级结构上, NaNHX1蛋白主要由49.81%的α-螺旋(Alpha helix, 265个氨基酸参与)、33.27%的无规卷曲(Random coil, 177个氨基酸参与)、14.47%的延伸链(Extended strand, 77个氨基酸参与)以及2.44% β-转角(Beta turn, 13个氨基酸参与)所构成。同时, 利用Phyre2软件, 也预测了NaNHX1蛋白的三级结构。

|
| 左:二级结构预测; 右:三级结构预测 图 4 NaNHX1蛋白的二级结构与三级结构预测 |
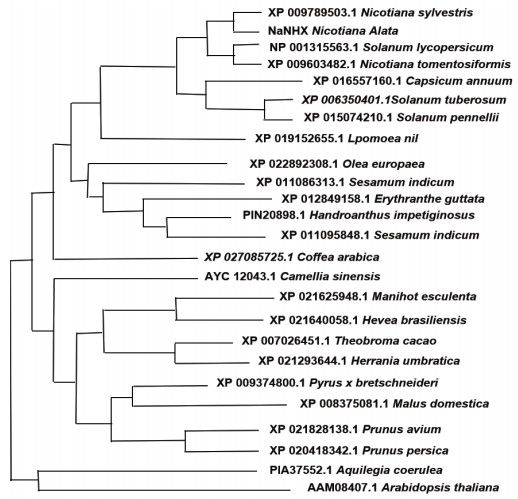
MEGA7软件, 选用邻位相连法构建系统发育树。从图 5可以看出, NaNHX1与茄科植物的NHX基因亲缘关系较近, 而与其它植物的NHX基因亲缘关系较远。其中, 同源性最高的为烟草属的美花烟草(Nicotiana sylvestris, XP009789503.1)、茸毛烟草(Nicotiana tomentosiformis, XP009603482.1)以及番茄属的番茄(Solanum lycoperisicum, XP001315563.1)的NHX基因; 同源性最低的为拟南芥的NHX基因(AAM 08407.1)。
|
| 图 5 NaNHX1蛋白的同源性分析 |
采用qRT-PCR的方法, 分析了NaNHX1在花烟草不同组织与器官中的表达量。结果(图 6)显示, NaNHX1基因在花中表达量最高, 茎中次之, 根和叶中表达量较低。该结果说明, NaNHX1的表达具有组织特异性, 广泛参与了花烟草的生理生化过程, 可能主要在花和茎中发挥作用。
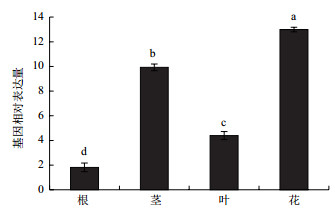
|
| 图 6 NaNHX1在花烟草不同组织器官中的表达分析 |
对花烟草进行了5%PEG、高盐(200 mmol/L NaCl)、低钾(10 μmol/L KCl)、低温(4℃)、ABA(1 μmol/L)和H2O2(10 mmol/L)等6种非生物胁迫, 并分析了在这6种处理下NaNHX1分别在0 h、3 h、6 h、12 h及24 h的表达情况。
从图 7可以看出, 在这6种非生物胁迫下, NaNHX1基因的表达呈现出不同表达的模式:(1)单峰升高型, 如在低钾、高盐及H2O2胁迫下的表达; (2)单峰降低型, 如在低温胁迫下的表达; (3)双峰型(先升高再降低再升高), 如在PEG及ABA胁迫下的表达。值得注意的是, NaNHX1响应PEG及ABA胁迫表达的模式类似; 在低钾及高盐下, NaNHX1的表达模式也较为一致, 均在12 h达到最高。本结果表明, NaNHX1可能广泛参与了花烟草对非生物逆境胁迫的响应, 尤其可能在干旱、高盐、低钾以及氧化胁迫中发挥重要作用。
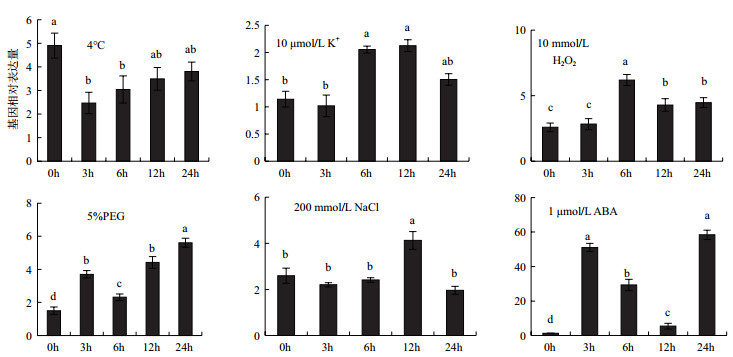
|
| 图 7 NaNHX1在非生物胁迫下的表达模式 |
植物NHX家族基因, 在植物的生长发育以及生物与非生物胁迫的应答反应中发挥着十分重要的作用[1-5]。其功能的行使, 依靠其保守的NhaP2(Na+/H+ Exchanger)结构域, 该结构域由大约393个氨基酸所组成[16]。本研究克隆的NaNHX1基因所编码的蛋白, 也包含了一个NhaP2结构域(图 3)。所以, 可以推测NaNHX1隶属于植物的Na+/ H+超家族, 能够行使植物NHX家族基因所具有的功能。
NaNHX1蛋白是一个疏水性较强的蛋白, 在其氨基酸序列上, 包含多个连续的疏水性区域。这些疏水性区域, 能够在植物的膜系统上形成跨膜结构域, 从而行使离子跨膜运输的功能。跨膜区预测的结果显示, NaNHX1蛋白具有10个跨膜螺旋结构, 与NHX类蛋白具有10-12个跨膜区的特征一致[4-5, 16, 20-21]。此外, NaNHX1蛋白还包含了两个不完全的跨膜区域, 而该不完全跨膜区域被认为是Na+的结合位点[16, 21-22]。此结果说明, NaNHX1蛋白在跨膜结构上具备了通透Na+的功能。
在正常生长的花烟草中, NaNHX1基因在根、茎、叶及花中均有表达, 说明该基因的表达属于组成型表达, 这与拟南芥AtNHX1[23]、甜菜BvNHX1[24]和菊芋HtNHX1[25]的组成型表达特性相一致。同时, NaNHX1基因在花中的表达量最高, 茎中次之, 说明该基因的表达具有组织特异性, 并可能主要在花与茎中发挥作用。在盐胁迫下, 杜梨PbNHX1[17]、紫花苜蓿MsNHX1[26]、马蔺IlNHX 基因[27]、苦荞FtNHX1[28]以及菊花Dnnhx1[29]的表达量均显著增强。在本研究中, 花烟草NaNHX1基因在200 mmol/L NaCl胁迫12 h后, 其表达量达到最高。该结果表明, 花烟草NaNHX1基因的表达对盐胁迫有显著的响应, 该基因很大可能与花烟草的耐盐性密切相关。
研究表明, 植物的NHX基因还参与了植物对渗透胁迫的响应过程。例如, ABA处理后, PbNHX1[17]、GhNHX1[30]及OsNHX1/OsNHX2/OsNHX5[31]的转录水平明显上升。此外, 苹果MdNHX1[4]、PbNHX1[17]和拟南芥AtNHX1[23]对PEG胁迫有显著的转录响应过程。本研究也得出了相同的结果, NaNHX1在5%PEG及1 μmol/L ABA处理3 h后, 其表达量有明显的上升。由此说明, NaNHX1还可能参与了花烟草对渗透胁迫的响应。
前人的研究表明, 植物NHX蛋白是一个Na+(K+)/H+逆向转运蛋白, 承担Na+/K+的跨膜运输[1, 3-5]。例如, AtNHX3是拟南芥低钾胁迫响应中的关键组分[32]; 拟南芥NHX1及NHX2承担着向液泡中运输钾的功能, 并在细胞膨压维持及气孔运动中发挥作用[33]。在本研究中, NaNHX1的表达在低钾处理6 h后急剧升高, 并在12 h达到最高, 说明NaNHX1可能参与了花烟草响应外界低钾的胁迫过程, 同时也表明NaNHX1可能参与了钾的跨膜运输。
综上所述, 本研究所获得的NaNHX1基因, 具有与其他物种共同的功能属性, 如参与Na+与K+的运输以及渗透胁迫等。同时, NaNHX1基因可能还具有不同于其他物种的自身独特的功能。本研究还观察到, NaNHX1的表达受4℃低温及10 mmol/L H2O2的强烈诱导, 这是以往NHX基因功能研究未见报道的。所以, 本结果暗示, NaNHX1可能还参与了如氧化胁迫和低温胁迫响应等非生物胁迫的应答, 也说明了该基因功能的复杂与多样性。因此, 本研究的结果为花烟草NaNHX1基因功能研究以及响应非生物胁迫机制研究, 提供了有价值的线索。
花烟草NaNHX1的克隆及表达模式分析, 只是为花烟草NHX基因的功能研究提供了有益的借鉴, 其在花烟草生长发育及非生物胁迫响应中的分子机制, 有待更进一步的深入研究。
4 结论花烟草NaNHX1基因所编码的蛋白具有Na+/ H+超家族反向转运蛋白的典型保守结构域NhaP2(Na+/H+ Exchanger), 属于植物的Na+/ H+超家族。该基因的表达具有组织特异性, 响应非生物胁迫的诱导, 并且对高盐及低钾有强烈的响应, 能够在花烟草离子胁迫响应中行使相应的功能。
| [1] |
李静, 刘明, 孙晶, 等. Na+(K+)/H+转运蛋白NHX基因的研究进展[J]. 大豆科学, 2011, 30(6): 1035-1039. |
| [2] |
Bassil E, Blumwald E. The ins and outs of intracellular ion homeostasis:NHX-type cation/H+ transporters[J]. Current Opinion in Plant Biology, 2014, 22: 1-6. |
| [3] |
Rodriguez- Rosales MP, Galvez FJ, Huertas R, et al. Plant NHX cation/proton antiporters[J]. Plant Signaling & Behavior, 2009, 4(4): 265-276. |
| [4] |
Bassil E, Zhang SQ, Gong HJ, et al. Cation specificity of vacuolar NHX-Type cation/H+ antiporters[J]. Plant Physiology, 2019, 179: 616-629. DOI:10.1104/pp.18.01103 |
| [5] |
Reguera M, Bassil E, Blumwald E. Intracellular NHX-Type cation/H+ antiporters in plants[J]. Molecular Plant, 2014, 7(2): 261-263. DOI:10.1093/mp/sst091 |
| [6] |
Apse MP, Sottosanto JB, Blumwald E. Vacuolar cation/H+ exchange, ion homeostasis, and leaf development are altered in a T-DNA insertional mutant of AtNHX1, the Arabidopsis vacuolar Na+/H+ antiporter[J]. Plant J, 2003, 36(2): 229-239. DOI:10.1046/j.1365-313X.2003.01871.x |
| [7] |
Bassil E, Tajima H, Liang YC, et al. The Arabidopsis Na+/H+ antipo-rters NHX1 and NHX2 control vacuolar pH and K+ homeostasis to regulate growth, flower development, and reproduction[J]. Plant Cell, 2011, 23(9): 3482-3497. DOI:10.1105/tpc.111.089581 |
| [8] |
Yamaguchi T, Fukadatanaka S, Inagaki Y, et al. Genes encoding the vacuolar Na+/H+ exchanger and flower coloration[J]. Plant & Cell Physiology, 2001, 42(5): 451-461. |
| [9] |
Gaxiola RA, Rao R, Sherman A. The Arabidopsis thaliana proton transporters, AtNHX1 and Avp1 can function in cation detoxification in yeast[J]. Proc Natl Acad Sci USA, 1999, 96: 1480-1485. DOI:10.1073/pnas.96.4.1480 |
| [10] |
杜利霞, 董宽虎, 朱慧森. 植物Na+/H+逆向转运蛋白研究进展[J]. 草原与草坪, 2012, 32(2): 82-86. DOI:10.3969/j.issn.1009-5500.2012.02.018 |
| [11] |
Liang MX, Lin MM, Lin ZY, et al. Identification, functional characterization, and expression pattern of a NaCl-inducible vacuolar Na+/H+ antiporter in chicory(Cichorium intybus L.)[J]. Plant Growth Regulation, 2015, 75(3): 605-614. DOI:10.1007/s10725-014-9963-3 |
| [12] |
Sun MH, Ma QJ, Liu X, et al. Molecular cloning and functional characterization of MdNHX1 reveals its involvement in salt tolerance in apple calli and Arabidopsis[J]. Scientia Horticulturae, 2017, 215: 126-133. DOI:10.1016/j.scienta.2016.11.031 |
| [13] |
Gouiaa S, Khoudi H, Leidi EO, et al. Expression of wheat Na+/H+ antiporter TNHXS1 and H+-pyrophosphatase TVP1 genes in tobacco from a bicistronic transcriptional unit improves salt tolerance[J]. Plant Mol Biol, 2012, 79(1/2): 137-155. |
| [14] |
Wu CX, Gao XH, Kong XQ, et al. Molecular cloning and functional analysis of a Na+/H+ antiporter gene ThNHX1 from a halophytic plant Thellungiella halophila[J]. Plant Molecular Biology Reporter, 2009, 27(1): 1-12. DOI:10.1007/s11105-008-0048-1 |
| [15] |
李平, 王晓宇, 徐惠, 等. 蓖麻质膜型Na+/H+逆向转运蛋白基因(RcSOS1)克隆及表达载体构建[J]. 分子植物育种, 2018, 16(10): 3182-3189. |
| [16] |
陈江飞, 余津铭, 杨建坤, 等. 茶树Na+/H+逆向转运蛋白基因CsNHX1、CsNHX2的克隆及表达分析[J]. 茶叶科学, 2018, 38(6): 559-568. DOI:10.3969/j.issn.1000-369X.2018.06.002 |
| [17] |
刘威, 李慧, 蔺经, 等. 杜梨PbNHX1基因的克隆、表达分析及功能验证[J]. 果树学报, 2018, 35(2): 137-146. |
| [18] |
张雪薇, 刘仑, 鲁黎明, 等. 烟草NtCBL1基因的克隆、表达载体构建及表达分析[J]. 植物研究, 2017, 37(3): 387-394. |
| [19] |
鲁黎明. 烟草钾转运体基因TPK1的电子克隆及生物信息学分析[J]. 中国农业科学, 2011, 44(1): 28-35. DOI:10.3864/j.issn.0578-1752.2011.01.004 |
| [20] |
Sardt C, Franchi A, Pouyssegur J. Molecular cloning, primary structure and expression of the human growth factor-activatable Na+/H+ antiporter[J]. Cell, 1989, 56(2): 271-280. DOI:10.1016/0092-8674(89)90901-X |
| [21] |
马玉花, 冶贵生, 龙晓晨, 等. 柴达木盆地梭梭NHX基因的克隆及其编码蛋白的结构预测[J]. 西北林学院学报, 2016, 31(3): 86-90. DOI:10.3969/j.issn.1001-7461.2016.03.14 |
| [22] |
张雨良, 张智俊, 杨峰山, 等. 新疆盐生植物车前PmNHX1基因的克隆及生物信息学分析[J]. 中国生物工程杂志, 2009, 29(1): 27-33. |
| [23] |
Shi HZ, Zhu JK. Regulation of expression of the vacuolar Na+/H+ antiporter gene AtNHX1 by salt stress and abscisic acid[J]. Plant Molecular Biology, 2002, 50(3): 543-550. DOI:10.1023/A:1019859319617 |
| [24] |
Xia T, Apse MP, Aharon GS, et al. Identification and characterization of a NaCl-inducible vacuolar Na+/H+ antiporter in Beta vulgaris[J]. Physiol Plant, 2002, 116(2): 206-212. |
| [25] |
严一诺, 孙淑斌, 等. 菊芋Na+/H+逆向转运蛋白基因的克隆与表达分析[J]. 西北植物学报, 2007, 27(7): 1291-1298. DOI:10.3321/j.issn:1000-4025.2007.07.002 |
| [26] |
Yang QC, Wu MS, Wang PQ, et al. Cloning and expression analysis of a vacuolar Na + /H+ antiporter gene from alfalfa[J]. DNA Sequence, 2005, 16(5): 352-357. DOI:10.1080/10425170500272742 |
| [27] |
郭强, 孟林, 李杉杉, 等. 马蔺NHX基因的克隆与基因表达分析[J]. 植物生理学报, 2015, 51(11): 2006-2012. |
| [28] |
刘雪华, 宋琎楠, 张玉喜, 等. 苦荞麦FtNHX1基因的克隆及表达分析[J]. 华北农学报, 2017, 32(4): 49-54. |
| [29] |
Liu QL, Xu KD, Zhong M, et al. Cloning and characterization of a novel vacuolar Na+/H+ antiporter gene(Dgnhx1)from chrysanthemum[J]. PLoS One, 2013, 8(12): e83702. DOI:10.1371/journal.pone.0083702 |
| [30] |
Wu CG, Yang GD, Meng QW, et al. The cotton GhNHX1 gene encoding a novel putative tonoplast Na+/H+ antiporter plays an important role in salt stress[J]. Plant Cell Physiology, 2004, 45(5): 600-607. DOI:10.1093/pcp/pch071 |
| [31] |
Fukuda A, Nakamura A, Hara N, et al. Molecular and functional analyses of rice NHX-type Na+/H+ antiporter genes[J]. Planta, 2011, 233(1): 175-188. DOI:10.1007/s00425-010-1289-4 |
| [32] |
Liu H, Tang RJ, Zhang Y, et al. AtNHX3 is a vacuolar K+/H+ antiporter required for low potassium tolerance in Arabidopsis thaliana[J]. Plant Cell Environ, 2010, 33(11): 1989-1999. DOI:10.1111/j.1365-3040.2010.02200.x |
| [33] |
Barragan V, Leidi EO, Andres Z, et al. Ion exchangers NHX1 and NHX2 mediate active potassium uptake into vacuoles to regulate cell turgor and stomatal function in Arabidopsis[J]. Plant Cell, 2012, 24(3): 1127-1142. DOI:10.1105/tpc.111.095273 |




