2. 作物科学国家级实验教学示范中心(四川农业大学), 成都 611130
2. National Demonstration Center for Experimental Crop Science Education(Sichuan Agricultural University), Chengdu 611130
马铃薯(Solanum tuberosum L.)是茄科茄属一年生植物, 具有适应性广、产量高、营养丰富的特点[1], 是我国重要的粮菜兼用作物, 对促进贫困地区增产增收、保证粮食安全、助力脱贫攻坚和乡村振兴战略具有重要意义。马铃薯块茎具有复杂的萌芽特性[2], 贮藏不当会引起块茎发芽或腐烂, 其内部营养物质消耗并伴随以龙葵素为主的有毒物质产生, 严重影响马铃薯产业的发展。
龙葵素(Steroidal glycoalkaloids, SGA)是茄科植物生长过程中的次生代谢物[3], 马铃薯中龙葵素主要分布于呼吸作用旺盛的部位, 其含量随着马铃薯生长发育呈现动态变化, 并在抵御昆虫、病原菌等生物胁迫和干旱、冷害等非生物胁迫响应中发挥重要的作用。当马铃薯受到马铃薯块茎蛾的取食时, StHMGR1表达增加, 龙葵素大量积累, 增加植物抗性[4], 单独施加龙葵素能显著影响对大蜡螟幼虫的存活率和发育繁殖能力[5], 而在沉默StGAME4的转基因株系中龙葵素减少, 黄萎病菌水平增加[6]。龙葵素加入晚疫病霉培养液中能显著抑制晚疫病霉生长[7], 光照和受伤处理块茎, 均能促进StSSR2的表达, 提高内源龙葵素的含量[8]。马铃薯腐烂、变绿、发芽时, 龙葵素大量积累[9], 且龙葵素与马铃薯的发芽表现出显著的正相关[10], 在芽和芽周部位呈现异常的高含量, 研究证实, 龙葵素对茄子、番茄和辣椒种子的萌发和幼苗的生长均有抑制作用, 但对大白菜和菜豆种子萌发呈现出低浓度促进高浓度抑制[11], 敲除龙葵素合成基因PGA1和PGA2以及对16DOX蛋白功能缺失后, 马铃薯块茎中龙葵素含量降低、芽不萌发或萌发生长受抑[12-13], 甾醇侧链还原酶2(Sterol side chain reductase 2, SSR2)催化环阿屯醇还原成胆甾醇, 沉默NbSSR2的烟草植株中胆甾醇含量降低, 但未对烟草生长产生影响[14], 对马铃薯StSSR2和番茄SlSSR2体外酶活试验表明, 酵母细胞中积累了大量胆甾醇[15], 而马铃薯中StSSR2作为龙葵素合成途径上的关键限速酶, 是否影响块茎萌发, 仍不清楚。
本研究以马铃薯短休眠期品种费乌瑞它(Favorite)为材料, 克隆StSSR2编码序列, 运用生物信息学的方法对其理化性质、结构、进化关系等进行分析, 预测其蛋白作用区域, 结合qRT-PCR法分析StSSR2在马铃薯各组织表达特异性, 并检测不同生育时期、不同贮藏时期中该基因的表达差异, 旨为进一步探究StSSR2与马铃薯萌芽的关系提供理论依据。
1 材料与方法 1.1 材料以见光易变绿的马铃薯品种费乌瑞它(Favorita)块茎为试验材料, 由四川农业大学农学院马铃薯研究与开发中心提供。TRIzol试剂、反转录试剂盒RevertAid First Strand cDNASynthesis购自Thermo公司, 高保真PrimeSTAR® Max DNA Polymerase酶、SYBR Green Master mix购自宝生物公司, DNA凝胶纯化回收试剂盒、质粒提取试剂盒、pMD19-T载体购自天根生化科技有限公司, 大肠杆菌DH5α购自博迈德基因技术有限公司, 引物合成、测序由擎科梓熙生物科技有限公司完成, 其余试剂均为国产分析纯或者化学纯。
1.2 方法 1.2.1 取样不同生育时期取样:播种后第2周开始取样, 分别取出苗期、块茎形成期、成熟期的叶片, 取样周期为1周; 不同组织部位取样:取成熟期的根、茎、叶、块茎、匍匐茎; 不同贮藏时期取样:挑取大小均匀刚收获的马铃薯块茎, 愈伤化后置于常温(16±2)℃储藏。收获当天为第1次取样, 取样周期为10 d, 共取7次样; 取样方式为, 以顶芽芽眼为中心, 用直径3 mm硬质塑料管打孔, 取从表皮起5 mm的圆柱体, 芽长超过2 mm时, 即认为该薯块已解除休眠而萌芽, 本实验中贮藏第56天块茎萌芽, 所有取样材料于-80℃保存。
1.2.2 StSSR2的克隆从马铃薯基因组数据库(PGSC)中找到StSSR2的CDS序列, 利用primer 5.0软件设计引物并由成都擎科梓熙生物科技有限公司合成引物(上游引物cSSR2-PF:5'-CACCATGTCGGATGCTAAGGCCC-3', 下游引物cSSR2-PR:5'-TCAATTCGCAGG TTCATCAG-3'), 用TRIzol法[16]提取费乌瑞它块茎芽眼的RNA, 采用Thermo公司反转录试剂盒说明书合成cDNA, 以cDNA为模板, 进行PCR扩增, 反应体系为2×PrimeSTAR Max Premix 25 μL、上下游引物(10 μmol/L)各1.5 μL、cDNA 2 μL和ddH2O 20 μL; 反应程序为94℃ 3 min; 98℃ 30 s, 58℃ 30 s, 72℃ 2 min, 35个循环; 72℃ 7 min。回收目的条带, 并与pMD19-T载体连接后转化至大肠杆菌DH5α, 挑取单菌落进行菌落PCR检测后测序。
1.2.3 StSSR2的生物信息学分析将测得的序列拼接后通过NCBI的BLAST比对同源序列(http://blast.ncbi.nlm.nih.gov/); 利用ProtParam程序(http://web.expasy.org/protparam/)在线预测氨基酸序列分子量、理论等电点(pI)、不稳定系数等; 通过SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线预测蛋白质二级结构, 运用SWISS-MODEL(https://www.swissmodel.expasy.org/interactive)进行三维建模, 使用PROSITE(https://prosite.expasy.org/)预测功能域; 通过TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测其是否属于跨膜蛋白, 使用在线工具WoLFPSORT(https://wolfpsort.hgc.jp/)预测StSSR2蛋白的亚细胞定位; 通过DNAMAN软件分析氨基酸序列同源性, 采用MEGA 7.0软件进行系统进化树的构建。
1.2.4 qRT-PCR分析提取费乌瑞它不同生育时期、成熟期不同组织部位和不同贮藏时期的总RNA, 以Oligo(dT)为引物反转录合成cDNA。以马铃薯EF1αL为内参基因设计定量引物(EF1αL-F:5'-CTTGTACACCACGCTAAGGAG-3';EF1αL-R:5'-GTCAATGCAAACCATTCCTTG-3')。依据全长cDNA序列设计StSSR2定量引物(qSSR2-PF:5'-CATGGATTTCAGGCTCAATACG-3';qSSR2-PR:5'-GAACGTTCCGATAGCTTTGTAC-3')。荧光定量PCR反应体系为2×Ssofast Eva Green 5 μL、上下游引物(10 μmol/L)各0.4 μL、cDNA 4.2 μL; 反应程序为95℃ 3 min; 95℃ 5 s, 56℃ 30 s, 39个循环; 95℃ 15 s, 65-95℃ 1 min做熔解曲线, 各温度以0.5℃上升, 并停5 s。每个试验样品设置3个重复, 基因表达量用2-△△Ct方法计算相对表达量。
数据采用Microsoft Office Excel 2013整理和作图, Data Processing System 7.05统计分析软件进行数据分析, 并用LSD法进行差异显著性检验, 显著性水平设定为α =0.05。
2 结果 2.1 StSSR2的克隆提取马铃薯块茎总RNA后, 经琼脂糖凝胶电泳检测, 有2条明显条带(28S和18S), RNA质量较好(图 1-A), 分光光度计测定D260/D280和D260/D230均在2.0左右。以Oligo(dT)为引物合成cDNA, 进行PCR扩增, 克隆StSSR2片段, 扩增出一条约1 700 bp清晰条带(图 1-B), 对目的片段进行回收, 并连接pMD19-T载体, 转化到大肠杆菌, 鉴定阳性克隆并测序, 结果表明, 目的片段大小为1 713 bp。
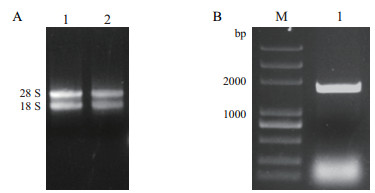
|
| A:马铃薯总RNA电泳图, 1和2为费乌瑞它RNA; B:StSSR2扩增图, M:DL5000Marker, 1:StSSR2 图 1 马铃薯总RNA提取与StSSR2的克隆 |
StSSR2蛋白分子式为C3026H4625N795O842S23, 原子总数9 311个, 相对分子质量为66.35 kD, 由570个氨基酸组成, 包含75个酸性氨基酸, 73个碱性氨基酸, 理论等电点为6.73, 平均亲水系数为-0.389, 脂肪指数为82.23, 不稳定系数为43.65, 属于亲水性的酸性不稳定蛋白。
2.2.2 蛋白质结构分析对StSSR2蛋白的二级结构进行分析(图 2)发现, 其二级结构主要由无规则卷曲和α-螺旋构成, 含量分别是40.07%和38.42%, 其次是延伸链和β-转角, 含量分别是16.67%和4.21%;对其蛋白的三级结构进行预测, 并构建三维蛋白模型(图 3); 利用在线网站Net NES1.1 Sever预测StSSR2蛋白的NES, 结果表明, StSSR2蛋白具有7个NES保守位点, 分别是亮氨酸(155, 158, 161)、天冬氨酸(159, 160)、丙氨酸(156)和谷氨酸(157)。
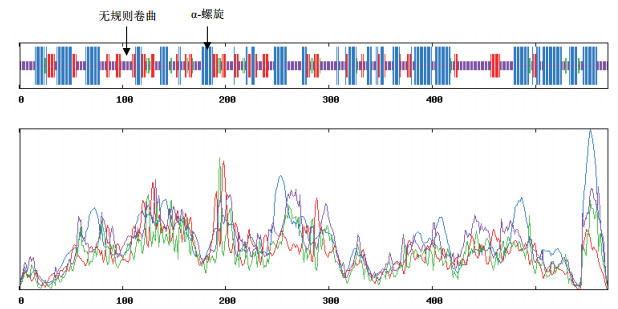
|
| 紫色部分为无规则卷曲, 蓝色部分为螺旋结构 图 2 StSSR2二级结构预测 |
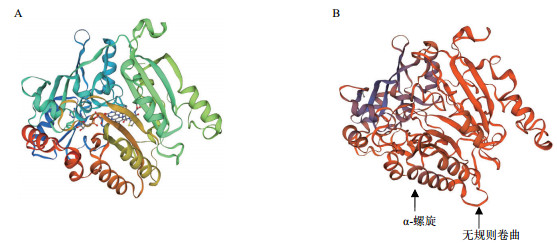
|
| A:Decaprenylphosphoryl-beta-D-ribose oxidase三级结构; B:StSSR2三级结构 图 3 StSSR2蛋白三级结构预测 |
将StSSR2蛋白序列通过PROSITE网站分析其功能域(图 4-A), 结果显示StSSR2蛋白在51-234位氨基酸处具有FAD结合结构域保守区域, 该区域与氧化还原反应的发生有关; 通过TMHMM Server v.2.0在线网站对StSSR2蛋白进行跨膜区域分析(图 4-B), 该蛋白在24-47位氨基酸处存在跨膜区域, 推测StSSR2蛋白为跨膜蛋白; 亚细胞定位通过WoLF PSORT网站预测(图 4-C), 结果表明, StSSR2蛋白主要存在于质膜(45.95%)和细胞质(27%), 其余存在于叶绿体(5.41%)、细胞核(5.41%)、液泡(5.41%)、内质网(5.41%)和过氧化物酶体(5.41%)中, 利用SignalP5.0信号肽预测的结果显示StSSR2蛋白无信号肽。
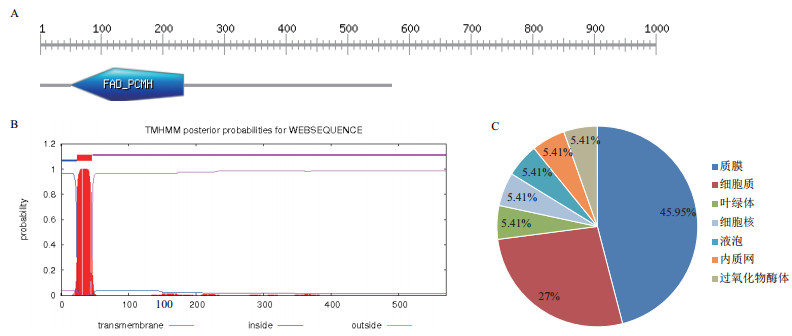
|
| A:StSSR2功能域; B:跨膜区域分析; C:StSSR2亚细胞定位预测 图 4 功能域、跨膜区、亚细胞定位预测 |
在NCBI中使用Blast工具检索与StSSR2蛋白同源的蛋白, 用DNAMAN软件对检索到的同源蛋白进行序列比对, 结果(图 5)表明, 马铃薯StSSR2蛋白(Solanum tuberosum, BAQ55275.1)与野生番茄(Solanum pennellii, XP_015065843.1)、番茄(Solanum lycopersicum, NP_001306251.1)、中华辣椒(Capsicum chinense, PHU25746.1)、本氏烟草(Nicotiana benthamiana, BBE00761.1)、药用酸浆果(Alkekengi officinarum, AXG64151.1)、南非醉茄(Withania somnifera, AXG64150.1)、朝天椒(Capsicum baccatum, PHT55506.1)的SSR蛋白均具有同源性, 相似度分别为97.89%、97.02%、91.07%、90.03%、89.67%、88.79%和85.83%, 通过MEGA 7.0软件, 构建系统进化树(图 6), 结果表明, StSSR2蛋白与番茄、辣椒、烟草等茄科植物亲缘关系较近, 与花生、苹果等亲缘关系较远, 系统进化树与物种进化关系一致。

|
| 图 5 在不同植物中多序列比对StSSR2同源蛋白 |

|
| 图 6 SSR2系统进化树 |
通过分析StSSR2在马铃薯根、匍匐茎、块茎、茎、叶中的表达, 以及在不同生育时期的叶片和不同贮藏时期的块茎中的表达。结果(图 7)表明, StSSR2在5种组织中均有表达, 经显著性分析(P < 0.05), StSSR2在块茎和茎中的表达显著高于其他组织, 其次是叶片、匍匐茎和根, 表明StSSR2主要在块茎和茎中表达, 各组织表达存在显著差异; StSSR2在马铃薯生长各时期的叶片中均有表达, 0-14 d出苗期StSSR2表达最高, 21-28 d块茎形成期StSSR2表达平稳, 35-56 d块茎成熟期下降到最低并趋于稳定; StSSR2在马铃薯块茎不同贮藏时期均有表达, 0-10 d贮藏早期StSSR2表达维持稳定, 10-20 d深度休眠期StSSR2表达最低且保持稳定, 30-60 d萌芽期StSSR2表达量急剧上升且与其他时期表达量有显著性差异, 表明StSSR2与块茎萌芽存在一定关系。
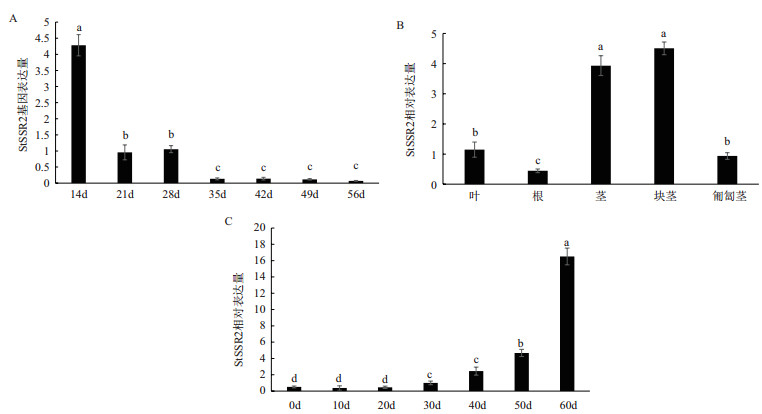
|
| A:不同生育时期StSSR2表达; B:不同组织部位StSSR2表达; C:不同贮藏时期StSSR2表达。图中小写字母表示在0.05水平上差异显著 图 7 StSSR2的表达分析 |
植物次生代谢物合成与积累取决于其合成途径中的关键限速酶, 它们在植物次生代谢物生物合成途径中往往位于代谢支路分叉口或途径的下游[17]。马铃薯中龙葵素的生物合成主要通过萜类、甾醇类与茄啶三大合成路径[18], StSSR2不仅是甾醇类合成途径中催化环阿屯醇合成胆甾醇的关键限速酶, 还位于龙葵素和油菜素内酯(BR)合成的分支点, 其同家族StDWF1催化BR合成[19]。本研究从马铃薯费乌瑞它块茎中克隆StSSR2全长编码序列1 713 bp, 与前期马铃薯全基因组和转录组研究一致, 但与PGSC中公布的序列相比, 氨基酸序列存在一个位点的差异, 而该位点不在功能结构域内, 这可能是由于测序品种和试验品种不同造成的[20], 保守结构域分析表明StSSR2包含高度保守的FAD结合结构域, 是催化氧化还原反应的重要功能域, 这与StDWF1研究结果相同[21], 表明StSSR2与StDWF1在催化龙葵素和油菜内酯合成中的功能高度相似; 亚细胞定位预测表明StSSR2蛋白位于质膜上, 与番茄、辣椒、烟草中同源蛋白预测结果相同, 但其具体定位仍需深入分析; 系统发育树分析结果显示马铃薯StSSR2蛋白与番茄、辣椒、烟草、药用酸浆果、南非醉茄等茄科植物中SSR2蛋白亲缘关系最近, 具有相似的保守结构域, 表明StSSR2基因功能相对保守, 而与花生、苹果亲缘关系较远, 符合植物各科属在进化中的关系, 多序列比对结果也表明马铃薯StSSR2与番茄、辣椒和烟草等同源性分别高达97.89%、91.07%和90.03%, 其亲缘关系的远近程度与同科植物较高的同源性也体现了各同源蛋白与StSSR2蛋白的功能相似性[22]。
研究表明, 马铃薯块茎中龙葵素的积累与其合成基因的表达呈现一致[23]。马铃薯中龙葵素广泛存在于各个部位, 在不同组织器官中表现出不同的含量且通常不发生转移[24-25], 马铃薯地下部分以根中含量最低, 地上部分以花中含量较高, 而块茎表皮下1.5 mm的组织是龙葵素含量最高的部位[26-27]; SSR2基因在不同茄科植物中的表达具有不同的组织特异性, 辣椒中CaSSR2在根中表达量高, 在叶片中表达量低, 茄子中SmSSR2在花中表达量较高, 衰老的叶片中表达偏低[28]。本研究中, StSSR2在马铃薯块茎和茎中的表达显著高于其他组织, 该基因在不同植物中发挥作用的部位不同。
马铃薯呼吸作用旺盛的部位龙葵素含量较高, 高浓度CO2和低浓度O2处理均显著抑制块茎龙葵素的积累[29], 随着马铃薯块茎的生长和成熟, 龙葵素含量呈下降趋势[30]; 不同生育时期表达分析表明, StSSR2在出苗期表达量高, 该时期马铃薯生长旺盛, 龙葵素在幼嫩叶片中大量积累[31], 其高水平有助于增加植株抗性[32], 促进发育, 随着生长发育的进行, 龙葵素含量降低, StSSR2表达趋于稳定。
马铃薯收获后的储藏条件对龙葵素的含量有较大影响, 提前收获未充分成熟的块茎, 其含量往往偏高, 随着储藏期的延长, 特别是储藏期间见光薯皮变绿和块茎发芽时, 龙葵素明显积累[33]。不同贮藏时期表达分析表明StSSR2在马铃薯贮藏过程中发生显著变化, 刚收获时块茎处于深度休眠, 代谢水平较低[34], StSSR2表达量较低, 随着贮藏时间的延长, StSSR2表达量逐渐增加, 当马铃薯块茎休眠解除时, StSSR2表现出高水平表达, 表明StSSR2通过催化龙葵素的合成促进块茎的萌发, 关于龙葵素与块茎萌芽的内在机制有待进一步研究。
4 结论从马铃薯品种费乌瑞它中克隆获得StSSR2, 其全长1 713 bp, 编码570个氨基酸, 含有FAD结合域, 与番茄、辣椒、烟草等茄科植物亲缘关系较近。马铃薯StSSR2在块茎中呈现高表达, 在各生长发育时期均有表达, 幼苗期表达量高, 随着马铃薯贮藏时间的延长, 萌芽期时该基因表达量急剧上升。StSSR2可能参与马铃薯生长与块茎萌芽过程。
| [1] |
文丽. 马铃薯营养价值探讨[J]. 现代农业科技, 2016(4): 293-294. DOI:10.3969/j.issn.1007-5739.2016.04.178 |
| [2] |
Sophia S, Uwe S. Regulation of potato tuber sprouting[J]. Planta, 2014, 239: 27-38. DOI:10.1007/s00425-013-1968-z |
| [3] |
Emanuela V, Zbigniew A, Ewa C, et al. Solanum tuberosum and Lycopersicon esculentum leaf extracts and single metabolites affect development and reproduction of drosophila melanogaster[J]. PLoS One, 2016, 11(5): e0155958. DOI:10.1371/journal.pone.0155958 |
| [4] |
Pavan K, Erandi VO, Etzel G, et al. Potato tuber herbivory increases resistance to aboveground lepidopteran herbivores[J]. Oecologia, 2016, 182(1): 177-187. DOI:10.1007/s00442-016-3633-2 |
| [5] |
Zbigniew A, Pawel M, Kazimierz Z, et al. Potato leaf extract and its component, α-solanine, exert similar impact on development and oxidative stress in Galleria mellonella L.[J]. Archives of Insect Biochemistry and Physiology, 2014, 87(1): 26-39. |
| [6] |
Jamuna RP, Charlotte D, Jun S, et al. Pathogen and pest responses are altered due to RNAi-mediated knockdown of GLYCOALKALOID METABOLISM 4 in Solanum tuberosum[J]. Molecular Plant Microbe Interact, 2017, 30(11): 876-885. DOI:10.1094/MPMI-02-17-0033-R |
| [7] |
Dahlin P, Muller MC, Ekengren S, et al. The impact of steroidal glycoalkaloids on the physiology of phytophthora infestans, the causative agent of potato late blight[J]. Molecular Plant Microbe Interact, 2017, 30(7): 531-542. DOI:10.1094/MPMI-09-16-0186-R |
| [8] |
Nurun N, Erik W, Usman A, et al. Transcript profiling of two potato cultivars during glycoalkaloid-inducing treatments shows differential expression of genes in sterol and glycoalkaloid metabolism[J]. Scientific Reports, 2017, 7. DOI:10.1038/srep43268 |
| [9] |
Grokore YK, Magali RS, Ahipo ED, et al. Isolation and chemoenzymatic treatment of glycoalkaloids from green, sprouting and rotting Solanum tuberosum potatoes for solanidinerecovery[J]. Food Chemistry, 2017, 220: 257-265. DOI:10.1016/j.foodchem.2016.10.014 |
| [10] |
霍权恭, 范璐. 储藏条件对马铃薯品质的影响[J]. 河南工业大学学报:自然科学版, 2005, 26(6): 47-49. |
| [11] |
周宝利, 李志文, 丁昱文, 等. 茄子根系糖苷生物碱对5种蔬菜作物的化感效应及相关分析[J]. 生态环境学报, 2009(1): 310-316. DOI:10.3969/j.issn.1674-5906.2009.01.057 |
| [12] |
Umemoto N, Nakayasu M, Ohyama K, et al. Two cytochrome P450 monooxygenases catalyze early hydroxylation steps in the potato steroid glycoalkaloid biosynthetic pathway[J]. Plant Physiology, 2016, 171(4): 2458-2467. |
| [13] |
NakayasuM, Umemoto N, OhyamaK, et al. A dioxygenase catalyzes steroid 16alpha-hydroxylation in steroidal glycoalkaloid biosynthesis[J]. Plant Physiology, 2017, 175(1): 120-133. |
| [14] |
Go A, Uiko K, Noriko T, et al. Analysis of the mechanisms regulating the expression of isoprenoid biosynthesis genes in hydroponically-grown Nicotiana benthamiana plants using virus-induced gene silencing[J]. Science Report, 2018, 8: 14804. DOI:10.1038/s41598-018-32901-5 |
| [15] |
Satoru S, Kiyoshi O, Shuhei Y, et al. Sterol side chain reductase 2 is a key enzyme in the biosynthesis of cholesterol, the common precursor of toxic steroidal glycoalkaloids in potato[J]. The Plant Cell, 2014, 26: 3763-3774. DOI:10.1105/tpc.114.130096 |
| [16] |
邹雪. StGAPC和AtGAPC2基因的克隆以及对马铃薯的转化[D].雅安: 四川农业大学, 2011.
|
| [17] |
何水林, 郑金贵, 王晓峰, 等. 植物次生代谢:功能调控及其基因工程[J]. 应用与环境生物学报, 2002, 8(5): 558-563. DOI:10.3321/j.issn:1006-687X.2002.05.024 |
| [18] |
邓孟胜, 张杰, 唐晓, 等. 马铃薯中龙葵素的研究进展[J]. 分子植物育种, 2019, 17(7): 2399-2407. |
| [19] |
Nahirñak V, Rivarola M, Almasia NI, et al. Snakin-1 affects reactive oxygen species and ascorbic acid levels and hormone balance in potato[J]. PLoS One, 2019, 14(3): e0214165. DOI:10.1371/journal.pone.0214165 |
| [20] |
高世敏, 董阳, 王武, 等. 葡萄赤霉素合成关键基因VvGA20ox2的克隆、亚细胞定位和表达分析[J]. 江苏农业学报, 2018, 34(6): 1331-1338. DOI:10.3969/j.issn.1000-4440.2018.06.019 |
| [21] |
唐晓, 邓孟胜, 邹雪, 等. 马铃薯StDWF1基因克隆及表达分析[J]. 浙江农业学报, 2018, 30(6): 909-917. DOI:10.3969/j.issn.1004-1524.2018.06.04 |
| [22] |
张杰, 邓孟胜, 蔡诚诚, 等. 马铃薯StCYP734A1基因克隆、表达模式及生物信息学分析[J]. 分子植物育种, 2019, 17(15): 4883-4893. |
| [23] |
Pinchas K, Edna F, Idit G. Potato steroidal glycoalkaloid levels and the expression of key isoprenoid metabolic genes[J]. Planta, 2007, 227: 143-150. DOI:10.1007/s00425-007-0602-3 |
| [24] |
Nema PK, Ramayya N, Duncan E, et al. Potato glycoalkaloids:formation and strategies for mitigation[J]. Journal of the Science of Food and Agriculture, 2008, 88(11): 1869-1881. DOI:10.1002/jsfa.3302 |
| [25] |
Valkonen JPT, Keskitalo M, Vasara T, et al. Potato glycoalkaloids:A burden or a blessing?[J]. Critical Reviews in Plant Sciences, 1996, 15(1). DOI:10.1080/07352689609701934 |
| [26] |
Mweetwa AM, Hunter D, Poe R, et al. Steroidal glycoalkaloids in Solanum chacoense[J]. Phytochemistry, 2011, 75: 32-40. |
| [27] |
Sarquis JI, Coria NA, Aguilar I, et al. Glycoalkaloid content in Solanum species and hybrids from a breeding program for resistance to late blight(Phytophthora infestans)[J]. American Journal of Potato Research, 2000, 77(5): 295-302. DOI:10.1007/BF02853950 |
| [28] |
Eva K, Satoko S, Tetsuya M, et al. Third DWF1 paralog in Solanaceae, sterol Δ24-isomerase, branches withanolide biosynthesis from the general phytosterol pathway[J]. PNAS, 2018, 115(34): 8096-8103. DOI:10.1073/pnas.1807482115 |
| [29] |
孟卫芹.马铃薯采后绿变控制及品质保持技术研究[D].泰安: 山东农业大学, 2012.
|
| [30] |
赵丹青, 张锋锋, 吴燕, 等. 宁夏不同地区不同品种马铃薯中龙葵素在不同生长期的积累含量测定[J]. 中国野生植物资源, 2017, 36(6): 29-31. DOI:10.3969/j.issn.1006-9690.2017.06.007 |
| [31] |
彭真.二倍体马铃薯薯肉龙葵素的驯化与遗传研究[D].昆明: 云南师范大学, 2019.
|
| [32] |
Fragoyiannis DA, Mckinlay RG, D'Mello JP. Interactions of aphid herbivory and nitrogen availability on the total foliar glycoalkaloid content of potato plants[J]. Journal of Chemical Ecology, 2001, 27(9): 1749-1762. DOI:10.1023/A:1010400523647 |
| [33] |
董晓茹, 沈敏, 刘伟. 龙葵素中毒及检测的研究进展[J]. 中国司法鉴定, 2013(2): 35-41. DOI:10.3969/j.issn.1671-2072.2013.02.009 |
| [34] |
Jia B, Xu L, Guan W, et al. Effect of citronella essential oil fumigation on sprout suppression and quality of potato tubers during storage[J]. Food Chem, 2019, 284: 254-258. DOI:10.1016/j.foodchem.2019.01.119 |




