2. 作物科学国家级实验教学示范中心, 成都 611130
2. National Demonstration Center for Experimental Crop Science Education, Chengdu 611130
钾素是植物生长所必须的营养元素之一, 参与植物多种生理生化反应过程, 与植物的生长发育紧密相关。马铃薯(Solanum tuberosum L.)作为我国第四大粮食作物, 是典型的喜钾植物, 钾素的吸收和利用与马铃薯的产量和质量直接相关[1]。植物对钾的吸收和转运主要依靠低亲和性钾离子通道和高亲和性钾离子转运体。按照结构和功能, 钾离子通道蛋白分为:Shaker家族通道、TPK通道及Kri-like通道[2]。钾离子通道AKT1影响植物的生长发育, 与植物的抗旱、耐盐性及抗病性有关[3]。钾转运体分为:KUP/HAK/KT转运体、HKT/TrK转运体、CHX转运体及KEA转运体[4], 其中KUP/HAK/KT家族是一类H+/K+同向转运的高亲和钾离子转运体, 能介导细胞内钾的积累[4-5]。根据该家族基因的序列同源性分为:Cluster Ⅰ、Cluster Ⅱ、Cluster Ⅲ和Cluster Ⅳ四个不同的亚家族, 而Cluster Ⅰ成员大部分属于高亲和性钾转运体; Cluster Ⅱ中的该家族多为低亲和性钾转运体; Cluster Ⅲ和Cluster Ⅳ成员多为高亲和性钾转体[6]。KUP /HAK /KT家族基因已在多种植物中被分离和克隆, 拟南芥中鉴定出13个[7]; 水稻中27个[8]; 番茄中19个[9]; 桃中17个[8]; 木薯中21个[10]。在拟南芥中, AtKUP1被证实介导根部细胞吸收外界K+, 为双亲和性钾离子转运[11]; AtKUP7、AtKUP12为高亲和钾离子转运体[12-13]。PpeKUP11和PpeKUP1基因分别在桃花开放和果实发育过程中主导K+的吸收或转运[14-15]; PpeKUP5主导桃树根部K+吸收的钾转运体[16]。
目前, 该家族在马铃薯的研究报道相对较少, 张子义等[17]的研究表明, 钾离子浓度为0.1 mmol/L、1.0 mmol/L及10.0 mmol/L时StKUP6和StKUP7表达存在不同程度的上调, 1.00 mmol/L时, StKUP6和StKUP7表达上调最明显。本研究采用同源克隆的方法, 从马铃薯品种费乌瑞它中克隆得到一个StKUP12基因, 运用生物信息学对其结构、序列特征、进化规律等进行分析; 利用qRT- PCR技术对该基因的表达进行分析; 最后利用钾营养缺陷型酵母的功能互补, 初步研究该基因的钾吸收功能, 旨为该基因在钾营养方面的深入研究奠定基础。
1 材料与方法 1.1 材料供试马铃薯品种为费乌瑞它(Solanum tuberosum L. Favorita), 组培苗由本实验室提供。主要试剂包括:Vazyme Biotech的感受态大肠杆菌DH5α、质粒小量抽提试剂盒、DNA凝胶纯化回收试剂盒、克隆载体pMD19-T、10× Loading Buffer、Trizol、Gold View Ⅰ型核酸染色剂, 其中2× Taq PCR Master Mix和cDNA反转录试剂盒购自TaKaRa。酵母表达载体P416和钾吸收营养缺陷型酵母菌株R5421由本实验室提供, 测序与引物合成由上海生工生物股份有限公司完成。
1.2 方法 1.2.1 非生物胁迫材料处理供试马铃薯品种为费乌瑞它。将组培苗接种于MS培养基, 25℃恒温光照培养室培养30 d, 挑选长势一致的组培苗, 洗净根部原有的MS培养基, 分别接种到低钾(10 μmol/L K+)、高盐(200 mmol/L NaCl)、脱落酸(1 μmol/L ABA)以及聚乙二醇(5% PEG-6000)培养基, 放于25℃恒温光照培养箱, 分别在处理时间为0 h、3 h、6 h、12 h和24 h的时间点进行整株取样, 液氮速冻, 放入-80℃冰箱中保存备用。
1.2.2 StKUP12基因的克隆马铃薯苗在25℃恒温光照培养室培养60 d后, 选择长势较好的叶片进行取样, 液氮速冻, 保存在-80℃备用。参考GenBank收录的马铃薯(Solanum tuberosum L.)StKUP12序列(XM_006340052.1.), 采用同源克隆的方法, Premier5.0软件设计全长引物StKUP12-F和StKUP12-R(表 1, 下划线为BamH I和Sal I酶切位点序列), 扩增程序为:95℃预变性5 min; 95℃变性30 s; 55℃退火30 s; 72℃延伸2 min 40 s; 35个循环。目的片段纯化后与pMD19-T载体16℃下连接过夜, 转入感受态大肠杆菌DH5α, 随后在含有氨苄青霉素(Ampicillin)的LB固体平板上进行筛选, 利用菌落PCR检测筛选出阳性克隆, 送往上海生工生物股份有限公司进行测序。
采用ExPASy ProtParam tool分析StKUP12的理化性质; ExPaSy-ProScale分析该蛋白的亲疏水性; NetPhos 3.1 Server分析蛋白磷酸化位点; 利用NCBI网站的CDD程序分析蛋白的同源结构域; 利用MEGA5.0软件, 以邻近分析法构建系统进化树。
1.2.4 StKUP12基因的表达分析分别对马铃薯费乌瑞它块茎的芽眼、愈伤15 d的原种顶芽以及正常生长60 d马铃薯植株的根、茎、叶进行取样, 在液氮中速冻后-80℃保存备用。利用Trizol法提取总RNA, 反转录cDNA进行qRT- PCR。用Premier5.0设计Real-Time PCR引物StKUP12-qF和StKUP12-qR(表 1), 以马铃薯的EF1aL作为内参。反应体系为10 μL, 反应程序为95℃反应30 s; 95℃反应5 s; 52℃反应30 s。所有的样品均设置3个生物学重复, 相对表达量计算采用2-∆∆Ct方法。
1.2.5 StKUP12基因转化酵母功能互补实验将克隆载体StKUP12-pMD19-T与表达载体P416进行BamH I和Sal I双酶切, 连接转化大肠杆菌DH5α感受态后, 挑选单菌落进行菌落PCR检测法, 筛选构建成功的阳性克隆, 送往上海生工生物股份有限公司进行测序。将构建成功的酵母表达载体P416-StKUP12转入钾吸收缺陷型酿酒酵母菌株R5421, 取200 μL转化混合物铺于营养缺陷型平板, 30℃培养3 d后, 用PCR鉴定酵母的阳性克隆。挑选鉴定过的酵母单菌落在营养缺陷型平板上划线, 30℃培养3 d后, 用牙签蘸取少量菌体进行扩大培养, 调OD600为0.8, 分别稀释10倍、100倍和1 000倍后, 各取4 μL于正常和钾缺陷(2.25 mmol/L、0.12 mmol/L)的AP培养基, 3次重复, 28℃培养箱倒置培养2-3 d后观察酵母的生长情况。
2 结果 2.1 StKUP12基因的克隆提取马铃薯叶片的RNA进行反转录, 以cDNA为模板进行PCR扩增, 琼脂糖凝胶电泳结果显示, 在2 000-3 000 bp的位置上有清晰明亮的条带(图 1)。将该条带回收纯化后与pMD19-T载体连接, 转化感受态大肠杆菌DH5α, 利用菌落PCR鉴定阳性克隆, 随机挑选3个阳性克隆送测序。结果显示, 3个阳性克隆测序结果一致, 目的片段长度为2 547 bp。
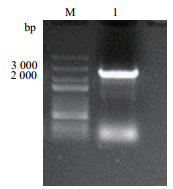
|
| M:5 000 bp marker;1:StKUP12基因 图 1 StKUP12基因的克隆 |
理化性质分析结果表明, 该基因编码848个氨基酸, 其中亮氨酸Leu(97, 1.4%)含量最高; 其次为丝氨(76, 9.0%), 而色氨酸(11, 3%)含量最少。带正电荷氨基酸(Arg + Lys)74个, 带负电荷氨基酸(Asp + Glu)77个。StKUP12蛋白的分子式为C4294 H6726 N1080 O1193 S44, 分子量大小为93.9 kD, 理论等电点pI为6.59, 不稳定系数为39.57, 脂肪系数为104.35, 表明其属于稳定的酸性蛋白。在亲疏水性序列谱中, 默认疏水氨基酸为较高的打分值(打分值> 0代表疏水性, 打分值< 0代表亲水性), 结果显示, 该蛋白预测亲水性的平均值(GRAVY)仅为0.329, 存在14个高打分峰值(scare > 2.0), 最低值在第600-700位氨基酸域; 最高值在500-600位氨基酸域(图 2), 结合GRAVY值推测该蛋白为疏水性蛋白。

|
| 图 2 StKUP12亲疏水区预测 |
磷酸化位点分析结果显示, 该蛋白磷酸化位点数量较多、分布广。共包含49个Ser磷酸化位点、19个Thr磷酸化位点和9个Tyr磷酸化位点(图 3-A)。结构域进行分析结果显示, 该蛋白的第103-676位氨基酸序列区为K+转运结构域, 属于K+转运蛋白家族(图 3-B)。

|
| A:StKUP12磷酸化位点预测; B:StKUP12蛋白结构域预测 图 3 StKUP12的磷酸化位点及结构域预测 |
选择20个不同物种的氨基酸序列构建系统进化树。结果表明, 该蛋白与潘那利番茄KUP12、番茄KUP12具有较高的氨基酸序列同源性(98.00%、97.88%), 与巴西橡胶树KUP12的同源性最低(77.74%)。另外, 该蛋白与潘那利番茄、番茄、辣椒、烟草、美花烟草、芝麻、欧洲橄榄、胡萝卜及咖啡树的KUP12蛋白在一个进化组(图 4)。

|
| 图 4 StKUP12进化树分析 |
采用qRT-PCR反应分析该基因的组织表达情况, LSD法P < 0.05水平下进行显著性检验。结果显示, StKUP12基因在根、茎、叶、顶芽和芽眼均有表达, 表达量在茎、叶和顶芽3个组织中较高; 其次是芽眼, 分别是根的1.75、2.08、2.50和1.63倍(图 5)。

|
| 图 5 StKUP12在不同组织中的相对表达量分析 |
采用qRT-PCR反应分析该基因在4种胁迫处理下的表达情况, 在LSD法P < 0.05水平下进行显著性检验。结果表明, 低钾胁迫处理后该基因表达量明显上调, 24 h内呈先上升后下降的趋势, 在胁迫12 h后表达量达到最大且为对照组的32.86倍(图 6-A)。ABA胁迫处理后该基因表达量先显著上调后受到抑制, 在胁迫3 h后表达量达到最大且为对照组的2.49倍, 随后表达量明显下降(图 6-B)。高盐胁迫处理后该基因表达量受到抑制, 在胁迫6 h后表达量最低且为对照组的0.36倍(图 6-C)。PEG胁迫处理后该基因表达量上调, 24 h内呈先上升后下降的趋势, 在胁迫处理6 h后表达量最大且为对照组的2.62倍(图 6-D)。

|
| A:低钾; B:ABA; C:高盐; D:PEG 图 6 StKUP12在非生物胁迫条件下的表达模式分析 |
取转化成功的酵母, 振荡培养16 h后, 转移到低钾和正常的AP培养基进行培养观察, 结果表明, 在正常的AP培养基上, 表达StKUP12和AtAKT1的酵母在4种稀释浓度下均正常生长, 而转P416的酵母在100、1 000倍稀释浓度生长缓慢; 在钾缺陷的AP培养基上, 表达AtAKT1和StKUP12的酵母均能正常生长, 而转P416酵母不能生长。结果表明, StKUP12转运体能恢复钾吸收营养缺陷型酵母在低钾条件下的K+吸收功能, 在酵母中具有吸收外界K+的能力(图 7)。

|
| AtAKT1:阳性对照; P416:阴性对照 图 7 酵母功能互补实验 |
生物信息学分析结果预测StKUP12编码蛋白为一个稳定的酸性疏水蛋白, 具有多个丝氨酸、苏氨酸和酪氨酸激酶磷酸化位点, 韩敏等[12]对AtKUP7蛋白3个磷酸化位点的研究发现, 蛋白质磷酸化位点对该基因的钾转运活性发挥着一定的作用, 说明StKUP12蛋白具有磷酸化位点, 能被激酶磷酸化, 从而参与生理过程的调控。该基因编码蛋白的第103-676位氨基酸序列属于K+转运蛋白家族结构域, 表明StKUP12蛋白可能参与钾离子的转运。
已有报道表明, AtKUP12在嫩叶中表达量较高[13], AtKUP4在植物根中的表达较强[18], NsHAK11在各组织器官中均有表达, 在主根中的表达量最高[19]。本实验结果表明, StKUP12基因在组织中均有明显的表达, 其中在茎、叶、顶芽表达较高, 与AtKUP12的表达一致[13]。StKUP12基因的表达受到低钾胁迫的诱导, 处理12 h时表达量达到对照组的32.86倍, 与AtKUP3、AtHAK5等受低钾诱导表达情况一致[20-21], 推测该基因参与马铃薯低钾胁迫的响应。该基因的表达在ABA胁迫下先显著诱导后受到抑制, 而宋志忠等[16]的实验表明PpeKUP5在ABA胁迫下表达上调, 推测是由于两个研究所用的ABA处理浓度不同。HAK/KUP/KT家族在盐胁迫下受到Ca2+信号、转录水平、转录因子及相关激素(如乙烯、ABA和生长素)等的调控[22], StKUP12基因在盐胁迫下表达受到抑制, 而AtKUP2、AtKUP3及AtKUP6的表达受盐胁迫的诱导[23], 可能是由于基因和材料的差异造成。干旱是影响植物生长和发育的一个重要因素, 该基因的表达在PEG胁迫下受到诱导, 与獐茅的AlHAK1基因响应干旱胁迫的结果一致[24], 推测该基因参与马铃薯对干旱胁迫的响应。
利用酵母功能互补试验, 韩敏等[12]证明了AtKUP7具有钾离子转运活性, 杨天元等[25]发现OsHAK5表现为高亲和钾转运特性。本实验结果表明, 在正常的AP培养基中3种酵母可以正常生长; 在钾缺陷的AP培养基中转StKUP12和阳性对照的酵母可以正常生长, 而阴性对照的酵母不能正常生长, 表明StKUP12在酵母中具有转运外界K+的功能, 与韩敏[12]的实验结果一致。后续可通过构建过表达或CRISPR基因编辑载体转化马铃薯, 获得转基因材料, 进一步明确该基因在钾营养方面的功能。
4 结论本研究利用同源克隆的方法获得了StKUP12, 生物信息学分析预测该基因编码一种稳定的酸性疏水蛋白, 该蛋白存在钾离子转运结构域, 属于钾离子转运体。表达分析结果说明, StKUP12在组织中均有明显的表达, 表达量在茎、叶、顶芽3个组织中较高; 其次是芽眼, 最后是根。其表达量受低钾、高盐、ABA和PEG的调控, 其中在低钾和PEG胁迫下表达受到诱导, 在高盐和ABA胁迫下表达受到抑制。酵母功能互补实验表明, 该转运体能恢复钾吸收缺陷型酵母在低钾培养基上生长的能力。
| [1] |
Gomat MS, Mworia M. Evaluation of the effects of potassium fertilizer on potato growth and yield in Saboti Sub County, Trans Nzoia County, Kenya[J]. International Journal of Academic Research in Environment and Geography, 2017, 4(1): 33-40. |
| [2] |
程钰宏, 赵瑞雪, 董宽虎. 植物钾(K+)离子通道的研究[J]. 山西农业科学, 2008, 36(2): 3-7. |
| [3] |
杨玲琴, 刘敬, 李魏, 等. 植物钾离子通道AKT1的研究进展[J]. 生物技术通报, 2019, 35(4): 94-100. |
| [4] |
Gupta M, Qiu X, Wang L, et al. KT/HAK/KUP potassium transporters gene family and their whole-life cycle expression profile in rice(Oryza sativa)[J]. Molecular Genetics & Genomics, 2008, 280(5): 437-452. |
| [5] |
Rubio F, Santacmaría GE, Rodríguezkmavarro A. Cloning of Arabidopsis and barley cDNAs encoding HAK potassium transporters in root and shoot cells[J]. Physiologia Plantarum, 2000, 1(109): 34-43. |
| [6] |
Grabov A. Plant KT/KUP/HAK potassium transporters:single family-multiple functions[J]. Annals of Botany, 2007, 99(6): 1035-1041. |
| [7] |
Mäser P, Thomine S, Schroeder JI, et al. Phylogenetic relationships within cation transporter families of Arabidopsis[J]. Plant Physiology, 2001, 126(4): 1646-1667. |
| [8] |
Song ZZ, Ma RJ, Yu ML. Genome-wide analysis and identification of KT/HAK/KUP potassium transporter gene family in peach(Prunus persica)[J]. Genetics and Molecular Research, 2015, 14(1): 774-787. |
| [9] |
Hyun TK, Rim Y, Kim E, et al. Genome-wide and molecular evolution analyses of the KT/HAK/KUP family in tomato(Solanum lycopersicum L.)[J]. Genes & Genomics, 2014, 36(3): 365-374. |
| [10] |
Ou WJ, Mao X, Huang C, et al. Genome-wide identification and expression analysis of the KUP family under abiotic stress in cassava(Manihot esculenta Crantz)[J]. Frontiers in Physiology, 2018, 9: 17. |
| [11] |
Hui HF, Sheng L. AtKuP1:a dual-affinity K+ transporter from Arabidopsis[J]. Plant Cell, 1998, 10(1): 63-73. |
| [12] |
Han M, Wu WH, Wang Y, et al. Potassium transporter KUP7 is involved in K+ acquisition and translocation in Arabidopsis root under K+-limited conditions[J]. Molecular Plant, 2016, 9(3): 437-446. |
| [13] |
游西龙, 杨中敏, 王艳. 拟南芥钾转运突变体AtKUP12鉴定及非生物胁迫的敏感性检测[J]. 生物技术, 2017, 27(5): 497-504. |
| [14] |
宋志忠, 郭绍雷, 马瑞娟, 等. KT/HAK/KUP家族基因在桃开花期的表达及对钾肥施放的响应分析[J]. 中国农业科学, 2015, 48(6): 1177-1185. |
| [15] |
Song ZZ, Guo SL, Zhang CH, et al. KT/HAK/KUP potassium transporter genes dif-ferentially expressed during fruit development, ripening, and postharvest shelf-life of 'Xiahui6' peaches[J]. Acta Physiologiae Plantarum, 2015, 37(7): 131. |
| [16] |
宋志忠, 马瑞娟, 郭绍雷, 等. 桃钾转运体基因PpeKUP5的表达及功能分析[J]. 园艺学报, 2016, 43(2): 218-226. |
| [17] |
张子义, 赵阳, 梁红胜, 等. 钾素对马铃薯钾转运体KUP6和KUP7基因表达量的调节[J]. 华北农学报, 2018, 33(2): 95-99. |
| [18] |
Zou N, Li BH, Dong GQ, et al. Ammonium-induced loss of root gravitropism is related to auxin distribution and TRH1 function, and is uncoupled from the inhibition of root elongation in Arabidopsis[J]. Journal of Experimental Botany, 2012, 63(10): 3777-3788. |
| [19] |
宋毓峰. 林烟草KUP/HAK/KT钾转运体基因NsHAK11的亚细胞定位与表达[J]. 中国农业科学, 2014, 47(6): 1058-1071. |
| [20] |
Gierth M, Mäser P, Schroeder JI. The potassium transporter AtHAK5 functions in K+ deprivation-induced high-affinity K+ uptake and AKT1 K+ channel contribution to K+ uptake kinetics in Arabidopsis roots[J]. Plant Physiology, 2005, 137(3): 1105-1114. |
| [21] |
Kim EJ, Kwak JM, Uozumi N, et al. AtKUP1:An arabidopsis gene encoding high-affinity potassium transport activity[J]. Plant Cell, 1998, 10(1): 51-62. |
| [22] |
李学文, 游西龙, 王艳. 钾离子转运载体HAK/KUP/KT家族参与植物耐盐性的研究进展[J]. 植物科学学报, 2019, 37(1): 105-112. |
| [23] |
Maathuis FJM. The role of monovalent cation transporters in plant responses to salinity[J]. Journal of Experimental Botany, 2006, 57(5): 1137-1147. |
| [24] |
王兰.獐茅高亲和性K+转运蛋白基因的表达调控[D].大连: 大连理工大学, 2009.
|
| [25] |
Yang TY, Zhang S, Hu YB, et al. The role of a potassium transporter OsHAK5 in potassium acquisition and transport from roots to shoots in rice at low potassium supply levels[J]. Plant Physiology, 2014, 166(2): 945-959. |





