卵泡闭锁是一种多因素调控的选择性的细胞凋亡的生理现象。自从1976年Gilbert[1]第一次用机械分离法将鸡卵泡颗粒细胞和膜细胞分离培养后,研究者开始在其基础上对卵泡内细胞培养体系进行改良和优化,为卵泡发育和闭锁的研究奠定了基础。目前,大量研究表明卵泡闭锁的根本原因是由颗粒细胞的凋亡引起的[2-4]。然而,在哺乳动物的研究中发现卵泡闭锁不仅是颗粒细胞的凋亡,而且是颗粒细胞自噬到凋亡的一个过程,自噬的发生先于凋亡,二者存在动态平衡的关系,并证明了颗粒细胞的自噬和凋亡呈促性腺激素依赖性[5-6]。由此可见,针对卵泡闭锁的机制仍有待进一步探讨,尤其在家禽方面,将对挖掘家禽的产蛋性能有重大意义。因此,本文对近几年关于卵泡内细胞自噬和凋亡引起卵泡闭锁的研究进行综述,旨为家禽卵泡闭锁机制的研究提供理论依据。
1 闭锁卵泡内细胞形态学变化家禽卵泡闭锁在卵泡发育的各个时期都有发生,具有明显的形态学特征变化。当闭锁发生时,卵泡由圆润饱满开始皱缩变形,颜色由光亮变灰暗并有明显出血点[3]。一般卵泡闭锁分为两种形式:一种是始于卵母细胞,即在卵泡发育前卵母细胞直接发生凋亡引起卵泡闭锁;一种是始于颗粒细胞,即在发育过程中由于颗粒细胞凋亡而引起卵泡闭锁[7-8]。根据结构的变化,颗粒细胞凋亡形式分为两种,第一种是正常颗粒细胞之间在原位发生凋亡;第二种是颗粒细胞脱落到卵泡腔内形成凋亡小体发生凋亡[9]。Lin等[10]对哺乳动物卵泡颗粒细胞研究发现,闭锁卵泡中的颗粒细胞层和膜细胞层明显变的松散、破裂、凹陷、甚至脱落。黄正洋等[9]在鹅的闭锁卵泡发现与Lin[10]在哺乳动物闭锁卵泡的发现基本一致,并通过透视电镜发现正常卵泡有明显边界,而闭锁卵泡边界不清晰,且还发现闭锁卵泡颗粒细胞层与膜层边界不明显。这种现象可能是由于发生卵泡闭锁后,细胞内的细胞器以及各种内容物被分解附着在卵泡边界所致。以上结果表明,哺乳动物与家禽的卵泡闭锁的形态学变化基本一致,先是颗粒细胞线粒体、内质网等生物学活性减弱,通过分泌细胞信号因子抑制膜细胞与外界的物质交换,同时抑制卵母细胞的活动,在颗粒细胞的主导下三者共同作用调控引起卵泡发生闭锁[11-13]。据报道,Choi等[14]在体外利用细胞饥饿法诱导颗粒细胞凋亡,用荧光免疫染色法对颗粒细胞染色观察,发现颗粒细胞出现正常的核皱缩、破裂等凋亡现象。在透视电镜下还发现大量颗粒细胞出现细胞质累积,双膜结合的空泡,细胞器发生变化,大量自噬体累积等现象。郭燕君等[15]通过对小鼠微管相关蛋白1轻链3(Microtubule-associated proteins light chain 3,LC3)的定位也发现颗粒细胞凋亡过程中伴随着大量自噬体的产生。以上研究结果表明,颗粒细胞自噬可能也是卵泡闭锁的一种调节方式。
2 卵泡内细胞调控家禽卵泡闭锁的发生与颗粒细胞、膜细胞、卵母细胞或次级卵母细胞之间的调控密切相关。它们之间通过信号传导、物质交换及转化等方式共同维持卵泡内环境的稳定,防止卵泡闭锁的发生。综述下文文献报道,其简化调控模式图见图 1。
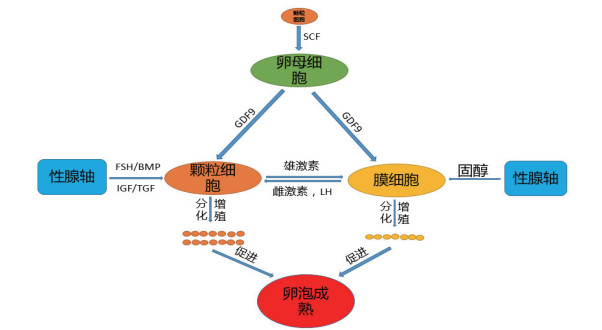
|
| 图 1 卵母细胞、颗粒细胞、膜细胞之间相互调控关系 |
家禽卵母细胞是卵泡内最大的细胞,被颗粒细胞和膜细胞包裹,它调控卵泡闭锁的机制主要与原始卵泡的启动有关。据报道,原始卵泡的生长发育启动是由颗粒细胞分泌的干细胞因子(Stem cell growth factors,SCF)结合卵母细胞上的c-kit受体共同完成,此过程并不依赖激素调节[16]。若原始卵泡未接收到启动信号,卵母细胞则一直处于“休眠状态”,最终在颗粒细胞分泌的白细胞介素1β(Interleukin- 1β,IL1-β)和肿瘤坏死因子α(Tumor necrosis factor,TNF-α)的作用下原始卵泡开始皱缩、裂解,最终发生闭锁,在3日龄之前鸡会有90%的原始卵泡发生闭锁[7, 17-18]。当卵母细胞接收到启动信号后,在SCF的作用下卵母细胞分泌生长分化因子(Growth differentiation factor 9,GDF9)作用颗粒细胞,促进颗粒细胞上促卵泡素受体(Follicle-stimulating hormone receptor,FSHR)的率先表达,FSHR在FSH的作用下正反馈调节卵母细胞,增强GDF9信号作用,同时GDF9作用膜细胞促进膜细胞上类固醇合成急性调节蛋白(Steroidogenic acute regulatory protein,StAR)与细胞色素P450家族的17A1/19A1(CytochromeP450,Family 17 /19,Subfamily A,Polypeptide1,CYP17/19A1)的表达和细胞膜上内质网的活性[19]。颗粒细胞上的FSHR的表达也标志着卵泡发育的启动[3]。Yongje[20]通过下调GDF9的表达发现颗粒细胞的增殖分化受到抑制,因此GDF9可能是颗粒细胞增殖的必须因子,但也有研究发现卵母细胞的启动信号受抗缪勒氏激素(Anti-mullerian hormone,AMH)的调控[17-18],其具体机制仍有待进一步研究。通过抑制或敲除鸡FSHR在颗粒细胞的表达,则会导致孕酮、雌激素、LH、TGFβ等迅速下调甚至不表达,卵母细胞快速进入凋亡期,导致卵泡发生闭锁[21-23]。因此,GDF9和FSHR的下调可能是引起卵母细胞凋亡,进而调控卵泡闭锁的重要原因。
2.2 颗粒细胞调控机制家禽卵泡颗粒细胞是卵泡内数量、比重以及功能最多的细胞,它的增殖分化和凋亡主导卵泡的发育,决定卵泡的闭锁。在家禽正常发育阶段,家禽卵泡闭锁主要与其严格的选择机制有关。只有被选择的卵泡的颗粒细胞才具有较强的分化能力,在FSH的作用下颗粒细胞迅速增殖分化进入优势卵泡阶段[22, 24-25]。未被选择的卵泡颗粒细胞FSHR表达量下调甚至不表达,FSH与FSHR结合的活性减弱,抑制颗粒细胞膜环磷酸腺苷(Cyclic adenosine monophosphate,cAMP),通过下调cAMP的浓度抑制cAMP-PKA信号通路。颗粒细胞的转录活性下降,CYP11A1、CYP17A1、StAR等重要固醇转运蛋白下调,同时下调颗粒细胞上雌激素受体(Estrogen receptor,ESR)、胰岛素样生长因子受体(Insulin like growth factor receptor,IGFR)、黄体素受体(Luteinizing hormone receptor,LHR)等受体的表达[11, 26-28]。随着FSH的作用减弱,与其级联反应的cAMP依赖蛋白激酶A(Protein kinase A,PKA),P13K/Akt信号均被抑制[29]。此外,FSH的作用减弱导致颗粒细胞膜上Ca2+的浓度下调上游蛋白Ras,Ras下调丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)家族信号通路,ERK1/2的作用被减弱,颗粒细胞周期蛋白cyclinD2的合成停止。同时,ERK5信号通路增强,激活Caspase信号通路,促进颗粒细胞凋亡[30-31]。随着颗粒细胞上ESR、FSHR等G蛋白偶联受体的表达量下调,它们可与IGF、转化生长因子(Transforming growth factor,TGF)等家族的受体构成的复合受体在溶酶体的作用下裂解,颗粒细胞的一系列生理活动逐渐停止,凋亡信号增强[32-34]。Wang等[35]利用转录组富集信号通路发现,在鸡等级卵泡选择过程中,被选择优势卵泡过程中还存在较强Wnt4信号的调控,而闭锁卵泡中Wnt4的信号富集显著弱于优势卵泡,说明Wnt4信号的减弱可能也会引起卵泡闭锁。在凋亡因子的作用下,卵泡内颗粒细胞由整齐紧凑逐渐变得疏松凌乱,最终卵泡发生闭锁。
颗粒细胞的凋亡是引起卵泡闭锁的根本原因,而颗粒细胞的凋亡主要受细胞凋亡因子的调控。卵泡闭锁早期,卵泡内固醇的合成以及生长因子无显著差异变化,而是颗粒细胞上的FSHR、ESR、LHR等受体的数量减少,一系列蛋白合成以及酶的活性降低,线粒体活动减弱[21]。随即颗粒细胞凋亡诱导因子(Apoptosis inducing factor,AIF)的表达量升高,细胞膜上的FAS和FASL信号作用增强,Akt信号通路作用B淋巴细胞瘤2(B-cell lymphoma-2,Bcl2),Bcl2的磷酸化和氧化作用增强,释放Bax、Bak,与其联级的Caspase3信号作用也增强,并通过Caspase8切割Bcl2正反馈调控凋亡信号,在TNF-α和IL-β的作用下进入凋亡程序。在颗粒细胞凋亡信号的作用下,膜细胞随着颗粒细胞的凋亡而凋亡,最终卵母细胞也随之凋亡。当颗粒细胞的凋亡率达到10%时,标志着卵泡进入闭锁状态[36]。卵泡在发育过程中受到多种信号通路的调控,但其信号通路的作用强度依赖颗粒细胞内的激素及受体作用。
2.3 膜细胞调控机制家禽卵泡膜细胞位于卵泡膜内侧,颗粒细胞层外侧,是连接卵泡内和卵泡外物质和信号交流的重要通道,也是卵泡内固醇合成加工的重要场所。卵泡膜细胞层主要由膜细胞、毛细血管和基底膜构成,在膜细胞的表面含有大量的滑面内质网以及脂类物质构成的小泡状结构。Gan等[37]发现CYP17A1和CYP19A1主要表达在膜细胞,它们的密度、生存能力和它们合成固醇类物质的能力趋势是一致的。当卵泡发生闭锁时,凋亡信号增强,负反馈作用颗粒细胞和卵母细胞GDF9的分泌,抑制膜细胞的增殖分化。膜细胞在凋亡因子的作用下,CYP17A1、CYP19A1和StAR被抑制甚至失活,而CYP17A1、CYP19A1和StAR作为cAMP的依赖基因,因此cAMP-FSHR信号的传导也被抑制[24, 38]。此外,家禽卵泡排卵时,会形成临时分泌器官黄体,而膜细胞是通过丰富的毛细血管为颗粒细胞和黄体提供连接桥梁。由膜细胞分泌的BMP减少,卵泡膜上毛细血管系统的发育受到阻滞,通过毛细血管连接以及膜连接与卵泡外进行营养物质的交换、信息交流以及生长因子的转化能力减弱;另一方面通过间隙连接颗粒细胞为颗粒细胞和卵母细胞的发育提供营养物质和信息交流逐渐停止,加速卵泡闭锁过程[24, 39]。更为重要的是,膜细胞是雌激素、雄激素和孕酮等固醇合成和转运的主要场所[40]。膜细胞在LH的作用下促进CYP17A1和CYP19A1的大量表达,同时活化膜上的芳香化酶,膜细胞通过将卵泡外的固醇类物质合成雄激素,维持卵泡内必须的雄激素含量外,在芳香化酶的作用下可将自身合成的雄激素以及颗粒细胞分泌的雄激素转化为雌激素,刺激颗粒细胞的发育[41]。当膜细胞分泌大量雌激素时,雌二醇会负反馈作用LH信号,维持卵泡内雄激素和雌激素动态平衡[36, 42]。因此,CYP17A1和CYP19A1的失活可能打破卵泡内激素动态平衡,是引起卵泡闭锁的一个重要因素。此外,Hattori等[43]通过将膜细胞和颗粒细胞共培养发现,膜细胞LH轴可以通过旁分泌上调雄激素或雌激素的合成激活IGF信号抑制颗粒细胞凋亡和卵泡闭锁。综上所述,膜细胞参与卵泡闭锁可能与细胞间信息交换和卵泡内激素平衡有关。
3 颗粒细胞自噬卵泡内细胞自噬主要是卵泡在其发育过程中净化自身参与或者受损细胞器的作用机制,机体借此维持蛋白代谢的平衡。目前,关于自噬调控家禽卵泡闭锁的研究主要在颗粒细胞自噬,其调控机制主要包括两个方面:(1)负调控因子m-tor信号通路。(2)正调控因子JNK信号通路。在鸡颗粒细胞自噬的过程激活凋亡信号,二者共同调控卵泡闭锁[44]。
颗粒细胞自噬主要发生在等级卵泡发育阶段,尤其在优势卵泡选择之后,卵泡发育中颗粒细胞自噬对促性腺激素(Gonadotropic hormone,GnH)呈线性负相关[5, 9]。哺乳动物颗粒细胞在GnH的作用下,FSH通过上调P13K/AKT信号,增加AKT和S6K的磷酸化,活化m-tor信号,m-tor通过m-torc1的作用增强细胞内的活性蛋白合成,提高细胞活性并抑制LC3-Ⅱ和Caspase3的表达,抑制细胞自噬和凋亡[45]。也有研究表明,FSH也可以直接通过m-tor活化因子MHY1485的作用激活m-tor显著抑制自噬信号,但通过FSH处理颗粒细胞发现,FSH可显著上调低氧诱导因子1(Hypoxia inducible factor1α,HIF1α)的表达,并通过HIF1α的作用诱导自噬信号的传导引起卵泡闭锁[46]。m-tor作为m-tor/HIF1α轴的上游主要信号因子,FSH通过活化HIF1α的作用可能远远弱于m-tor的信号作用[47-48]。因此,m-tor信号通路在颗粒细胞自噬调节具有重要作用,但在家禽卵泡闭锁过程中的机制仍有待进一步研究。此外,FSH也可参与颗粒细胞自噬正向因子JNK信号通路。Gao等[49]发现FSH通过抑制核转录因子(Nuclear factor-kappa B,NF-κB)的水平,促进p65在颗粒细胞细胞质的表达,在p65的作用下增强JNK信号,JNK通过对Bcl2的磷酸化抑制Bcl2的作用,并降低“自噬调节器”Beclin1和Bcl2的结合能力或者使Beclin1-Bcl2复合体分离,使Beclin1的作用机制增强,诱导细胞自噬引起卵泡闭锁发生[50-51]。据报道,Beclin1主要表达于鸡膜细胞,通过与LC3β-Ⅱ相结合,下调p62和上调Beclin1的作用,显著增加膜细胞层的自噬活性,并且Beclin1诱导Caspase3的表达促进颗粒细胞凋亡[44]。该结果表明,Beclin1的表达可能与膜细胞存在密切的关系,并可推测颗粒细胞的自噬可能取决于膜细胞的调控。综上所述,在细胞自噬信号的传导过程中伴随着Bcl2和Caspase3等凋亡信号的产生,因此颗粒细胞凋亡和自噬可能共同调控卵泡闭锁。
另一方面,颗粒细胞自噬还受其它多种因素调控。Yu等[52]发现鹅卵泡内环境的不均衡会引起自噬正调控因子miR-7,miR-29,miR-100,miR-181,PRLR,LC3,p53,Beclin1,Atg9和Atg12的表达上调,负调节因子miR-34b和miR-34c的下调导致颗粒细胞自噬。Lou等[53]发现颗粒细胞的氧化损伤通过抑制m-tor和促进p53信号通路调节颗粒细胞自噬,但褪黑素可以通过GFP-MAP1LC3B和SQSTM1降解Beclin1靶向抑制JNK/Bcl2/Beclin1信号传导,也可以通过介导FOXO1脱乙酰化及其与ATG蛋白的相互作用以及抑制氧化应激的颗粒细胞中自噬需要SIRT1信号传导的激活,抑制颗粒细胞因氧化损伤发生自噬[54-55]。Kang等[56]通过3-硝基丙酸(3-nitropropionic acid,3-NPA)刺激鹅颗粒细胞氧化应激反应发现,抑制Bcl2促进Caspase3的表达,引起颗粒细胞自噬和凋亡。引起卵泡颗粒细胞发生自噬的因素众多,但自噬的发生最终途径都涉及到m-tor信号或JNK信号的调控,并且伴随着凋亡的发生。因此,通过应用m-tor激动剂或者JNK信号抑制剂可能对家禽因自噬导致卵泡闭锁具有较好疗效。
4 展望家禽卵泡闭锁受凋亡和自噬共同调控,影响家禽的产蛋性状,但适量的卵泡闭锁会加速优势卵泡的发育和排卵,并有研究发现颗粒细胞自噬和凋亡过程中产生的TNFα可以通过减少卵母细胞释放数量和诱导未破裂卵泡的颗粒细胞死亡重塑卵巢组织[57]。因此,家禽繁殖性能与卵泡闭锁数量相关,如何建立一个闭锁标准,充分挖掘家禽的产蛋性状是一个值得探究的问题。此外,在哺乳动物中被认为颗粒细胞凋亡开关的Dicer酶可通过抑制黄体的形成引起卵泡闭锁[58],而家禽不同于哺乳动物存在明显的黄体,仅在家禽排卵时作为临时分泌器官出现,是否该酶在家禽卵泡闭锁的调控机制与哺乳动物相同,Dicer酶也是合成microRNA和siRNA的必须酶,microRNA和siRNA在颗粒细胞、膜细胞和卵母细胞之间可能有着重要的传递信息的功能,在分子辅助生殖技术中,将microRNA在各细胞中的丰度作为评价卵泡成熟和重量的一个重要指标[59-60]。随着第三代测序技术的发展,对microRNA、siRNA以及circRNA等小片段RNA的挖掘更全面,笔者认为,在未来进一步完善小片段RNA在颗粒细胞的凋亡和自噬的调控网络对家禽繁殖性状具有重要意义。
| [1] |
Gilbert AB, Evans AJ, Perry MM, et al. A method for separating the granulosa cells, the basal lamina and the theca of the preovulatory ovarian follicle of the domestic fowl(Gallus domesticus)[J]. J Reprod Fertil, 1977, 50(1): 179-181. DOI:10.1530/jrf.0.0500179 |
| [2] |
Zhang J, Xu Y, Liu H, et al. MicroRNAs in ovarian follicular atresia and granulosa cell apoptosis[J]. Rep Bio and End, 2019, 17(1): 9. |
| [3] |
李碧春, 秦洁. 雌禽生殖生理研究进展[J]. 中国畜牧兽医, 2006, 33(1): 36-39. DOI:10.3969/j.issn.1671-7236.2006.01.012 |
| [4] |
陈秀萍, 姜勋平, 丁家桐, 等. 鹅卵泡颗粒细胞凋亡及其与生殖激素间的关系[J]. 畜牧兽医学报, 2006, 37(10): 982-986. DOI:10.3321/j.issn:0366-6964.2006.10.007 |
| [5] |
Jing Y, Lou Y, Ke H, et al. Goose broodiness is involved in granulosa cell autophagy and homeostatic imbalance of follicular hormones[J]. Poult Sci, 2016, 95(5): 1156-1159. DOI:10.3382/ps/pew006 |
| [6] |
Meng L, Jan SZ, Hamer G, et al. Preantral follicular atresia occurs mainly through autophagy, while antral follicles degenerate mostly through apoptosis[J]. Biol Reprod, 2018, 99(1): 853-863. |
| [7] |
金艳梅.鸡等级前卵泡颗粒细胞发育的激素和营养调控及机理研究[D].杭州: 浙江大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10335-2010144276.htm
|
| [8] |
Gupta SK, Gilbert AB, Walker MA. Histological study of follicular atresia in the ovary of the domestic hen(Gallus domesticus)[J]. Journal of Reproduction & Fertility, 1988, 82(1): 219-225. |
| [9] |
黄正洋.表皮生长因子参与鹅卵泡颗粒细胞增殖调控机理的研究[D].扬州: 扬州大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-11117-1016289065.htm
|
| [10] |
Lin JX, Jia YD, Zhang CQ. Effect of epidermal growth factor on follicle-stimulating hormone-induced proliferation of granulosa cells from chicken prehierarchical follicles[J]. J Zhejiang Univ Sci B, 2011, 12(11): 875-883. DOI:10.1631/jzus.B1100023 |
| [11] |
Johnson AL, Woods DC. Dynamics of avian ovarian follicle development:Cellular mechanisms of granulosa cell differentiation[J]. Gen & Comp Endocrinol, 2009, 163(1): 12-17. |
| [12] |
梁学超, 蒋明, 等. 猪卵巢发育的组织学变化及卵泡闭锁规律研究[J]. 畜牧兽医学报, 2017, 48(10): 1863-1870. DOI:10.11843/j.issn.0366-6964.2017.10.009 |
| [13] |
何宝祥, 郑喜邦, 等. 水牛有腔卵泡颗粒细胞凋亡的生物形态学特征[J]. 畜牧兽医学报, 2006, 37(11): 1209-1216. DOI:10.3321/j.issn:0366-6964.2006.11.021 |
| [14] |
Choi JY, Jo MW, Lee EY, et al. Induction of apoptotic cell death via accumulation of autophagosomes in rat granulosa cells[J]. Fertility & Sterility, 2011, 95(4): 1482-1486. |
| [15] |
郭燕君, 徐营, 刘胜兵, 等. LC3蛋白在小鼠卵泡颗粒细胞中的表达及定位研究[J]. 中国病理生理杂志, 2017, 33(9): 1690-1695. DOI:10.3969/j.issn.1000-4718.2017.09.025 |
| [16] |
罗茜, 陈伟, 郑春田, 等. 家禽卵泡颗粒细胞体外培养方法研究进展[J]. 动物营养学报, 2016, 28(9): 2681-2686. DOI:10.3969/j.issn.1006-267x.2016.09.003 |
| [17] |
Chen F, Jiang X, Chen X, et al. Effects of downregulation of inhibin α gene expression on apoptosis and proliferation of goose granulosa cells[J]. J Genetics Genomics, 2007, 34(12): 1106-1113. DOI:10.1016/S1673-8527(07)60126-X |
| [18] |
宋艳画, 宋善道, 张家骅. 原始卵泡形成和发育调节机制研究进展[J]. 动物医学进展, 2006, 27(3): 30-33. DOI:10.3969/j.issn.1007-5038.2006.03.008 |
| [19] |
应诗家, 于建宁, 施振旦. GDF9/BMP15对卵泡发育的调控[J]. 家畜生态学报, 2013, 34(9): 8-12. DOI:10.3969/j.issn.1673-1182.2013.09.002 |
| [20] |
Yongje R.体外成熟牛卵母细胞BMP15和GDF9的表达及其对卵丘细胞凋亡的影响[D].北京: 中国农业科学院, 2015. http://cdmd.cnki.com.cn/Article/CDMD-82101-1016171288.htm
|
| [21] |
李悦, 计红, 薛琳琳, 等. 不同培养时间对鸡卵泡颗粒细胞孕酮、雌激素分泌水平及FSHR、LHR基因表达的影响[J]. 中国应用生理学杂志, 2017, 33(2): 174-178. |
| [22] |
Woods DC, Johnson AL. Regulation of follicle-stimulating hormone-receptor messenger RNA in hen granulosa cells relative to follicle selection[J]. Biology of Reproduction, 2005, 72(3): 643-650. |
| [23] |
Rangel PL, Gutierrez CG. Reproduction in hens:Is testosterone necessary for the ovulatory process?[J]. General & Comparative Endocrinology, 2014, 203(2): 50-61. |
| [24] |
Johnson AL. Ovarian follicle selection and granulosa cell differentiation[J]. Poultry Science, 2015, 94(4): 781-789. DOI:10.3382/ps/peu008 |
| [25] |
Wang J, Zhao C, Li J, et al. Transcriptome analysis of the potential roles of FOXL2 in chicken pre-hierarchical and pre-ovulatory granulosa cells[J]. Comparative Biochemistry & Physiology Part D, 2017, 21(5): 56-66. |
| [26] |
Nepomuceno AI, Muddiman DC, Petitte JN. Global proteomic analysis of functional compartments in immature avian follicles using laser microdissection coupled to LC-MS/MS[J]. Journal of Proteome Research, 2015, 14(9): 3912-3923. DOI:10.1021/acs.jproteome.5b00346 |
| [27] |
Akazome Y, Abe T, Mori T. Differentiation of chicken gonad as an endocrine organ:expression of LH receptor, FSH receptor, cytochrome P450c17 and aromatase genes[J]. Biol Reprod, 2002, 123(5): 721-728. DOI:10.1530/rep.0.1230721 |
| [28] |
李晓雯, 郎朗, 季宇彬, 等. 卵泡刺激素促进卵巢颗粒细胞增殖分化的信号通路的研究进展[J]. 北京联合大学学报, 2012, 26(4): 46-50. DOI:10.3969/j.issn.1005-0310.2012.04.014 |
| [29] |
Ghanem K, Johnson AL. Follicle dynamics and granulosa cell differentiation in the turkey hen ovary[J]. Poultry Science, 2018, 97(10): 3755-3761. DOI:10.3382/ps/pey224 |
| [30] |
Wen R, Hu S, Xiao Q, et al. Leptin exerts proliferative and anti-apoptotic effects on goose granulosa cells through the PI3K/Akt/mTOR signaling pathway[J]. J Steroid Bioch & Mol Bio, 2015, 149(70): 9-15. |
| [31] |
魏泽辉, 贾存灵. 家禽卵泡选择过程中颗粒细胞的分子调控机制[J]. 中国家禽, 2017, 39(21): 1-5. |
| [32] |
Du X, Pan Z, Li Q, et al. Smad4 feedback regulates the canonical TGF-β signaling pathway to control granulosa cell apoptosis[J]. Cell Death & Dis, 2018, 9(2): 151-158. |
| [33] |
Ramasamy M, Sreesujatha. Regulation of ovarian follicular atresia through apoptotic process in Japanese Quail(Coturnix coturnix japonica)[J]. Internation Journal of Advacne Research in Biological Sciences, 2014, 9(1): 326-330. |
| [34] |
Johnson AL. The avian ovary and follicle development:Some comparative and practical insights[J]. Turkish Journal of Veterinary & Animal Sciences, 2014, 38(6): 660-669. |
| [35] |
Wang Y, Chen Q, Liu Z, et al. Transcriptome analysis on single small yellow follicles reveals that wnt4 is involved in chicken follicle selection[J]. Front End, 2017, 8(3): 17-21. |
| [36] |
林金杏.局部性促生长因子对鸡卵泡发育的调控及其机理的研究[D].杭州: 浙江大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10335-1012317284.htm
|
| [37] |
Gan X, Chen D, Deng Y, et al. Establishment of anin vitroculture model of theca cells from hierarchical follicles in ducks[J]. Bioscience Reports, 2017, 37(3): BSR20160491. DOI:10.1042/BSR20160491 |
| [38] |
Lee KA, Bahr JM. Utilization of substrates for testosterone and estradiol-17 beta production by small follicles of the chicken ovary[J]. Domest Anim Endocrinol, 1994, 11(3): 307-314. |
| [39] |
Kim D, Ocón-Grove O, Johnson AL. Bone morphogenetic protein 4 supports the initial differentiation of hen(Gallus gallus)granulosa cells[J]. Biology of Reproduction, 2013, 88(6): 161. DOI:10.1095/biolreprod.113.109694 |
| [40] |
Nitta H, Osawa Y, Bahr JM. Two populations of steroidogenic cells in the theca layer of chicken ovarian follicles[M]. Serono Symposia USA, 1991.
|
| [41] |
Vitt UA, Mcgee EA, Hayashi M, et al. In vivo treatment with GDF-9 stimulates primordial and primary follicle progression and theca cell marker CYP17 in ovaries of immature rats[J]. Endocrinology, 2000, 141(10): 3814-3820. DOI:10.1210/endo.141.10.7732 |
| [42] |
Rangel PL, Rodríguez A, Gutierrez CG. Testosterone directly induces progesterone production and interacts with physiological concentrations of LH to increase granulosa cell progesterone production in laying hens(Gallus domesticus)[J]. Animal Reproduction Science, 2007, 102(1): 56-65. |
| [43] |
Hattori K, Orisaka M, Fukuda S, et al. Luteinizing hormone facilitates antral follicular maturation and survival via thecal paracrine signaling in cattle[J]. Endocrinology, 2018, 159(6): 2337-2347. DOI:10.1210/en.2018-00123 |
| [44] |
Lin X, Liu X, Ma Y, et al. Coherent apoptotic and autophagic activities involved in regression of chicken postovulatory follicles[J]. Aging, 2018, 10(4): 819-832. DOI:10.18632/aging.101436 |
| [45] |
Choi J, Jo M, et al. AKT is involved in granulosa cell autophagy regulation via mTOR signaling during rat follicular development and atresia[J]. Reproduction, 2014, 147(1): 73-80. DOI:10.1530/REP-13-0386 |
| [46] |
Zhou J, Yao W, Li C, et al. Administration of follicle-stimulating hormone induces autophagy via upregulation of HIF-1α in mouse granulosa cells[J]. Cell Death & Disease, 2017, 8(8): e3001. |
| [47] |
Kim C, Park JM, Song Y, et al. HIF1α-mediated AIMP3 suppression delays stem cell aging via the induction of autophagy[J]. Aging cell, 2019(1): e12909. |
| [48] |
Siddiqui FA, Prakasam G, Chattopadhyay S, et al. Curcumin decreases Warburg effect in cancer cells by down-regulating pyruvate kinase M2 via mTOR-HIF1α inhibition[J]. Scientific Reports, 2018, 8(1): 8323. DOI:10.1038/s41598-018-25524-3 |
| [49] |
Gao H, Lin L, Haq IU, et al. Inhibition of NF-κB promotes autophagy via JNK signaling pathway in porcine granulosa cells[J]. Biochemical & Biophysical Research Communications, 2016, 473(1): 311-316. |
| [50] |
覃芳, 张智博. JNK信号通路与自噬的研究进展[J]. 中南大学学报:医学版, 2015, 40(9): 1035-1038. |
| [51] |
Du L, Gu T, et al. Transcriptome profiling to identify key mediators of granulosa cell proliferation upon FSH stimulation in the goose(Anser cygnoides)[J]. British Poult Sci, 2018, 59(4): 416-421. DOI:10.1080/00071668.2018.1459474 |
| [52] |
Yu J, Lou Y, He K, et al. Goose broodiness is involved in granulosa cell autophagy and homeostatic imbalance of follicular hormones[J]. Poult Sci, 2016, 95(5): 1156-1162. DOI:10.3382/ps/pew006 |
| [53] |
Lou Y, Yu W, Han L, et al. ROS activates autophagy in follicular granulosa cells via mtor pathway to regulate broodiness in goose[J]. Ani Rep Sci, 2017, 185(1): 37-103. |
| [54] |
Ming S, Yan C, Yi J, et al. Melatonin protects mouse granulosa cells against oxidative damage by inhibiting FOXO1-mediated autophagy:Implication of an antioxidation-independent mechanism[J]. Redox Bio, 2018, 18(1): 38-57. |
| [55] |
Cao Y, Shen M, Jiang Y, et al. Melatonin reduces oxidative damage in mouse granulosa cells via restraining JNK-dependent autophagy[J]. Reproduction, 2018, 155(3): 307-319. DOI:10.1530/REP-18-0002 |
| [56] |
Kang B, Wang XX, Xu QL, et al. Effect of 3-NPA inducing oxidative stress and apoptosis of granulosa cells in geese[J]. Biosci Rep, 2018, 38(5): pii:BSR20180274. DOI:10.1042/BSR20180274 |
| [57] |
Yamamoto Y, Kuwahara A, et al. Tumor necrosis factor alpha inhibits ovulation and induces granulosa cell death in rat ovaries[J]. Reprod Med Biol, 2015, 14(3): 107-115. DOI:10.1007/s12522-014-0201-5 |
| [58] |
曹伟.鹅Dicer基因克隆及其在卵泡中的发育性表达研究[D].雅安: 四川农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10626-1013157521.htm
|
| [59] |
Shen M, Li T, et al. Dynamic expression and functional analysis of circRNA in granulosa cells during follicular development in chicken[J]. BMC Genomics, 2019, 20(1): 96-102. DOI:10.1186/s12864-019-5462-2 |
| [60] |
Worku T, Rehman Z, Talpur H, et al. MicroRNAs:new insight in modulating follicular atresia:a review[J]. International Journal of Molecular Sciences, 2017, 18(2): E333. DOI:10.3390/ijms18020333 |




