2. 山东省烟台市农业科学研究院,烟台 265500;
3. 中国科学院上海高等研究院低碳转化科学与工程重点实验室,上海 201210;
4. 中国石油大学(华东)生物工程中心,青岛 266580
2. Yantai Academy of Agricultural Sciences, Yantai 265500;
3. Shanghai Advanced Research Institute, Chinese Academy of Sciences, Shanghai 201210;
4. China University of Petroleum, Bioengineering Center, Qingdao 266580
我国是传统农业大国,从20世纪80年代开始,化肥的大量施用,带动了作物产量的大幅度提升,为我国农业生产和粮食安全作出了突出贡献。但随着化肥施用量的逐年加大,我国迅速成为世界化肥消费大国,在占世界7%的耕地上消耗了全球近1/3的化肥量。2013年我国农用化肥施用量5.912×107 t,农作物亩均化肥用量21.9 kg,远高于世界平均水平(每亩8 kg),是美国的2.6倍,欧盟的2.5倍[1]。过量施肥和农药使用导致土壤质量下降、农作物病虫害增加、化肥利用率下降、农产品质量下降,农业面源污染已成为我国环境污染的重要组成部分[2]。设施农业(Facility agriculture)基于工程技术手段,能够实现培养条件相对可控,是一种促进动植物高效生产的现代农业模式。但在设施农业产业迅速发展的同时,亦衍生出一系列肥料和农药过度使用等绿色安全生产难题,同时也关系到农民的经济收入和产品质量安全。如化肥过量使用导致土壤结构破坏与群落微生物变化、作物病虫害发生频繁且幅度增强、作物产品营养品质下降等问题。过量施肥和农药使用导致的农业面源污染已经成为设施蔬菜产业发展的瓶颈[3]。国家近几年连续发布《大气污染防治行动计划》、《水污染防治行动计划》、《土壤污染防治行动计划》及推进农业供给侧结构性改革中,都对减少化肥和农药使用、保护生态环境提出了迫切需求。寻找新型的传统化肥替代品、提高化肥吸收效率及保护生态环境是现代农业亟待解决的重大问题。
生物刺激剂(Biological stimulants,BS)是具有调控植物生长作用的成分和(或)微生物的统称,用于农业生产,能改善土壤理化性质与群落微生物、促进作物的代谢与生长、增强对营养物质的吸收和利用、提升作物抗逆能力及提高作物产量与产品品质。目前生物刺激剂包括有机质(氨基酸、腐植酸、海藻提取物、有机碳、乙酸、糖醇酸、甲壳素、壳聚糖)和生物质(微生物菌剂、激素类)两大类[4]。常见的生物刺激剂产品包括:新型免疫增强剂(甲壳寡聚糖)、多肽(植物源多肽和动物源多肽)、生防菌(木霉菌和枯草芽孢杆菌)等。尽管目前已有规模化生产和销售的生物刺激剂,但同时也需要挖掘功能独特、来源稳定、易于规模化制备强效生物刺激剂的天然活性物质。
微藻是一类重要的光合微生物,具有品质可塑、固碳能力强、生长速率快、培养方式多样化(光合自养、混养及异养)、生长周期短,可工业化养殖等特点。藻细胞能合成积累多种结构和功能特异的高附加值生物活性成分,包括功能性糖类(螺旋藻多糖、紫球藻多糖等)、健康型脂类(高不饱和脂肪酸、EPA、DHA等)、优质功能蛋白(藻蓝蛋白、藻红蛋白、别藻蓝蛋白等)、天然活性色素(番茄红素、胡萝卜素、玉米黄质、叶黄素、岩藻黄质、虾青素等)、有效抗菌成分(特殊脂类、酚类、萜类)等[5-8]。微藻已经成为新型强效生物刺激剂制备的理想来源。除此之外,微藻生物技术已经广泛应用于环境治理领域,在煤基烟道气、畜禽养殖废水、市政生活废水、食品加工废水治理及资源化利用等方面展现出强大的优势[9-11]。更重要的是,微藻在用于环境治理的同时,获得的微藻生物质可用来制备生物刺激剂,进而达到治理环境、降低成本、提质增效的多重效益[12]。
本文重点综述了微藻源生物刺激剂的定义及功能、适合开发生物刺激剂的藻源活性成分及藻种,微藻源生物刺激剂的制备及施用方法,微藻源生物刺激剂在设施农业生产中的应用效果及作用机理,并对微藻强效生物刺激剂的规模化制备及综合应用进行展望,以期为微藻源强效生物刺激剂的规模化制备及农业生产应用奠定理论基础和提供现实指导。
1 微藻源生物刺激剂的定义及功能微藻源生物刺激剂(Microalgae source biological stimulants,MSBS)是来源于微藻的具有调控植物生长作用的成分和(或)富含微藻活细胞的一类新型生物刺激剂。微藻源生物刺激剂兼具微藻功能性肥料与微藻生物农药的双重属性[13]。与传统功能性肥料或生物农药相比,微藻源生物刺激剂不但具有肥料与农药功效,更重要的是能促进作物代谢与生长,更有效吸收营养物质和提高抗逆能力[14]。同时还能改善土壤理化性质与群落微生物,提高作物产量与产品品质。因此,在使用过程要注意区分微藻功能性肥料、微藻生物农药及微藻源生物刺激剂。
2 适合开发微藻源生物刺激剂的活性成分及藻种微藻源生物刺激剂包括全藻细胞和微藻源天然活性物质。尽管微藻种类繁多、形态各异,但从全藻细胞的角度出发,并不是所有微藻种都适合开发生物刺激剂。可开发生物刺激剂的藻种是一类能在土壤中存活繁殖,并且可合成单一或多种功效成分的种类。生活在土壤里的微藻种类主要包括:蓝藻门、绿藻门、红藻门、硅藻门和隐藻门等,其中蓝藻门和绿藻门占了绝大多数[15]。土壤蓝藻门主要包括色球藻属、平裂藻属、微囊藻属、螺旋藻属、颤藻属、席藻属、鱼腥藻属、拟鱼腥藻属和念珠藻属等。土壤绿藻门主要包括杜氏藻属、衣藻属、小球藻属、盘星藻属、栅藻属、团藻属、四孢藻属、胶球藻属、绿球藻属、集球藻属、四角藻属、纤维藻属、卵囊藻属、网球藻属、刚毛藻属、盘藻属、羽枝藻属、鞘藻属、转板藻属、新月藻属、鼓藻属和水绵属等。能在特定的土地中生存繁殖是选择微藻源生物刺激剂藻种的优先条件。沙漠地[16]、盐碱地[17]、沼泽地[18]、贫瘠地等农业种植艰难的地方均有微藻生存的痕迹。筛选、培育当地优势藻种,制备微藻源生物刺激剂,是解决当地农业种植、改善土质的途径之一。
基于全藻细胞制备生物刺激剂的优势在于微藻可存活且具有活性。有研究报道,微藻可合成与高等植物激素类似的物质以及分泌对周围环境作出应答的物质[19],如多酚化合物和抗生素类,可刺激植物体内非特异性活性因子的产生、调节内源激素的平衡;一些次生代谢产物也具有同种功效[20-21]。对于微藻源生物刺激剂的功效,藻株性能发挥了至关重要的作用。基于微藻的属地化特性,中科院上海高等研究院在江浙地区、西北及东北地区分离100余株微藻,并从中筛选了20株高效固氮固碳藻株,最大固碳速率为1.30 g/L/d,固氮酶活性最高可达到107.4 nmol/h/mg。Mazhar等[22]研究也发现从农田土壤分离到的4种固氮蓝藻,有较高的固氮效果。1939年印度首次报道固氮蓝藻(Cyanobacterium)作为生物肥应用于水稻增产研究[23],现如今已有诸多学者对固氮蓝藻在农业中的研究进行了挖掘[24-26],姜继辉等[27]实验发现施用蓝藻沼肥的土壤全氮含量、有效磷含量、有机质含量分别增加了49.1%、52.3%、33.3%。固氮蓝藻在作物生长调节剂和生物农药开发、农业环境污染防治和农业生态环境保护等方面发挥作用[28-29],是较好的微藻源生物刺激剂藻种。
基于微藻活性物质制备生物刺激剂的前提是挖掘功能独特的功效成分。微藻中含有结构独特、功能新颖、丰富多样的生物活性物质[30-31],包括藻多糖及其衍生物(寡糖)、特殊脂肪酸、氨基酸、小分子肽、天然色素、矿物质、植物激素、微量元素、抗生素、酚类、萜类等。例如红藻门中的紫球藻(Porphyridium cruentum)具有胞外分泌多糖的特性[32-33],是比较理想的生物刺激剂的制备藻种。欧洲细叶藻(Euglena gracilis)是一种单细胞藻类,属于裸藻属(Euglena.),具有完整的叶绿体结构和伸展性很强的细胞膜,可通过光合作用和吞噬两种方式来满足自身生长需要。从进化角度分析,细叶藻比其他藻种更接近高等植物,可以合成更为复杂的碳水化合物。研究报道,在沼泽地里细叶藻(Euglena gracilis)和莴苣(Lactuca sativa L.)可以共培养[18]。Jochum等[34]研究表明水稻和微藻的共培养可以提高水稻的产量与品质。目前,已经通过试验证明微藻源生物刺激剂(生物肥)的效果显著[35-38]。
3 微藻源生物刺激剂的制备及施用方法微藻源生物刺激剂应用于设施农业主要以新鲜活体、提取物及单一活性物质3种形式,前者基于全藻细胞,而后两者基于微藻活性物质。
基于新鲜活体制备微藻源生物刺激剂的一般流程:培养至营养胁迫期的新鲜藻液,用壳聚糖改粘性土壤絮凝微藻,制成浓缩藻液。这种微藻源生物刺激剂可以采用单一藻种也可多藻种混合使用,用于培土期,播种前,播种后,苗期,以及植物各生长时期的灌溉,以活的生命体形式注入到土壤中,可通过其生命周期和自身代谢活动促进植物生长。采用与水一起灌溉的方式,在作物根系部位形成藻-作物互作体系。这种方式具有制备成本低、方便易行的优点,但同时对藻种活力有较高要求,保存及运输成本较高。另外大规模的制备微藻浓缩液需要花费大量人力财力,但与环境治理系统耦合,例如基于微藻培养的废水[39]、废气、废渣处理耦合获得大量的微藻生物质,用于制备生物刺激剂,可降低生产成本。刘淑芳等[40]用3种微藻液作为功能性肥料,促进了黄瓜的生长,同时增加了土壤养分,提高了土壤酶活性。目前,已在实验室或大田中对葡萄、桃树、韭菜、山药、莴苣、黄瓜和苜蓿[41]等作物进行了新鲜活体微藻源生物刺激剂的效果验证。
基于微藻提取物制备生物刺激剂主要有水提物与醇提物两大类。水提物中的功效成分主要是一些水溶性的物质,一般的制备流程:将培养获得的藻液浓缩成湿藻泥,干燥后获得干藻粉;在藻粉中加入10倍体积的水,沸水浴3 h;室温下离心3 000 r/min,4 min,取上清;水相0.22 µm滤膜过滤;过滤液浓缩至粉末,4℃保存,此时藻中的大多数水溶活性成分被保留。醇提物主要含有一些脂溶性功效成分,一般制备流程包括:在藻粉中加入10倍体积的无水乙醇,超声波破碎15 min,离心取上清;在沉淀中再次加入10倍体积无水乙醇,超声波破碎15 min,离心取上清,混合两次上清液;有机相0.22 µm滤膜过滤;过滤液浓缩至粉末,4℃保存,此时藻中的大多数醇溶活性成分被保留。这种提取方法是经过高度浓缩的,具有制备成本较高,获得量小的特点。因此在使用方式上与上述不同,主要采用稀释与喷施结合策略,作用于植物生长发育各个时期,因提取物中含有促进植物生长调节剂,可诱使植物生长,也可在自然灾害来临之前预先喷施此种生物刺激剂,诱导植物的抵抗力,使植物在灾害来临时可安全度过,达到预防的目的。例如,小球藻热水提物(CE)具有促进作物生长的功效[42]。
单一活性物质生物刺激剂是在水提物和醇提物的基础上进一步提纯获得的。这种制备方法得到的生物刺激剂成本更高,但功效更强。有研究报道微藻源寡糖(由2-10个氨基葡萄糖以β-1,4-糖苷键连接而成)作为诱导因子可以有效提高植物的防御应答反应[43]。寡糖还可以促进种子萌发,促进根系生长,促进茎叶、果实生长,加快植物生长发育、改善品质、增产增收等功效[44-45]。1,3-葡聚糖是一种从小球藻中分离的活性成分免疫刺激剂[46],可清除动植物体内的自由基。另外还有蓝藻中的藻胆蛋白和固氮酶可以固定氮元素[47]。多数情况下单一活性物质是以复合添加剂的形式添加在其他肥料和生物农药中。
微藻源生物刺激剂制备目前存在的问题是:微藻种类繁多,体内的活性物质也是多种多样,针对不同提取物的提取工艺差距较大,没有统一标准。另外我国农资产品登记中没有专门的微藻生物刺激剂品类,对此将藻类提取型生物刺激剂划归到有机水溶肥料或微生物菌剂的品类中,因此急需行业统一标准,精准应用微藻源生物刺激剂独特的促生提质功效。
4 微藻源生物刺激剂在设施农业生产中的应用实例微藻源生物刺激剂的应用主要体现在设施农业生产中,可分为大田肥料增强剂、温室大棚肥料增强剂及园艺生产肥料增强剂3大类。
大田作物,即在作物生长周期内不覆盖或阶段性覆盖地膜、顶棚等设施的,全天接受自然光照、温度、养分调节的农业生态系统。由于大田环境相对不稳定,无论是光照、雨水、肥力流失和风力等非生物因素,还是土害、病虫患等生物因素,均对微藻源生物刺激剂的制备及使用提出了很高的要求。一般的微藻源生物刺激剂筛选自当地或同一作物长期种植的土壤中,因此微藻源生物刺激剂具有广适性、耐受性、生物固氮固碳强的特点。在大田中,微藻源生物刺激剂的量比较少,无法大规模使用,一般少量添加于其他肥料中。微藻源生物刺激剂主要是依靠活性细胞进行自身生长繁殖、释放一些激素等小分子物质进而调节作物的代谢。
瓜果蔬菜规模化生产往往依赖温室大棚,目前针对一些常见瓜果蔬菜进行了研究。对于设施生菜种植来讲,同化肥减半组相比,藻源生物刺激剂施加能增产33.6%。同化肥组相比,在减少化肥一半用量时,藻源生物刺激剂增产23.4%。藻源生物刺激剂的施加,提高了生菜总可溶性蛋白含量。水稻大田实验发现,在减少氮肥25%时,微藻源生物刺激剂能提高稻米10%-20%的产量,主要表现为增加穗数和千粒重[26]。本课题组对小油菜试验研究表明,施加微藻源生物刺激剂的植株自身叶绿素合成显著增加,其中叶绿素b的生成量是对照组的2倍。植物中叶绿素a与叶绿素b的比值一般为3:1,施加微藻源生物刺激剂会降低叶绿素a/b的值,促进植物生物质的累积。另外,微藻源生物刺激剂—全藻细胞在种子萌发阶段也有显著效果,我们课题组对绿豆种子在光照条件和避光条件下施加微藻源生物刺激剂,表明微藻源生物刺激剂在避光条件下可提高绿豆种子的发芽势(图 1-A)。以全藻细胞施肥于盆栽黄瓜生长全周期,黄瓜生长状况与对照组相比具有明显优势(图 1-B)。以水为对照,藻肥为实验组,复合肥为阳性对照分别施于盆栽小油菜生长全周期,结果表明藻肥与复合肥生长状况相差不大均比对照组好,但藻肥的营养成分和生物质累积相比复合肥有明显优势(图 1-C)。微藻源生物刺激剂—藻源提取物对谷子生长具有促进效果,我们课题组用小球藻、螺旋藻、莱茵衣藻、雨生红球藻四种藻的水提取物在正常光照和黑暗下对谷子种子进行处理,发现在光照和黑暗条件下4种水提物对谷子种子萌发至幼苗阶段的生长均有促进效果,在黑暗条件下促进效果明显(图 1-D)。

|
| 图 1 微藻源生物刺激剂应用于作物效果 |
在园艺生产方面,微藻源生物刺激剂在家庭园艺中具有广泛的应用前景。家庭园艺由于生态系统很小,内部可能有植物、部分藻类、甚至鱼虾等高等脊椎动物,因此养分的持续缓释供应和维持生态系统的稳定性功能显得尤为重要。而微藻源生物刺激剂中的微藻就是来源于自然水体和土壤中,因此能极好地适应该环境,且内部生态系统的生物排泄物等也有助于藻类生长及其活性物质的释放。无论是养植物还是动物,微藻生物饲料或肥料添加量无需很多,可如同营养液一般兑水使用即可,如有高级的自动进料系统,可定时定量补充饲料,能够在较长一段时间内无需添加额外饲料或肥料,减少换水和移植频率,稳定园艺微生态系统。
已有文献报道[48-49]及我们团队的实验都证实了微藻源生物刺激剂能够促进土壤改良及农作物绿色增产。
5 微藻源生物刺激剂作用效果与作用原理微藻源生物刺激剂的作用机制(图 2)包括改善土壤理化性质、调节群落微生物、增强土壤肥力、促进作物的代谢与生长、增强作物对营养物质的吸收和利用、提升作物抗逆能力及提高作物产量与产品品质。
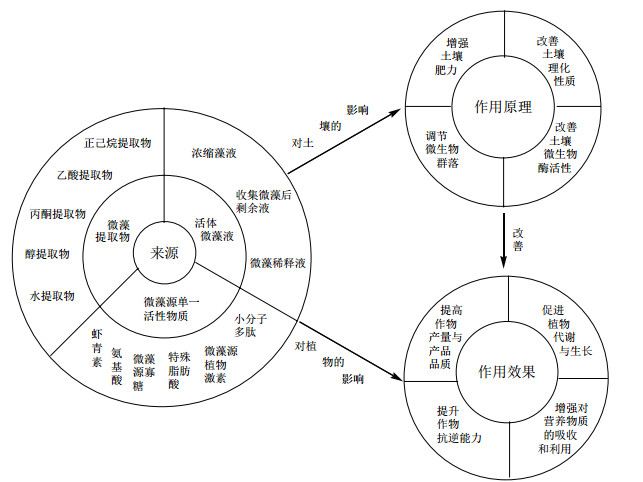
|
| 图 2 微藻源生物刺激剂作用于设施农业效果图 |
土壤理化性质包括土壤结构和土壤酸碱度等。土壤结构实际上是土壤颗粒按照不同的排列方式堆积、复合而形成的土壤团聚体。不同的排列方式往往形成不同的土壤结构,化学肥料的长期过度使用,使得土壤微生物减少,土壤板结现象严重。土壤板结现象造成土壤性质变化,土壤孔隙状况欠佳,进而影响土壤肥力和耕力。土壤酸化是指土壤中氢离子增加,pH值下降,土壤呈强酸性或极强酸性的现象。导致土壤酸化的物质包括大气污染造成的酸雨,土壤中有机质的分解产生的有机酸,土壤中微生物及植物根系的代谢作用产生的碳酸等。一般情况下自然酸化过程较为缓慢,人为因素造成的土壤酸化速度非常快。
使用微藻源生物刺激剂可对土壤的团粒结构进行改善,增强土壤的物理性能和减少土壤颗粒的损失,在一定的条件下,还能参与腐殖质形成。一方面,微藻光合作用消耗大量的二氧化碳等碳源,经过微生物分解后的有机酸如碳酸、醋酸、琥珀酸和柠檬酸等可以作为微藻的碳源,合成有机物。一般微藻培养过程中可调整pH达到接近中性状态,正好对抗土壤变酸的过程。活性微藻生物刺激剂复配的小苏打和光合细菌可以改良酸性土壤,小苏打是常用的改良酸性土壤产品,光合细菌能够分解土壤大分子有机物,形成的小分子有机物可以被藻类利用作为碳源,同时光合细菌在土壤中的培养时间增长使pH逐渐提高,亦可对抗土壤酸化。另一方面经显微镜观察,微藻源生物刺激剂改善了土壤团粒结构,增加土壤表层叶绿素a含量。土壤的团粒结构决定了植株生根定植、汲取水分及养分,是土壤呼吸速率、持水性能等的主要载体和体现。微藻产生糖类物质,占土壤有机质的0.1%,与植物粘液,矿物胚体和有机胶体结合在一起,可以改善土壤团粒结构,增强土壤的物理性能和减少土壤颗粒的损失,在一定的条件下,还能参与腐殖质形成。
土壤团粒结构的优劣有时直接关系到植株的生长及土壤的健康可持续发展。团粒结构过于紧密的土壤容易造成土壤尤其是下层结构缺氧而形成异养环境,使得土壤性质和pH等发生变化,生态系统朝向厌氧环境发展而非好氧和厌氧共存的方向发展,导致植物根系活力下降甚至坏死。由于微藻源生物刺激剂中的微藻生物基本都属于单细胞或单细胞不紧密结合细胞团,可渗入土壤内部,调节土壤微生物的活力,加速分解土壤块,有效缓解土壤团粒结构过于紧密的现象。在光照极弱的地下土壤部分,微藻即使因无足够的光照而无法进行光合自养逐渐死亡,也会为其他有异养代谢的微生物提供能量,继续为植株根系的共生体系做出贡献。在部分荒漠化、水分含量较少、周期性的农田地区,土壤表面和土壤下层结构还容易形成藻-菌-原生动物共同构成的生物结皮结构,这一物理结构对土壤结构和作物的稳定生长均有极大的好处。
5.2 调节土壤微生物群落土壤微生物是生活在土壤中的肉眼看不见的微小生物统称,包括细菌、真菌、病毒和显微藻类等生物。不同土层分布着不同种类和数量的微生物,它们通过一些氧化、硝化、固氮等作用,促进土壤有机质的分解和养分的转化(图 3)。土壤中的微生物种类异常丰富,主要包括细菌、古菌、真菌、病毒、原生动物等。它们对土壤的形成发育、物质循环和肥力演变等均有重大影响。
|
| 图 3 土壤微生物作用于土壤结构示意图 |
化学肥料的过量施用破坏了土壤微生物群落的丰度,如尿素里面的氨,高浓度的氨对于大多数微生物来说都是毒害性的。土壤微生物破坏后,土壤板结,肥力降低,继而形成肥料使用量和肥力效果逆反的恶性循环局面。
采用活性微藻源生物刺激剂生物肥料可以改善土壤的微生物生态系统,提高肥力,降低化学肥料的使用,促进作物对营养物质的吸收和利用。某些微藻种类在生长过程中,胞内胞外多糖含量明显增加,可将更多的C固定于土壤内,因而土壤溶解性有机碳(Dissolved organic carbon,DOC)及总碳(Total carbon,TC)含量明显增加[50]。同时,无论微藻源生物刺激剂单独使用还是与传统化肥和生物肥混合使用,都能够促进土壤固氮酶活性的提高。土壤固氮酶活性的提高,促进了土壤铵态氮(Ammonium nitrogen,AN)含量的提高[14]。
5.3 提高土壤肥力质量根据生物化学基本理论,从太阳光到生物质理论上最大的能量转化率大约为10%,现代田间农作物的产量大概为理论值的1/10-1/3,因此提升整个生物质转化过程的关键是提高光合作用的效率,微藻的能量转化率普遍高于田间作物,液体微藻源生物刺激剂中的活体微藻在土壤表面形成一层保护膜,可大面积吸收利用转化能量,为土壤增加有效肥力。微藻中的固氮株——固氮蓝藻通过其细胞中固氮酶的作用,将大气中游离态的分子氮还原成可供植物利用的氮素化合物,同时在其生长繁殖过程中不断分泌出氨基酸、多肽等含氮化合物和活性物质,加之固氮蓝藻死亡后释放出大量的氨态氮,因而大大增加土壤肥力。固氮蓝藻单独使用或与有机肥/生物炭/基质等混合使用可形成微藻生物肥料,减少或替代部分化肥的使用。
微量元素作为土壤指标之一,在评价土壤肥力质量中也是至关重要的。微藻源生物刺激剂生物肥中含有多种微量元素,活体微藻亦可吸收土壤中的微量元素,转化为植物可吸收的复合物。功能农业中也强调在农产品和食品中注重微量元素含量。微藻源生物刺激剂生物肥的使用可提高土壤中的微量元素进而增加农产品的营养价值。
传统化肥释放氮磷钾等元素时间很短,短时间在局部就能达到作物需求营养元素相应的浓度,但由于施肥方式、作物特性、土壤类型等多种因素,化肥的利用率一般都不高。而微藻生物肥具有的生物活性恰恰可以解决这一问题。微藻生长过程也需要氮磷等营养物质进行代谢,并不断同化成为细胞内含物、细胞器、细胞膜及其它组分,也会通过其种群的不断扩大而逐步、缓慢地释放土壤中的氮碳磷库内的元素储备,而后通过微藻群落的繁殖—死亡循环使得土壤氮碳磷元素处于不断的“汇”和“源”的交替过程中,这样的代谢通路比化肥的释放通路要延长不少,使得土壤和其上的植株在收纳肥料和土壤原本肥力的过程中有一个缓冲的能力和屏障,既能保证植株在一些特定时期不发生肥力过猛、植株细胞内脱水的“烧苗”现象导致减产甚至绝收,也能够在一段时期内固定来自土壤本身或人工施加的肥料营养成分,达到缓慢释放营养的效果,保证植株生长的营养需求。
从微藻的培养过程来讲,将富含氮磷钾的废水中培养出来的微藻用于微藻源生物刺激剂生物肥的开发,既达到了废水去氮去磷的效果,又能将氮磷缓慢释放到土壤中,有效增加土壤肥力,保证植物生长所需要的营养。就以农家肥和微藻肥做对比(表 1),微藻肥的各类营养物质均高于常用的农家肥。但是,微藻生物质累积量不足,因此在生物肥料方面,还是以活体液体肥为主,通过其他方式作用于土壤和植物,而不是直接作为生物质来增加土壤肥力。
微藻源生物刺激剂包含活体的复合细胞团,其来源大多数是采集、分离、纯化自属地的生态结构。因此其施加到当地生态系统中后能够快速地对当地生态系统中的非生物和生物因子做出适当的响应。而作为植株来说,其营养吸收的主要手段便是通过其根系从土壤周隙中汲取水分及水溶性的无机和有机物质,作为其光合同化和呼吸的底物。因此其根系周边的微环境就显得尤为重要,其根系表面的氧化还原反应类型、速率、反应条件的变化程度等将直接影响植株吸收和生长的速率。微藻源生物刺激剂施加入土壤中后,其活体成分能够在土壤表面快速形成一层微藻、细菌等优势生物的群体性生物结皮结构,在根系组织表面,微藻能够和细菌等形成较为稳定的、呈现周期性规律的共生体,持续不断地为植株提供必要的代谢产物,而植株也会给予其相应的有机碳及其它植株不能利用而共生体结构能够利用的氮源或碳源,形成互惠共利的关系。
5.5 促进作物生长、提升抗逆能力及提高产量与品质在蓝藻无害化处理和资源化利用的基础上,将蓝藻制备成微藻源生物刺激剂,并应用于水稻种植[52],能显著促进水稻生长,提高产量和稻米品质,其蛋白质含量比化肥种植的水稻高出55.8%,直链淀粉和胶稠度分别高出9.3%和7.9%。基于高效固氮功能的原核生物——蓝藻与高能营养和光合功能的真核生物——绿藻混合制备的微藻源生物刺激剂能显著促进桃树平均单果重,增加可溶性固形物含量,大幅提升产品品质。基于固氮鱼腥藻制备的微藻源生物刺激剂能显著促进小麦和西红柿的产量[53]。
6 微藻源生物刺激剂应用展望微藻源生物刺激剂具有独特的优势,但目前还存在一系列问题,包括微藻细胞或活性物质的制备,微藻源生物刺激制备行业标准、微藻源生物刺激剂的使用方法等。
降低微藻养殖成本是实现微藻源生物刺激剂规模化制备的关键。设计新型微藻规模化养殖设备是有效途径之一[54-55]。例如,近年来广泛采用的垂直管道、水平管道、跑道池、交错流平板反应器及仿生树形反应器等有效提高了微藻光合活性及生物量,具有高的混合效率及停留时间,30 L反应器最大生物量在7 g/L左右。以35%更新率,可半连续培养20 d,比批次培养可多获得20%左右的微藻生物量。除此之外,微藻已经广泛应用于环境治理,在环境治理的同时制备微藻生物质也是降低成本的有效途径。通过与废液(生活废水、畜禽养殖废水、市政废水等)和废气(电厂、煤焦烟道气等)处理系统耦合,利用微藻吸收烟道气中的CO2及NOX提供碳源与氮源,利用工厂的余热及其他能量,提供微藻生长所需温度及微藻干燥,结合高效光生物反应器,实现微藻的规模化廉价生产。利用某些微藻的异养和混养特性,吸收废液中的氮、磷等营养成分,转化为微藻自身生物质,达到低碳减排、微藻源生物刺激剂的制备及设施农业提质增效的目的。
当然,微藻源生物刺激剂的产业发展还有很长的路要走,还需要更多的科研工作者投入精力和资金,研究每种植物和土质适合的微藻源生物刺激剂,除了要考虑藻种配方和加工方式及施用方式外,还要考虑微藻源生物刺激剂的释放速率和保质期,以及当地种植的惯有操作,当地气候与土壤本底值等因素。这些因素也将成为微藻源生物刺激剂开发的重点和难点。
| [1] |
李敏. 化肥使用量零增长专题报道之一:耕地之"恙"[J]. 中国石油和化工经济分析, 2015(6): 12-13. |
| [2] |
黄国勤, 王兴祥, 钱海燕, 等. 施用化肥对农业生态环境的负面影响及对策[J]. 生态环境, 2004(4): 656-660. |
| [3] |
刘志雄, 邱正明, 闵勇, 等. 设施蔬菜"三减三增"健康栽培技术[J]. 长江蔬菜, 2015(24): 77-78. |
| [4] |
陈绍荣. 科学发展生物刺激剂产业, 建设现代生态文明农业[J]. 磷肥与复肥, 2019, 34(8): 1-6. |
| [5] |
Buono S, Langellotti AL, Martello A, et al. Functional ingredients from microalgae[J]. Food Funct, 2014, 5(8): 1669-1685. |
| [6] |
Eppink MHM, Olivieri G, Reith H, et al. From current algae products to future biorefinery practices:a review[J]. Adv Biochem Eng Biotechnol, 2019, 166: 99-123. |
| [7] |
赵伟, 高保燕, 黄罗冬, 等. 微藻及其生物活性成分在水产养殖中的营养价值、生理功能和抗病活性[J]. 饲料工业, 2019, 40(8): 9-16. |
| [8] |
胡光荣, 范勇, 李福利. 微藻中的高附加值天然产物与挖掘策略[J]. 氨基酸和生物资源, 2015, 37(4): 1-6. |
| [9] |
Mukherjee C, Chowdhury R, Sutradhar T, et al. Parboiled rice effluent:A wastewater niche for microalgae and cyanobacteria with growth coupled to comprehensive remediation and phosphorus biofertilization[J]. Algal Research, 2016, 19: 225-236. |
| [10] |
Wang JH, Zhang TY, Dao GH, et al. Microalgae-based advanced municipal wastewater treatment for reuse in water bodies[J]. Appl Microbioln Biotechnol, 2017, 101(7): 2659-2675. |
| [11] |
Huang G, Chen F, Kuang Y, et al. Current techniques of growing algaen using flue gas from exhaust gas industry:a review[J]. Appl Biochem Biotechnol, 2016, 178(6): 1220-38. |
| [12] |
Jenkins SN, Paredesvaldivia CA, Waite IS, et al. Assessing the suitability of microalgae biomass produced from piggery waste as a fertiliser[J]. Animal Production Science, 2017, 57(12): 2480. |
| [13] |
熊思健. 生物刺激剂——我国农业高质量发展的新动力[J]. 磷肥与复肥, 2019, 34(4): 4. |
| [14] |
Bryant HL, Gogichaishvili I, Anderson D, et al. The value of post-extracted algae residue[J]. Algal Research, 2012, 1(2): 185-193. |
| [15] |
杜琼, 孔维宝, 韩锐, 等. 土壤微藻的种类及其功能研究进展[J]. 生物学通报, 2015, 50(1): 1-5. |
| [16] |
Perera I, Subashchandrabose SR, Venkateswarlu K, et al. Consortia of cyanobacteria/microalgae and bacteria in desert soils:an underexplored microbiota[J]. Appl Microbiol Biotechnol, 2018, 102(17): 7351-7363. |
| [17] |
刘国强, 王洪斌, 郑勇. 盐碱地专用肥研究进展[J]. 新疆师范大学学报:自然科学版, 2017, 36(4): 50-54. |
| [18] |
Takemura K, Endo R, Kitaya Y. Possibility of co-culturing Euglena gracilis and Lactuca sativa L. with biogas digestate[J]. Environ Technol, 2018, 28: 1-8. |
| [19] |
Lu Y, Xu J. Phytohormones in microalgae:a new opportunity for microalgal biotechnology[J]. Trends in Plant Science, 2015, 20(5): 273-282. |
| [20] |
郑庆伟. 中国科学院提出基于植物激素的微藻生物技术新观点[J]. 农药市场信息, 2015(12): 51. |
| [21] |
Renuka N, Guldhe A, Prasanna R, et al. Microalgae as multi-functional options in modern agriculture:current trends, prospects and challenges[J]. Biotechnol Adv, 2018, 36(4): 1255-1273. |
| [22] |
Mazhar S, Cohen JD, Hasnain S. Auxin producing non-heterocystous Cyanobacteria and their impact on the growth and endogenous auxin homeostasis of wheat[J]. J Basic Microbiol, 2013, 53(12): 996-1003. |
| [23] |
De PK. The role of blue-green algae in nitrogen fixation in rice-fields[J]. Proceedings of the Royal Society of London, 1939, 127(846): 121-139. |
| [24] |
Bargaoui S. Evaluating the establishment and agronomic proficiency of cyanobacterial consortia as organic options in wheat-rice cropping sequence[J]. Experimental Agriculture, 2013, 49(3): 416-434. |
| [25] |
Žižková E, Kubeš M, Dobrev PI, et al. Control of cytokinin and auxin homeostasis in cyanobacteria and algae[J]. Annals of Botany, 2017, 119(1): 151-166. |
| [26] |
Barminski R, Storteboom H, Davis JG. Development and evaluation of an organically certifiable growth medium for cultivation of cyanobacteria[J]. J Appl Phycol, 2016, 28(5): 2623-2630. |
| [27] |
姜继辉, 严少华, 陈巍, 等. 蓝藻沼肥对土壤的影响[J]. 土壤, 2010, 42(4): 678-680. |
| [28] |
Dash NP, Kumar A, Kaushik MS, et al. Cyanobacterial(unicellular and heterocystous)biofertilization to wetland rice influenced by nitrogenous agrochemical[J]. Journal of Applied Phycology, 2016, 28(6): 3343-3351. |
| [29] |
包江桥, 周伊薇, 何璐茜, 等. 固氮蓝藻的农业应用研究进展[J]. 中国生态农业学报, 2018, 26(4): 574-583. |
| [30] |
卢仡, 林红华, 柯群. 微藻的生物活性物质及其功能[J]. 食品工业科技, 2011, 32(7): 470-473. |
| [31] |
夏嵩, 万凌琳, 李爱芬, 等. 微藻生物质产品和生物活性物质的研究与开发[J]. 天然产物研究与开发, 2014, 26(3): 463-469, 453. |
| [32] |
Barclay WR, Lewin RA. Microalgal polysaccharide production for the conditioning of agricultural soils[J]. Plant & Soil, 1985, 88(2): 159-169. |
| [33] |
陈玮, 刘启顺, 李曙光, 等. 微藻多糖生物活性研究进展[J]. 中国海洋药物, 2012, 31(3): 55-60. |
| [34] |
Jochum M, Moncayo LP, Jo YK. Microalgal cultivation for biofertilization in rice plants using a vertical semi-closed airlift photobioreactor[J]. PLoS One, 2018, 13(9): e0203456. |
| [35] |
Akoijam C, Singh AK, Rai AN. Characterization of free-living cyanobacterial strains and their competence to colonize rice roots[J]. Biology & Fertility of Soils, 2012, 48(6): 679-687. |
| [36] |
Benemann JR, Olst JCV, Massingill MJ, et al. The controlled eutrophication process: Using microalgae for CO2 utilization and agricultural fertilizer recycling[C]. Greenhouse Gas Control Technologies, Volume Ⅱ, 2003.
|
| [37] |
Coppens J, Grunert O, Hende SVD, et al. The use of microalgae as a high-value organic slow-release fertilizer results in tomatoes with increased carotenoid and sugar levels[J]. Journal of Applied Phycology, 2016, 28(4): 2367-2377. |
| [38] |
Dineshkumar R, Subramanian J, Gopalsamy J, et al. The impact of using microalgae as biofertilizer in maize(Zea mays L.)[J]. Waste & Biomass Valorization, 2017(4): 1-10. |
| [39] |
杨方浩, 侯利园, 苑瑞东, 等. 废水资源化小球藻对拟南芥生长的肥效研究[J]. 安徽农业科学, 2018, 46(9): 75-77. |
| [40] |
刘淑芳, 吕俊平, 冯佳, 等. 施用微藻对黄瓜生长及土壤质量的影响[J]. 山西农业科学, 2016, 44(9): 1312-1315. |
| [41] |
代小, 木其叶乐, 敖敦, 等. 藻类活性细胞生物肥对苜蓿草产量及品质的影响[J]. 黑龙江畜牧兽医, 2018(22): 164-167. |
| [42] |
庄秀园, 黄英明, 张道敬, 等. 小球藻高附加值生物活性物质"小球藻热水提取物"的研究现状与展望[J]. 生物工程学报, 2015, 31(1): 24-42. |
| [43] |
Yin H, Li Y, Zhang HY, et al. Chitosan oligosaccharides-triggered innate immunity contributes to oilseed rape resistance against Sclerotinia sclerotiorum[J]. International Journal of Plant Sciences, 2013, 174(4): 722-732. |
| [44] |
O'Hara LE, Paul MJ, Wingler A. How do sugars regulate plant growth and development? New insight into the role of trehalose-6-phosphate[J]. Mol Plant, 2013, 6(2): 261-274. |
| [45] |
Winkler AJ, Dominguez-Nuñez JA, Aranaz I, et al. Short-chain chitin oligomers:Promoters of plant growth[J]. Mar Drugs, 2017, 15(2): pii:E40. |
| [46] |
申婷, 胡蕾, 冉炜, 等. 微藻在生物质开发中的应用进展[J]. 绿色科技, 2017(22): 128-130. |
| [47] |
Shalaby EA. Algae as promising organisms for environment and health[J]. Plant Signal Behav, 2011, 6(9): 1338-1350. |
| [48] |
Wu Y, Rao B, Wu P, et al. Development of artificially induced biological soil crusts in fields and their effects on top soil[J]. Plant and Soil, 2013, 370(1-2): 115-124. |
| [49] |
Mukherjee C, Chowdhury R, Ray K. Phosphorus recycling from an unexplored source by polyphosphate accumulating microalgae and cyanobacteria—a step to phosphorus security in agriculture[J]. Frontiers in Microbiology, 2015, 6: 1421. |
| [50] |
余劲聪. 海藻寡糖在农业领域的应用研究进展[J]. 南方农业学报, 2016, 47(6): 921-927. |
| [51] |
郑娇莉, 李双双, 彭成荣, 等. 干燥对人工生物土壤结皮固氮酶活性恢复过程的影响[J]. 中国科学:生命科学, 2017, 47(7): 759-769. |
| [52] |
Gupta V, Ratha SK, Sood A, et al. New insights into the biodiversity and applications of cyanobacteria(blue-green algae)—Prospects and challenges[J]. Algal Research, 2013, 2(2): 79-97. |
| [53] |
孔德柱, 张树峰, 周玉生, 等. 固氮鱼腥藻在小麦和西红柿上的肥效[J]. 江苏农业科学, 2016, 44(10): 499-502. |
| [54] |
刘玉环, 黄磊, 王允圃, 等. 大规模微藻光生物反应器的研究进展[J]. 生物加工过程, 2016, 14(1): 65-73. |
| [55] |
Sun ZL, Sun LQ, Chen GZ. Microalgal cultivation and nutrient removal from digested piggery wastewater in a thin-film flat plate photobioreactor[J]. Appl Biochem Biotechnol, 2019, 187(4): 1488-1501. |





