创伤弧菌(Vibrio vulnificus)主要分布在热带及亚热带近海岸地区,为嗜温、嗜盐、嗜碱型革兰氏阴性细菌,是一种重要的人-鱼共患致病菌[1]。2006年8月,Emerging infectious diseases杂志将创伤弧菌列入最危险的细菌行列。该菌通过污染的海产品(尤其是生蚝、海洋贝类产品)或伤口接触感染人类,严重危及人类生命[2-3]。创伤弧菌可导致皮肤起泡溃烂、坏死性筋膜炎、败血症、急性肠胃炎和感染性休克,55%以上的败血症患者在发病48 h内因多器官功能衰竭而死亡;免疫功能低下的患者属于易感人群,尤其是有基础性疾病的患者,如慢性肝炎、肝硬化、酗酒和遗传性血色沉着病,以及有慢性疾病如糖尿病、风湿性关节炎、慢性肾衰和淋巴瘤患者,严重感染该病原体的风险较高[4]。另男性相比女性更易发生感染,占比86%,是女性的6倍。且在男性群体中,创伤弧菌倾向于感染年长男性(> 40岁)[5]。且值得注意的是,最近有越来越多的报道显示健康宿主通过伤口感染创伤弧菌。
对于感染创伤弧菌患者,在大部分情况下,必须通过外科手术来清理创口,避免创伤弧菌快速增殖[6]。目前对创伤弧菌的致病机理并不明了,但可以肯定的是,其原因是多方面的。如创伤弧菌具有多种公认的毒力因子,如溶血素、弹性蛋白酶、荚膜多糖、脂多糖和胶原酶等[7]。此外,毒素多功能自动重复序列(Multifunctional-autoprocessing repeats-in-toxin,MARTX)毒素亦存在于创伤弧菌中,在其致病性中承担重要角色,创伤弧菌可利用MARTX毒素蛋白抵抗宿主免疫防御,使细菌在宿主体内增殖扩散[8]。
上述毒力因子大部分都是蛋白质,可见蛋白质的翻译质量对于细菌的生存、毒力等方面发挥重要作用。而几乎所有的原核微生物中,均有一套由转移信使RNA(Transfer-messenger RNA,tmRNA)和小蛋白B(Small molecular protein B,SmpB)介导的反式翻译系统。细菌主要通过该系统确保蛋白质翻译质量,对致病菌的毒力因子的表达、维持细菌内稳态和在逆境下的生存能力等方面发挥着非常重要作用[9]。因此本研究以海洋致病菌创伤弧菌为研究对象,对其反式翻译系统核心蛋白SmpB进行基因克隆及原核表达,旨为后续进一步研究SmpB蛋白与创伤弧菌致病性之间的关系奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株与试剂创伤弧菌(Vibrio vulnificus)标准菌株ATCC27526,购自上海士锋生物科技有限公司;E. coli DH5αD、E. coli BL21菌株以及含pET-28a载体的大肠杆菌,均为实验室保存菌株;卡那霉素、异丙基-β-D-硫代吡喃半乳糖苷(Isopropyl β-D-1-thiogalactopyranoside;IPTG)购自碧云天生物技术研究所;Pfu mix DNA聚合酶、高纯度质粒小量提取试剂盒购自广州东盛生物科技有限公司;PCR产物回收试剂盒购自江苏溥博生物科技有限公司;限制性内切酶EcoR I-HF、Xho I、T4 DNA连接酶购自NEB公司;引物及测序由生工生物工程(上海)股份有限公司完成。
1.1.2 主要仪器与设备NanoDropTM One/Onec微量紫外可见光分光光度计,美国Thermo Scientific公司;THZ-300C型恒温摇床(可制冷)、上海一恒科学仪器有限公司;XY-SH-150-ⅢY-SH-150-XY-JH-11C型个人型单面超净台,上海昕仪仪器仪表有限公司;T100型梯度PCR仪、GelDoc XR+型全自动凝胶成像系统、PowerPac Universal型通用电泳仪、1658001小型垂直电泳槽,美国Bio-Rad公司;HE-120多功能水平电泳槽,南京普阳科学仪器研究所;YXQ-LS-100A型内循环立式压力蒸汽灭菌器,上海博迅医疗生物仪器股份有限公司。
1.2 方法 1.2.1 创伤弧菌基因组DNA的提取创伤弧菌富含荚膜多糖,使用常规DNA提取方法无法有效获取基因组DNA。因此,参照侯卫国等[10]的文献,采用LiCl沉淀法提取创伤弧菌基因组DNA。提取后进行琼脂糖凝胶电泳检测,以及使用NanoDropTM One/Onec微量紫外可见光分光光度计(美国Thermo Scientific公司)测定基因组DNA浓度及纯度,-20℃保存备用。
1.2.2 引物设计根据GenBank数据库公布的V. vulnificus CECT 4999菌株smpB基因序列(NZ-CP014636),使用Oligo 6软件设计一对引物:F:5′-CGGAATTCATGGCAAAGAAAAATTCAAAAC-3′和R:5′-CCGCTCGAGACGCAGCGAGCTCTTCATC-3′,在引物5′端分别添加原核表达质粒pET-28a多克隆位点中所包含的EcoR I和Xho I酶切位点及对应的保护碱基,由生工生物工程(上海)股份有限公司合成。
1.2.3 smpB基因的扩增以创伤弧菌基因组DNA为模板,利用Pfu DNA聚合酶PCR扩增smpB基因,其片段大小为486 bp。PCR反应体系为:2×Pfu mix 25 μL,SmpB-F(10 μmol/L)1 μL,SmpB-R(10 μmol/L)1 μL,创伤弧菌基因组DNA 1 μL,ddH2O 22 μL,反应总体积为50 μL。瞬间离心混匀,进行PCR扩增,扩增反应条件为:94℃预变性3 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,共30个循环,72℃后延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳鉴定,并使用PCR产物回收试剂盒纯化回收。
1.2.4 重组原核表达质粒的构建将纯化回收的PCR产物和原核表达载体pET-28a分别经EcoR I和Xho I双酶切,再使用PCR产物回收试剂盒纯化回收酶切片段,酶切载体片段与酶切目的片段按1:3的比例,进行T4 DNA连接酶4℃过夜酶连,连接产物经热激法转入E. coli DH5αDH5αli产物经热激法转入,酶切载50 μg/mL卡那霉素的LB固体平板上,挑取单菌落,转接到新的含卡那霉素的LB平板上,进行菌落PCR验证,扩增产物使用1%琼脂糖凝胶电泳鉴定。挑取阳性克隆子,接种到5 mL含卡那霉素的LB液体培养基中,37℃ 150 r/min振荡培养过夜,高纯度质粒小量提取试剂盒提取重组质粒,送往生工生物工程(上海)股份有限公司测序。
1.2.5 生物信息学分析对测序获得的smpB基因序列,使用DNAMAN 9.0软件进行翻译,获得其氨基酸序列;使用ExPASy ProtParam在线工具(https://web.expasy.org/protparam/)分析SmpB蛋白的理化性质,TMHMM 2.0在线工具(http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜区域;使用SignalP 3.0在线信号肽预测工具(http://www.cbs.dtu.dk/services/SignalP-3.0/)进行信号肽预测;使用NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)进行磷酸位点分析;使用JPred 4.0(http://www.compbio.dundee.ac.uk/jpred/)预测二级结构,Swiss-Model对其高级结构进行预测;最后通过String蛋白质相互作用预测网站(https://string-db.org/),预测创伤弧菌SmpB蛋白的互作网络。
1.2.6 SmpB蛋白的诱导表达将测序正确的重组原核表达质粒热激法转入大肠杆菌BL21(DE3)感受态细胞中,复苏涂布到含50 μg/mL卡那霉素的LB固体平板上,挑取阳性克隆子,转接到5 mL含50 μg/mL的LB液体培养中,37℃振荡培养过夜,按1%的比例转接到200 mL含卡那霉素的LB液体培养基中,37℃振荡培养3-4 h,待OD600达到0.4-0.6时,加入IPTG至终浓度为100 μmol/L,25℃振荡诱导表达5 h,同时设置不加IPTG诱导剂组,最后均4℃ 4 000 r/min离心10 min,收集菌体,加入适量预冷PBS悬浮,在冰水条件下进行超声破碎,破碎功率为300 W,工作时间5 s,间歇时间6 s,全程时间45 min。4℃ 12 000 r/min离心10 min,收集上清及沉淀,进行12% SDS-PAGE凝胶电泳分析。
2 结果 2.1 创伤弧菌基因组DNA提取按照侯卫国等[10]的文献报道提取海洋创伤弧菌基因组DNA,进行琼脂糖凝胶电泳,凝胶成像系统拍照,结果如图 1,条带清晰无杂质,使用NanoDropTM One/Onec微量紫外可见光分光光度计检测基因组DNA的OD260/OD280和OD260/OD230分别为1.83和2.22,表明其纯度较好,浓度为28.4 ng/μL,可用于后续实验。
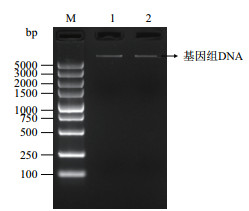
|
| M:DNA分子量Marker DSTM 5000 ladder;1-2:海洋创伤弧菌基因组DNA 图 1 创伤弧菌基因组DNA电泳图 |
创伤弧菌smpB基因的PCR扩增产物经1.0%琼脂糖凝胶电泳检测,可见约486 bp的特异条带,大小与预期一致,如图 2。使用PCR产物回收试剂盒纯化回收PCR扩增产物,经NanoDropTM One/Onec微量紫外可见光分光光度计检测,其质量浓度为101.5 ng/μL,OD260/OD280和OD260/OD230值各为1.83和2.35,满足后续实验要求。

|
| M:为DNA分子量Marker DSTM 5000 ladder;1-2:海洋创伤弧菌smpB基因PCR扩增产物 图 2 创伤弧菌smpB基因PCR扩增产物电泳图 |
将创伤弧菌smpB基因PCR产物双酶切片段和pET-28a双酶切片段进行T4 DNA连接酶酶连后,热激法转入大肠杆菌DH5α后,复苏后涂布到50 μg/mL卡那霉素的LB固体平板上培养,对长出来的单菌落使用通用载体引物进行菌落PCR验证,结果如图 3,1-3号,5-8号可见约800 bp的特异条带,包含目的基因及载体部分片段,其大小与预期一致,为目的阳性克隆子。挑取阳性克隆子,接种到含卡那霉素的LB培养液中,振荡培养过夜,提取质粒测序,测序结果表明,克隆的smpB基因序列与GenBank报道的序列一致,表明成功构建好原核重组表达质粒pET-28a-SmpB。
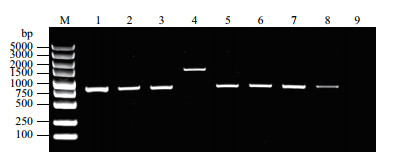
|
| M:DNA分子量marker DSTM 5000 ladder;1-8:阳性克隆子;9:空白对照 图 3 阳性克隆子菌落PCR鉴定电泳图 |
DNAMAN 9.0软件翻译测序获得的smpB基因序列,获得其氨基酸序列如图 4,共161个氨基酸。与GenBank报道的创伤弧菌smpB基因序列一致。

|
| 图 4 创伤弧菌smpB核苷酸序列及推测的氨基酸序列 |
ExPASy ProtParam在线分析软件分析SmpB蛋白的分子式为C808H1331N247O230S7,预测蛋白质分子量约为18.41 kD,理论等电点为10.28。SmpB蛋白含18个带负电荷的氨基酸残基(天冬氨酸和谷氨酸)及33个带正电荷的氨基酸残基(精氨酸和赖氨酸)。其蛋白不稳定系数为35.02 < 40,为稳定蛋白,总平均亲水性(GRAVY)为-0.635 < 0,表明该蛋白为亲水蛋白。TMHMM结果显示SmpB蛋白并不形成跨膜结构,主要定位于胞质溶胶中。NetPhos 3.1结果表明SmpB蛋白可能含有11个磷酸化位点,其中丝氨酸7个、苏氨酸3个、酪氨酸1个。我们使用Jpred 4预测了创伤弧菌SmpB蛋白二级结构,结果显示主要由7个β折叠、3个α螺旋组成,如图 5-A。同时,以耻垢分枝杆菌Mycobacterium smegmatis SmpB电子显微镜结构为模板(PDB ID:5zeyC),Swiss-Model预测的SmpB高级结构如图 5-B,其中核心结构为5个β折叠组成,C端30个氨基酸形成α螺旋。
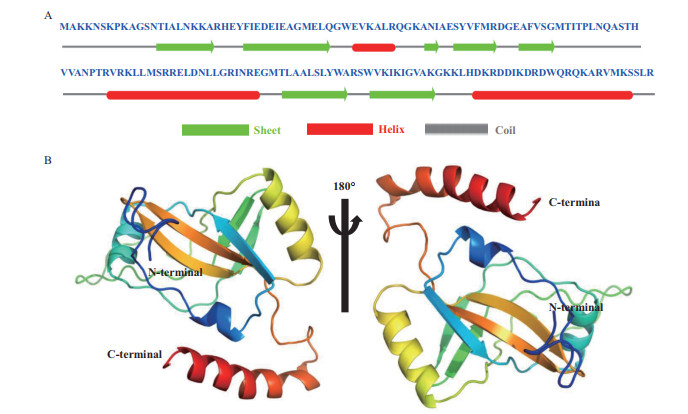
|
| A:创伤弧菌SmpB二级结构;B:创伤弧菌SmpB蛋白三级结构 图 5 创伤弧菌SmpB二级结构和三级结构预测 |
String方法对创伤弧菌SmpB蛋白进行互作预测结果显示,SmpB蛋白与10种蛋白质存在相互作用,其中50S核糖体蛋白L19(50 S ribosomal protein L19,RplS)、苯丙氨酸tRNA合成酶A氨酸iphenylalanyl-tRNA synthetase subunit alpha,PheS)、核糖核酸酶R(Ribonuclease R,RNase R)与SmpB蛋白互作比较显著(图 6)。
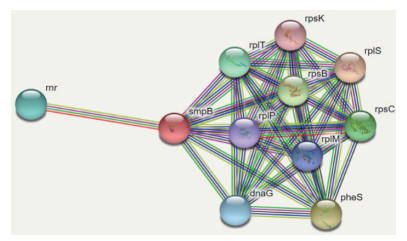
|
| 图 6 创伤弧菌SmpB相互作用蛋白预测 |
SDS-PAGE凝胶电泳结果显示,可见pET-28a-SmpB的诱导表达产物在25 kD附件有一条特异蛋白条带(图 7),虽然表观分子量要大于理论分子量,分析可能是融合了6个组氨酸标签,组氨酸是碱性氨基酸,具有强正电荷,会改变SmpB蛋白在SDS-PAGE凝胶中的泳动,降低其泳动速率,导致出现滞后现象,表观分子量在一定范围内变大[11]。
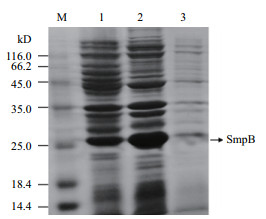
|
| M:蛋白质Marker;1:未诱导的pET-28a-SmpB/BL21全菌;2:诱导的pET-28a-SmpB/BL21上清;3:诱导的pET-28a-SmpB/BL21沉淀 图 7 创伤弧菌SmpB表达产物SDS-PAGE凝胶电泳图 |
创伤弧菌是一种革兰氏阴性嗜盐细菌和机会性人类病原体,可引起原发性败血症和伤口感染[12]。由于其广泛存在于近海和海湾区域,一些生蚝、贝类等海洋产品可能受到创伤弧菌的污染,人们一旦生食,或者伤口接触到这样的海产品,均可能导致感染,对人们的健康带来巨大威胁[13]。目前创伤弧菌已成为全球最危险的海产食品病原体,其生物安全危害程度分级为3-4级[14]。并且随着全球气温变暖,海洋温度上升,创伤弧菌感染发生率逐步上升[15]。因此深入研究创伤弧菌致病机制,寻找抗菌靶标,研发有效的疫苗具有重要意义。尤其是近年来越来越多研究报道,创伤弧菌对多种抗菌药物产生了不同程度的耐药性,开发新型抑菌靶标,研究新型抑菌药物变得更为迫切。
而几乎在所有的原核生物中,均存在一套由tmRNA-SmpB介导的反式翻译系统,确保细菌蛋白翻译质量[16]。细菌在正常生长条件和逆境条件下,均有可能发生基因转录错误,mRNA受损,翻译移码错误等问题。一旦出现mRNA畸变,缺乏正常终止密码子,核糖体会卡在mRNA链的3′端,无法释放下来,所产生的新生不完整肽链,会导致细菌中毒,同时占用了细菌中数量有限的核糖体,影响细菌的生长及毒力水平,而反式翻译系统就是纠正mRNA翻译畸变的一种主要的修复方式,通过其核心分子tmRNA和SmpB进行滞留核糖体的拯救,通过对新生的肽链加上一段10个氨基酸长度的标签肽,被体内的管家蛋白酶识别水解掉,从而使滞留的核糖体释放下来,使核糖体、tRNA等重新合成蛋白。此外除了翻译质量控制以外,反式翻译系统对细菌的耐压、基因调控表达、毒力水平以及生长水平等方面也起到重要作用[17]。
许多报道均表明反式翻译系统核心分子SmpB蛋白在细菌发病过程中起着重要作用。如Baumler等[18]报道鼠伤寒沙门氏菌SmpB突变体在巨噬细胞内的生存能力出现降低,Okan等[19]也报道假结核耶尔森菌SmpB突变体,在巨噬细胞中的生存能力和增殖能力均下降,并且表现出对小鼠无毒现象,并发现SmpB突变体在毒力效应蛋白的表达和分泌方面具有严重缺损。总之,SmpB蛋白对于细菌毒力具有非常重要作用。而在创伤弧菌中,关于SmpB对于其毒力调控或致病机制方面的研究尚无相关报道,因此本研究通过克隆创伤弧菌smpB基因,构建其原核表达质粒,并成功可溶性表达,为后续重组蛋白SmpB的纯化,以及深入研究SmpB蛋白互作、SmpB与创伤弧菌致病性之间的关系奠定基础,并为寻找抗创伤弧菌的新靶点提供一定的实验数据。
4 结论成功克隆创伤弧菌反式翻译系统smpB基因,并成功构建pET-28a-SmpB原核表达重组质粒,在E. coli BL21(DE3)中可以大量可溶性表达。
| [1] |
Pfeffer CS, Hite MF, Oliver JD. Ecology of Vibrio vulnificus in estuarine waters of eastern North Carolina[J]. Appl Environ Microbiol, 2003, 69(6): 3526-3531. DOI:10.1128/AEM.69.6.3526-3531.2003 |
| [2] |
Chung PH, Chuang SK, Tsang T, et al. Cutaneous injury and Vibrio vulnificus infection[J]. Emerg Infect Dis, 2006, 12(8): 1302-1303. DOI:10.3201/eid1208.051495 |
| [3] |
Chiang SR, Chuang YC. Vibrio vulnificus infection:clinical manifestations, pathogenesis, and antimicrobial therapy[J]. J Microbiol Immunol Infect, 2003, 36(2): 81-88. |
| [4] |
Horseman MA, Surani S. A comprehensive review of Vibrio vulnificus:an important cause of severe sepsis and skin and soft-tissue infection[J]. Int J Infect Dis, 2011, 15(3): 157-166. DOI:10.1016/j.ijid.2010.11.003 |
| [5] |
Baker-Austin C, Oliver JD. Vibrio vulnificus:new insights into a deadly opportunistic pathogen[J]. Environ Microbiol, 2018, 20(2): 423-430. DOI:10.1111/1462-2920.13955 |
| [6] |
Yamazaki K, Kashimoto T, Morita M, et al. Identification of in vivo essential genes of Vibrio vulnificus for establishment of wound infection by signature-tagged mutagenesis[J]. Front Microbiol, 2019, 10(123): 1-12. |
| [7] |
Debra AL, James DO. Pathogenesis of Vibrio vulnificus[J]. FEMS Microbiology Letters, 1999, 174: 207-214. DOI:10.1111/j.1574-6968.1999.tb13570.x |
| [8] |
Jeong HG, Satchell KJ. Additive function of Vibrio vulnificus MARTX(Vv) and VvhA cytolysins promotes rapid growth and epithelial tissue necrosis during intestinal infection[J]. PLoS Pathog, 2012, 8(3): e1002581. DOI:10.1371/journal.ppat.1002581 |
| [9] |
Okan NA, Mena P, Benach JL, et al. The smpB-ssrA mutant of Yersinia pestis functions as a live attenuated vaccine to protect miceagainst pulmonary plague infection[J]. Infect Immun, 2010, 78(3): 1284-1293. DOI:10.1128/IAI.00976-09 |
| [10] |
侯卫国, 连宾. LiCl沉淀法提取富含荚膜的细菌基因组DNA[J]. 土壤, 2006, 38(6): 774-777. DOI:10.3321/j.issn:0253-9829.2006.06.019 |
| [11] |
唐威华, 张景六, 王宗阳, 等. SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因[J]. 植物生理学报, 2000, 26(1): 64-68. DOI:10.3321/j.issn:1671-3877.2000.01.012 |
| [12] |
Oliver JD. The biology of Vibrio vulnificus[J]. Microbiol Spectr, 2015, 3: 349-366. |
| [13] |
Jones MK, Oliver JD. Vibrio vulnificus:disease and pathogenesis[J]. Infect Immun, 2009, 77: 1723-1733. DOI:10.1128/IAI.01046-08 |
| [14] |
Baker-Austin C, Oliver JD. Vibrio vulnificus:new insights into a deadly opportunistic pathogen[J]. Environ Microbiol, 2018, 20(2): 423-430. |
| [15] |
Phillips KE, Satchell KJ. Vibrio vulnificus:from oyster colonist to human pathogen[J]. PLoS Pathog, 2017, 13(1): e1006053. DOI:10.1371/journal.ppat.1006053 |
| [16] |
Himeno H, Kurita D, Muto A. tmRNA-mediated trans-translation as the major ribosome rescue system in a bacterial cell[J]. Front Genet, 2014, 5(66): 1-13. |
| [17] |
Keiler KC. Biology of trans-translation[J]. Annu Rev Microbiol, 2008, 62: 133-151. DOI:10.1146/annurev.micro.62.081307.162948 |
| [18] |
Bäumler AJ, Kusters JG, Stojiljkovic I, et al. Salmonella typhimu-rium loci involved in survival within macrophages[J]. Infect Immun, 1994, 62(5): 1623-1630. DOI:10.1128/IAI.62.5.1623-1630.1994 |
| [19] |
Okan NA, Bliska JB, Karzai AW. A Role for the SmpB-SsrA system in Yersinia pseudotuberculosis pathogenesis[J]. PLoS Pathog, 2006, 2(1): e6. DOI:10.1371/journal.ppat.0020006 |




