2. 盐城师范学院,盐城 224051;
3. 江苏省免疫诊断工程技术研究中心,苏州 215028
2. Yancheng Teachers University, Yancheng 224051;
3. Jiangsu Immuno-diagnostic Engineering and Technology Research Center, Suzhou 215028
过敏性疾病又称变态反应性疾病,是当前世界性的重大卫生学问题。世界卫生组织(WHO)将过敏列为21世纪重点防治的三大疾病之一[1-5],全球发病率约为15%-30%,我国约5%-10%的人患有过敏,且发病率逐年上升。
牛奶中含有丰富的蛋白质组分,为人类提供了重要的营养,改善着人类的健康状况,更是婴幼儿饮食中添加最早的食物之一。然而,牛奶作为八大主要食物过敏原之一,能引起严重的过敏反应。特别是牛奶中的多种蛋白质都能引起食物过敏反应,儿童的牛奶过敏发生率已高达1.2%-17%[6-8]。β-乳球蛋白、酪蛋白和α-乳白蛋白是牛奶过敏原组分中含量最多、致敏性最强的蛋白组分[9]。牛奶过敏可划分为IgE介导和非IgE介导,在IgE介导的牛奶过敏性疾病中大约有60%是由β-乳球蛋白引起[10]。β-乳球蛋白也被称为Bos d5,分子量为18.3 kD,由178个氨基酸组成,在牛奶中占比约10%,其在乳清中则含量很高,约占乳清总蛋白的50%[11]。
牛奶过敏原检测的方法主要基于蛋白水平和核酸水平[12-13],在蛋白水平上包括电泳法、色谱法、酶联免疫吸附法(ELISA)、生物免疫传感器法、质谱蛋白质组学(LC-MS/MS)等检测技术,在核酸水平上通常采用普通聚合酶链式反应和实时荧光定量PCR等检测技术。虽然这些方法在一定程度上能够满足检测的灵敏度和准确性要求,但还没有一种方法可以满足多样化的样品检测要求。随着现代分析技术的快速发展,自动化、高通量、高灵敏度、高准确度和低成本等特点的检测方法是牛奶过敏原检测的发展方向。
纳米磁微粒化学发光免疫分析技术是以纳米级磁性微粒做固相载体,使抗原、抗体最大限度结合,且兼具化学发光与酶免疫技术的优点,以化学发光剂为底物的酶免疫技术[14]。其原理是磁微粒上连接链霉亲和素,抗原进行生物素化后通过生物素-亲和素特异性结合形成固相抗原;血清中抗体和固相抗原反应,再加入被酶标记过的二抗;然后加入酶促化学发光底物,在酶作用下底物被催化裂解,形成激发态中间体,当激发态中间体回到基态时发出光子,仪器接受光信号,测定光强度,以强度的强弱反应待检样品中抗原或者抗体的含量。与传统的免疫印迹及酶联免疫法相比,纳米磁微粒法具有高灵敏度和特异性以及宽线性范围的优点,结合全自动高灵敏度的全自动化学发光仪,在体外诊断领域得到越来越多的关注和应用。
本研究构建体外载体表达系统以制备重组β-乳球蛋白,经分离纯化后采用生物素标记,通过在纳米磁微粒化学发光免疫平台上检测验证,建立稳定的纳米磁微粒化学发光免疫检测方法,旨为研制满足市场需要的牛奶过敏原检测技术奠定基础。
1 材料与方法 1.1 材料限制性内切酶BamH I、Xho I和Sca I购买于美国Thermo公司;生物素标记试剂盒购于英国Innova Biosciences公司;无内毒素质粒小提中量试剂盒和大肠杆菌Rosetta购于天根生化科技(北京)有限公司;质粒载体pET22b(+)购自宝生物工程(大连)有限公司。全自动化学发光分析仪(LumiRay 1260)购于深圳雷杜生命科学股份有限公司。
1.2 方法 1.2.1 合成目的基因从NCBI主页查询Bos d5蛋白的编码区全长序列(GenBank登录号X14712),密码子优化后在5'端、3'端分别添加BamH I、Xho I酶切位点,委托苏州金唯智生物科技有限公司合成目的基因序列。
1.2.2 重组表达载体构建与酶切鉴定原核表达载体pET-22b(+)分别用限制性内切酶BamH I、Xho I双酶切,将Bos d5基因片段与pET-22b(+)的酶切产物连接,构建重组表达质粒pET-22b(+)-Bos d5。质粒提取试剂盒提取质粒后,采用Xho I和Sca I双酶切鉴定,1%琼脂糖凝胶电泳分析酶切产物。
1.2.3 重组蛋白的诱导表达和纯化将重组的pET-22b(+)-Bos d5转入感受态细胞Rosetta,挑取过夜培养单菌落接种于含氨苄青霉素的LB培养液中,再按1%的比例接种放大培养,在OD600为0.6时加入终浓度为0.01 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG)诱导蛋白表达,蛋白以包涵体形式存在。菌体中加入细菌裂解液和0.1 mmol /L的PMSF,用8 mol /L尿素溶解处理包涵体。将裂解的包涵体溶液上样于预先平衡好的Ni柱,然后以20 mmol /L的咪唑缓冲液洗去杂质蛋白,最后用500 mmol /L的咪唑缓冲液对目的蛋白进行洗脱。将纯化后的蛋白进行SDS-PAGE电泳,鉴定重组蛋白的表达情况。
1.2.4 重组蛋白的化学发光检测将重组Bos d5蛋白用Innova生物素标记试剂盒标记后,采用纳米磁微粒化学发光平台以间接法验证重组蛋白功能。校准曲线采用全点定标,人源性IgE蛋白有7个浓度的校准品:0 IU/mL(S0)、0.35 IU/mL(S1)、0.7 IU/mL(S2)、3.5 IU/mL(S3)、17.5 IU/mL(S4)、50 IU/mL(S5)、100 IU/mL(S6)。第1步:加20 μL样本至发光管中,再加50 μL链霉亲和素共价偶联而成的磁性纳米颗粒,然后加入50 μL生物素标记的Bos d5,混匀,于37℃孵育15 min,形成固相抗原。第2步:清洗液清洗3次,加入135 μL碱性磷酸酶标记的抗人IgE抗体,混匀,于37℃孵育15 min形成抗原-抗体-二抗的反应模式。第3步:清洗液清洗3次,加150 μL发光底物液,37℃避光孵育5 min,化学发光检测仪检测光子数。纳米磁微粒化学发光检测仪检测光子数,代入校准曲线计算出样本中β-乳球蛋白特异性IgE抗体的含量。
1.2.5 最低检出限将S0作为样本重复测定20次,S1重复测5次,算出S0重复测定浓度的平均值(M)和标准差(SD),得出M+2SD,代入S0、S1的浓度和发光值平均值拟合得出的方程,计算得到的浓度值即为最低检出限(Limit of detection,LOD)。
1.2.6 方法学比对收集110份临床样本,应用化学发光法(CLIA)和免疫荧光法(FEIA)试剂盒同时检测临床样本中牛奶β-乳球蛋白sIgE抗体,以0.35 IU/mL作为cut-off值[15-16],对2种方法学的检测结果进行阴阳性符合率、总符合率以及线性分析。
1.2.7 统计学处理采用SPSS21.0软件,对CLIA、FEIA检测的牛奶过敏原β-乳球蛋白阴阳性测定值进行卡方检验和Kappa检验,检验水平为0.05。
2 结果 2.1 重组表达质粒的酶切鉴定结果将优化后的的Bos d5基因连接到pET-22b(+)表达载体后,用Sca I、Xho I双酶切鉴定阳性克隆产物,获得的两个片段约为1 100 bp和5 000 bp,电泳结果与理论长度基本一致(图 1),表明表达重组质粒pET-22b(+)-Bos d5构建成功。通过对酶切成功的pET-22b(+)表达载体质粒进行双向DNA测序,测序结果经序列比对分析表明,其序列与原始目标序列的相似性为100%,可用于后续蛋白的表达实验。

|
| 1:重组质粒pET-22b(+)-Bos d5;2:Sca I、Xho I的酶切产物;3:DNA marker 图 1 pET-22b(+)-Bos d5限制酶切鉴定结果 |
将pET-22b(+)-Bos d5重组质粒转入Rosetta感受态细胞,用IPTG诱导表达,经亲和纯化后,SDS-PAGE凝胶电泳后如图 2显示,在20-25 kD左右有明显条带,与目标大小22.5 kD大小一致,且产物纯度大于85%。

|
| 1:Maker;2:纯化后Bos d5蛋白 图 2 重组Bos d5的SDS-PAGE图 |
经过重复测定S0样本20次,代入S0、S1的浓度和发光值平均值拟合得出的一次方程,计算得到LOD均小于0.01 IU/mL(表 1)。
将生物素化的重组蛋白制备抗体试剂盒,用于测试110份临床样本,并以目前国际市场上使用较多的Phadia检测试剂盒测得的数据作参照,将重组蛋白试剂盒测得的效价测量值与Phadia检测试剂盒测得的数据相比较。结果如图 3所示,在化学发光平台检测的测量值和Phadia开发的检测试剂盒之间的线性关系为y = 0.874 1x+ 0.658 2,相关指数为R2 = 0.829 9。化学发光试剂盒检测和FEIA阳性符合率为88.9%(32/36),阴性符合率为97.3%(72/74),总符合率94.5%(104/110),P < 0.001,χ2=84.238,Kappa=0.874。由此可见本研究制备的重组蛋白试剂盒与Phadia参照试剂盒同样具有较好的一致性。
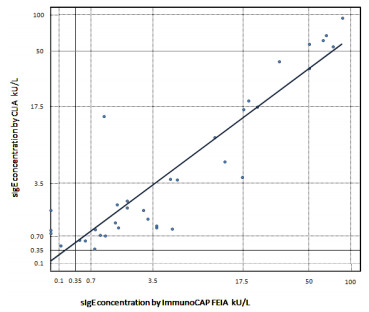
|
| 图 3 方法学比对图 |
传统的牛奶过敏原检测大多使用的是天然的过敏原提取物,但天然提取物存在许多缺点[17-19]:在过敏原提取中,致敏与非致敏组分均存在,会致使提取物中组分复杂,难得到高纯度的单一过敏原组分;提取物中致敏原会含量不足,且含量以及活性因厂家不同使过敏原难于标准化、不具可比性,不仅不利于食物过敏原的检测,也很难找到与特异性IgE抗体相对应的过敏原;天然过敏原提取物在加工提取和贮藏的过程中,其中固有的酶也能导致蛋白降解,导致其生物学活性降低。此外,传统的过敏检测不能具体区分和鉴定致敏物中的过敏原与非过敏原,对过敏原的定量十分有限。组分分析诊断(Component-resolved diagnosis,CRD)技术是基于分子诊断,使过敏原中的致敏组分分离,精确诊断出使患者产生过敏的组分,对于过敏原的精确诊断和后续的脱敏治疗具有重要的意义[20-21]。
重组过敏原是过敏原新型免疫治疗和诊断方法发展的基础,重组获得的蛋白纯度和浓度高,使得自制的重组过敏原研究成本大幅度降低[22-23]。由于重组过敏原具有明确的质量、浓度和组成,批次间差异小,可重复性强,已被广泛地应用于体外诊断试剂的研发。李建杰等[24]成功地克隆、表达了牛奶主要过敏原β-乳球蛋白的一个基因片段,经Western Blot和ELISA检测具有较好的抗原性,能够为后续牛奶的免疫原性研究提供参考。本研究中利用pET-22b(+)载体和目的基因构建的重组质粒经鉴定与预期大小相符,重组质粒构建成功后,经转化、培养、诱导蛋白表达和SDS-PAGE电泳检测显示,获得了高效表达的重组蛋白,为继续开展过敏原检测新技术研究提供基础材料。
IgE在人体内的含量仅为IgG的1/40 000,传统的检测方法难以在灵敏度和特异性方面达到要求,建立高灵敏度的检测方法尤为必要。基于高效液相色谱法、超高效液相色谱法、液相色谱-质谱联用法、酶联免疫吸附法、免疫层析法、电化学免疫法、蛋白微阵列法、等离子体共振法等色谱学和免疫学方法均可用于牛奶中β-乳球蛋白的微量检测[25-26]。食物激发试验是大众公认的诊断食物过敏的黄金标准,SPT(Skin prick test)提供了一种快速检测IgE抗体的方法[27]。SPT虽然灵敏度高,但特异性较低,尚不能作为食物过敏的确诊依据,更不能确诊是哪种组分。SPT、食物sIgE检测适用于速发型牛奶过敏,两者联合可增加诊断的准确性。随着年龄的增长,牛奶蛋白sIgE抗体的临界值点也相应增加,需根据患者年龄特点,选择适宜的诊断阈值,因而一个合适的检测方法对检测效果有很大的影响[28]。布冠好[29]建立了定量检测牛乳β-乳球蛋白的间接竞争ELISA方法,检测范围在0.05-1 μg/mL之间。ELISA技术在目前市场上已有多种针对牛奶过敏原检测的商业试剂盒,可在短时间内实现牛奶过敏原的定性或半定量检测,但存在线性范围窄的缺点,不能精确定量,对后续的脱敏治疗没有很好地指导作用。贾敏等[30]建立的实时荧光定量PCR方法可应用于食品中牛奶过敏原β-乳球蛋白质的检测,其需要对牛奶基因组DNA进行提取,步骤相对繁琐,且不能检测血液中的sIgE,不利于后续脱敏治疗。本实验是基于碱性磷酸酶标记技术的化学发光体系,灵敏度比RIA或ELISA大3-5个数量级,血清检测取得了相较其他反应体系更高的阴阳性样本比值,以及更大的线性检测范围,达到过敏原项目灵敏度检测高的目的。
随着现代科学技术的不断发展,过敏原的检测向高灵敏度、高准确度、高通量、操作简单方向发展。纳米磁微粒化学发光免疫诊断技术是磁微粒载体技术和化学发光检测技术的结合,以复合材料表面标记蛋白为基础,具有放射污染微小、自动化、检测范围广、灵敏度高、准确性强、特异性强等优点[10-12]。本研究中,将制备的重组蛋白Bos d5利用生物素标记纯化后,与纳米磁微粒上的链霉亲和素进行偶联以形成固定抗原,在纳米磁微粒化学发光平台上验证。使用重组蛋白开发的试剂盒检测临床样本,灵敏度以及特异性与国外的试剂盒(Phadia的试剂盒)检测结果的符合率较高,对比图的线性较好,蛋白的灵敏度高、特异性强,说明制备的重组牛奶过敏原蛋白符合开发试剂盒的性能指标,可以用于后续研究和临床检测。
4 结论构建牛奶过敏原Bos d5原核表达系统,表达了特异性和效价优良的重组β-乳球蛋白,β-乳球蛋白生物素化后作为规模化生产牛奶β-乳球蛋白过敏原检测试剂盒的基础材料,适用于全自动纳米磁微粒化学发光检测系统。
| [1] |
Patel BY, Volcheck GW. Food allergy:common causes, diagnosis, and treatment[J]. Mayo Clin Proc, 2015, 90(10): 1411-1419. DOI:10.1016/j.mayocp.2015.07.012 |
| [2] |
Trrnbull JL, Adams HN, Gorard DA. Review article:the diagnosis and management of food allergy and food intolerances[J]. Aliment Pharmacol Ther, 2015, 41(1): 3-25. DOI:10.1111/apt.12984 |
| [3] |
Mehta R. Allergy and asthma:food allergies[J]. FP Essent, 2018, 472: 16-19. |
| [4] |
苗青, 向莉. 过敏原实验室诊断技术在儿童过敏性疾病中的应用现状及进展[J]. 临床儿科杂志, 2018, 16(10): 1710-1713. |
| [5] |
杜小曼, 李燕明. 过敏性疾病的发展历史和未来展望[J]. 临床药物冶疗杂志, 2019, 17(1): 14-17. |
| [6] |
侯丽英, 朱黎娜, 李婵, 等. 牛奶中高分子质量蛋白致敏作用的初步研究[J]. 天津医药, 2014, 42(11): 1091-1093. DOI:10.3969/j.issn.0253-9896.2014.11.010 |
| [7] |
Hochwallner H, Schulmeister U, Swoboda I, et al. Cow's milk allergy:from allergens to new forms of diagnosis, therapy and prevention[J]. Methods, 2014, 66(1): 22-33. DOI:10.1016/j.ymeth.2013.08.005 |
| [8] |
Manuyakorn W, Tanpowpong P. Cow milk protein allergy and other common food allergies and intolerances[J]. Paediatr Int Child Health, 2019, 39(1): 32-40. DOI:10.1080/20469047.2018.1490099 |
| [9] |
谭梦, 华家才, 冯凤琴. 牛乳过敏原及加工技术对其致敏性的影响[J]. 食品工业科技, 2016, 37(5): 384-387. |
| [10] |
Solène LM, Bouhallab S, Giblin L, et al. Bovine β-lactoglobulin/fatty acid complexes:binding, structural, and biological properties[J]. Dairy Science & Technology, 2014, 94(5): 409-426. |
| [11] |
Fiocchi A, Bouygue GR, Albarini M, et al. Molecular diagnosis of cow's milk allergy[J]. Curr Opin Allergy Clin Immunol, 2011, 11(3): 216-221. DOI:10.1097/ACI.0b013e32834694ef |
| [12] |
贾敏, 张亦凡, 张银志, 等. 牛奶过敏原检测方法研究进展[J]. 食品工业科技, 2015, 36(12): 385-389. |
| [13] |
Ashley J, D'Aurelio R, Piekarska M, et al. Development of a β-La-ctoglobulin sensor based on SPR for milk allergens detection[J]. Biosensors, 2018, 8(2): 32. DOI:10.3390/bios8020032 |
| [14] |
夏振伟, 丁建华, 余卫国, 等.一种人肿瘤标志物癌胚抗原(CEA)的磁微粒化学发光免疫分析试剂盒及其检测方法: 中国, CN201310301623. 8[P]. 2013-10-23.
|
| [15] |
YY/T 1581-2018.过敏原特异性IgE抗体检测试剂盒行标[S]. 2018.
|
| [16] |
Villalta D, Da Re M, Conte M, et al. Allergen component specific IgE measurement with the immuliteTM 2000 system:diagnostic accuracy and intermethod comparison[J]. Journal of Clinical Laboratory Analysis, 2015, 29(2): 135-141. DOI:10.1002/jcla.21741 |
| [17] |
Valenta R, Linhart B, Swoboda I, et al. Recombinant allergens for allergen-specific immunotherapy:10 years anniversary of immunotherapy with recombinant allergens[J]. Allergy, 2011, 66(6): 775-783. DOI:10.1111/j.1398-9995.2011.02565.x |
| [18] |
Esch RE. Evaluation of allergen vaccine potency[J]. Current Allergy and Asthma Reports, 2006, 6(5): 402-406. DOI:10.1007/s11882-996-0013-8 |
| [19] |
Shreffler WG. Microarrayed recombinant allergens for diagnostic testing[J]. Journal of Allergy and Clinical Immunology, 2011, 127(4): 843-849. DOI:10.1016/j.jaci.2011.02.011 |
| [20] |
Borres MP, Maruyama N, Sato S, et al. Recent advances in component resolved diagnosis in food allergy[J]. Allergology International, 2016, 65(4): 378-387. DOI:10.1016/j.alit.2016.07.002 |
| [21] |
Fu LL, Cherayil BJ, Shi HN, et al. Overview of the immunology of food allergy[J]. Allergology International, 2016, 65(4): 378-387. DOI:10.1016/j.alit.2016.07.002 |
| [22] |
Liu C, Willison LN, Sathe SK. Recombinant allergen production[M]// Lin J, Alcocer M. Food allergens: methods in molecular biology. New York: Humana Press, 2017: 23-45.
|
| [23] |
Cook QS, Burks AW. Peptide and recombinant allergen vaccines for food allergy[J]. Clin Rev Allergy Immunol, 2018, 55(2): 162-171. DOI:10.1007/s12016-018-8673-4 |
| [24] |
李建杰, 陈大玮, 闫浩, 等. 牛奶主要过敏原β-乳球蛋白的一基因片段的克隆、表达、纯化及抗原性鉴定[J]. 中国食品卫生杂志, 2011, 23(2): 109-113. |
| [25] |
何圣发, 陈红兵, 龙彩云, 等. 牛乳过敏原β-乳球蛋白检测方法的研究进展[J]. 食品安全质量检测学报, 2019, 10(7): 1763-1769. DOI:10.3969/j.issn.2095-0381.2019.07.004 |
| [26] |
Ricciardi C, Santoro K, Stassi S, et al. Microcantilever resonator arrays for immunodetection of β-lactoglobulin milk allergen[J]. Sensors and Actuators B:Chemical, 2018, 254: 613-617. DOI:10.1016/j.snb.2017.07.150 |
| [27] |
Dupont C. Food allergy:recent advances in pathophysiology and diagnosis[J]. Annals of Nutrition & Metabolism, 2011, 59(Suppl. 1): 8-18. |
| [28] |
黄秋香, 金玉. 牛奶蛋白过敏诊断方法的研究现状[J]. 检验医学与临床, 2016, 13(8): 1132-1134. DOI:10.3969/j.issn.1672-9455.2016.08.052 |
| [29] |
布冠好, 郑喆, 郑海, 等. 牛乳过敏原β-乳球蛋白间接竞争ELISA检测方法的建立[J]. 中国农业大学学报, 2008, 13(6): 71-76. DOI:10.3321/j.issn:1007-4333.2008.06.013 |
| [30] |
贾敏, 张银志, 张亦凡, 等. 牛奶β-乳球蛋白质实时荧光定量PCR检测方法的建立[J]. 食品与生物技术学报, 2015, 34(6): 605-612. DOI:10.3969/j.issn.1673-1689.2015.06.010 |





