催乳素(Prolactin,PRL)是一种由内分泌器官腺垂体前叶分泌的多效单链多肽类激素,于1928年被Stricker和Grneter验证该激素具有使假阳性妊娠母兔分泌乳汁的功能,并命名为催乳素。国内外研究结果证实了催乳素的生理功能不单单是生殖和泌乳,还包括调节水盐平衡、胰岛细胞分化、脂肪代谢、增强非特异性免疫、刺激肠道加速钙的吸收等[1-2]。研究显示,催乳素通过与其受体蛋白—催乳素受体(Prolactin receptor,PRLR)结合,启动信号级联,利用JAK激酶和信号传导子及转录激活子(Janus kinase-signal transducer and activator of transcription,JAK-STAT)在靶细胞上介导其生理功能,主要的信号蛋白为JAK2和STAT[3-4]。PRLR是跨膜受体蛋白,属于I类细胞因子受体超家族。大量的研究证实了PRLR在哺乳动物中存在多种亚型,可分为长链PRL、中长链PRL和短链PRL,主要差异为长度和胞内段的组成。而在硬骨鱼类中则存在两种PRLR基因,是硬骨鱼类特有的现象。据报道,莫桑比克罗非鱼存在PRLR1和PRLR2两种PRL受体亚型[5]。目前,已在多种硬骨鱼类上克隆出PRLR的全长序列,如尼罗罗非鱼(Oreochromis niloticus)、黑鲷(Acanthopagrus schlegelii),并且利用不同激素刺激转染细胞或直接体内注射,证实两种亚型的PRLR都能启动下游信号通路,说明这两种亚型PRLR都是PRL的特异性受体[6-7]。
广盐性鱼类适应不同盐度的过程中受神经内分泌调节系统调控,主要作用在渗透压调节器官,如鳃、肠和体肾等[8]。Pavlosky等[9]发现莫桑比克罗非鱼(O. mossambicus)在海水中血浆渗透压和PRLR2鳃组织mRNA表达量均高于淡水实验组,而PRL和NKAaα1a、PRLR1鳃组织mRNA表达量则低于淡水实验组,提示PRL、PRLR1参与了鱼类适应淡水生活的生命活动。王杰[2]将尖鳍鲤(Cyprinus acutidorsalis Wang)急性胁迫48 h后,在鳃、肠、肾、肝、性腺、脑、脑垂体、脾及皮肤等组织中均能检测到PRLR的mRNA,其中,在鳃中表达量最高。同样的,在黑鲷的鳃、肠、肾、肌肉、性腺、心脏、肝脏、胃、脾脏及脑垂体中也检测出PRLR的存在,且表达规律相似[10],说明PRLR在各个组织中均有分布,除渗透压调节外,可能参与多项生理活动的调控。
军曹鱼(Rachycentron canadum)又名海鲡,隶属鲈形目(Perciformes)、军曹鱼科(Rachycentridae)、军曹鱼属(Rachycentron),为广盐性、中型肉食性洄游鱼类[11]。军曹鱼广泛分布于热带和亚热带海域,包括大西洋、印度洋和太平洋。其生长速度快,肉质鲜美,营养价值高,是具有食用价值的重要海水经济鱼类。军曹鱼养殖多以海水网箱为主,受台风、暴雨等极端天气影响,海水盐度波动较大,对军曹鱼的生长和存活造成了一定的影响。目前在其他硬骨鱼类盐度适应过程中PRL和PRLR的表达模式的研究较多,而军曹鱼的较少。因此,为探究军曹鱼适应高盐和低盐水体的渗透压调节机制,本实验克隆了PRLR1 cDNA,并通过荧光定量PCR(qRT-PCR)检测了PRLR1在健康组织中的mRNA表达丰度和分别适应高盐、低盐后的表达规律,为研究军曹鱼盐度适应渗透压调节机制奠定分子理论基础。
1 材料与方法 1.1 材料 1.1.1 实验动物及试剂实验用鱼(军曹鱼)采自于广东海洋大学东海岛海洋生物研究基地,挑选出规格一致,健康有活力,体表无损伤的军曹鱼幼鱼,测得平均体长为18.35±1.75 cm,平均体重为60.53±8.21 g。试验前暂养于室内1.5立方水体的水桶,使用正常盐度(30‰)的过滤海水,水温为27±2℃。暂养1周后,挑选健康个体,剖取鳃、肠、体肾、脑及心脏等8个组织,迅速置于液氮中速冻,3 h后移至-80℃冰箱保存。
总RNA提取试剂盒TransZol Up Plus RNA Kit、反转录试剂盒EasyScript First-Strand cDNA Synthesis SuperMix、胶回收试剂盒EasyPure Quick Gel Extraction Kit均购自北京全式金生物有限公司,SYBR®Select Master Mix购自聚研生物科技有限公司(广州),SMARTer® RACE 5'/3' Kit、DH5α感受态细胞、pMD18-T Vector、LA-Taq DNA聚合酶购自大连宝生物有限公司。引物均由上海生工生物工程公司合成。
1.1.2 慢性盐度适应实验盐度实验设置3个盐度梯度,分别为10‰、30‰和35‰,其中以30‰组为对照组。将暂养7 d后的军曹鱼分为3组,每组设3个重复,放置10尾军曹鱼。使用淡水或高品质海水晶将养殖用水以每天调低或调高5个盐度,直到实验组盐度达到要求后开始实验。养殖采取静水充气方式,每日投喂6%体重的石斑鱼配合饲料,换水率为30%。养殖4周后,各盐度下随机挑选5尾军曹鱼,分别采取鳃、肠、体肾3种组织,立即放入液氮中速冻,3 h后移至-80℃冰箱保存。
1.2 方法 1.2.1 总RNA的提取与cDNA第一链合成参照RNA提取试剂盒的说明书,以军曹鱼幼鱼的鳃丝为材料,提取总RNA后,使用1.5%的琼脂糖凝胶电泳检测完整性,超微量核酸蛋白测定仪测定浓度,-80℃保存。参照反转录试剂盒说明书,使用1 μg总RNA合成cDNA第一链,-20℃保存。
1.2.2 军曹鱼PRLR1基因的克隆通过实验室已有的转录组数据,筛选出注释为PRLR的unigene,经NCBI数据库(https://www.ncbi.nlm.nih.gov/)BLAST比较,确定为鱼类PRLR1基因片段。根据比较结果,选取保守区域设计特异性引物(表 1)进行扩增。其中,PRLR-F1、PRLR-F2、PRLR-R1和PRLR-R2用来克隆中间片段,PCR程序设计为95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸60 s,循环35次;72℃延伸5 min。PCR产物使用1.5%的琼脂糖凝胶分离出目的条带,转化连接,挑选阳性单克隆菌落进行测序。根据测序得到的中间片段序列设计3'和5'末端巢式PCR引物(分别为3'-F1、3'-F2、5'-R1和5'-R2)(表 1)。先以3'-F1和Long primer、5'-R1和Long primer配对扩增,程序设计为95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸90 s,循环35次;72℃延伸10 min。产物稀释2倍后作为模板进行第二次扩增,引物为3'-F2和Short primer、5'-R2和Short primer。程序设计为95℃预变性5 min;95℃变性30 s,62 /67℃退火30 s,72℃延伸60 s/30 s,循环35次;72℃延伸10 min。PCR产物切胶回收、连接、转化。最终,挑选出单菌落送上海生工生物工程公司测序。
将测序结果导入DNAMAN软件,拼接后得到PRLR1基因的全长cDNA序列。经NCBI数据库的分析工具ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)预测,获得完整的军曹鱼PRLR1开放阅读框(ORF)和氨基酸序列。利用TMHMM Server2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测跨膜螺旋域。利用signalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽。使用SMART网站(http://smart.embl-heidelberg.de/)在线预测蛋白质结构和功能。从NCBI数据库中下载同源氨基酸序列,运行ClustalX1.83进行氨基酸序列多重比较和同源性分析。使用MEGAX软件以领接法(neighbor-joining method,NJ)构建系统进化树。
1.2.4 PRLR1基因的组织差异表达和盐度适应后PRLR1基因的表达分析根据PRLR1基因cDNA序列,设计特异性引物qPRLR -F、qPRLR -R(表 1),扩增长度为199 bp;以军曹鱼β-actin基因为内参。qRT-PCR扩增反应在实时荧光定量扩增仪(Roche light CyclerTM 96)中进行,使用SYBR®Select Master Mix试剂盒检测PRLR1基因在鳃、肠、体肾、脑、胃、肌肉、脾脏和心脏等8个组织的表达丰度和盐度适应后PRLR1基因在鳃、肠及体肾等渗透压相关器官的表达丰度。扩增程序设计为:95℃预变性10 min;95℃变性10 s,60℃退火20 s,72℃延伸20 s,循环40次。每个样品重复检测3次以减少误差。运用2-ΔΔCt 方法计算PRLR1基因的相对表达量,使用SPASS19.0对实验数据进行单因素方差分析。
2 结果 2.1 PRLR1基因全长cDNA序列的克隆和氨基酸序列分析根据测序结果拼接结果,得到军曹鱼PRLR1基因cDNA序列(GenBank序列登录号为MN080491),全长有2 629 bp,开放阅读框ORF有1 953 bp,编码650个氨基酸(图 1)。其中,5'UTR大小为248 bp,3'UTR大小为427 bp。细胞外区的4个半胱氨酸,分别位于37、47、76和87位氨基酸上。利用TMHMM Server2.0预测跨膜螺旋域,结果显示第1-234个氨基酸为膜外段,第235-257个氨基酸存在跨膜螺旋域,第258-650个氨基酸为膜内段。利用signalP-5.0预测信号肽,发现PRLR1信号肽为第1-25个氨基酸,剪切位点为第25-26个氨基酸。通过SMART预测功能结构域,结果显示PRLR1氨基酸序列含有2个纤维连接蛋白3型结构域(Fibronectin type 3 domain,FN3)(29-113 aa、128-214 aa)。

|
| 图 1 军曹鱼PRLR1基因cDNA序列及氨基酸序列 |
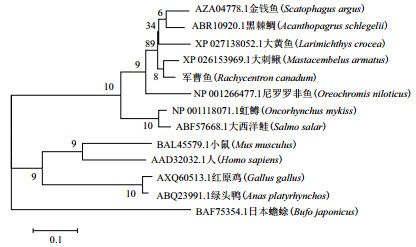
氨基酸序列同源比较结果如图 2。Blast结果显示:军曹鱼PRLR1与大黄鱼(Larimichthys crocea)、大刺鳅(Mastacembelus armatus)和金钱鱼(Scatophagus argus)同源性最高,分别为76.95%、74.89%和74.88%。此外,与黑棘鲷、尼罗罗非鱼、虹鳟(Oncorhynchus mykiss)、大西洋鲑(Salmo salar)的同源性分别为73.66%、68.48%、55.45%和55.95%;使用MEGAX软件构建进化树,结果显示:军曹鱼先与邻近鲈形目的大刺鳅在物种进化上聚为一支,距离最近;其次与大黄鱼、黑棘鲷和金钱鱼等聚为一支;人(Homo sapiens)和小鼠(Mus musculus)、鸟类绿头鸭(Anas platyrhynchos)和红原鸡(Gallus gallus)分别聚为一支,与军曹鱼关系较远(图 3)。

|
| WS结构和box1以方框表示 图 2 军曹鱼PRLR1氨基酸序列多重序列比对分析 |
|
| 图 3 军曹鱼PRLR1氨基酸序列聚类分析 |
qRT-PCR组织表达结果显示,PRLR1基因在军曹鱼的各个组织中均有表达,其中鳃表达量最高;其次是肌肉、体肾和肠,而在胃、脾、脑和心脏中则微量表达(图 4)。

|
| 1.鳃;2.肌肉;3.体肾;4.肠;5.胃;6.脾;7.脑;8.心脏。不同字母表示不同组织之间表达量差异显著(P < 0.05) 图 4 军曹鱼PRLR1各组织相对表达量 |
高盐(30‰)和低盐(10‰)适应4周后,军曹鱼PRLR1基因在鳃、肠、体肾的表达情况如图 5所示。结果显示,高盐适应后,PRLR1基因在鳃中表达量最高(为对照组1.49倍,显著差异,P < 0.05),肠次之,体肾最少;对照组中,PRLR1基因在鳃中表达量最高,体肾次之,肠最少;低盐适应后,PRLR1基因同样在鳃组织中表达量最高(为对照组0.06倍,极显著差异,P < 0.001),在肠、体肾中微量表达。其中,随着盐度下降,PRLR1基因的在鳃、肠、体肾中表达量均逐渐下降。PRLR1基因在对照组和低盐组的肠组织的表达量均低于体肾,而在高盐组则相反,表现为肠表达量高于体肾。

|
| 1.10‰;2.30‰;3.35‰。*、**、***表示PRLR1基因表达量与对照组差异显著,显著性水平分别为P < 0.05,0.01和0.001 图 5 盐度适应后军曹鱼PRLR1各组织相对表达量 |
PRLR1是I类细胞因子受体超家族中重要成员,与PRL结合后,形成激素受体三聚合体复合物,进而激活PRLR1和细胞内酪氨酸激酶的磷酸化,在鱼类渗透压调节中发挥着重要的信号传导作用[10]。本研究利用RACE技术成功克隆出军曹鱼的PRLR1全长cDNA序列,其中包含1 953 bp的ORF,编码650个氨基酸,具有脊椎动物PRLR的基本特征。相对于有较大差异的细胞内区,脊椎动物PRLR细胞外区保守性较高,其C端包含了由4个保守的半胱氨酸构成的2个二硫键以及由W-S-X-W-S(X为差异氨基酸)构成的WS区[12]。细胞内区作为受体偶联启动信号级联的关键部位,在鱼类中存在着不同长度和组成,相似度不高,仅有2个相对保守区域,分别为box1和box2。box1是由靠近跨膜区的8个富含脯氨酸的疏水残基组成的,其形成的SH3折叠(SrC kinase homology domain3)是信号转换分子特异识别位点。box2由疏水残基、带负电荷和正电荷的残基组成,在鱼类和哺乳动物中保守性比box1小[13]。军曹鱼的PRLR1除存在二硫键和WS区外,同样含有box1。在斜带石斑鱼[14]、黑棘鲷中PRLR1也存在WS区和box1,运行ClustalX软件对军曹鱼与其他物种进行氨基酸序列同源比较,结果显示,军曹鱼PRLR1的WS区和box1确实在鱼类和哺乳动物上高度保守,说明PRLR1的WS区和box1结构域在鱼类和哺乳动物进化上相对保守。系统进化树结果也显示,军曹鱼PRLR1与鲈形目的大刺鳅、大黄鱼等聚为一支,与人、小鼠等哺乳动物较远,这与物种进化过程规律相符,进一步说明本研究中PRLR1属于鱼类PRLR家族成员。
广盐性鱼类能适应较大范围盐度的水环境,主要与其渗透压调节器官有关,如鳃、肠、体肾和皮肤等。其中,鳃作为广盐性鱼类的主要渗透压调节器官之一,已有大量文献证实其渗透压调节能力与鱼鳃中的氯细胞和Na+/K+-ATPase酶密切相关,其中,氯细胞进行Na+、Cl-离子的运输,Na+/K+-ATPase酶为其运输离子提供动力。鱼在外界水环境盐度由低渗转向高渗时,鳃丝结构与生理功能存在显著性差异。中华鲟在盐度为15的半咸水中驯养60 d后,鳃丝和鳃小片中氯细胞数量显著超过淡水驯化组,其细胞体积膨大,这与氯细胞排出过量的Na+、Cl-以辅助鱼体适应高渗环境的特征相适应[15]。在施氏鲟(Acipenser schrenckii)[16]、马苏大马哈鱼(Oncorhynchus masou)[17]、美洲鲥(Alosa sapidissima)[18]中也有类似的研究结果。鱼类PRLR通过与催乳素结合,可以抑制Na+/K+-ATPase酶活性、缩小氯细胞,达到稳定鱼体渗透压的目的[19]。军曹鱼PRLR1组织分布结果显示,其在鳃、肠、体肾、肌肉、胃、脾、脑和心脏中都有分布,其中主要分布在鳃、肠和体肾等渗透压调节器官,鳃表达量最高,肌肉次之,这与虹鳟、金头鲷(Sparus aurata)、金鱼(Carassius auratus)等鱼类PRLR1表达规律相似[20-22],说明军曹鱼PRLR1基因主要功能为渗透压调节,且主要作用场所在鳃上,同时也暗示了PRLR1参与其他生理活动的调节。
在硬骨鱼类中,人们普遍认为PRL和生长激素(GH)在盐度适应过程中共同参与渗透压调节,前者适应低盐水体,后者适应高盐水体。研究表明,在急性盐度胁迫中,褐牙鲆(Paralichthys olivaceus)、日本鳗鲡(Anguilla japonica)的血浆中PRL浓度与外部渗透压呈负相关,而GH呈正相关[23-24]。从达里湖(半咸水)中洄游到贡格尔河(淡水)的瓦氏雅罗鱼(Leuciscus waleckii),其血清中PRL含量显著上升,而GH含量显著下降[25]。此外,有研究表明在不同鱼类中,PRL的调节能力表现出了种属差异,如PRL在大马哈鱼淡水适应过程中并没有产生显著影响[26]。在体外实验中,鳃和垂体中的受体受PRL和环境渗透压刺激后,均产生差异反应:受PRL刺激后PRLR1表达量升高[27],而增加细胞外渗透压则促使PRLR2表达量升高[28]。因此,PRL对渗透调节的作用可能受到激素水平和环境渗透压共同调控。本研究结果中同样发现了军曹鱼PRLR1基因经低盐适应后,在鳃、肠、体肾中mRNA表达量皆显著性上调,而在高盐适应中表达量变化规律均呈逐步下降趋势,且在肠和体肾中微量表达。低盐组、正常组和高盐组中,PRLR1基因的表达量均为鳃组织最高,肠次之,体肾最低。类似的研究结果可见于尖鳍鲤[2]、金钱鱼[29]。由以上结果推测,PRLR1基因能调节鱼体渗透压稳态,且鳃组织为PRLR1的主要作用场所,在军曹鱼适应低盐度环境中起到重要作用。
4 结论本研究首次克隆出军曹鱼PRLR1基因全长cDNA,该基因全长为2 629 bp,包含1 953 bp的开放阅读框ORF,共编码650个氨基酸。通过多重序列比对发现,军曹鱼PRLR1基因与鲈形目鱼类相似性高,都含有WS区和box1等标志性结构域。该基因在多个组织中均有表达,其表达水平鳃最高,肌肉、肠和体肾次之。在盐度适应中,鳃、肠、体肾中PRLR1表达量随着盐度的降低而升高,与对照组差异显著。
| [1] |
Bole-Feysot C, Goffin VM, Binart N, et al. Prolactin(PRL)and its receptor:actions, signal transduction pathways and phenotypes observed in PRL receptor knockout mice[J]. Endocrine Reviews, 1998, 19(3): 225-268. |
| [2] |
王杰.尖鳍鲤催乳素(PRL)及其受体(PRLR)的cDNA克隆及表达[D].南京: 南京农业大学, 2012.
|
| [3] |
Don F, Ramamani A, Michael F. Growth hormone and prolactin receptors in adipogenesis:STAT-5 activation, suppressors of cytokine signaling, and regulation of insulin-like growth factor I[J]. Hormone Research, 2006, 66(3): 101-110. |
| [4] |
Morammazi S, Masoudi AA, Vaez TR, et al. Changes in the expression of the prolactin receptor(PRLR)gene in different physiological stages in the mammary gland of the Iranian adani goat[J]. Reproduction in Domestic Animals, 2016, 51(4): 585-590. DOI:10.1111/rda.12723 |
| [5] |
Fiol DF, Enio S, Romina S, et al. A novel tilapia prolactin receptor is functionally distinct from its paralog[J]. Journal of Experimental Biology, 2009, 212. |
| [6] |
Yong Z, Long Z, Li Y, et al. The second prolactin receptor in Nile tilapia(Oreochromis niloticus):molecular characterization, tissue distribution and gene expression[J]. Fish Physiology & Biochemistry, 2010, 36(2): 283-295. |
| [7] |
Huang X, Jiao B, Fung CK, et al. The presence of two distinct prolactin receptors in seabream with different tissue distribution patterns, signal transduction pathways and regulation of gene expression by steroid hormones[J]. Journal of Endocrinology, 2007, 194(2): 373-392. DOI:10.1677/JOE-07-0076 |
| [8] |
Yamaguchi Y, Breves JP, Haws MC, et al. Acute salinity tolerance and the control of two prolactins and their receptors in the Nile tilapia(Oreochromis niloticus)and Mozambique tilapia(O. mossambicus):a comparative study[J]. General and Comparative Endocrinology, 2018, 257: 168-176. DOI:10.1016/j.ygcen.2017.06.018 |
| [9] |
Pavlosky KK, Yamaguchi Y, Lerner DT, et al. The effects of transfer from steady-state to tidally-changing salinities on plasma and branchial osmoregulatory variables in adult Mozambique tilapia[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2019, 227: 134-145. |
| [10] |
Devi YS, Seibold AM, Shehu A, et al. Inhibition of MAPK by prolactin signaling through the short form of its receptor in the ovary and decidua:involvement of a novel phosphatase[J]. Journal of Biological Chemistry, 2011, 286(9): 7609-7618. DOI:10.1074/jbc.M110.166603 |
| [11] |
徐力文, 刘广锋, 王瑞旋, 等. 急性盐度胁迫对军曹鱼稚鱼渗透压调节的影响[J]. 应用生态学报, 2007, 18(7): 1596-1600. DOI:10.3321/j.issn:1001-9332.2007.07.031 |
| [12] |
张勇, 马细兰, 陈勇智, 等. 斜带石斑鱼(Epinephelus coioides)两种催乳素受体基因的cDNA克隆和mRNA表达分析[J]. 海洋与湖沼, 2012, 43(1): 138-146. |
| [13] |
Freeman ME, Kanyicska B, Lerant A, et al. Prolactin:structure, function, and regulation of secretion[J]. Physiological Reviews, 2000, 80(4): 1523-1631. DOI:10.1152/physrev.2000.80.4.1523 |
| [14] |
Huang X1, Jiao B, Fung CK, et al. The presence of two distinct prolactin receptors in seabream with different tissue distribution patterns, signal transduction pathways and regulation of gene expression by steroid hormones[J]. Journal of Endocrinology, 2007, 194(2): 373-392. DOI:10.1677/JOE-07-0076 |
| [15] |
赵峰, 杨刚, 张涛, 等. 淡水和半咸水条件下中华鲟幼鱼鳃上皮泌氯细胞的形态特征与数量分布[J]. 海洋渔业, 2016, 38(1): 35-41. DOI:10.3969/j.issn.1004-2490.2016.01.005 |
| [16] |
侯俊利, 陈立侨, 庄平, 等. 不同盐度驯化下施氏鲟幼鱼鳃泌氯细胞结构的变化[J]. 水产学报, 2006, 30(3): 316-322. |
| [17] |
Mizuno S, Ura K, Okubo T, et al. Ultrastructural changes in gill chloride cells during smoltification in wild and hatchery-reared masu salmon Oncorhynchus masou[J]. Fisheries Science, 2000, 66(4): 670-677. DOI:10.1046/j.1444-2906.2000.00107.x |
| [18] |
Zydlewski J, McCormick SD. Developmental and environmental regulation of chloride cells in young American shad, Alosa sapidissima[J]. Journal of Experimental Zoology, 2001, 290(2): 73-87. DOI:10.1002/jez.1037 |
| [19] |
Hui MA, Liu SF, Qian MA, et al. Endocrine hormone adjustment mechanism of osmotic pressure in teleost[J]. Fisheries Science, 2012, 135(135): 209-246. |
| [20] |
Rouzic PL, Sandra O, Grosclaude J, et al. Evidence of rainbow trout prolactin interaction with its receptor through unstable homodimerisation[J]. Molecular & Cellular Endocrinology, 2001, 172(1): 105-113. |
| [21] |
Santos CRA, Ingleton PM, Cavaco JEB, et al. Cloning, characterization, and tissue distribution of prolactin receptor in the sea bream(Sparus aurata)[J]. General & Comparative Endocrinology, 2001, 121(1): 32-47. |
| [22] |
Tse DLY, Chow BKC, Chan CB, et al. Molecular cloning and expression studies of a prolactin receptor in goldfish(Carassius auratus)[J]. Life Sciences, 2000, 66(7): 593-605. DOI:10.1016/S0024-3205(99)00632-3 |
| [23] |
贾倩倩, 吕为群. 低盐胁迫对褐牙鲆成鱼血浆渗透压、皮质醇、生长激素和催乳素的影响[J]. 上海海洋大学学报, 2016, 25(1): 71-77. |
| [24] |
夏保密.日本鳗鲡渗透压调节机理对高渗环境的响应[D].上海: 上海海洋大学, 2016.
|
| [25] |
王瑞芳, 刘玉辉, 王俊, 等. 瓦氏雅罗鱼生殖洄游过程中离子调节相关生理变化研究[J]. 水生生物学报, 2019, 43(4): 832-840. |
| [26] |
Makino K, Onuma TA, Kitahashi T, et al. Expression of hormone genes and osmoregulation in homing chum salmon:A minireview[J]. General & Comparative Endocrinology, 2007, 152(2): 304-309. |
| [27] |
Mayu I, Breves JP, Shunsuke M, et al. Prolactin 177, prolactin 188, and extracellular osmolality independently regulate the gene expression of ion transport effectors in gill of Mozambique tilapia[J]. American Journal of Physiology Regulatory Integrative & Comparative Physiology, 2015, 309(10): 1251-1263. |
| [28] |
Seale AP, Moorman BP, Stagg JJ, et al. Prolactin177, prolactin188 and prolactin receptor 2 in the pituitary of the euryhaline tilapia, Oreochromis mossambicus, are differentially osmosensitive[J]. Journal of Endocrinology, 2012, 213(1): 89-98. DOI:10.1530/JOE-11-0384 |
| [29] |
梁雪梅.催乳素在金钱鱼盐度适应过程中的机理研究[D].上海: 上海海洋大学, 2018.
|