白细胞介素-2(IL-2)是一种多效细胞因子,可驱动T细胞生长,增强NK细胞溶解活性,诱导调节性T细胞分化,并介导激活诱导的细胞死亡。目前,IL-2已成为一种在预防和治疗疾病方面备受关注的重要细胞因子[1]。可以提高动物机体细胞免疫和体液免疫能力,解除机体免疫抑制,增强疫苗免疫效果,降低疫苗副反应,治疗寄生虫感染等[2]。IL-2在作为免疫治疗剂,构建新型基因工程苗,作为免疫增强剂等方面都取得良好效果[3]。重组细胞因子能明显提高细菌、病毒和寄生虫疫苗的免疫效果。在医学领域商品化的重组人IL-2已经用于肿瘤、艾滋病、乙型肝炎等疾病的治疗[4-5]。
红鳍东方鲀隶属于硬骨鱼纲,鲀形目,鲀科,东方鲀属,是一种北太平洋西部海域近海底层的中大型鱼类[6]。近些年在中国的江苏、上海和辽宁等地红鳍东方鲀的人工养殖已初具规模,其产品主要出口日本、韩国。随着养殖规模的扩大,病害时有发生[7]。2005年,Bird等[8]成功克隆了日本河豚(Japanese rubripes)的IL-2基因;2008年,王建平等[9]成功克隆了红鳍东方鲀IL-2基因,为红鳍东方鲀IL-2蛋白作为新型疫苗免疫佐剂和自然抗病生物活性物质的开发奠定了基础。鱼类的血细胞对于自身生理状态的变化以及外界环境因子的刺激十分敏感,通过对鱼类血液指标的检测,可以初步了解鱼类的健康状况[10]。本研究探索r IL-2对红鳍东方鲀血液生化的血液生化指标及一些免疫指标的影响,旨在为能提高红鳍东方鲀机体免疫力的治疗剂等的开发和利用提供一些参考。
1 材料与方法 1.1 材料试验鱼购自大连天正养殖场,随机挑选体质量为(205.9±30.5)g的红鳍东方鲀,在农业部北方海水增养殖重点实验室暂养一周,水温为19-21℃,溶解氧大于7 mg/L,总氨氮小于0.05 mg/L,亚硝酸盐小于0.01 mg/L。载有红鳍东方鲀白介素-2基因阳性克隆的大肠杆菌为实验室自有[11]。
1.2 方法 1.2.1 rIL-2的获取挑取保种的菌液涂布在LB固体培养基上,37℃培养过夜。次日挑取单菌落接种于10 mL有氨苄的LB液体培养基中,37℃,200 r/min培养过夜。吸取1 mL以1:100的比例接种于100 mL新鲜LB液体培养基,37℃,200 r/min培养至OD600达到0.45-0.6时,加入IPTG至终浓度为1 mmol/L,然后28℃,150 r/min诱导8 h。取100 mL的两管菌液,离心,弃上清,用PBS洗涤重悬。经超声波破菌(200-500 W,超3 s、停3 s,持续15 min),然后再以5 000 r/min离心10 min,分离上清液和沉淀,沉淀用适量PBS重悬,分别将可溶性表达的IL-2和包涵体进行SDS-PAGE分析并根据孙鹤等的方法进行纯化分离及鉴定[11]。最后用凯基生物的Bradford法蛋白含量检测试剂盒测定用于免疫的菌液中的蛋白含量,并计算浓度。
1.2.2 试验设计随机挑选75尾试验鱼并随机分为5组,4个实验组,1个对照组,每组15尾鱼。依据乔海霞等、Cata等和Wu等[12-14],r IL-2腹腔注射含量参考值约在0.4 μg/mL-2 μg/mL。设计r IL-2免疫剂量为2.5、5、7.5和10 μg/尾鱼,依据浓度稀释并进行腹腔注射,以同等量的PBS作为对照。腹腔注射前用碘伏,酒精对体表进行局部消毒。并于注射后的4 h、8 h和12 h分别随机抽取各浓度组的5尾鱼进行尾静脉采血。
1.2.3 血样的采集和处理采血24 h前空腹,尾静脉采血制作血清用于后续试验,采血前用浓度为0.02%-0.05%的MS-222对试验鱼进行麻醉。从每个注射浓度组随机取5尾鱼,使用一次性无菌注射器(1 mL)进行尾静脉采血,采血时针头使用抗凝剂(素钠浓度为1%)润洗,并将全血分装在1.5 mL的离心管中,置于室温。采血完及时离心,以4℃,3 000 r/min,离心10 min,吸取血清于新的1.5 mL离心管中,用Parafilm封口膜封口,放入-20℃冰箱,备检。
1.2.4 血清生化和免疫指标测定本试验对血清中的总蛋白(TP)、白球比(A/G)、谷草转氨酶(AST)、尿素氮(BUN)、甘油三酯(TG)等生化指标均用日本日立7020生化分析仪测得。非特异性免疫指标超氧化物歧化酶(SOD)、溶菌酶(LYS),特异性免疫指标补体C3,免疫球蛋白G(IgG)、M(IgM)、E(IgE)均按照试剂盒(购自科华生物)说明书进行测量。
1.2.5 数据统计与分析试验数据采用SPSS19.0软件进行采用One-way ANOVA分析,采用Duncan多重比较法检验,P < 0.05为显著性差异水平。试验结果用平均值±标准差(x±s)表示。
2 结果 2.1 重组蛋白分离结果经过IPTG诱导表达后菌液经过超声波破碎后,进行SDS-PAGE凝胶电泳分析,可溶性表达的IL-2的表达量显著高于其他杂蛋白,表达产物为融合蛋白,其相对分子质量约32.5 kD(与预测大小相符)。上清纯化后经检测只有唯一带,相对分子质量约32.5 kD(图 1)。测得重组蛋白浓度为0.865 0 μg/μL。
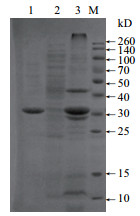
|
| M:marker;1:目的蛋白;2:包涵体;3:可溶性表达的IL-2 图 1 IPTG诱导表达和纯化结果 |
经r IL-2免疫之后不同浓度组在不同时间的血液生化指标变化如图 2。从图 2中可见,2.5 μg浓度组在4 h时间点白球比显著高于8 h和12 h时间点(P < 0.05),其余各组之间无显著差异(P > 0.05)。5 μg和7.5 μg浓度组尿素氮含量在8 h时间点有显著升高的趋势,在各个浓度组的8 h时间点显著高于同组内其它时间点,2.5 μg、10 μg浓度组的4 h时间点尿素氮含量显著低于各时间浓度组(P < 0.05)。在注射了rIL-2之后,2.5 μg浓度组甘油三酯含量在8 h时间点显著高于PBS组,4 h时间点甘油三酯含量有随着注射浓度增加而增加的趋势;8 h时间点甘油三酯含量有随着注射浓度增加先降低再升高的趋势(P < 0.05)。
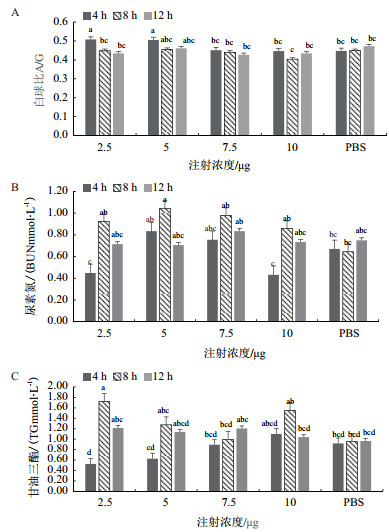
|
| 标有不同小写字母者表示组间有显著性差异(P < 0.05),标有相同小写字母者表示组间无显著性差异(P > 0.05),下同 图 2 经r IL-2免疫之后红鳍东方鲀的血液的生化指标 |
经r IL-2免疫之后不同浓度组在不同时间的血液的非特异性免疫指标变化如图 3。由图 3可知:经r IL-2免疫之后,5 μg浓度组在4 h时间点溶菌酶活性显著升高(P < 0.05),但各个时间浓度组无显著性差异(P > 0.05)。谷草转氨酶活性2.5 μg浓度组8 h时间的要显著高于同组其他时间点,同时也显著高于PBS组。5 μg浓度组4 h和8 h时间的要显著高于同组其他时间点,也显著高于PBS组,整体看来2.5 μg、5 μg和7.5 μg浓度组的谷草转氨酶活性在8 h时间点要显著高于其他时间点(P < 0.05),10 μg浓度组与PBS组无显著差异(P > 0.05)。经r IL-2免疫之后,2.5 μg和5 μg浓度组超氧化物歧化酶的活性的在4 h时间点显著高于其他各组,5 μg浓度组的8 h时间点超氧化物歧化酶活性也显著高于各组(P < 0.05),其余各个浓度时间点之间无显著性差异(P > 0.05)。
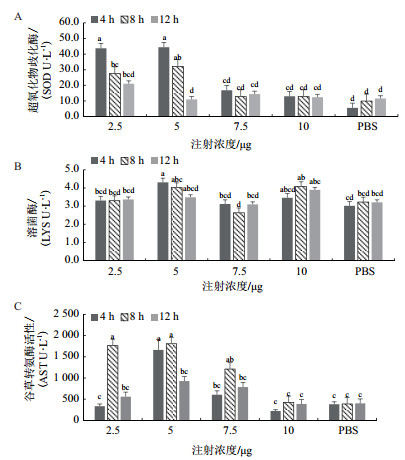
|
| 图 3 经r IL-2免疫之后红鳍东方鲀的血液非特异性免疫指标 |
经r IL-2免疫之后不同浓度组在不同时间血液的特异性免疫指标变化如图 4。由图 4可知,各组血清补体C3含量受r IL-2含量和采样时间影响显著(P < 0.05),5 μg浓度组的补体C3含量在4 h时间点显著低于各组(P < 0.05),其余各浓度时间点内无显著性差异(P > 0.05)。注射r IL-2后,随着注射浓度增加,免疫球蛋白E含量有升高趋势,但在各时间点各浓度组间无显著性差异(P > 0.05)。5 μg浓度组的12 h时间点免疫球蛋白G的含量显著低于PBS组,7.5 μg浓度组8 h、12 h时间点免疫球蛋白G含量有显著升高(P < 0.05),其余各时间点各浓度组间无显著性差异(P > 0.05)。各组血清免疫球蛋白M含量受r IL-2含量和采样时间的影响显著(P < 0.05),7.5 μg浓度组的免疫球蛋白M含量在12 h时间点显著低于各组(P < 0.05),其余各浓度时间点内无显著性差异(P > 0.05)。

|
| 图 4 经r IL-2免疫之后红鳍东方鲀的血液的生化指标 |
血液生化指标能反映鱼类的生理状态。鱼类血液与机体的代谢、疾病及营养状况有着密切的关系[15]。2.5 μg在本研究中,经r IL-2免疫之后,在注射2.5 μg组和5 μg组血液中的白球比在第4小时时有显著地增高,总蛋白含量无显著差异。总蛋白包括白蛋白和球蛋白,血液中白蛋白的主要功能是维持血液中胶体的渗透压,而球蛋白主要参与脂类或脂溶性物质的运输及机体免疫反应。A/G能在一定程度上反映白蛋白和球蛋白的含量变化,反映肝脏的功能状况[16-18]。血清中尿素氮的含量是反映肾功能的指标,尿素氮浓度降低表明氨基酸平衡好,蛋白质分解速度降低,机体蛋白质合成速度加快,同时尿素氮的含量变化也和生物体摄入含氮物质的多少有关系[19-20]。在各个浓度组的8 h时间点显著高于同组内其它时间点,2.5 μg和10 μg浓度组的4 h时间点,尿素氮含量显著低于各时间浓度组,在注射rIL-2后血清尿素氮含量的波动属于正常变化,但可以从数据看出2.5 μg和10 μg注射浓度组在4 h内机体的蛋白合成速度加快,4 h-8 h内蛋白质分解速度提高,8-12 h内又逐渐降低恢复至正常水平。甘油三酯和胆固醇是血脂的主要组成,当体内有多余的能量时,脂肪组织会以甘油三酯的形式将其储存备用,大部分组织均可利用甘油三酯的分解产物供给能量,同时肝脏和脂肪等组织还可以进行甘油三酯合成[20-21]。在注射了rIL-2之后,2.5 μg浓度组甘油三酯含量在8 h时间点显著高于PBS组,8 h时间点甘油三酯含量有随着注射浓度增加先降低再升高的趋势,注射rIL-2对机体合成脂肪的速度有一定影响,可能与肝脏的免疫反应有关。
谷草转氨酶(AST)主要参与体内转氨基作用,肝功能正常时,血浆谷草转氨酶活性很低,但当肝细胞或某些组织损伤或坏死,都会导致血液中的谷草转氨酶活性升高[19, 22]。从实验结果可见,经r IL-2免疫之后,血液中的谷草转氨酶含量升高,说明对肝脏有一定的影响,总体呈现出随时间先升高后降低的趋势,其中低浓度组影响较为明显。对于动物,超氧化物歧化酶(SOD)在消除活性氧的毒性中发挥了重要作用,并参与由病毒感染和细菌引起的免疫反应,抗氧化酶在机体内表现出一定的抑菌效果,从而保护机体不受外源物质的破坏[23-24]。本实验中,低浓度注射组的超氧化物歧化酶明显升高,说明外源rIL-2可以提高红鳍东方鲀体内超氧化物歧化酶活性。溶菌酶是生物机体在免疫反应过程中分泌的具有溶解细菌作用的非特异性免疫因子,在动物的免疫防御中发挥重要作用[25]。5 μg浓度组在4 h时间点溶菌酶活性显著升高,说明外源rIL-2可以影响鱼体免疫反应,在一定程度上提高鱼体免疫。
免疫球蛋白是鱼类特异性体液免疫应答中最主要的介质,在体液免疫尤其是抵抗细菌性抗原侵扰方面起着重要的作用,硬骨鱼类中目前已发现有IgM、IgD、IgZ、IgT和IgM-IgZ及从红鳍东方鲀(Takifugu rubripes)中报道的新型IgH[26]。本实验中,注射rIL-2,对免疫球蛋白的含量有影响,但各组之间差异并不显著,可能IL-2并未介导免疫球蛋白产生的途径。
IL-2主要通过直接作用于T细胞而在免疫系统的关键功能、耐受性和免疫中发挥重要作用,并且当最初的T细胞也受到抗原刺激时,IL-2也会促进T细胞分化为效应T细胞和记忆T细胞,从而帮助机体抵抗感染[27]。淋巴细胞(Lymphocyte)是白细胞的一种,可分为T淋巴细胞(又名T细胞)、B淋巴细胞(又名B细胞)和自然杀伤(NK)细胞[28]。本研究中白球比的上升,表示着白细胞的增多,外源IL-2促使了红鳍东方鲀白细胞的产生,刺激了免疫反应,而对同为鱼类重要免疫分子的补体和抗原并没有太大的促进作用。吞噬细胞也是硬骨鱼类细胞免疫的重要组分[28],而超氧化物歧化酶是吞噬细胞吞噬过程中的反映指标。本研究中超氧化物歧化酶明显升高,表明了IL-2对吞噬细胞具有促进作用。肝肾作为硬骨鱼类重要的免疫器官,在本研究中通过常规的检测肝肾功能的血液指标表明,外源IL-2也刺激肝肾作出反应,但具体是促免疫还是肝肾毒性损伤还需做更多研究。IL-2不遵循化学疗法的经典剂量反应曲线,高剂量和低剂量IL-2的免疫活性表现出鲜明的对比,这可能与IL-2受体(CD25、CD122和CD132)在不同细胞群体上的分布不同有关,从而导致不同细胞受高剂量和低剂量IL-2的激活反应不同,通常高剂量会抑制免疫,而低剂量会刺激1型免疫[29],和我们的研究是一致的,在低剂量时血液各项指标表现出了显著差异(P < 0.05)。
本试验结果表明,注射rIL-2影响了红鳍东方鲀免疫相关指标的变化,数据各项指标的变化峰值可能在8 h内,外源IL-2促使红鳍东方鲀的肝脏做出反应,各项指标的变化差异可能与实验鱼个体大小也有关系,外源IL-2对鱼体抗病能力等方面还需进一步研究。
4 结论本试验活化载有rIL-2的大肠杆菌,对经诱导表达后得到重组目的蛋白r IL-2进行进一步鱼体免疫,得到了不同免疫浓度下红鳍东方鲀血液的生化指标及免疫指标的变化趋势,证明外源IL-2促使红鳍东方鲀的肝脏等身体免疫器官做出反应的同时也促使了免疫细胞做出反应。
| [1] |
沙万里, 杨桂连, 王春凤. 白细胞介素-2在动物疾病防治中的应用进展[J]. 中国兽药杂志, 2013, 47(4): 58-61. |
| [2] |
李蕴玉, 李佩国, 张艳英, 等. 白细胞介素-2(IL-2)在兽医中的应用进展(综述)[J]. 河北科技师范学院学报, 2006, 20(4): 63-66. |
| [3] |
李宏梅, 李祥瑞, 郭慧君. 白细胞介素-2的研究进展及应用[J]. 山东畜牧兽医, 2002(1): 38-39. |
| [4] |
钟显英. 白细胞介素-2国内临床应用现状[J]. 医学文选, 2000(s1): 129-130. |
| [5] |
陈广华, 吴德沛, 等. IL-2和IL-15的生物学及免疫治疗应用研究进展[J]. 中国实验血液学杂志, 2009, 17(4): 1088-1092. |
| [6] |
苏锦祥, 李春生. 中国动物志硬骨鱼纲鲀形目海蛾鱼目喉盘鱼目鮟鱇目[M]. 北京: 科学出版社, 2002.
|
| [7] |
王斌, 于兰萍, 胡亮, 等. 红鳍东方鲀皮肤溃烂病病原菌的分离与鉴定[J]. 中国水产科学, 2008, 15(2): 352-358. DOI:10.3321/j.issn:1005-8737.2008.02.022 |
| [8] |
Bird S, Zou J, Kono T, et al. Characterisation and expression analysis of interleukin-2(IL-2)and IL-21 homologues in the Japanese pufferfish, Fugu rubripes, following their discovery by synteny[J]. Immunogenetics, 2005, 56(12): 909-923. DOI:10.1007/s00251-004-0741-7 |
| [9] |
王建平, 陈吉刚. 红鳍东方纯IL-2基因克隆及序列分析[J]. 上海海洋大学学报, 2008, 17(4): 497-501. |
| [10] |
陈刚, 周晖, 张健东, 等. 军曹鱼血液指标及血细胞发生的观察[J]. 水生生物学报, 2005, 29(5): 564-570. DOI:10.3321/j.issn:1000-3207.2005.05.015 |
| [11] |
孙鹤.红鳍东方鲀IL-2基因的重组表达及其免疫应答的研究[D].大连: 大连海洋大学, 2017.
|
| [12] |
乔海霞, 张彦霞, 张存辉. IL-2联合不可分型流感嗜血杆菌P6重组蛋白对小鼠免疫功能的影响[J]. 免疫学杂志, 2014(5): 412-415. |
| [13] |
Cata JP, Weng HR, Dougherty PM. Spinal injection of IL-2 or IL-15 alters mechanical and thermal withdrawal thresholds in rats[J]. Neuroscience Letters, 2008, 437(1): 45-49. DOI:10.1016/j.neulet.2008.03.074 |
| [14] |
Wu J, Shi YH, Zhang XH, et al. Molecular characterization of an IL-1β gene from the large yellow croaker(Larimichthys crocea)and its effect on fish defense against Vibrio alginolyticus infection[J]. Zoological Research, 2015, 36(3): 133-141. |
| [15] |
何志刚, 王冬武, 曾国清, 等. 不同饲料对红白锦鲤生长、体色和血液生化指标的影响[J]. 广东农业科学, 2015, 42(20): 107-111. DOI:10.3969/j.issn.1004-874X.2015.20.021 |
| [16] |
李维勤, 黎介寿. 肝脏白蛋白基因表达的调控及其影响因素[J]. 肠外与肠内营养, 1994(1): 77-82. |
| [17] |
刘丽萍. 人血白蛋白在肝硬化治疗中的应用[J]. 中国医院用药评价与分析, 2013, 13(5): 388-391. |
| [18] |
李献平, 于伟燕, 赵彩彦. 人血白蛋白治疗终末期肝病研究进展[J]. 实用肝脏病杂志, 2017(1): 115-119. DOI:10.3969/j.issn.1672-5069.2017.01.033 |
| [19] |
刘襄河, 叶超霞, 郑丽勉, 等. 饲料糊精水平对暗纹东方鲀幼鱼生长、消化酶活性和血液生化指标的影响[J]. 水产学报, 2013, 37(9): 1359-1368. |
| [20] |
吴俊光, 王连生, 王常安, 等. 饲料中精氨酸水平对杂交鲟幼鱼抗氧化能力及血清生化指标的影响[J]. 大连海洋大学学报, 2016, 31(3): 272-278. |
| [21] |
张永泉, 尹家胜, 郭文学, 等. 野生黑斑狗鱼血液学常值的研究[J]. 东北农业大学学报, 2015(3): 81-86. |
| [22] |
冯建, 王萍, 何娇娇, 等. 大豆浓缩蛋白替代鱼粉对大黄鱼幼鱼生长、体成分、血清生化指标及肝组织学的影响[J]. 中国水产科学, 2017, 24(2): 268-277. |
| [23] |
袁牧, 王昌留, 王一斐, 等. 超氧化物歧化酶的研究进展[J]. 中国组织化学与细胞化学杂志, 2016, 25(6): 550-558. |
| [24] |
方春华, 乔琨, 刘智禹, 等. 海洋生物中抗氧化酶的研究进展[J]. 渔业研究, 2016, 38(4): 331-342. |
| [25] |
顾雪飞, 陈玉春, 刘敏. 中草药对鲤血清和免疫器官溶菌酶活性的影响[J]. 淡水渔业, 2007, 37(2): 30-33. DOI:10.3969/j.issn.1000-6907.2007.02.008 |
| [26] |
肖凡书, 聂品. 鱼类免疫球蛋白重链基因与基因座的研究进展[J]. 水产学报, 2010, 34(10): 1617-1628. |
| [27] |
Liao W, Lin JX, Leonard WJ. IL-2 family cytokines:new insights into the complex roles of IL-2 as a broad regulator of T helper cell differentiation[J]. Current Opinion in Immunology, 2011, 23(5): 598-604. DOI:10.1016/j.coi.2011.08.003 |
| [28] |
孙德文, 詹勇, 许梓荣. 鱼类免疫系统的研究进展[J]. 水生态学杂志, 2002, 22(6): 17-19. |
| [29] |
Tomova R, Pomakov J, Jacobs JJL, et al. Changes in cytokine profile during local IL-2 therapy in cancer patients[J]. Anticancer research, 2006, 26(3A): 2037-2047. |




