随着生活质量的提高和环境及卫生状况的改善,人们对自身的健康状况的日益关注,使得我国国民寿命整体得到提升[1]。寿命除受到先天基因遗传影响,也与后天环境有很大的关系[2]。
果蝇生命周期短,并且与人类高度同源,是一种十分适合进行寿命研究的模式动物[3]。2000年,Science报道,果蝇的基因测序已经基本完成[4],使在各个领域对果蝇的研究均得到广泛应用并取得重大突破,这意味着果蝇可作为研究人类健康有关问题的最佳模式动物[3, 5-6]。
吸烟是一种潜在的可能加速衰老从而影响寿命的环境因素,已然成为影响人类的非常严重的公共环境卫生问题[7]。研究发现,主动吸烟与被动吸烟都都会严重危害人类健康[8-9]。根据世界卫生组织(WHO)的统计数字,每年全世界因吸烟而死亡的人数达到600万;烟民中将会有半数因吸烟而提早死亡;暴露在烟雾中的被动吸烟者每年死亡人数约为60万。香烟的烟雾成分极其复杂,由若干复杂的有机物以及很多种气体和微粒组成[10],包括很多能引起组织炎症、致癌及其他危及身体健康的毒性成分[11],会对人类健康造成极大的损害,并影响人类寿命[10]。
影响寿命与衰老的基因有许多类:通过调节代谢而影响寿命的基因有SOD1、SOD2、CAT、GSH-Px(在果蝇中同源物为PHGPx),SOD、CAT和PHGPx能够发生协同作用,作为O2-清除剂,使O2-转化为O2,解除氧化胁迫对机体的损伤[12]。参与机体泛素化调节与蛋白酶活性调节从而影响寿命的有Usp7、Rpn11等,机体在经过应激反应后产生大量变性蛋白,usp7、Rpn11在变性蛋白去泛素化重新回收利用的过程中起到重要作用,并且可以抑制肿瘤产生[13-14]。之前报道过MTH及Sirt基因家族与果蝇的寿命也有着密切的关系,MTH突变体会比其父本延长寿命35%[15-17],Sirt家族的基因表达降低会降低正常的寿命[18-19]。
虽然吸烟有害健康,但是烟草是否或怎样影响生物体的寿命与衰老依然没有明确的定论,因此借助果蝇模型探究烟草对寿命与衰老的影响具有极大的现实意义。我们希望通过研究烟草对果蝇寿命影响的机制,为吸烟的有害性提供切实明确的实验证据与理论依据。
1 材料与方法 1.1 材料 1.1.1 动物W1118系黑腹果蝇,来自山东农业大学动物发育实验室。
1.1.2 香烟哈德门香烟(市售软包装,烟碱量:1.0 mg)
1.1.3 酵母粉(安琪酵母有限公司);葡萄糖(天津市凯通化学试剂有限公司);玉米粉(吉林中粮生化能源销售有限公司);琼脂(Solarbio Life Sciences);尼泊金甲酯(BBL Life Sciences);0.45 μm滤膜(Millipore);Trizol(Sangon Biotech);HiScript® QRT Super Mix with gDNA wiper(Vazyme);ChamQ SYBR® Color qPCR Master Mix(Vazyme)。
1.1.4 仪器生化培养箱(江南同君仪器有限公司HPS-280);体视显微镜(奥林巴斯有限公司SZ61-SET);立式压力蒸汽灭菌器(上海申安医疗器械厂LDZX-50KBS);荧光定量PCR仪(BIO-RAD CFX96);超纯水机(Millipore Milli-Q Integral)。
1.2 方法 1.2.1 浸出烟草内含物将哈德门香烟去除香烟外的包装纸得到烟丝,用电子天平称取烟丝1 g、2 g和3 g,用100 mL重蒸水浸泡24 h,使用0.45 μm滤膜过滤,得烟草提取液,在4℃下保存备用。
1.2.2 制备果蝇培养基将酵母粉80 g/L加水煮沸20 min后,加入葡萄糖110 g/L、玉米粉40 g/L、琼脂7.5 g/L后再次煮沸,冷却至65℃并加入尼泊金甲酯1.5 g/L。再加入培养基质量1/10的纯净水或不同浓度的烟草提取液并混匀,趁热倒入平底玻璃培养管(Φ=3.0 cm)中,高度约为1 cm。
1.2.3 构建受烟草影响的果蝇模型使用二氧化碳进行麻醉,挑选刚孵化未满12 h的雄性果蝇,培养于空白对照培养基(CK)与各不同浓度的烟草培养基(1 g/d、2 g/d和3 g/d)中,每种处理下至少150只。于温度(25±1)℃湿度(70±10)%的生化培养箱中培养,每天定时检查记录果蝇存活情况并更换培养基。
1.2.4 提取样本总RNA选取特定时间点的雄性果蝇进行称重,研磨得到果蝇匀浆,利用改良后的Trizol法[20]提取果蝇总RNA,在RNase-free离心管中加入500 μL Trizol,室温静置3 min后4℃ 12 000×g离心10 min,取上清液,加200 μL氯仿,震荡15 s,室温静置2-3 min后4℃ 12 000×g离心15 min,取上清液,加等体积异丙醇,混匀,冰浴静置10 min后4℃ 12 000×g离心10 min,用500 μL 70%乙醇漂洗后4℃ 12 000×g离心5 min,去上清液,晾干,加入适量DEPC milliQ溶解获得样本总RNA。
1.2.5 Real-time PCR检测基因表达变化取1 mg RNA,依照说明书使用逆转录试剂盒进行逆转录。得到样本cDNA后,使用荧光定量仪,依照说明书使用荧光定量试剂盒检测有关基因表达变化,所用引物见表 1。以Actin、β-Tubulin基因作为内参,经均一化处理后分析基因表达改变情况。
使用Origin 9.0软件进行统计分析。所有数据至少来自3次独立重复,并通过t检验、Breslow检验或单因素方差分析进行分析,然后进行Least-Significant Difference检验进行多重比较,P < 0.05被认为具有统计学意义。在未显示精确P值的情况下,统计显著性显示为* P < 0.05,** P < 0.01,*** P < 0.001;不同小写字母表示P < 0.05。
2 结果 2.1 烟草影响果蝇寿命动物种群的平均寿命和半数死亡时间是衡量群体预期寿命的重要数据。因此,我们通过每天在固定时间更换果蝇培养基并统计果蝇的死亡情况。实验发现,不同浓度的烟草处理(1 g/d、2 g/d和3 g/d)对雄性果蝇平均寿命和半数死亡时间的影响,如图 1所示。图中所有处理组的两个寿命指标均低于对照组,当烟草达到一定浓度时,果蝇的寿命显著降低。烟草对果蝇的平均日存活率的影响,如图 2所示。结合图 1可以发现烟草对果蝇寿命的不利影响具有剂量效应,其随着烟草浓度的增加而增加,最终导致日均存活率与对照组相比出现显著差异。

|
| 图 1 烟草处理对雄性果蝇寿命的影响 |

|
| 图 2 烟草处理下雄性果蝇寿命曲线 |
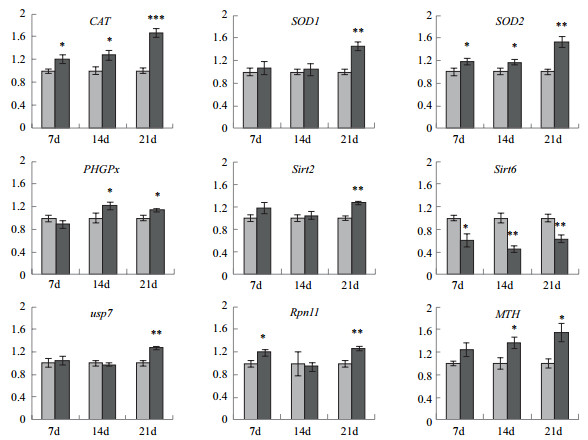
为了揭示果蝇寿命缩短的原因,我们分别在第7天,第14天和第21天检测了可能与衰老或寿命相关的几个基因的表达情况。在烟草的影响下,果蝇中的一些基因表达水平发生了显著的变化。通过Real-time PCR技术检测了与果蝇衰老和寿命相关的9个基因。结果如图 3所示。烟草处理7 d后,果蝇体内CAT、SOD2和Rpn11的表达显著上调,Sirt6的表达显著下调;14 d后,果蝇体内PHGPx、SOD2和MTH的表达显著上调,Sirt6的表达超显著下调。21 d后,果蝇体内CAT的表达极显著上调,SOD1、SOD2、Sirt2、Usp7和Rpn11的表达超显著上调,PHGPx和MTH的表达显著上调,Sirt6的表达超显著下调。随着影响时间的延长,果蝇中越来越多的基因受到影响,受影响的情况也更加严重。
|
| 图 3 处理7、14和21 d后雄性果蝇有关基因表达情况 |
随着人们对于延长寿命、减缓衰老等问题越来越关注,此类研究已成为一大热点。近年来人们通过研究存活率、抗氧化酶活性以及与衰老相关基因表达情况,发现了越来越多的物质具有抗氧化、延缓衰老的作用[21-22],这为人类健康,延长寿命作出了巨大贡献。本实验在通过研究存活率以及衰老相关基因表达情况中发现,烟草影响将会导致果蝇寿命的缩短。
烟草影响到亿万烟民乃至国计民生,其带来的健康危害也不容小觑。由于果蝇的衰老基因和代谢途径与人类非常相近,本研究以W1118系黑腹果蝇为材料,通过水浸泡烟草提取烟草内物质处理果蝇,测定了果蝇的寿命和与衰老有关的基因表达情况。结果发现吸烟会缩短果蝇的寿命,对果蝇生存产生不利影响,甚至引起果蝇体内某些基因表达的变化。在烟草的影响下,几种抗氧化酶的表达水平增加,表明在烟草刺激下果蝇遭受了某种氧化胁迫,其很有可能导致果蝇的衰老加速。有研究表明,吸烟会导致细胞遭受氧化胁迫[23],产生过多的ROS而导致活性氧消除系统有关酶类和抗氧化物质的量显著上升,这与本研究发现的烟草导致抗氧化酶基因表达量升高具有一致性。Sirt6的表达水平降低也可能说明烟草处理对果蝇细胞造成不利影响和氧化胁迫,之前研究发现 Sirt家族蛋白质是一种在调节氧化应激和寿命中发挥出关键作用的蛋白质,过表达Sirt家族基因可以显著增长机体的寿命[19],烟草影响导致Sirt6表达降低进而影响了果蝇的寿命。Rpn11被报道编码一种促进26S蛋白酶体活性的蛋白质[13],其增加暗示烟草引起了氧化胁迫,使得细胞内蛋白质受到活性氧影响而未折叠或错误折叠,最终激活泛素途径降解[24]。MTH的表达升高也暗示了一种负面影响,因该基因作用机制仍不明确,只发现敲除该基因会使雄性果蝇寿命显著升高,与寿命存在负相关关系[17]。我们认为烟草影响主要导致果蝇遭受氧化胁迫进而引起早衰,近年来的研究还证实了烟草能导致肿瘤的产生,影响卵巢正常功能等诸多的疾病[25-26],这些疾病可能与氧化损伤一起影响到机体的健康与寿命。
对于烟草的萃取人们通常采用水或80%的甲醇水溶液提取,相比有机溶剂,用水提取成本低、污染小且对果蝇不会产生其他影响,在烟草行业标准YC/T 251-2008中也采用水萃取样品[27]。在之前相关的实验中,我们发现用水浸泡烟草与过滤燃烧后的烟气两种方式提取烟草内物质对果蝇的影响十分相似,因此我们利用果蝇的开管循环系统,巧妙地以消化道为途径通过饲喂含烟草成分的培养基来处理果蝇,构建受烟草影响的果蝇模型。在之前我们也发现,通过四层纱布简单过滤的烟草提取液制成的培养基,可以在很低的浓度引起雌性果蝇寿命出现显著降低本研究中使用0.45 μm滤膜对烟草提取液进行过滤发现,对果蝇寿命产生影响所需的浓度阈值提高了很多,这也与近期的研究结论一致[28]。因此,香烟滤嘴的过滤质量对吸烟人群健康的影响也是不容忽视的。
从宏观的群体平均寿命与微观的基因表达调控的角度,我们均发现烟草会对果蝇的健康产生不利影响,烟草也很可能对人的生命产生不利影响,其通过使身体受到氧化损伤而加速衰老。从社会学的角度来看,本研究可以为吸烟引起早衰提供理论依据,能使人们更深入地了解烟草的危害。未来,我们也希望从烟草对蛋白质水平的影响和烟草引起早衰的分子机制进行更深入研究。
4 结论本研究通过重蒸水浸泡香烟烟丝提取烟草内物质,雄性果蝇经烟草影响后寿命出现了显著缩短,且该影响具有剂量效应。果蝇体内多种抗氧化酶转录水平出现上调,泛素化调节酶与乙酰化酶转录水平也出现改变,暗示氧化胁迫导致果蝇机体出现早衰。
| [1] |
张震. 1950年代以来中国人口寿命不均等的变化历程[J]. 人口研究, 2016, 40(1): 8-21. |
| [2] |
Dato S, Rose G, Crocco P, et al. The genetics of human longevity:an intricacy of genes, environment, culture and microbiome[J]. Mech Ageing Dev, 2017, 165(Pt B): 147-155. |
| [3] |
Milinkeviciute G, Gentile C, Neely GG. Drosophila as a tool for studying the conserved genetics of pain[J]. Clinical Genetics, 2012, 82(4): 359-366. DOI:10.1111/j.1399-0004.2012.01941.x |
| [4] |
Adams MD, Celniker SE, Holt RA, et al. The genome sequence of Drosophila melanogaster[J]. Science, 2000, 287(5461): 2185-2195. DOI:10.1126/science.287.5461.2185 |
| [5] |
Roberts DB. Drosophila melanogaster:the model organism[J]. Entomologia Experimentalis et Applicata, 2006, 121(2): 93-103. |
| [6] |
Werry N. Digest:The importance of genital morphology in Drosophila copulation[J]. Evolution, 2018, 72(11): 2567-2568. DOI:10.1111/evo.13621 |
| [7] |
Au WW, Su D, Yuan J. Cigarette smoking in China:public health, science, and policy[J]. Reviews on Environmental Health, 2012, 27(1): 43-49. |
| [8] |
Reardon JZ. Environmental tobacco smoke:respiratory and other health effects[J]. Clinics in Chest Medicine, 2007, 28(3): 559-573. |
| [9] |
Walker JC, Jennings RA, Nelson PR, et al. Sensory responses to environmental tobacco smoke from tobacco-burning and tobacco-heating cigarettes[J]. Indoor Air, 1993, 3(3): 170-180. |
| [10] |
Cataldo JK, Malone RE. False promises:The tobacco industry, "low tar" cigarettes, and older smokers[J]. Journal of the American Geriatrics Society, 2008, 56(9): 1716-1723. DOI:10.1111/j.1532-5415.2008.01850.x |
| [11] |
Howard DH, Richards TB, Bach PB, et al. Comorbidities, smoking status, and life expectancy among individuals eligible for lung cancer screening[J]. Cancer, 2015, 121(24): 4341-4347. DOI:10.1002/cncr.29677 |
| [12] |
Mozaffarieh M, Krepler K, Heinzl H, et al. Visual function, quality of life and patient satisfaction after ophthalmic surgery:a comparative study[J]. Ophthalmologica, 2004, 218(1): 26-30. DOI:10.1159/000074563 |
| [13] |
雷坚, 刘小柳, 张芸, 等. 去泛素化酶Rpn11在套细胞淋巴瘤中的表达及其临床病理意义[J]. 华夏医学, 2016, 29(5): 1-5. |
| [14] |
金伟军, 姚祥春, 吕美巧, 等. 泛素-蛋白酶体系统的结构、作用和调控机制[J]. 科技通报, 2008, 24(1): 29-34. DOI:10.3969/j.issn.1001-7119.2008.01.006 |
| [15] |
Sgrò CM, Heerwaarden B, Kellermann V, et al. Complexity of the genetic basis of ageing in nature revealed by a clinal study of lifespan and methuselah, a gene for ageing, in Drosophila from eastern Australia[J]. Molecular Ecology, 2013, 22(13): 3539-3551. DOI:10.1111/mec.12353 |
| [16] |
Luis EDG, Ghildyal P, Fischer KE, et al. Modulation of methuselah expression targeted to Drosophila insulin-producing cells extends life and enhances oxidative stress resistance[J]. Aging Cell, 2013, 12(1): 121-129. |
| [17] |
Friedrich M, Jones JW. Gene Ages, Nomenclatures, and functional diversification of the Methuselah/Methuselah-Like GPCR family in Drosophila and Tribolium[J]. Journal of Experimental Zoology Part B:Molecular and Developmental Evolution, 2016, 326(8): 453-463. DOI:10.1002/jez.b.22721 |
| [18] |
Whitaker R, Faulkner S, Miyokawa R, et al. Increased expression of Drosophila Sirt2 extends life span in a dose-dependent manner[J]. Aging(Albany NY), 2013, 5(9): 682-691. |
| [19] |
Burnett C, Valentini S, Cabreiro F, et al. Absence of effects of Sirt2 overexpression on lifespan in C. elegans and Drosophila[J]. Nature, 2011, 477(7365): 482-485. DOI:10.1038/nature10296 |
| [20] |
温雪梅, 段晓雷, 刘虎岐. 不同方法提取淡色库蚊总RNA的定量比较分析[J]. 西北农业学报, 2012, 21(2): 99-102, 110. DOI:10.3969/j.issn.1004-1389.2012.02.020 |
| [21] |
王子涵, 钱籽霖, 向敏, 等. 乳酸发酵拐枣汁对果蝇寿命及抗氧化活性的影响[J]. 食品与发酵工业, 2019, 45(20): 112-117. |
| [22] |
王慧, 赵江, 杨胜楠, 等. 玉米黄质延缓果蝇衰老作用的研究[J]. 营养学报, 2018, 40(5): 506-508. DOI:10.3969/j.issn.0512-7955.2018.05.019 |
| [23] |
杨萨, 周洋洋, 张佳彤, 等. 烟草烟雾凝集物对BEAS-2B细胞氧化应激的影响[J]. 郑州大学学报:医学版, 2019, 54(4): 517-521. |
| [24] |
崔亚欢, 陈乃耀. 帕金森病的发病机制研究[J]. 中华老年心脑血管病杂志, 2019, 21(1): 106-110. DOI:10.3969/j.issn.1009-0126.2019.01.028 |
| [25] |
梁照锋, 陶海, 郭文浩, 等. 香烟烟雾促进膀胱癌干细胞的自我更新和干性基因的表达[J]. 江苏大学学报:医学版, 2019, 29(3): 205-207. |
| [26] |
周洋, 章帆, 徐湛湛, 等. 香烟烟雾对卵巢颗粒细胞的影响[J]. 四川生理科学杂志, 2019, 41(4): 313-316. |
| [27] |
张涛, 曾婉俐, 向海英, 等. 在线固相萃取净化-离子色谱法测定烟草中的糖[J]. 江西农业学报, 2018, 30(8): 90-94. |
| [28] |
楚文娟, 孟祥士, 许旭, 等.滤嘴参数对细支烟主要理化指标的影响[J/OL].烟草科技, 2019, 52(8): 60-66.
|




