溶菌酶,又称胞壁质酶,是由亚历山大·弗莱明发现并命名的一种多糖水解酶[1],能够水解细菌细胞壁肽聚糖中N-乙酰胞壁酸和N-乙酰-D-葡萄糖胺之间的β-1,4-糖苷键,导致细菌死亡[2]。基于溶菌酶的氨基酸序列和生物化学性质,其被分为3种类型:C型(Chicken or Conventional type),G型(Goose type)和I型(Invertebrate type)[3]。人源溶菌酶(Human lysozyme,HLZ)属于C型溶菌酶,是一种由130个氨基酸组成的分子量约为14.7 kD的单体蛋白[4-5]。其氨基酸序列中富含碱性氨基酸、带正电荷、等电点(pI)约为11.0[6]。人源溶菌酶的空间结构如图 1所示,它是由3个α螺旋(H1、H2和H3)与3个β折叠(S1、S2和S3)进一步卷曲折叠构成的具有特定构象的紧凑结构(图 1-A)[7-8]。其结构中所含有的4对二硫键(-S-S-)在稳定其空间结构和蛋白复性中具有重要作用(图 1-B)[9]。

|
| 图 1 人源溶菌酶的空间结构图 |
人源溶菌酶广泛分布于人体器官、细胞和体液中[6, 10]。已报道的含有人源溶菌酶的器官有肺、肾、胎盘等;细胞有巨噬细胞、白细胞等;体液有眼泪、唾液、尿液、血清和乳汁等[11]。其作为一种非特异性免疫因子和抗炎因子,人源溶菌酶在人体防御机制中扮演着重要角色[12]。此外,很多研究表明人源溶菌酶还具有抗真菌和抗病毒的作用[13-14]。在活性方面,其抗菌活性是鸡蛋清溶菌酶的3倍,是牛溶菌酶的10倍[15]。目前,人源溶菌酶已经被广泛应用于食品加工(食品防腐剂、保鲜剂、婴幼儿奶粉配方)、畜牧业、化妆品及医药等领域[16-19]。
然而,天然人源溶菌酶来源缺乏,不能充分提供产品,限制了人源溶菌酶的广泛应用。基因工程技术的发展使得人源溶菌酶已经在很多微生物系统中成功表达,如真菌、植物和动物等[20-22]。和这些生物反应器相比,大肠杆菌表达系统作为蛋白质异体表达最常用的宿主系统,具有成本低、蛋白表达量高、繁殖周期短、操作简便以及产品纯净等优点[23-24]。然而,在大肠杆菌中表达的重组人源溶菌酶在细胞内常以不溶性的没有生物活性的包涵体形式累积,从这些包涵体中恢复其生物活性成为DNA重组技术广泛应用的一个难题[25]。对于富含二硫键的人源溶菌酶而言,如何在体外复性过程中有效地形成正确配对的二硫键是复性的关键性问题之一[26-27]。
本研究旨在将人源溶菌酶编码基因的密码子进行优化,构建能够在大肠杆菌中高效表达的系统,并进一步通过包涵体体外复性技术获得具有高生物活性的人源溶菌酶。同时探究一步透析、梯度透析和梯度稀释3种复性方式以及复性液中谷胱甘肽氧化还原对(GSSG/GSH)、精氨酸、甘油等复性物的浓度对重组人源溶菌酶复性的影响,获得最佳的复性方案[28-30]。
1 材料与方法 1.1 材料 1.1.1 质粒和菌株原核表达载体pET21a由本实验室提供;大肠杆菌Trans10和BL21(DE3)感受态细胞购买于北京全式金生物有限公司;溶壁微球菌由北京北纳创联生物技术研究院提供。
1.1.2 酶和试剂人源溶菌酶标准品购买于北京经科宏达生物技术有限公司;NdeⅠ和XhoⅠ限制性核酸内切酶购买于日本TaKaRa公司;T4 DNA连接酶购买于美国Promega公司;DNA Marker 5000购买于康为世纪生物科技有限公司;琼脂糖、尿素、DTT、EDTA、Triton X-100、IPTG、PMSF购买于美国Amresco公司;普通琼脂糖凝胶DNA回收试剂盒、质粒DNA提取试剂盒购买于北京天根公司;PageRuler Prestained Protein Marker购买于美国Thermo Scientific公司。
1.1.3 仪器与设备Allegra-64R高速低温离心机(美国Beckman公司);SpectraMax M5多功能读板机(美国Molecular Device公司);AlphaImager Mini凝胶成像系统(美国ProteinSimple公司);5430R小型台式高速冷冻离心机(美国Eppendorf公司);SPX-150生化培养箱(上海申贤恒温设备厂);HZQ-QX全温振荡器(哈尔滨东联电子技术开发有限公司);JY98-Ⅲ超声波细胞破碎仪(宁波新芝生物科技有限公司)。
1.2 方法 1.2.1 人源溶菌酶基因的优化与合成利用NCBI网站对人源溶菌酶的氨基酸序列进行BLAST比对,得到其基因序列(基因号:D00413.1)。由于大肠杆菌对密码子的偏好性会影响到基因的表达水平,因此,根据大肠杆菌密码子使用频率表对人源溶菌酶基因进行优化。根据pET21a质粒多克隆位点,选择在基因序列的5'端引入NdeⅠ酶切位点(5'CA^TATG3'),在3'端引入XhoⅠ酶切位点(5'C^TCGAG3')。最后,将设计好的目的基因序列交由南京金斯瑞生物科技有限公司进行合成。
1.2.2 在大肠杆菌中表达重组人源溶菌酶表达载体的构建利用NdeⅠ和XhoⅠ对含有合成人源溶菌酶基因的pUC57-HLZ质粒进行双酶切后,利用琼脂糖凝胶回收试剂盒回收目标DNA片段。将回收后的HLZ基因与pET21a连接后筛选pET21a-HLZ阳性克隆交由上海生工有限公司进行DNA测序验证。
1.2.3 人源溶菌酶在大肠杆菌中的诱导表达及可溶性检测将重组质粒pET21a-HLZ转化至大肠杆菌BL21(DE3)感受态细胞,挑取单克隆至5 mL含氨苄的LB液体培养基中,并于37℃、200 r/min条件下振荡培养过夜。将过夜培养物按照1%接种量接入LB培养基中,继续振荡培养至菌液OD600 nm在0.6-0.8之间。向培养物中加入终浓度为0.5 mmol/L的IPTG诱导剂,于37℃下诱导培养6 h;将培养液于4℃、4 000 r/min条件下离心30 min,弃上清,保留菌体沉淀;将上述收集的菌体利用50 mmol/L Tris-HCl(pH8.0),内含150 mmol/L NaCl、1 mmol/L PMSF的缓冲溶液于冰上进行超声破碎,超声3 s、间隔7 s,超声约20 min至悬液半透明;将上述菌液于12 000 r/min、4℃条件下离心20 min,分离上清和沉淀。取适量诱导前后菌体以及菌体破碎后的上清和沉淀,加入5×SDS上样缓冲液混匀,煮沸10 min后离心1 min,进行SDS-PAGE检测,观察蛋白表达情况,以未经IPTG诱导的菌为阴性对照。
1.2.4 人源溶菌酶包涵体复性条件的研究首先,利用洗涤液(50 mmol/L Tris-HCl pH 8.0、100 mmol/L NaCl、2 mol/L尿素、1 mmol/L EDTA)对包涵体进行洗涤以除去包涵体中的脂类和部分杂蛋白。然后,将上述溶液于12 000 r/min、4℃条件下离心20 min,保留沉淀,沉淀即为粗制的包涵体。最后,利用变性液(50 mmol/L Tris-HCl pH8.0、20 mmol/L DTT、8 mol/L尿素)对洗涤后的包涵体进行溶解,在4℃搅拌变性1-2 h,离心20 min,收集上清,上清即为包涵体溶解液。
1.2.4.1 复性方式对人源溶菌酶复性的影响利用复性液(50 mmol/L Tris-HCl pH 8.0、50 mmol/L NaCl、1 mmol/L EDTA)分别探究一步透析、梯度透析和梯度稀释3种复性方式对人源溶菌酶复性的效果。一步透析法是将适量的包涵体溶解液置于上述复性液中进行透析,4℃磁力搅拌12-24 h,中途换一次复性液。然后,将复性后溶液于12 000 r/min、4℃条件下离心20 min,保留上清。梯度透析法是以2倍的梯度将包涵体溶解液依次置于含有4 mol/L、2 mol/L、1 mol/L、0.5 mol/L和0.25 mol/L,以及不含尿素的复性液中进行透析,每隔3 h换液,将透析后溶液离心后保留上清。梯度稀释法是以2倍的梯度(2、4、6、8和16倍)对包涵体溶解液进行逐级稀释直至尿素浓度达到0.5 mol/L,稀释过程中要将含有目标蛋白的溶液缓慢滴加至复性液中以减少蛋白聚集,稀释完毕后将蛋白溶液于不含尿素的复性液中进行透析。
1.2.4.2 GSSG/GSH浓度比值对人源溶菌酶复性的影响当复性液中分别添加浓度比为1:1、1:2、1:3、1:4和1:5的GSSG/GSH时,利用上一步确定好的最佳复性方式对包涵体进行复性,然后依据方法1.2.5进行抗菌活性检测,进而确定GSSG/GSH最佳浓度比例。
1.2.4.3 精氨酸浓度对人源溶菌酶复性的影响同样地,当复性液中分别添加1、2、3、4和5 mmol/L精氨酸时,利用最佳复性方式进行复性,根据不同条件下的酶比活力值来确定精氨酸的最佳浓度。
1.2.4.4 甘油浓度对人源溶菌酶复性的影响当复性液中分别添加2%、4%、6%、8%和10%甘油时,同样通过最佳复性方式对包涵体进行复性,探究甘油的最佳添加量。最后,根据上述实验结果,利用最佳复性方式以及同时添加最佳浓度的GSSG/GSH、精氨酸和甘油的复性液对包涵体进行复性,然后测定人源溶菌酶的最佳酶比活力,与人源溶菌酶标准品的比活力值进行比较。
1.2.5 人源溶菌酶抗菌活性的检测利用琼脂板扩散法来检测上述复性后人源溶菌酶的抗菌活性[6],即根据样品能否抑制底物(溶壁微球菌)生长从而产生透明的抑菌圈来初步判断复性是否成功。以复性液和人溶菌酶标准品分别作为空白对照和阳性对照,重复3次。
利用比浊法来测定人源溶菌酶的比活力值[6]。酶比活力的定义是:在pH 6.2、25℃反应条件下,单位质量的溶菌酶每分钟引起细菌悬液OD450 nm的变化值为1个酶活力单位(U)[5]。利用磷酸钠缓冲液(pH 6.2)制备溶壁微球菌悬液使其OD450 nm约为0.7;将底物与酶液或缓冲液(空白对照)按照一定比例混合后立即测定OD450 nm,每隔10 min测一次。每组设定3个平行。酶比活力计算公式为:酶比活力(U/mg)=酶活力(U/mL)/浓度(mg/mL)。
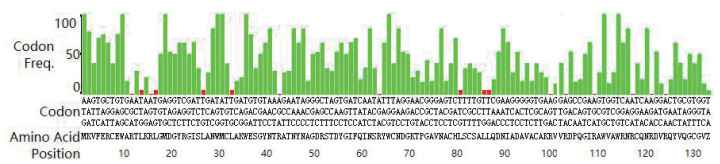
2 结果 2.1 人源溶菌酶基因的优化与合成为了提高人源溶菌酶在大肠杆菌中的表达效率,根据大肠杆菌密码子使用频率表对人源溶菌酶基因中的密码子使用频率进行分析,结果如图 2所示,纵坐标代表密码子的使用频率,横坐标为氨基酸对应的密码子,绿色和红色分别代表使用频率高于和低于10%的密码子。从图中可知,该序列中使用频率低于10%的密码子数量占总数的12%(17/131),在理想范围内(0-30%)。经过优化后的人源溶菌酶基因序列如下图 3所示。
|
| 图 2 人源溶菌酶基因的密码子分析结果 |

|
| 图 3 人源溶菌酶的DNA序列 |
将含有合成人源溶菌酶基因片段的pUC57-HLZ质粒进行亚克隆连接至pET21a构建重组表达质粒pET21a-HLZ,挑取阳性克隆进行测序验证,测序结果表明重组质粒中的目的基因序列正确,表明重组表达质粒pET21a-HLZ构建成功。
2.3 人源溶菌酶的诱导表达及可溶性检测如图 4-A所示,在37℃诱导温度下,利用0.5 mmol/L IPTG诱导重组菌表达后发现与未诱导的大肠杆菌相比,IPTG成功诱导了一条分子量介于10-17 kD间的蛋白质的表达,该蛋白的分子量与预期的人源溶菌酶的分子量(14.7 kD)相近。将大肠杆菌进行超声破碎后离心,分别取上清和沉淀进行SDS-PAGE电泳,发现表达人源溶菌酶的大肠杆菌上清中几乎没有重组蛋白的存在,绝大部分人源溶菌酶在沉淀中以包涵体的形式存在。

|
| A:M:蛋白Marker;1:未使用IPTG诱导样品;2:使用IPTG诱导样品;3:破碎大肠杆菌后上清样品;4:包涵体沉淀样品;B:M:蛋白Marker;1:纯化后的溶菌酶 图 4 人源溶菌酶在大肠杆菌中诱导表达及纯化的SDS-PAGE电泳图 |
如图 4-B所示,利用含有2 mol/L尿素的洗涤液对包涵体进行洗涤3次,除去杂蛋白后再使用含有8 mol/L尿素的变性液对洗涤后的包涵体进行变性溶解,得到了较纯的分子量为14.7 kD的溶菌酶。
2.4 人源溶菌酶包涵体复性条件的研究 2.4.1 复性方式对人源溶菌酶复性的影响包涵体经一步透析、梯度透析及梯度稀释3种复性方式进行复性后进行抑菌活性检测,结果如图 5-A所示,空白对照未产生抑菌圈,经梯度透析复性后人源溶菌酶产生的抑菌圈最大,其次是经梯度稀释和一步透析复性后样品,但远小于人源溶菌酶标准品产生的抑菌圈。比浊法实验结果如图 5-B所示,以上3种复性方式以及标准品对应的酶比活力值分别为147 U/mg、335 U/mg、176 U/mg和1 732 U/mg,表明最佳复性方式是梯度透析复性法。

|
| 数据的肩标字母相异者表示两者差异显著(P < 0.05) 图 5 复性方式对人源溶菌酶复性的影响 |
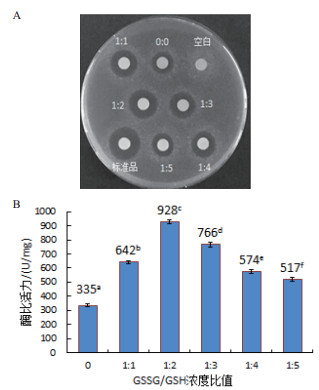
如图 6-A所示,空白对照无抑菌活性,当复性液中分别添加浓度比为1:1、1:2、1:3和1:4的GSSG/GSH时,经梯度透析复性后人源溶菌酶产生的抑菌圈均大于未加及添加1:5的GSSG/GSH时复性后人源溶菌酶产生的抑菌圈,其中1:2的GSSG/GSH对应的抑菌圈最大,但比标准品产生的抑菌圈小。
|
| 数据的肩标字母相异者表示两者差异显著(P < 0.05) 图 6 GSSG/GSH浓度比值对人源溶菌酶复性的影响 |
从图 6-B可知,0:0、1:1、1:2、1:3、1:4和1:5的GSSG/GSH以及标准品对应的酶比活力分别为335 U/mg、642 U/mg、928 U/mg、766 U/mg、574 U/mg、517 U/mg和1 732 U/mg,表明GSSG/GSH的最佳浓度比例是1:2。
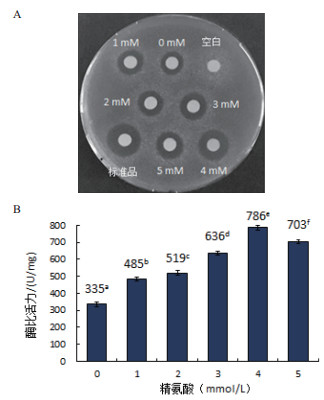
2.4.3 精氨酸浓度对人源溶菌酶复性的影响如图 7-A所示,空白对照未产生抑菌圈,当复性液中未加以及分别添加1、2、3、4和5 mmol/L精氨酸时,4 mmol/L精氨酸条件下复性的人源溶菌酶产生的抑菌圈比其他浓度精氨酸条件下复性的人源溶菌酶的抑菌圈大,但小于标准品产生的抑菌圈。
|
| 数据的肩标字母相异者表示两者差异显著(P < 0.05) 图 7 精氨酸浓度对人源溶菌酶复性的影响 |
从图 7-B可知,当复性液中未加以及分别添加1、2、3、4和5 mmol/L精氨酸时,测得酶比活力值分别为335 U/mg、485 U/mg、519 U/mg、636 U/mg、786 U/mg和703 U/mg,均低于标准品1 732 U/mg的比活力值,表明精氨酸的最佳浓度是4 mmol/L。
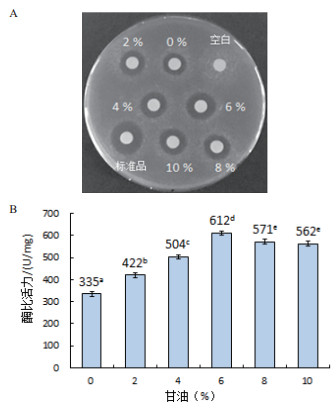
2.4.4 甘油浓度对人源溶菌酶复性的影响如图 8-A所示,空白对照未产生抑菌圈,当复性液中添加6%甘油时,复性后人源溶菌酶产生的抑菌圈明显比未加以及添加2%、4%、8%和10%甘油条件下的抑菌圈大,但比标准品的抑菌圈小。
|
| 数据的肩标字母相异者表示两者差异显著(P < 0.05) 图 8 甘油浓度对人源溶菌酶复性的影响 |
从图 8-B中可以看出,当复性溶液中不加以及分别添加2%、4%、6%、8%和10%甘油时,测得复性后人源溶菌酶的比活力分别为335 U/mg、422 U/mg、504 U/mg、612 U/mg、571 U/mg和562 U/mg,均低于标准品1 732 U/mg的比活力值。因此,甘油的最佳添加量为6%。
如图 9-A所示,空白组无抑菌活性,当复性液中同时添加浓度比为1:2的GSSG/GSH、4 mmol/L精氨酸和6%甘油时,复性后人源溶菌酶产生的抑菌圈明显比未加复性物时人源溶菌酶产生的抑菌圈大,而且与标准品的抑菌圈大小接近。

|
| 样品1:经不含复性物的复性液复性后人溶菌酶;样品2:经同时添加浓度比为1:2的GSSG/GSH、4 mmol/L精氨酸和6%甘油的复性液复性后人溶菌酶;数据的肩标字母相异者表示两者差异显著(P < 0.05) 图 9 最佳浓度的复性物对人源溶菌酶复性的影响 |
从图 9-B可知,3种复性物均加时的最佳比活力值为1 170 U/mg,远高于3种复性物均不加时人源溶菌酶335 U/mg的比活力值,但低于人溶菌酶标准品1 732 U/mg的比活力值。
3 讨论溶菌酶具有安全、无毒、无副作用等优良特性,目前已经被广泛应用于食品添加剂、防腐剂、婴幼儿奶粉配方以及保健品中,市场上对溶菌酶制剂的需求量与日俱增[31]。国内溶菌酶的主要来源是从鸡蛋的蛋清和蛋壳中提取,国外则以动物和霉菌为原料进行生产[32]。然而鸡源溶菌酶活性仅仅是人源溶菌酶活性的三分之一,同时有部分人群对溶菌酶制剂过敏,有研究表明过敏源来自于蛋清[33]。所以人源溶菌酶可能是其未来最好的替代品。
1986年,Jigami等[34]在人源溶菌酶前接上一段鸡源溶菌酶信号肽,从啤酒酵母中分泌出了有活性的人源溶菌酶。1987年,Hayakawa[35]利用啤酒酵母成功表达出重组人源溶菌酶,但是因其以包涵体形式存在而不具有活性,而后在大肠杆菌中表达,又存在溶菌酶产量小和活性低的问题。2006年,Maga等[36]在山羊乳腺中成功表达人源溶菌酶成功抑制了引起乳腺炎和牛奶冷腐败的细菌生长。李宁院士[37]团队2011年在猪乳腺上得到人源溶菌酶表达,并获得高产和稳定遗传。人源溶菌酶已经在很多生物系统中成功表达,其中,真菌表达系统虽然表达水平高,但是目的蛋白易发生翻译后修饰,如糖基化、磷酸化等修饰;植物和动物表达系统存在繁殖周期长、操作复杂等缺点,而且动物表达系统容易使溶菌酶产品污染致病菌。本研究成功将人源溶菌酶基因在大肠杆菌中表达,但是溶菌酶以包涵体的形式存在。众所周知,包涵体蛋白利用的局限性在于缺乏有效的复性方法。本研究通过包涵体体外复性技术成功获得了具有高活性的人源溶菌酶。在复性过程中,使用温和的增溶过程保留蛋白质的部分二级结构,并寻找合适比例的GSSG/GSH氧化还原剂和甘油溶液,为促进人源溶菌酶正确二硫键的形成提供更佳的氧化还原环境和渗透压,提高复性效率,这也是从包涵体中回收生物活性蛋白的关键[38]。
虽然,本研究成功实现人源蛋白质在大肠杆菌中表达并成功复性,但如果用于大批量生产,其复性率和酶活力还有待进一步提高。而且,IPTG诱导剂的价格昂贵,具有毒性,不适合批量生产,所以下一步可以从以下两个方面改进。第一,选择带有温控启动子的表达载体,其成本低,安全无毒;第二,进一步研究蛋白质复性机制,寻找更加温和的变性剂,减少蛋白质在复性过程中发生聚集。目前,开发易操作、新型高效且普适性好的蛋白质复性方法是生物工程下游纯化技术的研究热点,也是基因工程蛋白质产业化发展的需要[39]。
4 结论优化人源溶菌酶编码基因密码子在大肠杆菌菌株BL21(DE3)中成功诱导表达,并利用包涵体复性体系在复性液中同时添加浓度比为1:2的GSSG/GSH、4 mmol/L精氨酸和6%甘油时使用梯度透析法成功复性出人源溶菌酶,其比活力值为1 170 U/mg。
| [1] |
Fleming A. On a remarkable bacteriolytic element found in tissues and secretions[J]. Proceedings of the Royal Society of London, 1922, 93(653): 306-317. |
| [2] |
Kawai Y, Mickiewicz K, Errington J. Lysozyme counteracts β-lactam antibiotics by promoting the emergence of L-form bacteria[J]. Cell, 2018, 172(5): 1038-1049. DOI:10.1016/j.cell.2018.01.021 |
| [3] |
Ragland SA, Criss AK. From bacterial killing to immune modulation:Recent insights into the functions of lysozyme[J]. PLoS Pathogens, 2017, 13(9): e1006512. |
| [4] |
De ISC, De JM, Maia JA, et al. Milk from transgenic goat expressing human lysozyme for recovery and treatment of gastrointestinal pathogens[J]. European Journal of Pharmaceutical Sciences, 2018, 112: 79-86. DOI:10.1016/j.ejps.2017.11.005 |
| [5] |
Patel D, Kuyucak S. Computational study of aggregation mechanism in human lysozyme[D67H][J]. PLoS One, 2017, 12(5): e0176886. |
| [6] |
Yang B, Wang J, Tang B, et al. Characterization of bioactive recombinant human lysozyme expressed in milk of cloned transgenic cattle[J]. PLoS One, 2011, 6(3): e17593. DOI:10.1371/journal.pone.0017593 |
| [7] |
Sheng L, Wang J, Huang M, et al. The changes of secondary structures and properties of lysozyme along with the egg storage[J]. International Journal of Biological Macromolecules, 2016, 92: 600-606. DOI:10.1016/j.ijbiomac.2016.07.068 |
| [8] |
Ahe M, Hagan CL, Bernardo-Gancedo A, et al. The significance of the location of mutations for the native-state dynamics of human lysozyme[J]. Biophysical Journal, 2016, 111(11): 2358-2367. DOI:10.1016/j.bpj.2016.10.028 |
| [9] |
Zhu W, Silvrse R, Schwalbe H, et al. Reduced and mutant lysozyme refolding with lipid vesicles. Model study of disulfide impact on equilibria and dynamics[J]. Biochimica at Biophysica Acta(BBA)- Proteins and Proteomics, 2016, 1864(9): 1083-1092. DOI:10.1016/j.bbapap.2016.05.010 |
| [10] |
Oliver WT, Wells JE. Lysozyme as an alternative to antibiotics improves growth performance and small intestinal morphology in nursery pigs[J]. Journal of Animal Science, 2013, 91(7): 3129-3136. DOI:10.2527/jas.2012-5782 |
| [11] |
Zhang Z, Wang H, Wang H, et al. Fabrication and evaluation of molecularly imprinted magnetic nanoparticles for selective recognition and magnetic separation of lysozyme in human urine[J]. Analyst, 2018, 143(23): 5849-5856. DOI:10.1039/C8AN01746H |
| [12] |
Sandin L, Bergkvist L, Nath S, et al. Beneficial effects of increased lysozyme levels in Alzheimer's disease modelled in Drosophila melanogaster[J]. The FEBS Journal, 2016, 283(19): 3508-3522. DOI:10.1111/febs.13830 |
| [13] |
Wang SY, Ng TB, Chen TB, et al. First report of a novel plant lysozyme with both antifungal and antibacterial activities[J]. Biochemical & Biophysical Research Communications, 2005, 327(3): 820-827. |
| [14] |
Lee HS, Huang PL, Sun Y, et al. Lysozyme and RNases as anti-HIV components in beta-core preparations of human chorionic gonadotropin[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(6): 2678-2681. |
| [15] |
Parry RM, Chandan RC, Shahani KM. Isolation and characterization of human milk lysozyme[J]. Archives of Biochemistry & Biophysics, 1969, 130(1): 59-65. |
| [16] |
Chen Q, Li W, Wang J, et al. Lysozyme-antimicrobial peptide fusion protein promotes the diabetic wound size reduction in streptozotocin(stz)-induced diabetic rats[J]. Medical Science Monitor, 2018, 24: 8449-8458. DOI:10.12659/MSM.912596 |
| [17] |
Lu D, Li Q, Wu Z, et al. High-level recombinant human lysozyme expressed in milk of transgenic pigs can inhibit the growth of Escherichia coli in the duodenum and influence intestinal morphology of sucking pigs[J]. PLoS One, 2014, 9(2): e89130. |
| [18] |
Proctor VA, Cunningham FE. The chemistry of lysozyme and its use as a food preservative and a pharmaceutical[J]. Critical Reviews in Food Science & Nutrition, 1988, 26(4): 359-395. |
| [19] |
Eschenburg G, Heine W, Peters E. Fecal sIgS and lysozyme excretion in breast feeding and formula feeding[J]. Kinderarztl Prax, 1990, 58(5): 255-260. |
| [20] |
Zhu XA, Huang HT, Du K, et al. Progress of researches on lysozyme and its expression in oncomelania hupensis[J]. Chinese Journal of Schistosomiasis Control, 2016, 28(1): 108-110. |
| [21] |
Yu H, Chen J, Liu S, et al. Large-scale production of functional human lysozyme in transgenic cloned goats[J]. Journal of Biotechnology, 2013, 168(4): 676-683. DOI:10.1016/j.jbiotec.2013.10.023 |
| [22] |
Huang J, Wu L, Yalda D, et al. Expression of functional recombinant human lysozmye in transgenic rice cell culture[J]. Transgenic Research, 2002, 11(3): 229-239. |
| [23] |
Li G, Shi W, Chen G, et al. Construction and in vivo evaluation of a mammary gland-specific expression vector for human lysozyme[J]. Plasmid, 2014, 76: 47-53. DOI:10.1016/j.plasmid.2014.09.004 |
| [24] |
Mergulhao FJ, Summers DK, Monteiro GA. Recombinant protein secretion in Escherichia coli[J]. Biotechnology Advances, 2005, 23(3): 177-202. DOI:10.1016/j.biotechadv.2004.11.003 |
| [25] |
Palmer I, Wingfield PT. Preparation and extraction of insoluble(inclusion-body)proteins from Escherichia coli[J]. Current Protocols in Protein Science, 1995, 70(1): 6. 3. 1-6. 3. 20. |
| [26] |
Vasilescu A, Boulahneche S, Chekin F, et al. Porous reduced graphene oxide modified electrodes for the analysis of protein aggregation. Part 1:Lysozyme aggregation at pH 2 and 7. 4[J]. Electrochimica Acta, 2017, 254: 375-383. DOI:10.1016/j.electacta.2017.09.083 |
| [27] |
Wang S, Chang CK, Peng MJ, et al. Effect of glutathione redox system on lysozyme refolding in size exclusion chromatography[J]. Food & Bioproducts Processing, 2006, 84(1): 18-27. |
| [28] |
Desai A, Lee C, Sharma L, et al. Lysozyme refolding with cyclodextrins:structure-activity relationship[J]. Biochimie, 2006, 88(10): 1435-1445. DOI:10.1016/j.biochi.2006.05.008 |
| [29] |
方敏, 黄华樑. 包涵体蛋白体外复性的研究进展[J]. 生物工程学报, 2001, 17(6): 608-612. DOI:10.3321/j.issn:1000-3061.2001.06.003 |
| [30] |
Bisht M, Kumar A, Venkatesu P. Refolding effects of partially immiscible ammonium-based ionic liquids on the urea-induced unfolded lysozyme structure[J]. Physical Chemistry Chemical Physics Pccp, 2016, 18(18): 12419-12422. DOI:10.1039/C6CP01022A |
| [31] |
Kawai Y, Mickiewicz K, Errington J. Lysozyme counteracts β-lactam antibiotics by promoting the emergence of l-form bacteria[J]. Cell, 2018, 172(5): 1038-1049. DOI:10.1016/j.cell.2018.01.021 |
| [32] |
庞恋苏, 李亚男. 重组人溶菌酶的研究进展[J]. 中华老年口腔医学杂志, 2017(5): 306-309. DOI:10.3969/j.issn.1672-2973.2017.05.015 |
| [33] |
Calderón RP, Gonzalo-Garijo MA, Lamilla-Yerga A, et al. Recurrent angioedema due to lysozyme allergy[J]. J Investig Allergol Clin Immunol, 2007, 17(4): 264-266. |
| [34] |
Jigami Y, Muraki M, Harada N, et al. Expression of synthetic human-lysozyme gene in Saccharomyces cerevisiae:use of a synthetic chicken-lysozyme signal sequence for secretion and processing[J]. Gene, 1986, 43(3): 273-279. |
| [35] |
Takaki H, Asae T, Ryuji M, et al. Expression of human lysozyme in an insoluble form in yeast[J]. Gene, 1987, 56(1): 53-59. |
| [36] |
Maga EA, Cullor JS, Smith W, et al. Human lysozyme expressed in the mammary gland of transgenic dairy goats can inhibit the growth of bacteria that cause mastitis and the cold- spoilage of milk[J]. Foodborne Pathogens & Disease, 2006, 3(4): 384-392. |
| [37] |
Tong J, Wei H, Liu X, et al. Production of recombinant human lysozyme in the milk of transgenic pigs[J]. Transgenic Research, 2011, 20(2): 417-419. |
| [38] |
Mohan SS, Amulya KP. Solubilization and refolding of bacterial inclusion body proteins[J]. Journal of Bioscience and Bioengineering, 2005, 99(4): 303-310. DOI:10.1263/jbb.99.303 |
| [39] |
Ercan D, Demirci A. Recent advances for the production and recovery methods of lysozyme[J]. Critical Reviews in Biotechnology, 2015, 36(6): 1078-1088. |




