乳酸杆菌是一类对人体有益的微生物,通过定植在肠道上皮细胞,保护肠道免受病原微生物的侵害,常用于预防和治疗感染性腹泻,此外乳杆菌还有调节机体免疫功能、抗炎、抗氧化等功效[1]。利用益生菌代替抗生素治疗急慢性腹泻、便秘,保护肠道微生态平衡是治疗肠炎性疾病的新途径。临床常见的益生菌制剂如“金双歧”、“贝飞达”、“思连康”等已取得了良好的治疗效果[2]。临床应用最为广泛的两大类益生菌包括双歧杆菌和乳杆菌[3]。乳杆菌通过黏附在肠道内壁,并定植于肠道上皮细胞,降低肠道内pH,形成不利于病原微生物滋生的微环境,同时促进肠道黏膜的恢复,阻止病原微生物与肠上皮细胞的接触,从而抵御致病菌的侵袭[4-5]。研究表明,S-层蛋白是乳杆菌发挥益生功能的重要因子,S-层蛋白是细菌细胞壁的一种蛋白,分子量为40-200 kD,占细胞总蛋白的10%-15%。乳杆菌的S-层蛋白能够黏附于肠道上皮细胞,覆盖了病原菌与肠道上皮细胞结合的受体位点,从而抑制病原菌的黏附[6]。
Ren等[7]的研究表明,唾液乳杆菌(Lactobacillus salivarius)可抑制金黄色葡萄球菌(Staphylococcus aureus)对Caco-2细胞的黏附,当去除菌株的S-层蛋白后,抑制率由58%下降到4%;嗜酸乳杆菌(Lactobacillus acidophilus)的S层蛋白能够降解大肠杆菌表面的肽聚糖,进而抑制其对HT-29细胞的侵袭[8]。临床上使用益生菌制剂治疗细菌性肠炎已取得了良好的疗效,然而常规剂量的乳酸菌即使能定植于肠道其增值速度也很慢,难以覆盖整个肠道,大剂量的使用益生菌可能增加其移位的风险,引起不必要的炎症[9],同时抗生素类药物也能影响益生菌制剂的疗效[10],因此开发能够应用于临床的安全、稳定且不受抗生素影响的S-层蛋白制剂具有重要的意义。本研究提取获得嗜酸乳杆菌S-层蛋白,比较其对几种致病菌感染Caco-2的抑制效果,为后续开发该类产品提供实验依据。
1 材料与方法 1.1 材料嗜酸乳杆菌(Lactobacillus acidophilus)、致病性大肠杆菌(Enteropathogenic escherichia coli,EPEC)、金黄色葡萄球菌(Staphylococcus aureus,SAU)由本实验室保存。MRS培养基(北京陆桥技术股份有限公司)、盐酸左氧氟沙星(Sigma)、LiCl(Sigma)、DMEM/F12培养基(Hyclone)、胎牛血清(杭州四季青有限公司),其他试剂均为国产分析纯。
1.2 方法 1.2.1 菌种的发酵培养和S-层蛋白的提取和纯化嗜酸乳杆菌的培养采用三级发酵培养法,取冻干菌种1支,接种于MRS培养基中,38℃厌氧培养16 h,按5%的接种量传代活化,连续传两代得到三级发酵液,梯度稀释,平板计数法测定发酵液活菌数。
三级发酵液4℃、8 000 r/min离心收集菌体,用PBS洗两次,加入5 mol/L的LiCl,37℃、200 r/min摇床孵育1 h,4℃、8 000 r/min离心收集上清液,放入20 kD的透析袋中4℃透析24 h,期间换液3次,聚乙二醇浓缩,得到S-层蛋白粗提物浓缩液。使用Sephadex G-75凝胶柱进行纯化,用pH7.0、0.025 mol/L的Tris-HCl作为流动相平衡凝胶柱,上样,流动相洗脱,流速0.5 mL/min,每5 min换管收集洗脱液,酶标仪280 nm处检测吸光度,收集洗脱峰,浓缩得到S-层蛋白溶液。
取S-层蛋白粗提物和S-层蛋白溶液进行SDS-PAGE凝胶电泳,考马斯亮蓝染色,计算蛋白分子量。BCA法测定蛋白浓度,按照试剂盒说明书操作进行。
1.2.2 Caco-2细胞培养Caco-2细胞胰酶消化后接种于12孔板中,加入含10% FBS的DMEM/F12培养基,放置二氧化碳培养箱5% CO2、37℃静置培养。
1.2.3 不同浓度的S-层蛋白对致病菌的抑制作用选取致病性较强的大肠杆菌EPEC和金黄色葡萄球菌SAU为研究对象,考察不同浓度的S-层蛋白对两种菌的抑制作用。
Caco-2细胞用PBS清洗3次,加入细胞培养液,加入终浓度为1×108 CFU/mL的EPEC或SAU,放置二氧化碳培养箱37℃静置培养2 h,PBS清洗3次,加入细胞培养液,加入不同浓度(100、200、300 μg/mL)的S-层蛋白,以PBS为对照,放置二氧化碳培养箱37℃静置培养2 h,PBS清洗3次。加入终浓度为0.2%的Triton×100,反复吹打裂解细胞,保留菌体,梯度稀释与大肠杆菌显色培养基(鉴定EPEC)或金黄色葡萄球菌显色培养基(鉴定SAU)混匀,培养24 h平板计数,计算EPEC和SAU活菌数。
1.2.4 不同时间条件下S-层蛋白对致病菌的抑制作用同法考察EPEC或SAU侵袭Caco-2细胞0、1、2、4、6、8 h后,S-层蛋白干预2 h对EPEC或SAU的抑制作用。
1.2.5 嗜酸乳杆菌及S-层蛋白联合抗生素对致病菌的抑制作用同法考察在EPEC或SAU侵袭Caco-2细胞2 h后,1×108 CFU/mL的嗜酸乳杆菌或300 μg/mL的S-层蛋白联合抗生素(0.5%左氧氟沙星)干预2 h对EPEC或SAU的抑制作用。实验分组:(1)对照组;(2)嗜酸乳杆菌组;(3)S-层蛋白组;(4)抗生素组;(5)嗜酸乳杆菌+抗生素组;(6)S-层蛋白+抗生素组。
1.2.6 数据分析每组实验设4个重复,实验数据用SPSS 17.0处理,数据采用平均值±标准误差表示,组间比较采用t检验,P < 0.05和P < 0.01表示差异显著和极显著。
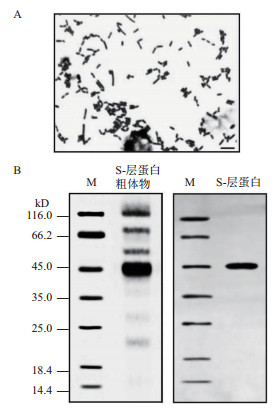
2 结果 2.1 嗜酸乳杆菌的培养及S-层蛋白的SDS-PAGE对嗜酸乳杆菌进行发酵培养,取三级发酵液显微镜下观察形态,结果(图 1-A)显示,菌体成短杆状,生长良好,可进行下一步实验。使用LiCl得到S-层蛋白粗提物,用Sephadex G-75凝胶柱纯化,并进行SDS-PAGE,结果(图 1-B)显示,在45 kD左右有清晰的条带,与文献中所描述的S-层蛋白分子量大小一致,且纯化后的S-层蛋白条带单一,可进行后续实验。
|
| A:嗜酸乳杆菌显微形态1000×,标尺=10 μm;B:S-层蛋白粗提物和S-层蛋白SDS-PAGE电泳图 图 1 嗜酸乳杆菌的培养及S-层蛋白的SDS-PAGE |
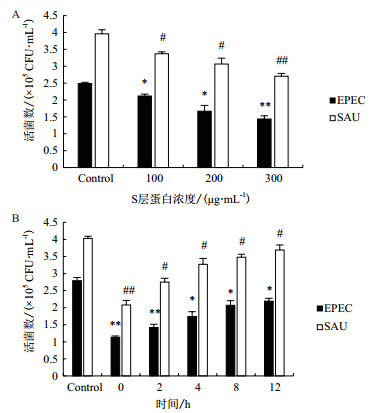
如图 2-A所示,培养好的Caco-2细胞分别经EPEC或SAU处理2 h后,再用不同浓度(100、200、300 μg/mL)的S-层蛋白干预2 h,平板计数EPEC或SAU的活菌数。结果显示,S-层蛋白可明显抑制EPEC或SAU对细胞的黏附,且程浓度依赖性,其中300 μg/mL的S-层蛋白抑制效果最好,对EPEC或SAU的抑制率分别达到42.2%、31.7%,抑制率%=(对照组活菌数-干预组活菌数)/对照组活菌数×100%。
|
| A:不同浓度的S-层蛋白对致病菌的抑制作用;B:致病菌作用不同时间条件下S层蛋白对致病菌的抑制作用(n=4,*/#P<0.05,**/##P<0.01,下同) 图 2 不同浓度的S-层蛋白和致病菌作用不同时间条件下的抑菌实验结果 |
如图 2-B所示,选取抑菌效果最好的300 μg/mL浓度的S-层蛋白,考察致病菌作用不同时间(0、2、4、8、12 h)后,S-层蛋白对EPEC或SAU的抑制作用。结果显示,S-层蛋白可明显抑制EPEC或SAU对细胞的黏附,且在致病菌侵袭短时间内干预效果明显,其中0 h,即EPEC或SAU与S-层蛋白同时加入对细菌的抑制作用最好,对EPEC或SAU的抑制率分别达到59.3%和48.4%。。
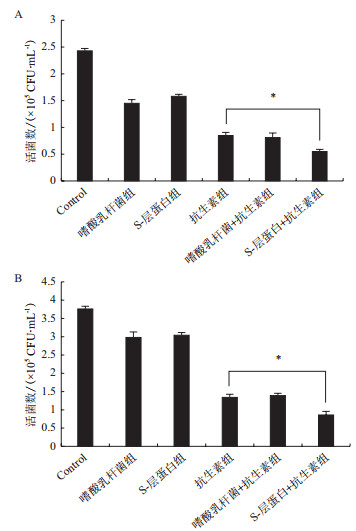
2.3 嗜酸乳杆菌及S-层蛋白联合抗生素对致病菌的抑制作用结果为了考察S-层蛋白对比嗜酸乳杆菌的抗菌效果,在EPEC(图 3-A)或SAU(图 3-B)作用Caco-2细胞2 h后,用嗜酸乳杆菌或S-层蛋白联合抗生素(0.5%左氧氟沙星)作用Caco-2细胞。结果显示,较对照组而言,嗜酸乳杆菌组、S-层蛋白组和抗生素组均可明显抑制EPEC或SAU对Caco-2细胞的侵袭,其中抗生素组的抑制效果最为明显。当联合用药后,嗜酸乳杆菌+抗生素组并没有显示出比抗生素组更强的抑菌效果,可能由于抗生素抑制了嗜酸乳杆菌的作用。S-层蛋白+抗生素组显示出比抗生素组有更强的抑菌效果,对EPEC和SAU抑菌率分别达到81.7%和78.3%,说明S-层蛋白可与抗生素联用,且效果优于单独使用抗生素。
|
| 图 3 嗜酸乳杆菌及S-层蛋白联合抗生素对EPEC(A)和SAU(B)的抑制作用结果 |
近年来,利用乳杆菌对抗病原微生物的入侵已成为研究的热点,乳杆菌的黏附定植是其发挥作用的前提,定植后的乳杆菌可以和肠道上皮细胞作用,形成保护层,阻止病原微生物与肠道的接触黏附,从而减轻肠炎类疾病的发生。研究表明,S-层蛋白是乳杆菌黏附肠道细胞的关键蛋白[11]。Johnson等[12]的研究显示,从瑞士乳杆菌(Lactobacillus helveticus)中提取的S-层蛋白可以抑制出血性大肠杆菌O157:H7对上皮细胞的黏附;同样Golowczyc等[13]的研究表明,克菲尔乳杆菌(Lactobacillus kefir)通过其表面的S-层蛋白保护了肠道免受肠炎沙门氏菌的损伤。本研究考察了嗜酸乳杆菌S-层蛋白在不同浓度和时间条件下对致病性较强的EPEC或SAU侵袭Caco-2细胞的干预作用,结果表明S-层蛋白可明显抑制EPEC或SAU的侵袭。在比较了嗜酸乳杆菌与S-层蛋白联合抗生素对致病菌的作用后发现,S-层蛋白与抗生素联用表现出协同抗菌作用,而嗜酸乳杆菌与抗生素联用则表现出拮抗作用。目前上市的益生菌活菌制剂均采用干粉状态保存,进入人体后必须定植于肠道,并利用肠道内的营养成分生长才能发挥益生作用,而抗生素会抑制益生菌的生长,从而影响其功能。S-层蛋白则避免了这种弊端,这也是本研究首次证明了嗜酸乳杆菌的S-层蛋白可以和抗生素联用,起到协同效果。
S-层蛋白具有基因多样性,即不同来源的S-层蛋白具有不同的晶格结构和生物学功能,乳杆菌的S-层蛋白是其具有定植和黏附功能的主要蛋白[14]。研究表明,一些种属的乳杆菌S-层蛋白能够裂解革兰氏阳性菌细胞壁,如嗜酸乳杆菌、瑞士乳杆菌和卷曲乳杆菌[15]。干酪乳杆菌(Lactobacillus casei)S-层蛋白能够显著抑制致病菌导致的HT-29细胞产生PGE2和NO。同时,能刺激HT-29细胞产生轻微的NF-ĸB核移位,也能一定程度上抑制S. sonnei引起的NF-ĸB核移位[16]。本研究显示嗜酸乳杆菌S-层蛋白与抗生素能够协同作用抑制EPEC或SAU,然而该菌的S-层蛋白是否有抵抗炎症的作用还有待进一步验证。S-层蛋白来源于安全性极高的乳酸菌,因此开发相关产品应用于临床具有较好的应用前景。
4 结论本研究证明了嗜酸乳杆菌S-层蛋白可浓度依赖性的抑制致病性大肠杆菌和金黄色葡萄球菌对Caco-2的侵袭,在致病菌感染初期干预最为有效,并且S-层蛋白与抗生素联用有协同抑菌效果,有望开发成为一种新型的抗菌药物。
| [1] |
郭远骥.乳杆菌菌株对人肠上皮细胞屏障功能的影响[D].大连: 大连工业大学, 2016.
|
| [2] |
曾庆.双歧杆菌乳杆菌三联活菌片通过提高肠道防御功能预防大肠杆菌K1株感染[D].广州: 南方医科大学, 2017.
|
| [3] |
Bautista-Gallego J, Ferrocino I, Botta C, et al. Probiotic potential of a Lactobacillus rhamnosus cheese isolate and its effect on the fecal microbiota of healthy volunteers[J]. Food Res Int, 2019, 119: 305-314. DOI:10.1016/j.foodres.2019.02.004 |
| [4] |
Ayyanna R, Ankaiah D, Arul V. Anti-inflammatory and antioxidant properties of probiotic bacterium Lactobacillus mucosae AN1 and Lactobacillus fermentum SNR1 in wistar albino rats[J]. Front Microbiol, 2018, 9: 3063. DOI:10.3389/fmicb.2018.03063 |
| [5] |
Vujkovic-Cvijin I, Swainson LA, Chu SN, et al. Gut-resident Lactobacillus abundance associates with IDO1 inhibition and Th17 dynamics in SIV-Infected macaques[J]. Cell Rep, 2015, 13(8): 1589-1597. DOI:10.1016/j.celrep.2015.10.026 |
| [6] |
Zhang YC, Zhang LW, Tuo YF, et al. Inhibition of Shigella sonnei adherence to HT-29 cells by lactobacilli from Chinese fermented food and preliminary characterization of S-layer protein involvement[J]. Res Microbiol, 2010, 161(8): 667-672. DOI:10.1016/j.resmic.2010.06.005 |
| [7] |
Ren D, Li C, Qin Y, et al. Inhibition of Staphylococcus aureus adherence to Caco-2 cells by lactobacilli and cell surface properties that influence attachment[J]. Anaerobe, 2012, 18(5): 508-515. DOI:10.1016/j.anaerobe.2012.08.001 |
| [8] |
Prado Acosta M, Mercedes Palomino M, Allievi MC, et al. Murein hydrolase activity in the surface layer of Lactobacillus acidophilus ATCC 4356[J]. Appl Environ Microbiol, 2008, 74(24): 7824-7827. DOI:10.1128/AEM.01712-08 |
| [9] |
Liong MT. Safety of probiotics:translocation and infection[J]. Nutr Rev, 2008, 66(4): 192-202. DOI:10.1111/j.1753-4887.2008.00024.x |
| [10] |
Goderska K, Agudo Pena S, Alarcon T. Helicobacter pylori treatment:antibiotics or probiotics[J]. Appl Microbiol Biotechnol, 2018, 102(1): 1-7. DOI:10.1007/s00253-017-8535-7 |
| [11] |
Prado Acosta M, Ruzal SM, Cordo SM. S-layer proteins from Lactobacillus sp. inhibit bacterial infection by blockage of DC-SIGN cell receptor[J]. Int J Biol Macromol, 2016, 92: 998-1005. DOI:10.1016/j.ijbiomac.2016.07.096 |
| [12] |
Johnson-Henry KC, Hagen KE, Gordonpour M, et al. Surface-layer protein extracts from Lactobacillus helveticus inhibit enterohaemorrhagic Escherichia coli O157:H7 adhesion to epithelial cells[J]. Cell Microbiol, 2007, 9(2): 356-367. DOI:10.1111/j.1462-5822.2006.00791.x |
| [13] |
Golowczyc MA, Mobili P, Garrote GL, et al. Protective action of Lactobacillus kefir carrying S-layer protein against Salmonella enterica serovar Enteritidis[J]. Int J Food Microbiol, 2007, 118(3): 264-273. DOI:10.1016/j.ijfoodmicro.2007.07.042 |
| [14] |
贾国东.嗜酸乳杆菌S层蛋白抗病毒感染特性研究[D].哈尔滨: 东北农业大学, 2013.
|
| [15] |
李鹏成, 杨倩, 侯继波. 乳酸杆菌S-层蛋白对产肠毒素大肠杆菌黏附Caco-2细胞的协同作用[J]. 江苏农业学报, 2017, 33(2): 384-388. |
| [16] |
石晓璐. L. casei Q8-LS层蛋白对HT-29细胞NF-κB通路相关蛋白的调控作用[D].哈尔滨: 哈尔滨工业大学, 2017.
|




