2. 贵州省农业科学院生物技术研究所,贵阳 550006
2. Guizhou Biotechnology Institute, Guizhou Academy of Agricultural Sciences, Guiyang 550006
镉(Cadmium,Cd)是一种能对人体造成巨大威胁的重金属污染物。据统计,我国农业土壤的Cd污染位点超标率已达7%,Cd已成为我国土壤重金属污染中的首要污染物[1]。Cd胁迫导致植物体内活性氧(Reactive oxygen species,ROS)含量上升,破坏叶绿体结构、抑制碳固定酶活性,并通过影响蛋白酶活性而导致细胞代谢紊乱等[2-3]。另外,Cd胁迫抑制营养元素吸收而导致植株生长受限[4]。同时还能通过食物链危害人体健康[5]。因此,研究缓解或解除植物中Cd毒害的措施及其机理,是当前国内外研究的热点问题。
硫(Sulfur,S)是植物体内胱氨酸、半胱氨酸、甲硫氨酸等的组成成分,而这些含硫氨基酸参与几乎所有蛋白质的合成,包括光合膜蛋白,因而对植物光合作用起着重要作用[6]。研究表明,半胱氨酸可通过其自身的抗氧化特性调节大麦氧化还原水平以缓解盐胁迫诱导的生长抑制[7]。充分的硫肥可保证充足的还原型谷胱甘肽(Glutathione,GSH)供应,以缓解因盐胁迫诱导的氧化胁迫对植物光合效率和生长的影响[8]。同时,植物对S的吸收和同化可促进蛋白源和非蛋白源硫醇的合成,以及铁胶膜(Iron plaque)的形成,从而提升植物对Cd的耐受性[9]。研究表明,添加外源S可以提升Cd胁迫下植物体内GSH的合成,降低ROS的积累,减少ROS对植物叶片基质蛋白和类囊体蛋白的攻击,调节气孔运动,从而增强植物的光合能力[6];提升植物螯合素(Phytochelatins,PCs)、金属耐受蛋白(Metallothioneins,MTs)的合成,并与Cd结合形成螯合物,降低Cd毒性[10-11]。因此,适量添加S肥对作物正常生长和缓解Cd毒过程具有重要意义。然而,当前对外源S是否影响与植物光合作用紧密相关的矿质元素的吸收,并揭示其与光合作用之间关联性的研究相对缺乏。
马齿苋(Portulaca oleracea L.)是中国古老的菜药兼用性肉质草本植物[12]。鉴于马齿苋的高营养保健功效,已经驯化出栽培型马齿苋品种,品质和口感均较野生型品种有所提高。但是,农业土壤Cd污染的加重,加之马齿苋对Cd具有较高的吸附效应,导致马齿苋的食用安全性大大降低[13]。因此,需要通过适当的措施,减少Cd向马齿苋叶片中的转移,提升其可食用性。当前对马齿苋对Cd胁迫生理生化响应机制的研究较少,更缺乏外源添加物影响马齿苋重金属耐受性的相关研究。本课题组前期研究发现外源S可以通过增强马齿苋体内乙烯信号传导途径,促进GSH的合成,而降低葡萄糖含量,从而缓解Cd胁迫诱导的氧化胁迫和葡萄糖介导的光合抑制作用,并降低马齿苋对Cd的吸收。然而,关于外源S促进Cd胁迫下马齿苋光合作用的内在机制仍未可知。
本研究以马齿苋为试材,探讨Cd胁迫下外源S对马齿苋叶片光合作用、叶绿素荧光参数和矿质营养的影响,以揭示在添加外源S的情况下,马齿苋矿质元素与光反应系统之间的关联性,为揭示外源S缓解重金属毒害提供理论依据。
1 材料与方法 1.1 材料供试马齿苋种子购自江苏长景种业有限公司(荷兰进口)。将马齿苋种子于35℃水浴浸种处理12 h,播于装有沙子的育苗盒(15穴,穴上口3.0 cm ×3.0 cm,穴底径3.0 cm×3.0 cm,穴深4 cm)中,置于人工气候培养箱(LRH-800-GS,天津市福元铭仪器设备有限公司)中栽种。培养箱条件:14 h白天/10 h黑夜,昼夜温度为30℃/25℃,相对湿度75%,光强设置为500 µmol/(m2·s)。前期每天用自来水浇水一次,生长一周后改用1/2 Hoagland营养液的营养液(pH6.0)浇水,浇水量以使沙子充分湿润为准。待马齿苋幼苗长至10 cm左右时,选择长势良好和长势一致的植株进行试验处理。
前期试验研究发现,马齿苋最适Cd处理浓度和S处理浓度分别为100和400 mg/L。本研究设置3个处理:1/2 Hoagland营养液(CK)、1/2 Hoagland营养液+100 mg/L CdCl2(T1)和1/2 Hoagland营养液+100 mg/L CdCl2+400 mg/L(NH4)2SO4培养液(T2)。为排除NH4+的影响,在CK和T1组均添加相同浓度的NH4Cl。每个处理8盆,每盆种植15株。胁迫处理15 d后进行指标参数测定,每个指标测定生物学重复3次,取平均值。
1.2 方法 1.2.1 叶绿素含量的测定称取植株中上部功能叶片0.5 g于4℃预冷的研钵中,加入5 mL 80%的预冷丙酮和少许MgCO3,于冰上避光条件下研磨至匀浆,转入10 mL离心管中,残渣用5 mL 80%的丙酮洗入离心管中。4 000 r/min 4℃离心后,上清液转入25 mL容量瓶中。按上述方法对残渣沉淀用80%丙酮进行重悬浮、离心,直至沉淀呈白色为止。定容后,采用722S型可见分光光度计(上海添时科学仪器有限公司)分别测定645和663 nm波长下叶绿素提取液的吸光值,采用以下公式计算叶绿素含量[14]:
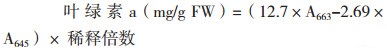 (1.1)
(1.1)
 (1.2)
(1.2)
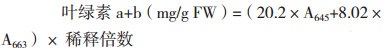 (1.3)
(1.3)
式中,FW表示鲜重。
1.2.2 光合参数测定利用LI-6400XT便携式光合测定仪(LI-COR公司,美国)测定不同处理下马齿苋叶片的光合速率(Net photosynthesis rate,Pn)、蒸腾速率(Transpiration rate,Tr)、气孔导度(Stomatal conductance,Gs)、胞间二氧化碳浓度(Intercellular CO2 concentration,Ci),使用人工光源,光强为1 000 μmol/(m2·s)。
1.2.3 叶片荧光参数的测定用配有荧光叶室的LI-6400XT便携式光合系统(LI-COR公司,美国)测定成熟叶片的净光合和荧光-光强响应曲线及暗呼吸速率(Dark respiration rate,R)。设定如下参数:气孔比率为0,参比室CO2浓度为400 μmol/mol,气体流速300 μmol/s,干燥管全旁路,气温30℃。参照万雪琴等[15]方法测定各处理条件下马齿苋叶片的初始荧光(Fo)、最大荧光(Fm)、恒态荧光(Fs)、能化类囊体最大荧光(F'm)、能化类囊体最小荧光(F'o)和气体交换参数。具体操作如下:(1)将叶片放于叶室中,暗适应30 min后,记录暗呼吸速率。然后在开启荧光记录(Fluorescence recording)的同时,于中心波长为630 nm处,测定Fo值。然后用中心波长为630 nm,光强为8 000 μmol/(m2·s)的饱和光测定Fm;(2)用强调为1 000 μmol/(m2·s)的测定光持续照光20 min,测得Fs,然后用8 000 μmol/(m2·s)的饱和光(同上)测得F'm,最后在暗脉冲(即中心波长为740 nm的远红光,同时关闭LED光化学光)的作用下测得F'o。
用光强 < 100 μmol/(m2·s)范围内的光响应回归直线方程求算光补偿点(Light compensation point,LCP)、光饱和点(Light saturation point,LSP)、表观量子效率(Apparent quantum efficiency,AQE);用通过拟合各处理的光响应曲线求得的回归方程,计算出净光合速率达到最大光合速率90%处的光强作为光饱和点。其他光合参数计算如下:
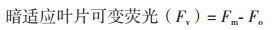 (1.4)
(1.4)
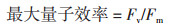 (1.5)
(1.5)
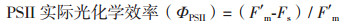 (1.6)
(1.6)
 (1.7)
(1.7)
 (1.8)
(1.8)
 (1.9)
(1.9)
其中,PFD表示光强,α是叶片对入射光的吸收比率常数,取值0.85。
1.2.4 Cd含量与矿质元素含量测定收集胁迫处理后的马齿苋叶片,称取鲜重,110℃杀青1 h、70℃恒温干燥、称重。干样用HNO3-HClO4(4:1 V/V)消煮(160℃)至澄清,定容以后,利用AA370MC型原子吸收分光光度计测定各组织中的Ca、Mg、Fe、Cu和Mn等矿质元素含量[16]。
1.2.5 数据统计所得数据以平均值±标准差(n=3)表示。采用SPSS18.0对试验数据进行统计分析,各处理间数据采用方差分析(One way ANOVA),利用最小显著差(Least significant difference,LSD)法检验差异显著性(P≤0.05),采用excel 2007作图。
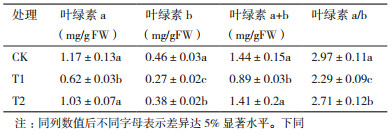
2 结果 2.1 外源S对Cd胁迫下马齿苋叶片叶绿素含量的影响由表 1可知,与对照相比,100 mg/L Cd处理使马齿苋叶片中的叶绿素a、叶绿素b和叶绿素a+b的含量分别降低47.01%、41.30%和38.19%,叶绿素a/b比值则显著降低22.90%。而添加外源S以后,与Cd处理(T1)相比,叶绿素a、叶绿素b和叶绿素a+b含量显著上升,叶绿素a/b比值显著增加,其中,叶绿素a含量几乎恢复至对照水平(表 1)。
由图 1看出,与对照相比,Cd处理15 d后,马齿苋叶片的Pn、Tr和Gs分别降低196.18%、165.65%和74.57%,而Ci则显著提升70.96%。与Cd处理(T1)相比,外施400 mg/L(NH4)2SO4处理(T2)导致马齿苋叶片的Pn、Tr和Gs分别提升96.45%、79.94%和27.53%,Ci值则显著降低30.92%。表明外源S可以缓解Cd胁迫对马齿苋叶片光合作用的影响。

|
| 方柱上不同字母表示差异达5%显著水平。下同 图 1 外源S对Cd胁迫下马齿苋叶片净光合速率Pn、蒸腾速率Tr、气孔导度Gs和胞间CO2浓度Ci的影响 |
马齿苋叶片的最大净光合速率(Pnmax)、光饱和点(LSP)、表观量子效率(AQE)和呼吸速率(R)在Cd处理以后,与对照相比,分别降低182.31%、134.07%、205.56%、107.14%,光补偿点(LCP)则上升150.96%(表 2)。与Cd处理(T1)相比,添加外源S可使Pnmax、LSP、AQE和R分别提升93.86%、96.06%、155.56%和59.52%,而LCP则降低47.38%。结果表明,外源S可显著促进Cd胁迫下马齿苋叶片的碳同化能力和新陈代谢速率。
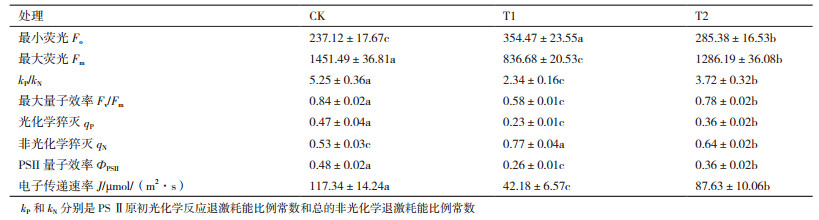
与对照(CK)相比,Cd处理(T1)可使马齿苋在暗适应下的叶绿素最小荧光(Fo)显著提升49.49%,而光适应下的kP/kN、最大荧光(Fm)、PSⅡ最大量子效率(Fv/Fm)、实际量子效率(ΦPSII)和电子传递速率(J)分别降低55.43%、42.36%、31.11%、45.83%和64.05%(表 3)。另外,Cd处理导致非化学猝灭系数(qN)显著提升45.28%,而化学猝灭系数(qP)则下降51.06%(表 3)。在添加外源S以后,与Cd处理(T1)相比,Fo和qN分别降低19.49%和16.88%,而kP/kN、Fm、Fv/Fm、ΦPSⅡ和J则分别提升53.73%、58.97%、35.01%、56.52%、38.46%和107.75%(表 3)。
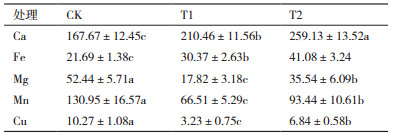
与CK相比,Cd处理(T1)可使马齿苋叶片Ca、Fe含量分别提升25.52%和40.02%,而Mg、Mn、Cu含量则分别降低194.28%、96.88%和217.96%(表 4)。与Cd处理(T1)相比,外施400 mg/L(NH4)2SO4(T2)可使Ca、Fe含量显著提升23.13%和35.27%,同时可使Mg、Mn、Cu含量分别提升99.44%、40.49%和111.76%(表 4)。结果表明,外源S可以显著提升马齿苋对矿质元素的吸收,从而增强其在Cd胁迫环境中的光合作用。
植物受到重金属胁迫时,典型症状就是抑制叶绿素的合成,导致叶色黄化,从而显著抑制植物的光合作用。因此,叶绿素含量常作为判断植物抗逆性能的重要指标[17]。本研究表明,Cd胁迫可显著降低马齿苋叶片叶绿素a、叶绿素b和叶绿素a+b含量,同时降低叶绿素a/b比值,而外源S则可使叶绿素a、叶绿素b和叶绿素a+b含量以及叶绿素a/b比值上升,表明外源S可通过增强马齿苋叶绿素的合成增强马齿苋的抗Cd性。这与外源S可促进Cd胁迫下小白菜叶绿素合成的研究结果一致[18]。
通常情况下,逆境胁迫引起植物光合速率下降的主要原因可归为两类:一是受气孔导度(Gs)影响的气孔因素;二是受叶肉细胞光合活性影响的非气孔因素[19-20]。Farquhar等[21]认为当Pn、Gs和Ci值在逆境中同时降低,则表明气孔因素是抑制Pn的主要原因;若植物叶片Pn值下降,而Ci值却上升,则表明光合作用的抑制是由非气孔因素引起的。本研究显示,Cd处理15 d后,马齿苋叶片的Pn、Gs值显著下降,而Ci值显著上升,表明非气孔因素是Cd胁迫诱导马齿苋叶片光合效率下降的主要因素。外施S能显著提升Cd胁迫下马齿苋叶片Pn、Tr和Gs值,从而提升了马齿苋叶肉细胞光合活性,提升光合速率。Khan等[22]和Masood等[23]均发现Cd胁迫下印度芥菜叶片Pn、Gs和Ci值均显著降低;外源S可显著提升Cd胁迫下印度芥菜叶片Pn、Tr和Gs值,促进光合作用,表明气孔因素是Cd诱导印度芥菜光合抑制的主要原因,同时也说明不同植物响应Cd胁迫时所采用的机制不同。
叶绿体的主要作用是将吸收的光能通过光合电子传递、叶绿素荧光和热耗散3种途径进行消化,因而逆境胁迫中植物叶片荧光参数的变化可以反映光合作用的情况[24-25]。Fv/Fm和Fo的变化可作为鉴别植物抗逆性的重要指标,而qP和qN则分别表示PSII天线色素吸收的光能用于光合电子传递的光能和以热能形式消耗的光能[26]。本研究发现,Cd处理可使马齿苋叶片Fo和qN显著增加,而kP/kN、Fm、Fv/Fm、ΦPSII、电子传递速率(J)和qP显著下降(表 3)。添加外源S则可显著降低Fo和qN值,而kP/kN、Fm、Fv/Fm、ΦPSII、J和qP则显著上升(表 3)。Fm随被激发的叶绿素分子数量的增加而上升,因而Cd处理下马齿苋叶片Fm的降低与叶绿素分子减少有关[15],这与本研究中叶绿素a和叶绿素b含量降低的结果一致。Cd处理下Fo的上升和kP/kN的下降表明被叶绿素吸收的能量转化成电能(电子传递)的比例下降,这与单位面积叶绿素分子数量减少,使光能在天线色素分子间的传递效率显著降低有关,同时与PSII反应中心数量减少或遭破坏而导致捕获天线色素分子传来的能量效率降低紧密相关[15]。Cd胁迫下马齿苋叶片qN的上升和qP的降低,表明天线色素分子所捕获的光能主要以热量而散失掉,从而导致ΦPSII和J的显著降低,导致PSII反应中心的电子供体侧的电子传递障碍。而添加外源S,则可提升qP值而降低qN值,增强天线色素分子对光能的捕获和传递效率,从而促进马齿苋叶片PSII光反应系统。
前人对Cd处理导致植物叶片黄化的原因总结为3类:一是认为Cd胁迫降低植物对Fe、Mg等矿质元素的吸收,直接抑制叶绿素的合成而失绿[27];二是认为Cd胁迫抑制植物对Mn的吸收而间接抑制叶绿素的生物合成[28];三是Cd胁迫破坏叶绿体结构破坏和合成受阻,间接导致失绿症[29]。本研究发现Cd处理后马齿苋叶片中Ca和Fe含量显著上升,而Mg、Mn、Cu含量显著降低,添加外源S则可使5种矿质元素含量均显著上升,表明Cd处理导致的马齿苋叶片失绿不是Fe、Ca亏缺引发的,而与Mg、Mn和Cu的缺乏有关。Mg是叶绿素分子的直接组成成分,参与诱导类囊体光合膜垛叠成基粒,对提高PSII的相对荧光产量、活性、原初光能转化效率和叶绿体电子传递速率具有重要作用[30];Mn是许多碳固定相关酶(如柠檬酸脱氢酶、草酰琥珀酸脱氢酶)的活化剂,Mn聚集体和3条多肽链构成的复合体帽结构是PSII氧化端最主要的结构单元-放氧复合体(OEC)的重要组成部分,Mn聚集体的破坏可抑制水的光解和电子传递[15, 31-32];Cu是是光合作用电子传递链中质蓝素(Plastocyanin)的组成成分,铜的亏缺可导致光合电子传递活力下降[32]。因此,Cd处理后Mg、Mn、Cu含量的降低是导致马齿苋叶片黄色症状、光合效能和光合电子传递下降的主要原因。Matraszek等[33-35]研究发现Cd胁迫诱导的小麦、白芥菜、莴笋叶片N、P、K、Ca、Mg等离子的降低,抑制植物生长,而外施S则可促进这些植物对营养元素的吸收。本试验表明外源S显著促进马齿苋对Ca、Fe、Mg、Mn、Cu的吸收,推断外源S提高叶绿素含量的原因可能是通过提高对Fe、Mg、Mn、Cu等的吸收和运输,促进其向叶绿体的分配,从而增强马齿苋叶片叶绿素的合成和叶绿体结构的完整性,维持马齿苋稳定的光合速率和PSII光反应系统功能,以抵御Cd胁迫环境。
4 结论从光合作用层面,外源S诱导马齿苋Cd胁迫耐性的可能机理为:(1)增强马齿苋叶片叶绿素a、叶绿素b的合成;(2)提升Cd胁迫下马齿苋叶片Pn、Tr和Gs值,通过抑制非气孔因素引起的马齿苋叶肉细胞光合活性降低,提升光合速率;(3)提升qP值而降低qN值,提升天线色素分子对光能的捕获和传递效率,增强马齿苋叶片PSⅡ光反应系统;(4)促进马齿苋对Ca、Fe、Mg、Mn、Cu的吸收,促进叶绿素的合成、叶绿体和放氧复合体结构稳定性和质蓝素的合成,提高PSII的相对荧光产量、活性和原初光能转化效率,以及水的光解和PSⅡ电子传递速率,从而增强光合作用。
| [1] |
李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农学通报, 2015, 21(24): 104-107. DOI:10.3969/j.issn.1007-7731.2015.24.044 |
| [2] |
Kováčik J, Babula P, Klejdus B, et al. Comparison of oxidative stress in four Tillandsia species exposed to cadmium[J]. Plant Physiology & Biochemistry, 2014, 80: 33-40. |
| [3] |
Choppala G, Ullah S, Bolan N, et al. Cellular mechanisms in higher plants governing tolerance to cadmium toxicity[J]. Critical Reviews in Plant Sciences, 2014, 33(5): 374-391. DOI:10.1080/07352689.2014.903747 |
| [4] |
Rizwan M, Ali S, Adrees M, et al. A critical review on effects, tolerance mechanisms and management of cadmium in vegetables[J]. Chemosphere, 2017, 182(5): 90-105. |
| [5] |
Chaney RL. How does contamination of rice soils with Cd and Zn cause high incidence of human Cd disease in subsistence rice farmers[J]. Current Pollution Reports, 2015, 1(1): 13-22. DOI:10.1007/s40726-015-0002-4 |
| [6] |
Huguet S, Bert V, Laboudigue A, et al. Cd speciation and localization in the hyperaccumulator Arabidopsis halleri[J]. Environmental & Experimental Botany, 2012, 82(5): 54-65. |
| [7] |
Verbruggen N, Hermans C, Schat H. Molecular mechanisms of metal hyperaccumulation in plants[J]. New Phytologist, 2009, 181(4): 759-776. DOI:10.1111/j.1469-8137.2008.02748.x |
| [8] |
薛洪宝, 常华兰, 陶兆林, 等. 玉米发芽过程中Cd和硫醇化合物相互作用的研究[J]. 农业环境科学学报, 2011, 30(5): 824-829. |
| [9] |
Cobbett CS. Phytochelatins and their roles in heavy metal detoxification[J]. Plant Physiology, 2000, 123(3): 825-832. DOI:10.1104/pp.123.3.825 |
| [10] |
Khan NA, Singh S, Umar S. Sulfur assimilation and abiotic stress in plants[M]. Berlin: Springer-Verlag, 2008.
|
| [11] |
Lou L, Kang J, Pang H, et al. Sulfur protects pakchoi(Brassica chinensis L.)seedlings against cadmium stress by regulating ascorbate-glutathione metabolism[J]. International Journal of Molecular Sciences, 2017, 18(8): 1628. DOI:10.3390/ijms18081628 |
| [12] |
洪立洲, 王茂文, 丁海荣, 等. NaCl胁迫对马齿苋光合作用及叶绿素荧光特性的影响[J]. 西北植物学报, 2011, 31(12): 2516-2521. |
| [13] |
陈艳.不同苋菜品种对重金属累积差异和机制初探[D].广州: 暨南大学, 2013.
|
| [14] |
Arnon DI. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris[J]. Plant Physiology, 1949, 24(1): 1-15. DOI:10.1104/pp.24.1.1 |
| [15] |
万雪琴, 张帆, 夏新莉, 等. 镉处理对杨树光合作用及叶绿素荧光参数的影响[J]. 林业科学, 2008, 44(6): 73-78. DOI:10.3321/j.issn:1001-7488.2008.06.013 |
| [16] |
谭明明, 贺忠群, 郑万刚. 嫁接对铜胁迫下甜瓜幼苗光合特性与矿质元素吸收的影响[J]. 华北农学报, 2014, 29(5): 186-192. |
| [17] |
张帆, 万雪琴, 翟晶. 镉处理下增施氮对杨树叶绿素合成和叶绿体超微结构的影响[J]. 核农学报, 2013, 28(3): 485-491. |
| [18] |
梁泰帅, 刘昌欣, 康靖全, 等. 硫对镉胁迫下小白菜镉富集、光合速率等生理特性的影响[J]. 农业环境科学学报, 2015, 34(8): 1455-1463. |
| [19] |
洪立洲, 王茂文, 丁海荣, 等. NaCl胁迫对马齿苋光合作用及叶绿素荧光特性的影响[J]. 西北植物学报, 2011, 31(12): 2516-2521. |
| [20] |
Zhang SY, Zhang GC, Liu X, et al. The responses of photosynthetic rate and stomatal conductance of Fraxinus rhynchophylla to differences in CO2 concentration and soil moisture[J]. Photosynthetica, 2013, 51(3): 359-369. |
| [21] |
Farquhar GD, Sharkey TD. Stomatal conductance and photosynth-esis[J]. Annual Review of Plant Physiology, 1982, 33(1): 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [22] |
Khan NA, Mohd A, Per TS, et al. Ethylene potentiates sulfur-mediated reversal of cadmium inhibited photosynthetic responses in mustard[J]. Frontiers in Plant Science, 2016, 7: 1628. |
| [23] |
Masood A, Khan MIR, Fatma M, et al. Involvement of ethylene in gibberellic acid-induced sulfur assimilation, photosynthetic responses, and alleviation of cadmium stress in mustard[J]. Plant Physiology and Biochemistry, 2016, 104: 1-10. DOI:10.1016/j.plaphy.2016.03.017 |
| [24] |
Hendrickson L, Furbank RT, Chow WS. A simple alternative approach to assessing the fate of absorbed light energy using chlorophyll fluorescence[J]. Photosynthesis Research, 2004, 82(1): 73-81. |
| [25] |
Losciale P, Hendrickson L, Grappadelli LC, et al. Quenching partitioning through light-modulated chlorophyll fluorescence:A quantitative analysis to assess the fate of the absorbed light in the field[J]. Environmental and Experimental Botany, 2011, 73(1): 73-79. |
| [26] |
Demmig-Adams B, Adams Ⅲ WW, Barker DH, et al. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation[J]. Physiologia Plantarum, 2008, 98(2): 253-264. DOI:10.1034/j.1399-3054.1996.980206.x |
| [27] |
Boscaiu M, Bautista I, Donat P, et al. Plant responses to abiotic stress[J]. Current Opinion in Biotechnology, 2011, 22(3): S130-S130. |
| [28] |
Schützendübel A, Polle A. Plant responses to abiotic stresses:Heavy metal-induced oxidative stress and protection by mycorrhization[J]. Journal of Experimental Botany, 2002, 53(372): 1351-1365. |
| [29] |
Li L, Ai S, Li Y, et al. Exogenous silicon mediates alleviation of cadmium stress by promoting photosynthetic activity and activities of antioxidative enzymes in rice[J]. Journal of Plant Growth Regulation, 2017, 37(2): 602-611. |
| [30] |
Laing W, Greer D, Sun O, et al. Physiological impacts of Mg deficiency in Pinus radiata:Growth and photosynthesis[J]. New Phytologist, 2000, 146(1): 47-57. DOI:10.1046/j.1469-8137.2000.00616.x |
| [31] |
Popelkova H, Boswell N, Yocum C. Probing the topography of the photosystem Ⅱ oxygen evolving complex:PsbO is required for efficient calcium protection of the manganese cluster against dark-inhibition by an artificial reductant[J]. Photosynthesis Research, 2011, 110(2): 111-121. |
| [32] |
Lysenko EA, Klaus AA, Kartashov AV, et al. Distribution of Cd and other cations between the stroma and thylakoids:a quantitative approach to the search for Cd targets in chloroplasts[J]. Photosynthesis Research, 2018, 139(1/3): 337-358. |
| [33] |
Matraszek R, Chwil S, Hawrylak-Nowak B, et al. Effect of sulphur and cadmium on macronutrient balance in spring wheat[J]. Proceedings of the National Academy of Sciences of the USA, 2015, 87(3): 927-936. |
| [34] |
Matraszek R, Hawrylak-Nowak B, Chwil S, et al. Interaction between cadmium stress and sulphur nutrition level on macronutrient status of Sinapis alba L.[J]. Water, Air, & Soil Pollution, 2016, 227(9): 355. |
| [35] |
Matraszek R, Hawrylak-Nowak B, Chwil S, et al. Macroelemental composition of cadmium stressed lettuce plants grown under conditions of intensive sulphur nutrition[J]. Journal of Environmental Management, 2016, 180: 24-34. DOI:10.1016/j.jenvman.2016.05.017 |