2. 西北农林科技大学动物科技学院,杨凌 712100;
3. 新乡医学院全过程教学基地,新乡 453000;
4. 新乡医学院第一临床学院,新乡 453000;
5. 新乡医学院法医学院,新乡 453000
2. College of Animal Science and Technology, Northwest A & F University, Yangling 712100;
3. Whole Process Teaching Base, Xinxiang Medical University, Xinxiang 453000;
4. First Clinical College, Xinxiang Medical University, Xinxiang 453000;
5. School of Forensic Medicine, Xinxiang Medical University, Xinxiang 453000
上皮钠通道(Epithelial sodium channel,ENaC)是阿米洛利敏感性钠离子通道[1],广泛分布于肺泡上皮细胞中,其主要功能是将Na+从顶膜摄入到极化的上皮细胞[2],该过程伴随着水和Cl-的重吸收[3],在肺泡腔水肿液清除(Alveolar fluid clearance,AFC)中起重要作用[4-5]。其中α亚基是ENaC的功能亚基,全身性敲除α-ENaC基因的小鼠因不能有效清除肺内羊水而在出生40 h内死亡[6]。对出生1 h的小鼠通过siRNA干扰α-ENaC基因的表达,肺泡腔水肿液显著增加,同时小鼠的死亡率增加了4倍[7]。人的α-ENaC基因的某些碱基的突变,会导致肺泡腔液体不能有效清除而引起呼吸窘迫综合征[8]。因此,肺泡α-ENaC蛋白的功能状态对肺水清除有重要的影响。
近年来人们在HepG2细胞、神经干细胞中研究还发现,α-ENaC蛋白还可能通过调控Na+流对细胞增殖产生影响[9-10]。同时α-ENaC蛋白还与雄性生殖系统有密切的联系,可能参与精子活力的调控[11]。因此α-ENaC蛋白具有许多重要的生离的Ⅱ型肺泡理功能。大鼠肺的α-ENaC蛋白主要分布于Ⅰ型和Ⅱ型肺泡上皮细胞[12]。Ⅱ型肺泡上皮细胞是肺泡上皮细胞的干细胞[13],在肺损伤时增生转化为Ⅰ型肺泡上皮细胞[14]。因此研究α-ENaC蛋白在Ⅱ型肺泡上皮细胞中的作用具有重要的意义。但是原代分离的Ⅱ型肺泡上皮细胞,在体外培养时,随着时间的推移,会逐渐分化为Ⅰ型肺泡上皮细胞,而失去Ⅱ型肺泡上皮细胞的一些生物学活性。L2细胞保留了大鼠Ⅱ型肺泡上皮细胞的主要特征,是大鼠Ⅱ型肺泡上皮细胞系。本实验利用CRISPR/Cas9技术构建敲除L2细胞α-ENaC基因的细胞株,这将为研究α-ENaC蛋白在Ⅱ型肺泡上皮细胞中的生物学功能提供基础。
1 材料与方法 1.1 材料CRISPR/Cas9骨架载体pll3.7-mU6-CMV-NLS-huCAS9-NLS(Cas9-Wild)、扩增导向RNA(guide RNA,gRNA)的载体JMB81-SP1.gRNA.opti和SSA-RPG报告载体骨架均来自西北农林科技大学动物科技学院张智英老师实验室[15-16];L2细胞(大鼠Ⅱ型肺泡上皮细胞)购自美国ATCC;限制性内切酶购自美国NEB;Protein ladder(美国Thermo Fisher Scientific,26617);DNA Marker(北京全式金生物技术有限公司,BM121);质粒提取试剂盒(美国Omega,D6943-01*);琼脂糖凝胶回收试剂盒(美国Omega,D2500-01);pMDTM19-T载体克隆试剂盒(日本TaKaRa,6013);胎牛血清(以色列BI,04-001-1ACS);F-12K培养基(美国ATCC,30-2004);兔源SCNN1A(α-ENaC)抗体(美国Affinity,DF9199);辣根酶标记的羊抗兔IgG抗体(美国Affinity,S0001);鼠源β-actin抗体(美国BOSTER,BM0627)和辣根酶标记的羊抗鼠IgG抗体(美国Biolegend,405306,);Lipofectamine®2000转染试剂(美国Thermo Fisher Scientific,11668-019);CCK-8试剂盒(中国US EVERBRIGHT INC,C6005)。
1.2 方法 1.2.1 CRISPR/Cas9表达载体的构建利用在线分析软件(http://benchling.com),在α-ENaC基因的第一外显子选择3个靶位点:GCATGGGCTGAGGA-GGACAAGGG,CAACAACACCACCATCCACGGGG和TGTCCTCCTCAGCCCATGCAAGG。3个靶位点的位置如图 1所示。上游引物分别为gRNA-α-ENaC-F1,gRNA-α-ENaC-F2和gRNA-α-ENaC-F3,下游引物同为gRNA-α-ENaC-R,引物序列见表 1。以JMB81-SP1.gRNA.opti为模板,利用TouchDown程序PCR扩增gRNA-α-ENaC。将gRNA-α-ENaC用BsaΙ和XhoΙ双酶切插入到BamHΙ和XhoΙ双酶切后的Cas9-Wild骨架中,得到靶向α-ENaC基因的CRISPR/Cas9表达载体α-ENaC.CRISPR/Cas9。

|
| 黑色划线部分表示靶位点,红色字体部分表示PAM序列 图 1 α-ENaC基因3个靶位点位置 |
SSA-RPG报告载体骨架示意图如图 2所示。载体中含有一个发红光的DsRed基因,用于反应转染效率。CAG启动子启动通过剪切肽T2A融合的PuroR和eGFP基因,PuroR基因中间插入靶位点而被打断,靶位点两侧是重复序列,因此PuroR和eGFP不表达(图 2-A),当靶位点被切割后,PuroR通过细胞内源的单链退火(Single-strand anealing,SSA)修复机制,恢复表达,eGFP随之表达,细胞表现出Puro抗性并发出绿色荧光(图 2-B),因此绿色荧光可以反应核酸酶的切割活性。

|
| A:PuroR修复前;B:PuroR修复后 图 2 SSA-RPG报告载体示意图 |
构建3组报告载体的靶点引物分别为:target-α-ENaC-F1和target-α-ENaC-R1;target-α-ENaC-F2和target-α-ENaC-R2;target-α-ENaC-F3和target-α-ENaC-R3,引物序列见表 1。为了便于检测,在靶位点前面插入XhoΙ酶切位点。将target-α-ENaC-F/ target-α-ENaC-R引物拟合后,插入到NotΙ和BamHΙ双酶切后的SSA-RPG报告载体骨架中,获得α-ENaC基因的报告载体α-ENaC.SSA-RPG。
1.2.3 HEK293T细胞转染及CRISPR/Cas9表达载体的活性检测HEK293T细胞用含10%胎牛血清的DMEM培养基培养,细胞密度达到80%时,利用Lipofectamine®2000进行转染。转染3组,转染质粒分别为:α-ENaC.CRISPR/Cas9-1+α-ENaC.SSA-RPG-1,α-ENaC.CRISPR/Cas9-2+α-ENaC.SSA-RPG-2,α-ENaC.CRISPR/Cas9-3 + α-ENaC.SSA-RPG-3。48 h后在荧光显微镜下观察荧光表达,并用流式细胞仪对DsRed+和GFP+阳性细胞进行计数。DsRed+代表被转染的细胞,DsRed+ GFP+代表CRISPR/Cas9表达载体有活性的细胞,因此DsRed+ GFP+/DsRed+代表CRISPR/Cas9表达载体活性的大小。
1.2.4 L2细胞转染L2细胞用含10%FBS的F-12K培养基培养,转染条件同HEK293T细胞。转染两组质粒,对照组质粒Cas9-wild+α-ENaC.SSA-RPG-3和以上筛选出的CRISPR/Cas9活性较高的实验组质粒α-ENaC.CRISPR/Cas9-3+ α-ENaC.SSA-RPG-3。
1.2.5 嘌呤霉素筛选L2细胞转染48 h后,细胞中加入终浓度为3 μg/mL的嘌呤霉素进行筛选,每天换液,连续筛选5 d,将细胞移入10 cm的培养皿中,撤去嘌呤霉素继续培养至长出单克隆。
1.2.6 Western Blot检测将单克隆细胞扩大培养后,裂解液4℃裂解,12 000 r/min离心,提取总蛋白,用Bradford法测量蛋白浓度。变性后的蛋白样本等质量上样进行SDS-PAGE凝胶电泳(80 V,30 min;120 V,50 min),用孔径0.45 μm的PVDF膜进行转膜(300 mA,90 min),5%脱脂牛奶封闭30 min后,分别用稀释好的α-ENaC抗体和β-actin抗体4℃摇床孵育过夜,TBST洗膜3次/10 min,再加入相应的辣根过氧化物酶标记的羊抗兔IgG抗体和羊抗鼠IgG抗体室温摇床孵育1 h,TBST洗3次后,ECL化学发光法显影,凝胶成像系统曝光并分析结果。
1.2.7 突变结果检测将α-ENaC蛋白表达量下降或无蛋白表达的单克隆细胞用SDS碱裂解法提取基因组DNA,以该基因组DNA为模板,分别以F1:CCCCATTCTGCCTTCACGCTA,R1:TCCTCGAACAGCAAGGCGAAC为上下游引物,PCR扩增靶位点附近的DNA片段进行测序,并将测序峰图为杂峰的PCR产物连接到pMDTM19-T载体上,进一步测序检测。
1.2.8 脱靶检测为了检测该CRISPR/Cas9系统的脱靶效应,考虑到脱靶现象的位置效应结合α-ENaC基因的特点,挑选α-ENaC基因高度同源的亚单位β-ENaC基因和γ-ENaC基因4个潜在的脱靶位点,分别为:AGGGCCCAGGCTACACCTACAAGG,TCTCCCCACTTAGGTACTCCAAGG,TCCATGCCGTCCACCTTGGAAGG和CTTTTCCACCATCCAATGTATGG。以野生型和3个突变克隆基因组混池为模板,进行PCR扩增,通过峰图确定脱靶效应。PCR扩增引物如表 2所示。
将各组细胞分别以2×103接种至96孔板,分别于贴壁后0、24、48、72 h加入10 μL CCK-8试剂,继续培养1 h(37℃,5% CO2),酶标仪测定450 nm处吸光度。每组5个复孔,实验重复3次。
1.2.10 统计学分析使用SPSS 24.0软件进行数据分析,数据以x±s表示。多组间比较采用单因素方差分析(ANOVA),以P < 0.05为差异有统计学意义。
2 结果 2.1 CRISPR/Cas9表达载体和SSA-RPG报告载体的构建将构建的CRISPR/Cas9表达载体α-ENaC.CRISPR/Cas9和SSA-RPG报告载体α-ENaC.SSA-RPG进行测序,测序结果显示靶向α-ENaC基因的gRNA已经插入到CRISPR/Cas9表达载体,靶位点序列已经插入到SSA-RPG报告载体,测序结果见图 3。
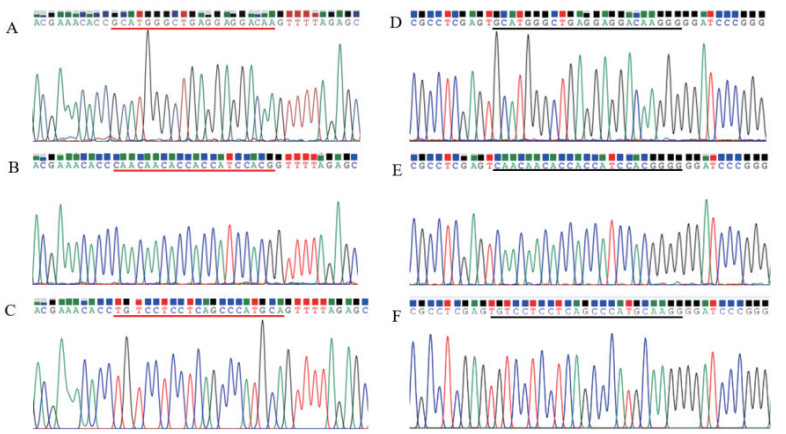
|
| A,B,C分别是α-ENaC.CRISPR/Cas9-1、α-ENaC.CRISPR/Cas9-2和α-ENaC.CRISPR/Cas9-3的测序图,D,E,F分别是α-ENaC.SSA-RPG-1、α-ENaC.SSA-RPG-2和α-ENaC.SSA-RPG-3的测序图。红色划线部分是α-ENaC.CRISPR/Cas9与靶位点互补的20 bp序列,黑色划线部分是α-ENaC.SSA-RPG报告载体的23 bp的靶位点 图 3 α-ENaC.CRISPR/Cas9和α-ENaC.SSA-RPG报告载体的测序图 |
为了验证3组CRISPR/Cas9表达载体的活性大小,在HEK293T细胞中对3组CRISPR/Cas9表达载体利用SSA-RPG报告载体进行了活性检测。将3组α-ENaC.CRISPR/Cas9和α-ENaC.SSA-RPG报告载体分别共转染HEK293T细胞,转染48 h后在荧光显微镜下观察荧光,同时用流式细胞仪对DsRed+ GFP+和DsRed+细胞进行计数。结果显示转染48 h后,a、b、c三组细胞都既发红色荧光又发绿色荧光(图 4-A),流式细胞仪检测c组的DsRed+ GFP+/DsRed+的比率较高(图 4-B),说明该组中α-ENaC.CRISPR/Cas9-3相比其他两组表达载体效率更高。因此后续的L2细胞的α-ENaC基因的敲除实验我们采用α-ENaC.CRISPR/Cas9-3表达载体。
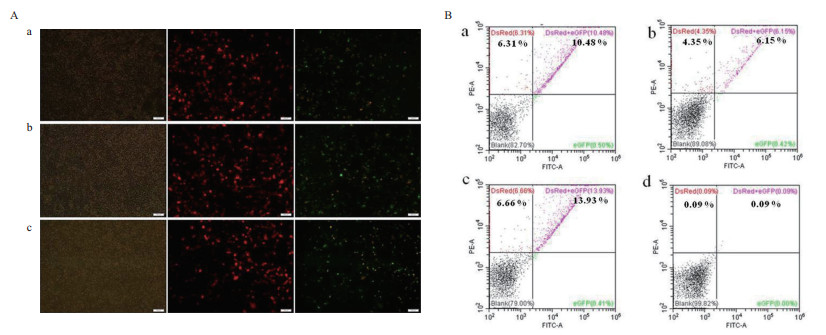
|
| A:HEK293T细胞转染48 h的荧光图片(a:转染α-ENaC.CRISPR/Cas9-1 +α-ENaC.SSA-RPG-1组;b:转染α-ENaC.CRISPR/Cas9-2 +α-ENaC.SSA-RPG-2组;c:转染α-ENaC.CRISPR/Cas9-3+α-ENaC.SSA-RPG-3组。比例尺,100 μm);B:HEK293T细胞转染48 h的流式检测结果(a:转染α-ENaC.CRISPR/Cas9-1 +α-ENaC.SSA-RPG-1组;b:转染α-ENaC.CRISPR/Cas9-2 +α-ENaC.SSA-RPG-2组;c:转染α-ENaC.CRISPR/Cas9-3+α-ENaC.SSA-RPG-3组;d:空细胞组) 图 4 HEK293T细胞转染48 h的CRISPR/Cas9系统活性检测 |
为了检测构建的α-ENaC.CRISPR/Cas9-3表达载体在L2细胞是否具有活性,将α-ENaC.CRISPR/Cas9-3和α-ENaC.SSA-RPG-3共转染L2细胞,将野生型的Cas9-Wild和α-ENaC.SSA-RPG-3共转染作为对照,48 h后在荧光显微镜下观察细胞(图 5)。从图中可以看出,转染48 h后,对照组细胞只发红光不发绿光,而实验组细胞既发红光又发绿光,说明构建的α-ENaC.CRISPR/Cas9-3表达载体具有活性,在报告载体水平可以有效的切割靶位点。
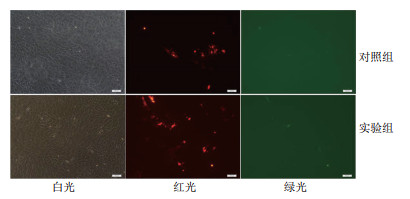
|
| 对照组:转染Cas9-Wild和α-ENaC.SSA-RPG-3;实验组:转染α-ENaC.CRISPR/Cas9-3和α-ENaC.SSA-RPG-3。比例尺,100 μm 图 5 L2细胞转染48 h的CRISPR/Cas9系统活性检测 |
挑取嘌呤霉素筛选后的8个单克隆细胞株进行蛋白水平的检测,克隆4#和7#细胞株中α-ENaC蛋白表达量显著下降,克隆8#细胞株α-ENaC蛋白完全没有表达(图 6)。

|
| 图 6 Western Blotting检测α-ENaC蛋白表达 |
提取单克隆的4#、7#和8#的基因组DNA,并PCR扩增靶位点附近序列,测序结果显示为杂峰,进一步将PCR产物克隆到pMDTM19-T载体中进行测序,测序结果显示,克隆4#和7#中细胞均为单等位基因突变,分别缺失4 bp和2 bp且都是移码突变,克隆8#为双等位基因突变,分别为插入1 bp的移码突变和186 bp的大片段缺失(图 7)。
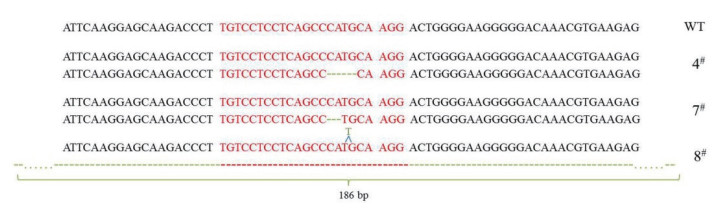
|
| 红色部分为靶位点,虚线为缺失碱基 图 7 突变株靶位点的测序结果 |
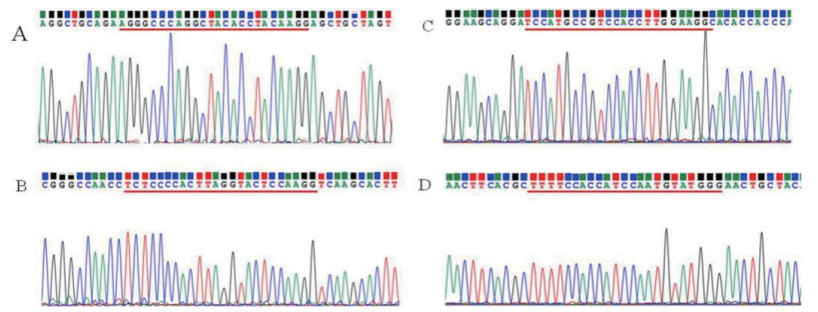
为了检测该CRISPR/Cas9系统的脱靶效应,选择了4个潜在的脱靶位点,PCR扩增后测序,通过峰图确定脱靶效应,结果(图 8)显示4个PCR产物测序结果都为单峰,并与NCBI公布的序列结果一致,说明4个潜在的脱靶位点没有发生脱靶现象。
|
| A,B是β-ENaC基因上潜在的脱靶位点测序结果,C,D是γ-ENaC基因上潜在的脱靶位点测序结果。红色划线部分表示潜在的脱靶位点 图 8 潜在脱靶位点的测序结果 |
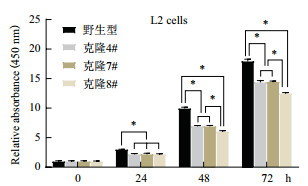
为了探讨α-ENaC蛋白的表达对L2细胞株增殖的影响,采用CCK-8对细胞增殖活力进行了测定。结果(图 9)显示,同一时点,α-ENaC基因敲除的细胞株增殖活力较野生型细胞均显著降低(P < 0.01),48 h和72 h时,双等位基因突变株增殖活力下降较单等位基因突变株更为显著(P < 0.01)。
|
| 图 9 细胞增殖试验(*P < 0.01) |
α-ENaC蛋白是ENaC通道的功能亚基,其主要功能是调节极化上皮细胞的水盐平衡,在肺水肿液的清除过程中必不可少[17];此外,α-ENaC蛋白还可能参与精子活力的调控[11]。研究发现,α-ENaC蛋白在HepG2细胞和神经干细胞中,还可能通过调控Na+电流对细胞增殖产生影响[9-10],因此推测α-ENaC蛋白可能与肺泡上皮细胞的增殖有关。由于α-ENaC基因敲除的小鼠出生后肺内羊水不能及时排出,最多只能存活40 h[6],该模型不能对α-ENaC蛋白的功能做进一步的研究。Ⅱ型肺泡上皮细胞是肺泡上皮细胞的干细胞[13],其增殖能力在肺损伤修复时具有重要的功能。因此,研究α-ENaC蛋白在Ⅱ型肺泡上皮细胞中的功能具有重要的意义。本实验利用CRISPR/Cas9系统结合SSA-RPG报告载体筛选系统,成功构建α-ENaC基因敲除的细胞株。
CRISPR/Cas9系统是近年来发展起来的基因编辑系统,因其成本低、构建简单、打靶效率高受到了科研工作者的青睐,在许多物种及细胞上都有应用。但是关于在大鼠Ⅱ型肺泡上皮细胞上的应用,还未见报道。SSA-RPG报告载体是一种富集基因编辑的阳性细胞的筛选报告系统[16],已应用于人、小鼠、鸡、猪等多种细胞[16, 18-20]。该系统不仅可以通过嘌呤霉素或流式细胞仪对基因编辑的阳性细胞进行富集,还可以通过转染后48 h的荧光来检测CRISPR/Cas9系统的活性。实验中我们选取了靶向大鼠L2细胞α-ENaC基因的3个靶位点,分别构建了3组CRISPR/Cas9表达载体和相应的SSA-RPG报告载体。但是由于大鼠L2细胞的转染效率较低,因此我们首先在HKE293T上首先进行了CRISPR/Cas9系统活性的检测,确定以切割活性较大的α-ENaC.CRISPR/Cas9-3表达载体在L2细胞中进行实验,获得2株单等位基因突变细胞株和一株双等位基因突变细胞株,这些突变造成移码突变或是大片段的缺失。CRISPR/Cas9系统虽然当前在动植物中得到了广泛的应用,但是脱靶效应一直是CRISPR/Cas9系统困扰科研工作者的一个重要的问题。大鼠ENaC家族由α、β和γ族3个高度同源的亚单位组成[21],因此我们根据CRISPR/Cas9系统的作用机理,同时结合α-ENaC基因的特点,选择含有NGG序列的潜在的脱靶位点检测,没有检测到脱靶现象,下一步我们将通过全基因组测序对脱靶问题做进一步分析。对敲除细胞株进行Western Blot检测,结果显示单等位基因突变细胞株蛋白表达明显降低,而双等位基因突变细胞株蛋白完全没有表达,因此我们成功构建了α-ENaC基因敲除的大鼠L2细胞株。对α-ENaC基因敲除前后的细胞进行细胞增殖活力检测结果发现,α-ENaC基因敲除后,L2细胞的增殖活力显著降低,证明α-ENaC蛋白表达与细胞增殖有关,这与之前的相关报道一致[9-10]。由此可见,α-ENaC蛋白表达对Ⅱ型肺泡上皮细胞的增殖具有重要意义。因此,α-ENaC基因敲除细胞株的构建,为进一步阐明α-ENaC对L2细胞增殖的调控机制及其它功能奠定了基础。
4 结论CRISPR/Cas9技术结合SSA-RPG报告载体系统靶向敲除L2细胞α-ENaC基因,通过嘌呤霉素筛选获得基因敲除的细胞株。对基因敲除细胞株进行细胞增殖试验表明,基因敲除细胞株的增殖活力显著降低,其中双等位基因突变的细胞株增殖活力下降更为显著。
致谢: 感谢吉宏龙教授在本实验和论文修改中给予的建议。
| [1] |
Giraldez T, Afonso-Oramas D, Cruz-Muros I, et al. Cloning and functional expression of a new epithelial sodium channel delta subunit isoform differentially expressed in neurons of the human and monkey telencephalon[J]. J Neurochem, 2007, 102(4): 1304-1315. DOI:10.1111/j.1471-4159.2007.04622.x |
| [2] |
Matthay MA, Folkesson HG, Clerici C. Lung epithelial fluid transport and the resolution of pulmonary edema[J]. Physiol Rev, 2002, 82(3): 569-600. DOI:10.1152/physrev.00003.2002 |
| [3] |
Keppler-Noreuil KM, Carroll AJ, Finley WH, et al. Chromosome 1p terminal deletion:report of new findings and confirmation of two characteristic phenotypes[J]. J Med Genet, 1995, 32(8): 619-622. DOI:10.1136/jmg.32.8.619 |
| [4] |
Deng J, Wang DX, Liang AL, et al. Effects of baicalin on alveolar fluid clearance and alpha-ENaC expression in rats with LPS-induced acute lung injury[J]. Can J Physiol Pharmacol, 2017, 95(2): 122-128. DOI:10.1139/cjpp-2016-0212 |
| [5] |
Cui Y, Ding Y, Chen L, et al. Dexmedetomidine enhances human lung fluid clearance through improving alveolar sodium transport[J]. Fundam Clin Pharmacol, 2017, 31(4): 429-437. DOI:10.1111/fcp.12278 |
| [6] |
Hummler E, Barker P, Gatzy J, et al. Early death due to defective neonatal lung liquid clearance in alpha-ENaC-deficient mice[J]. Nat Genet, 1996, 12(3): 325-328. DOI:10.1038/ng0396-325 |
| [7] |
Li T, Koshy S, Folkesson HG. Involvement of αENaC and Nedd4-2 in the conversion from lung fluid secretion to fluid absorption at birth in the rat as assayed by RNA interference analysis[J]. Am J Physiol Lung Cell Mol Physiol, 2007, 293(4): L1069-L1078. DOI:10.1152/ajplung.00151.2007 |
| [8] |
Li W, Long C, Renjun L, et al. Association of Scnn1a single nucleotide polymorphisms with neonatal respiratory distress syndrome[J]. Sci Rep, 2015, 5: 17317-17324. DOI:10.1038/srep17317 |
| [9] |
Bondarava M, Li T, Endl E, et al. Alpha-ENaC is a functional element of the hypertonicity-induced cation channel in HepG2 cells and it mediates proliferation[J]. Pflugers Arch, 2009, 458(4): 675-687. DOI:10.1007/s00424-009-0649-z |
| [10] |
Petrik D, Myoga MH, Grade S, et al. Epithelial sodium channel regulates adult neural stem cell proliferation in a flow-dependent manner[J]. Cell Stem Cell, 2018, 22(6): 865-878. DOI:10.1016/j.stem.2018.04.016 |
| [11] |
孔祥斌, 李红钢, 熊承良. 上皮细胞钠通道α亚基在大鼠和人睾丸、精子中的表达及其与精子活力的关系[J]. 中国计划生育学杂志, 2007, 15(3): 155-158. DOI:10.3969/j.issn.1004-8189.2007.03.010 |
| [12] |
Johnson MD, Bao HF, Helms MN, et al. Functional ion channels in pulmonary alveolar type Ⅰ cells support a role for type Ⅰ cells in lung ion transport[J]. Proc Natl Acad Sci USA, 2006, 103(13): 4964-4969. DOI:10.1073/pnas.0600855103 |
| [13] |
Barkauskas CE, Cronce MJ, Rackley CR, et al. Type 2 alveolar cells are stem cells in adult lung[J]. J Clin Invest, 2013, 123(7): 3025-3036. DOI:10.1172/JCI68782 |
| [14] |
Guillot L, Nathan N, Tabary O, et al. Alveolar epithelial cells:master regulators of lung homeostasis[J]. Int J Biochem Cell Biol, 2013, 45(11): 2568-2573. DOI:10.1016/j.biocel.2013.08.009 |
| [15] |
Xu K, Ren C, Liu Z, et al. Efficient genome engineering in eukaryotes using Cas9 from streptococcus thermophilus[J]. Cell Mol Life Sci, 2015, 72(2): 383-399. DOI:10.1007/s00018-014-1679-z |
| [16] |
Ren C, Xu K, Liu Z, et al. Dual-reporter surrogate systems for efficient enrichment of genetically modified cells[J]. Cell Mol Life Sci, 2015, 72(14): 2763-2772. DOI:10.1007/s00018-015-1874-6 |
| [17] |
Migneault F, Boncoeur E, Morneau F, et al. Cycloheximide and lipopolysaccharide downregulate alphaENaC mRNA via different mechanisms in alveolar epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305(10): L747-L755. DOI:10.1152/ajplung.00023.2013 |
| [18] |
Wu Y, Xu K, Ren C, et al. Enhanced CRISPR/Cas9-mediated biallelic genome targeting with dual surrogate reporter-integrated donors[J]. FEBS Lett, 2017, 591(6): 903-913. DOI:10.1002/1873-3468.12599 |
| [19] |
Bai Y, He L, Li P, et al. Efficient genome editing in chicken DF-1 cells using the CRISPR/Cas9 System[J]. G3(Bethesda), 2016, 6(4): 917-923. |
| [20] |
Shao S, Ren C, Liu Z, et al. Enhancing CRISPR/Cas9-mediated homology-directed repair in mammalian cells by expressing Saccharomyces cerevisiae Rad52[J]. Int J Biochem Cell Biol, 2017, 92: 43-52. DOI:10.1016/j.biocel.2017.09.012 |
| [21] |
Qian J, Mummalaneni S, Phan TT, et al. Cyclic-AMP regulates postnatal development of neural and behavioral responses to NaCl in rats[J]. PLoS One, 2017, 12(2): e0171335. DOI:10.1371/journal.pone.0171335 |






