2. 华中科技大学同济医学院生殖医学中心(武汉同济生殖医学专科医院),武汉 430030;
3. 云南省第三人民医院生殖遗传科,昆明 650011
2. Center of Reproductive Medicine, Tongji Medical College(Reproduce Medicine Hospital of Tongji Medical College), Huazhong Science and Technological University, Wuhan 430030;
3. Department of Reproductive Genetics, The Third People's Hospital of Yunnan Province, Kunming 650011
花生四烯5-脂氧合酶基因(Arachidonate 5-lipoxygenase gene,ALOX5)编码产生含673个氨基酸的5-脂氧合酶(5- Lipoxygenase,5-LO)。5-LO是人体必需脂肪酸花生四烯(Arachidonic acid,AA)代谢途径中的关键酶之一,通过催化AA生成白三烯(Leukotrienes,LTs)[1]。Chen等[2-3]观察到ALOX5是建立BCR-ABL逆转录病毒介导的小鼠慢性髓系白血病(Chronic myeloid leukemia,CML)模型的必需基因,运用DNA微阵列与实时荧光定量PCR技术检测到Alox5在白血病干细胞(Leukem stem cell,LSCs)中的表达显著上调,并伴有5-LO代谢产物白三烯B4(Leukotriene B4,LTB4)血浆浓度的升高,且Alox5表达上调不受酪氨酸激酶抑制剂imatinib的影响。Roos等[4]在PML-RARa诱发的急性髓细胞白血病(Acute myeloid leukemia,AML)小鼠模型中观察到5-LO抑制剂CJ-13,610呈剂量依赖性地抑制LSCs的存活、增殖和自我更新。上述研究结果提示ALOX5及其产物5-LO在髓系白血病的发生发展中扮演着重要角色,有望成为髓系白血病的一个生物标志物或治疗靶点。但目前对其功能及作用机制尚未完全阐述清楚。
规律成簇间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)/ CRISPR相关蛋白9(CRISPR-associated protein 9,Cas9)技术是一类高效经济的基因编辑技术[5],而传统的基因编辑手段,例如:锌指核酸酶(Zinc finger nucleases,ZFN)和类转录激活因子效应分子核酸酶(Transcriptionactivation-like effector nucleases,TALEN)因效率低、实验周期长及操作步骤繁琐等原因正逐渐被具有"魔剪"之称的CRISPR-Cas9技术所替代[6]。CRISPR/ Cas9技术可以对基因组特定位点/片段进行靶向编辑,包括缺失(Indel)、修复(Repair)和替换(Replacement)等进行基因敲除/插入;鉴于该技术在动物研究中已得到应用[7],而且在植物研究中也被涉及,为农业中的育种、培育等过程提供了新的技术与思路[8-9]。本文在CRISPR-Cas9骨架质粒pX458的基础上,建立敲除人源ALOX5基因的重组质粒,为后续基因功能及其机制研究奠定基础。
1 材料与方法 1.1 材料本研究获得我院医学伦理委员会批准。pX458质粒来自于本研究所,长9.3 kb,携带氨苄抗性与GFP标签。293T细胞(人肾上皮细胞)系为本研究所冻存。DH5α感受态细胞、Loading Buffer、DNA marker、Gibco胎牛血清、BbS Ⅰ限制性内切酶、T7核酸内切酶、琼脂糖粉、质粒纯化试剂盒、T4连接酶、T4磷酸化酶(T4PNK)、无内毒素质粒大提试剂盒(离心柱型)、PBS缓冲液、高纯度质粒DNA小量试剂盒、转染试剂LipoFiterTM;DNA marker、成品LB培养基粉末、DMEM培养基、电泳所需试剂。
1.2 方法 1.2.1 sgRNA靶点选择及其寡核苷酸链的合成从GenBank下载ALOX5基因序列(NG_011437)),基于美国杰克逊实验室(The Jackson Laboratory,www.jax.org)制备的ALOX5-/-小鼠是敲除ALOX5外显子6,本研究针对ALOX5外显子6在sgRNA设计网站设计3对sgRNA(表 1),由北京六合华大基因科技股份有限公司广州分公司合成。鉴定pX458-sgRNA重组质粒用U6通用引物进行测序,测序引物为F5′-atggactatcatatgcttaccgta-3′;R5′-atcaagtgtatcatatgcca -3′。
分别将合成的6条单链寡核苷酸sgRNA经退火形成二聚体,用T4多聚核苷酸激酶将寡核苷酸退火产物双链sgRNA连接到经BbSⅠ酶切后的pX458载体中,再将连接产物转化到DH5α感受态中,摇菌过夜后,将其涂于含有氨苄抗性的平板上,次日挑取单克隆进行测序,明确二聚体sgRNA是否与载体pX458正确连接。
1.2.3 293 T细胞的培养、转染将空载体以及构建的pX458-sgRNA重组质粒分别转染293T细胞,并在37℃、5%CO2培养箱中培养24-72 h,在倒置荧光显微镜下观察细胞转染情况。
1.2.4 提取转染细胞基因组DNA用基因组DNA提取试剂盒提取转染细胞基因组DNA,核酸定量仪确定DNA的纯度与浓度,取1 μL用于琼脂糖凝胶电泳检测,其余保存于-80℃冰箱备用。
1.2.5 PCR扩增sgRNA靶点附近的核苷酸片段PCR扩增引物为F5′-TGGGCTGAAGGACCTGAGT-3′,R5′-CCGCAATTCCTCCTCTGAT-3′;体系为20 μL,含2× Taq PCR MasterMix 10 μL,25 μmol/L上游、下游引物各0.25 μL,模板DNA 1 μL,扩增条件为95℃预变性5 min;95℃变性30 s,57℃退火45 s,72℃延伸60 s,32个循环;72℃充分延伸10 min,4℃保存。用PCR产物直接测序法验证pX458-sgRNAs对ALOX5基因的敲除效果。
1.2.6 统计学分析数据以x±s表示,用EXCEL软件处理,用DNAStar软件对测序结果进行分析。
2 结果 2.1 pX458-sgRNA质粒的酶切pX458质粒经过BbsⅠ酶切后,观察到酶切后pX458质粒的条带大小正确(图 1)。

|
| M:Marker;1:未经酶切的PX458质粒;2:经过酶切的PX458质粒 图 1 pX458质粒酶切的琼脂糖凝胶图 |
将sgRNA二聚体与酶切后pX458质粒连接,转化感受态细胞DH5α的菌落送铂尚生物技术有限公司测序,结果(图 2)显示gRNA-1、gRNA-2序列插入正确,提示二聚体sgRNA与pX458质粒成功连接,pX458-sgRNAs-ALOX5重组质粒构建成功。

|
| A:gRNA-1正向测序;B:gRNA-1反向测序;C:gRNA-2正向测序;D:gRNA-2反向测序 图 2 pX458-sgRNA重组质粒的测序图 |
在倒置荧光显微镜下观察到pX458-sgRNAs-ALOX5重组载体转染293T细胞后有绿色荧光(图 3),在转染24 h,将5个高倍镜视野中转染阳性细胞数量与接种细胞数量比较,转染阳性率约为50%。
2.4 一代测序法检测sgRNA的靶向敲除效果PCR扩增产物直接测序法获取EXON 6 sgRNA靶点附近的核苷酸序列,与野生型基因组进行比对分析,未检测到EXON 6 sgRNA对目标基因组核苷酸序列发生切割。
3 讨论在以逆转录病毒作为载体构建的BCR-ABL诱发小鼠CML模型中观察到,敲除ALOX5基因影响小鼠CML模型的建立,与其发挥清除白血病干细胞的作用有关[2]。在PML-RARa诱发小鼠AML模型中也观察到,5-LO在AML中扮演着重要角色[4]。但ALOX5基因及其编码产物5-LO在髓系白血病中的功能及其作用机制尚未阐述得十分清楚。
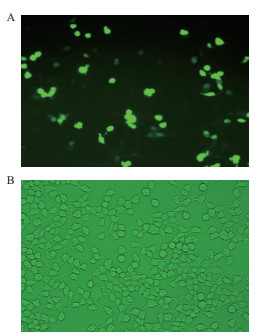
|
| A:转染PX458-ALOX5重组质粒作为实验组;B:未转染重组质粒作为对照组(200倍) 图 3 荧光显微镜下观察转染293T细胞 |
ALOX5基因位于染色体10q11.2,由71 937个碱基对组成(NG_011437),有14个外显子和13个内含子,编码产生含673个氨基酸的5-脂氧合酶(5- Lipoxygenase,5-LO)。5-LO广泛存在于组织细胞中,主要在中性粒细胞、肥大细胞、树突状细胞、B淋巴细胞、单核细胞和巨噬细胞中表达[10]。5-LO在生理状态下表达量少,在病理情况时表达上调,并且与疾病的发生、发展有关[11]。已有研究表明,5-LO直接参与许多的肿瘤发生、发展,如肝癌、肺癌、前列腺癌及结肠癌[10-13]。研究提示5-LO与肿瘤的增殖、转移、侵袭、凋亡过程有关,参与了多个信号通路的调控,对多个基因如P53、血管内皮生长因子(Ascular endothelial growth factor,VEGF)等的表达起关键的调控作用[14]。
在白血病中,5-LO抑制剂能抑制恶性血液肿瘤细胞系的增殖[15]。Rådmark等[16]报道,5-LO在HL-60、THP-1细胞中表达量与活性增加。Lo等[17]发现在矮小相关转录因子1(Runt related transcription factor 1,RUNX1/ETO,)即RE9a融合基因形成的小鼠AML模型中,通过微阵列与染色质免疫共沉淀-芯片(Chromatin immunoprecipitation-chip,ChIP-chip)技术分析发现Alox5是疾病相关的靶基因,且Alox5的表达水平显著上调。Woessner等[18]发现利用RNA干扰(RNA interference,RNAi)技术沉默ALOX5基因,再联合BCR-ABL蛋白的卷曲螺旋结构域突变体,粘蛋白1抑制剂GO-201,或自噬抑制剂氯喹均能有效清除人髓系白血病K562细胞中的LSCs、抑制K562细胞增殖以及促进细胞死亡。上述研究提示,ALOX5表达上调与髓系白血病密切相关,但机制尚不十分清楚。在BCR-ABL逆转录病毒介导的小鼠CML模型中证实,敲除ALOX5基因与清除LSCs有关。Roos等[4]报道,5-LO抑制剂CJ-13,610可抑制AML源LSCs的增殖能力,且与抑制剂浓度呈正相关,而对正常HSCs无明显影响。已有研究表明,Wnt/β-连环蛋白(β-catenin)信号通路是髓系LSCs存活与自我更新所必需的,ALOX5调控β-catenin、转录因子GATA-1的表达[19-20],但对ALOX5基因的功能及作用机制了解甚少。雒钰杰等[21]通过构建pGenesil-1-shRNA-Alox5重组质粒,转染白血病细胞K562/ADM,利用慢病毒载体携带shRNA敲低ALOX5的表达后,检测到BCR-ABL在基因、蛋白水平的表达量显著降低、细胞凋亡率显著增加。
基于CRISPR/ Cas9技术能高效、经济地敲除/插入基因[22],本研究利用该技术将靶向人ALOX5基因第6外显子的sgRNA插入携带绿色荧光蛋白(GFP)标记的PX458[23],构建pX458-sgRNAs-ALOX5重组质粒。sgRNA的设计普遍共识是选择靶基因的第1、第2外显子区域,但基于ALOX5基因敲除(ALOX5-/-)小鼠是在第6外显子,本研究在ALOX5基因第6外显子区域选择sgRNA靶点。将3对sgRNA分别与pX458进行连接后,转化感受态细胞DH5α,测序提示2对sgRNA插入序列正确,将成功构建的重组质粒pX458-sgRNAs转染到293T细胞中24 h,在荧光显微镜下观察到转染成功的细胞有GFP表达,转染阳性率约为50%;但分析转染组细胞中sgRNA靶点附近的核苷酸序列,发现sgRNA对靶点附近核苷酸序列未发生切割;其原因可能是sgRNA脱靶;另外,可能与检测敲除效果的方法有关,用PCR扩增未经筛选的转染组来源的模板DNA,其含有未转染成功的细胞基因组,因而PCR扩增产物经一代测序法获取的核苷酸序列中,发现sgRNA切割的核苷酸序列的机率降低。
4 结论本研究应用CRISPR/ Cas9技术成功构建敲除人源ALOX5基因第6外显子的重组质粒pX458-sgRNAs-ALOX5,为后续在白血病细胞系如K562、MEG-01、KA-1/A3中建立ALOX5基因敲除细胞模型奠定了理论基础和技术平台。
| [1] |
黄凯, 蒋世云, 陈柳军. 5-脂氧合酶及其抑制剂[J]. 中国生物化学与分子生物学报, 2014, 30(12): 1190-1196. |
| [2] |
Chen Y, Hu Y, Zhang H, et al. Loss of the Alox5 gene impairs leukemia stem cells and prevents chronic myeloid leukemia[J]. Nat Genet, 2009, 41(7): 783-792. DOI:10.1038/ng.389 |
| [3] |
Chen Y, Peng C, Sullivan C, et al. Critical molecular pathways in cancer stem cells of chronic myeloid leukemia[J]. Leukemia, 2010, 24(9): 1545-1554. DOI:10.1038/leu.2010.143 |
| [4] |
Roos J, Oancea C, et al. 5-Lipoxygenase is a candidate target for therapeutic management of stem cell-likecells in acute myeloid leukemia[J]. Cancer Res, 2014, 74(18): 5244-5255. DOI:10.1158/0008-5472.CAN-13-3012 |
| [5] |
Lone BA, Karna SKL, et al. CRISPR/Cas9 system:A bacterial tailor for genomic engineering[J]. Genet Res Int, 2018, 3797214. |
| [6] |
Naert T, Vleminckx K. Genotyping of CRISPR/Cas9 genome edited Xenopus tropicalis[J]. Methods Mol Biol, 2018, 1865: 67-82. |
| [7] |
贾启鹏, 申培磊, 张欢, 等. CRISPR/Cas9系统介导敲除CSN2基因奶山羊胎儿成纤维突变细胞的制备[J]. 生物技术通报, 2017, 33(9): 131-138. |
| [8] |
马晓丽, 景巧丽, 裴雁曦. 基于CRISPR/Cas9技术的大白菜内源硫化氢生成酶LCD基因突变体构建[J]. 中国细胞生物学学报, 2018, 40(11): 1799-1805. DOI:10.11844/cjcb.2018.11.0239 |
| [9] |
姚恒, 杨大海, 白戈, 等. 利用CRISPR/Cas9技术定点敲除烟草多酚氧化酶基因NtPPO1[J]. 生物技术通报, 2018, 34(11): 97-102. |
| [10] |
唐石树, 胡建安. 5-脂氧合酶在人体组织中的表达及其与疾病的关系[J]. 中南大学学报:医学版, 2015, 40(4): 438-445. |
| [11] |
Mashima R, Okuyama T. The role of lipoxygenases in pathophysiology; new insights and future perspectives[J]. Redox Biol, 2015, 6: 297-310. DOI:10.1016/j.redox.2015.08.006 |
| [12] |
Che XH, Chen CL, Ye XL, et al. Dual inhibition of COX-2/5-LOX blocks colon cancer proliferation, migration and invasion in vitro[J]. Oncol Rep, 2016, 35(3): 1680-1688. DOI:10.3892/or.2015.4506 |
| [13] |
Sarveswaran S, Varma N, Morisetty S, et al. Inhibition of 5-lipoxygenase downregulates stemness and kills prostate cancer stem cells by triggering apoptosis via activation of c-Jun N-terminal kinase[J]. Oncotarget, 2016, 17. |
| [14] |
Bishayee K, Khuda-Bukhsh AR. 5-lipoxygenase antagonist ther-apy:a new approach towards targeted cancer chemotherapy[J]. Acta Biochim Biophys Sin, 2013, 45(9): 709-719. DOI:10.1093/abbs/gmt064 |
| [15] |
Anderson KM, Seed T, et al. Selective inhibitors of 5-lipoxygenase reduce CML blast cell proliferation and induce limited differentia-tion and apoptosis[J]. Leuk Res, 1995, 19(11): 789-801. DOI:10.1016/0145-2126(95)00043-7 |
| [16] |
Rådmark OP. The molecular biology and regulation of 5-lipoxyge-nase[J]. Am J Respir Crit Care Med, 2000, 161(2): S11-S15. |
| [17] |
Lo MC, Peterson LF, Yan M, et al. Combined gene expression and DNA occupancy profiling identifies potential therapeutic targets of t(8;21)AML[J]. Blood, 2012, 120(7): 1473-1484. DOI:10.1182/blood-2011-12-395335 |
| [18] |
Woessner DW, Lim CS. Disrupting BCR-ABL in combination with secondary leukemia-specific pathways in CML cells leads to enhanced apoptosis and decreased proliferation[J]. Mol Pharm, 2013, 10(1): 270-277. DOI:10.1021/mp300405n |
| [19] |
Hu Y, Chen Y, Douglas L, et al. beta-Catenin is essential for survival of leukemic stem cells insensitive to kinase inhibition in mice with BCR-ABL-induced chronic myeloid leukemia[J]. Leukemia, 2009, 23(1): 109-116. DOI:10.1038/leu.2008.262 |
| [20] |
Wang Y, Krivtsov AV, Sinha AU, et al. The Wnt/beta-catenin pathway is required for the development of leukemia stem cells in AML[J]. Science, 2010, 327(5973): 1650-1653. DOI:10.1126/science.1186624 |
| [21] |
雒钰杰, 徐敏, 高雯琬, 等. 敲低花生四烯酸5脂加氧酶(Alox5)基因促进K562/ADM细胞凋亡[J]. 细胞与分子免疫学杂志, 2017, 33(10): 1398-1403. |
| [22] |
王大勇, 马宁, 惠洋, 等. CRISPR/Cas9基因组编辑技术在癌症研究中的应用[J]. 遗传, 2016, 38(1): 1-8. |
| [23] |
Ran FA, Hsu PD, et al. Genome engineering using the CRISPR-Cas9 system[J]. Nat Protoc, 2013, 8(11): 2281-2308. DOI:10.1038/nprot.2013.143 |





