日粮中纤维水平过高, 将影响能量及蛋白质等营养物质的消化率, 降低饲料转化效率[1-2]。然而, 纤维在动物营养调节方面的研究结果存在不一致性。近期研究表明, 日粮中适宜的纤维水平, 对促进畜禽肠道功能发育及其微生态平衡具有积极作用[3-6]。纤维源及其中非淀粉多糖(Non-starch polysaccharides, NSP)组分含量的差异, 是导致其应用效果呈现多样性的重要原因, 亦是其功能性评价成败的关键[7-8]。众多研究表明, 日粮纤维可以通过调节肠道菌群结构[9-11], 减少断奶仔猪腹泻, 进而提高生产性能[12], 是促生长型抗生素的理想替代物[13-14]。而NSP作为膳食纤维的重要组成部分, 其组分对于纤维的功能性反馈及其发挥的程度都至关重要。另有报道显示, NSP对猪肠道菌群正面调控效应的体现, 主要与肠道微生物对NSP的利用形式及其代谢产物密切相关[15]。猪肠道微生物通过自身糖苷酶的分泌, 降解NSP结构中的β或α糖苷键, 从而产生单糖和寡糖供微生物利用[16]。此外, 日粮NSP可为猪后肠段微生物提供良好的培养基质[17-18], 同时发酵产生的乙酸、丙酸、丁酸等短链脂肪酸(Short chain fatty acid, SCFA)可通过降低肠道pH以抵御感染及致病菌的侵袭[19-21]。
综上所述, 肠道菌群调控的机制探索, 已成为整个微生物研究最活跃的热点之一。然而纤维对猪肠道菌群调控机制阐释才刚刚开始, 许多问题亟待解决。由此, 重新定位并积极探索NSP对猪肠道菌群的调控机制, 无疑是对NSP与菌群间对话机制深入认识的重中之重。
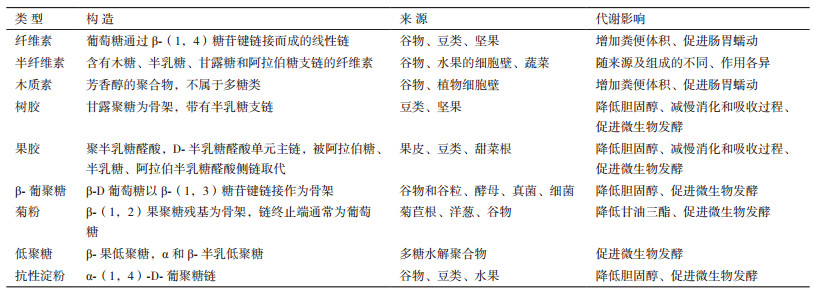
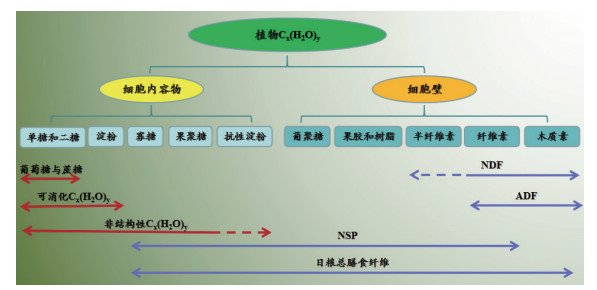
1 NSP的构成及其评价体系 1.1 NSP的构成作为高等植物细胞壁的主体, 纤维的组成复杂多样, 作用和功能各不相同, 主要由NSP和木质素组成。其中NSP的占比可高达90%以上[22], 主要包括纤维素、半纤维素、寡聚糖、抗性淀粉及果胶类等(图 1), 是纤维中相对容易被动物消化的类型。根据NSP是否具有溶解于水或弱碱溶液的特性, 又可分为可溶性非淀粉多糖(Soluble nonstarch polysaccharides, SNSP)和不可溶性非淀粉多糖(Insoluble non-starch polysaccharides, INSP)。
|
| 图 1 植物碳水化合物的组成 |
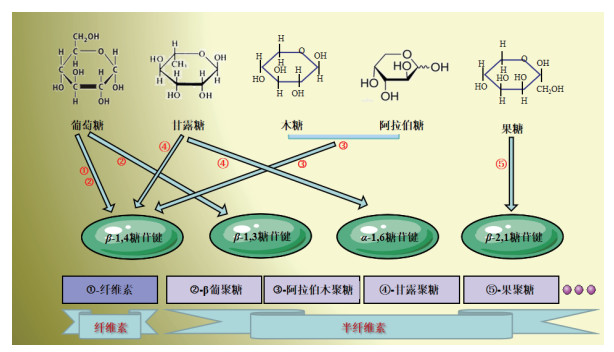
纤维素主要由葡萄糖通过β-(1, 4)糖苷键彼此链接而成, 而NSP中的非纤维素部分则由不同的单糖通过β-(1, 4)、β-(1, 3)、β-(2, 1)及α-(1, 6)等糖苷键异构性连接而成, 是目前发现异构型及缔合分子最多的物质之一(图 2)。
|
| 图 2 纤维素及半纤维素的构成 |
以往报道中, 研究者普遍采用粗纤维(Crude fiber, CF)、中性洗涤纤维(Neutral detergent fiber, NDF)及酸性洗涤纤维(Acid detergent fiber, ADF)等作为评价日粮纤维水平的参考指标。然而, 近几年随着精准营养及新旧动能转换行动的倡导, 合理图 1植物碳水化合物的组成开发并利用"纤维", 这一地球上储量最多的可再生资源, 便成为了当前科技工作者亟待解决的首要任务。原始的纤维评价体系, 已远远无法适应当前精准营养的需求。
CF评价体系中, 酸性洗涤剂和碱性洗涤剂的处理, 将分别使得样品中半纤维素和木质素含量大量损失, 而半纤维素中的阿拉伯木聚糖、β-葡聚糖、甘露聚糖等作为其主要组成部分, 均具有可溶于水的特性, 亦属于可溶性NSP范畴。因此, 在评价含可溶性纤维较多的原料时, 使得CF检测值远低于真实值。报道表明, 《中国饲料成分及营养价值表(27版)》中, NY/T 1级豆粕中CF含量为5.9%(风干基础), 而在黄庆华[8]的研究中显示, 豆粕中仅NSP含量就已达到20.3%(风干基础, 水分以10%计), 相似的结果在Choct等[23]的研究中也得到了证实。此外, 在NDF和ADF体系中, 研究者尽管能够对纤维含量进行相对客观的评价, 但对纤维组分构成, 仍不能进行进一步检测, 且在检测过程中果胶等可溶性纤维的损失, 难以避免。由此, "酶-气相色谱-比色-重量法"应运而生。该法将NSP酶解后, 酸性条件下水解为单糖, 中性糖衍生为糖醇乙酸酯, 糖醛酸在酸性条件下经3, 5-二甲基酚显色后定量, 可对纤维及其组分的实际含量进行准确测定, 是揭开纤维研究黑匣子的重要研究手段。
2 NSP的营养学功能猪自身不具备分泌纤维素酶、半纤维素酶和果胶酶的能力, 因此日粮NSP不能被猪自身分泌的消化酶降解, 而主要依赖于肠道微生物的发酵和非酶水解作用[24], 其发酵程度与日粮中ADF水平呈负相关[25-26]。随着日龄的增加, 猪大肠内具有NSP降解能力的菌群数量逐渐增加, 对日粮NSP的降解能力亦将逐步提高[27]。研究表明, 生长猪肠道内的NSP分解菌数量约为1×108 CFU/g, 而成年母猪大肠中的NSP分解菌数量是生长猪的6倍[28]。
猪后肠道微生物以日粮NSP作为主要碳源并最终将其转化为SCFA, 为宿主提供所需总能量的5%- 20%[29-31]。NSP被后猪肠段微生物利用, 同时产生乙酸、丙酸和丁酸等SCFA被肠上皮细胞吸收利用。研究表明, 猪体内丁酸主要被结肠上皮细胞吸收, 而丙酸、戊酸等被吸收入血后进入肝脏进行丙酸糖异生过程, 乙酸则被肌肉和脂肪组织利用[32-33]。此外, 有研究表明, 日粮NSP可以通过参与激活肠道中相关通路进行肠道免疫和代谢的调控, 且其对机体的影响包括但不仅限于其自身的能量供应[34]。
3 NSP对猪肠道微生物组成及代谢的影响 3.1 NSP研究的必要性近年来, 随着医学领域对肥胖、糖尿病与日粮纤维及肠道菌群间互作关系的深入研究, 日粮NSP及其代谢产物与肠道菌群间关系的探讨备受众多研究者青睐[35-38]。研究表明, NSP在调节动物肠道菌群结构、抑制病源微生物的定植及维持肠道健康等诸多方面日益体现出不可替代的作用[39-41]。NSP及木质素的构成、来源及其对动物代谢的影响, 见表 1。猪肠道微生物菌群数量及丰度, 依赖于日粮结构及营养素变化[42-45], 其中NSP是其后肠段微生物的主要能量来源[46]。日粮中不同含量的NSP被猪摄入后, 随食糜进入后肠段被微生物利用, 对猪后肠段微生物菌群结构及其代谢活性造成可逆性影响, 从而改变菌群代谢产物[47]。对于猪肠道微生物而言, NSP是除木质素外唯一一种几乎不受上消化道及前肠段干扰, 组分几近无损作用于肠道菌群的营养素, 推测可尝试作为肠道微生物区系调控的标志性营养素进行深入探究。近期众多研究中, 多采用微晶纤维素及羧甲基纤维素作为日粮纤维源, 研究其对动物肠道健康的影响[8, 48]。以上两种纤维素, 组成单糖均为葡萄糖, 尽管能够在一定程度上说明纤维素对机体的影响, 但由于忽略了纤维中NSP及其组分含量和比例的多样性, 故结论并不严谨。
3.2 NSP对断奶仔猪及生长育肥猪肠道菌群的调控断奶应激是促使仔猪肠道菌群建立稳态及多样性的重要阶段, 而不合理的营养调控无疑是导致仔猪腹泻的始作俑者。研究表明, 日粮中NSP可黏附于肠黏膜表面, 对外源病菌的吸附和定植起到一定的防御作用[53]。此外, 不同肠段微生物具备定向选择NSP并利用其不同组分的能力, 所以可根据NSP类型及其组分的不同, 对猪肠道菌群结构进行调控[54]。
根据溶解性, NSP可分为INSP和SNSP。其中, SNSP最早可在回肠被微生物开始利用, 而INSP却能够为直至大肠末端的微生物提供培养基[55], 提示NSP对猪肠道微生物的调控, 不仅与NSP来源及含量有关, 还与INSP/SNSP, 甚至NSP组分密切相关。SNSP可在后肠菌群的作用下迅速发酵并产生SCFA, 且不同NSP源产生的SCFA种类和浓度完全不同。而INSP可缩短食糜在肠道中的停留时间, 促进肠蠕动, 减少粪便在体内的滞留时间, 是营养素调控肠道健康及菌群结构的重要手段[56-57]。研究表明, 日粮中添加10%小麦麸, 可显著提高断奶仔猪回肠乳酸杆菌和结肠中双歧杆菌的数量, 降低腹泻率[58]。另有报道表明, 选择大豆皮为NSP源, 使得猪回肠段乳酸杆菌数量显著降低, 而盲肠中大肠杆菌数量显著升高[59]。推测原因除了大豆皮NSP高于小麦麸外(56.7%>30.6%), 也与两者INSP/SNSP(小麦: 26.5:4.1;大豆皮:48.3:8.4)有关[60]。此外, 小麦麸中NSP主要以阿拉伯木聚糖为主, 而大豆皮中NSP主要为半乳甘露聚糖和果胶[61], 暗示NSP组分的不同是两者发挥不同功能性的重要潜在原因之一。另有报道显示, 高NSP水平日粮能够显著增加肠道中具有高效纤维分解能力的菌群丰度[62]。SNSP可通过增加食糜黏稠性, 影响机体消化功能[63-64]。同时, 肠道厌氧环境使其蠕动迟缓, 为后肠段微生物提供了稳定的发酵环境[65]。龚敏[66]试验表明, 日粮中小麦NSP的含量对断奶仔猪回肠、结肠、盲肠中双歧杆菌、乳酸杆菌、大肠杆菌及链球菌数量影响并不显著。而小麦日粮中木聚糖酶的添加使双歧杆菌和乳酸杆菌数量呈现出一定的升高趋势, 大肠杆菌及链球菌呈现降低趋势。提示断奶仔猪肠道发育不完善, NSP酶缺乏, 可能是导致日粮中小麦NSP难以发挥功能性的重要原因, 推测育肥猪日粮中添加适宜剂量的NSP, 预期将获得积极效应, 这在高阳等[67]的研究中得到证实。猪育肥阶段肠道发育完善, 菌群相对稳定, 当采食高NSP日粮时, 肠道菌群需要一定时间进行自我调整, 以抵御原有微生物区系的冗余特性并适应新的发酵基质。有研究表明, 育肥猪饲粮中添加50%苜蓿, 其后肠道微生物总数呈现出先减少后增加的趋势, 且具有纤维素高效降解能力的菌属比例不断增加[68]。采用不同纤维类型及玉米粉碎粒度作为自变量, 对育肥猪日粮进行处理后, 支链及直链淀粉酶在试验第1天出现, 而木聚糖酶等相关NSP酶在试验第7天才开始出现[69], 提示猪肠道菌群对日粮NSP的反馈, 是一个相对缓慢的过程。
3.3 NSP对妊娠母猪肠道菌群的调控在非洲猪瘟疫情的影响下, 我国能繁母猪存栏量骤减, 生猪价格翻倍, 对民众的生活造成了一定的影响。全面的认识NSP在母猪营养调控中的作用并合理利用, 对于指导生产和提高其生产性能具有重要的意义。母猪后肠段具有庞大的微生物群(1×1010-11CFU/g), 是生长猪的6-7倍, 且食糜在其后肠段滞留时间长(20 h左右), 因而母猪对NSP的利用具有相较于生长猪更大的潜力。妊娠期母猪肠道微生物区系的健康稳定, 是提高仔猪成活率及生产效率的有力保障。前人研究大多集中高NSP特别是高INSP日粮对缓解妊娠母猪便秘具有积极的作用[70-71], 而对NSP在母猪妊娠阶段肠道微生物区系的调控却罕有报道。研究表明, 母猪可通过乳汁和粪便等母源微生物的垂直传递, 影响仔猪粘膜微生物的定植, 且表现出空间生态位点的选择特异性[72]。另有报道表明, 经健康人类粪菌移植后的无菌小鼠, 饲喂低NSP日粮后, 肠道菌群多样性显著降低, 此时改用高NSP日粮进行饲喂, 可在一定程度上恢复原有的菌群结构。低NSP水平日粮持续饲喂3代后, 高NSP日粮对其菌群结构的恢复效应大幅度降低[73]。提示随着世代间母子传递, 微生物的冗余特性逐渐降低直至消亡, 预示着妊娠期母猪高NSP型饮食干预, 在新生仔猪肠道菌群多样性的早期建立方面具有重要意义。此外, 一项来自斯坦福大学的研究表明, 抗生素使用后, 人体微生物菌群具有很强的自我恢复能力, 而不同的抗生素使用后, 小鼠肠道菌群的反应具有共性。值得一提的是, 低NSP日粮会加重肠道菌群的失衡, 延缓环丙沙星使用后的恢复, 而高NSP日粮可加快菌群的恢复, 提示高NSP日粮对于缓解抗生素对肠道菌群的负面影响具有积极作用[74]。
4 展望迄今为止, 国内外有关日粮NSP在动物上的应用研究多侧重于不同来源及浓度NSP的饲喂效果及其对表观指标的影响。尽管近年来部分研究对日粮NSP与肠道健康的关系进行了探讨, 但多集中于菌群数量及其代谢产物的调节方面, 缺乏宏基因组、宏转录组等现代微生物技术研究手段。此外, 目前有关NSP调控猪肠道菌群的核心微生物, 以及该微生物群在NSP调控肠道健康中的贡献及机制尚不十分明确。因此, 深入认识日粮NSP组分的营养作用, 探讨猪肠道微生物与NSP及其组分间的对话机制, 消除或缓解NSP对机体的不利影响, 充分发挥其积极作用, 对促进动物健康、提高饲料的有效能值以及缓解我国饲料资源短缺局面大有裨益。
| [1] |
Wu X, Chen D, Yu B, et al. Effect of different dietary non-starch fiber fractions on growth performance, nutrient digestibility, and intestinal development in weaned pigs[J]. Nutrition, 2018, 51(6): 20-28. |
| [2] |
Ginting N, Pase E. Effect of incubation time of sago(metroxylon sago)waste by local microorganism "ginta" on ph, crude protein, and crude fiber content[C]//IOP Conference Series: Earth and Enviro-nmental Science, 2018.
|
| [3] |
郝帅帅.高米糠日粮对苏淮猪生产性能、血液指标及肉质性状的影响[D].南京: 南京农业大学, 2016.
|
| [4] |
王志博, 陆东东, 倪冬姣, 等. 纤维对猪的营养和肠道健康的影响[J]. 国外畜牧学, 2018, 38(6): 93-96. |
| [5] |
张奇, 姜海龙, 杨海天, 等. 饲粮纤维对猪消化生理功能的影响研究进展[J]. 饲料研究, 2019(5): 37-40. |
| [6] |
Patience JF, Petry AL. Susceptibility of fibre to exogenous carbohydrases and impact on performance in swine[M]//The value of fibre: Engaging the second brain for animal nutrition. Wageningen Academic Publishers, 2019: 689-695.
|
| [7] |
乔岩瑞. 纤维性非淀粉多糖在单胃动物营养中的作用[J]. 饲料工业, 1995(9): 11-15. |
| [8] |
黄庆华.猪饲料中非淀粉多糖组分的测定方法及其对能量消化率的影响研究[D].北京: 中国农业科学院, 2015.
|
| [9] |
Williams BA, Verstegen MWA, Tamminga S. Fermentation in the large intestine of single-stomached animals and its relationship to animal health[J]. Nutrition Research Reviews, 2002, 14(2): 207-228. |
| [10] |
Jha R, Berrocoso JD. Review:Dietary fiber utilization and its effects on physiological functions and gut health of swine[J]. Animal, 2015, 9(9): 1441-1452. |
| [11] |
Koistinen VM, Olli K, Borewicz K, et al. Contribution of gut microbiota to metabolism of dietary glycine betaine in mice and in vitro colonic fermentation[J]. Microbiome, 2019, 7(1): 103-116. |
| [12] |
Mateos GG, Martín F, Latorre MA, et al. Inclusion of oat hulls in diets for young pigs based on cooked maize or cooked rice[J]. Animal Science, 2006, 82(1): 57-63. |
| [13] |
Verstegen MWA, Williams BA. Alternatives to the use of antibiotics as growth promoters for monogastric animals[J]. Animal Biotechnology, 2002, 13(1): 113-127. |
| [14] |
Rubin R. High-fiber diet might protect against range of conditions[J]. JAMA, 2019, 321(17): 1653-1655. |
| [15] |
Molist F, Van OM, Pérez JF, et al. Relevance of functional properties of dietary fibre in diets for weanling pigs[J]. Animal Feed Science and Technology, 2014, 189: 1-10. |
| [16] |
Hamaker BR, Tuncil YE. A perspective on the complexity of dietary fiber structures and their potential effect on the gut microbiota[J]. Journal of Molecular Biology, 2014, 426(23): 3838-3850. |
| [17] |
郭元晟, 靳鹏. 发酵乳酸杆菌对肉鸡血清抗氧化性能及肠道挥发性脂肪酸(VFA)的影响[J]. 畜牧与饲料科学, 2016, 37(2): 10-13. |
| [18] |
向兴, 唐行模, 刘艺, 等. 非淀粉多糖酶在猪上的应用研究进展[J]. 今日养猪业, 2019(3): 94-97. |
| [19] |
Engberg RM, Hammersh JM, Johansen NF, et al. Fermented feed for laying hens:effects on egg production, egg quality, plumage condition and composition and activity of the intestinal microflora[J]. British Poultry Science, 2009, 50(2): 228-239. |
| [20] |
Niba AT, Beal JD, Kudi AC, et al. Potential of bacterial fermentation as a biosafe method of improving feeds for pigs and poultry[J]. African Journal of Biotechnology, 2009, 8(9): 1758-1767. |
| [21] |
刘志云, 钟晓霞, 谢跃伟, 等. 发酵玉米-豆粕型全价饲料对生长猪生长性能、粪便臭味物质和菌群区系的影响[J]. 畜牧兽医学报, 2018, 49(6): 1169-1177. |
| [22] |
Asp NG. Dietary carbohydrates:classification by chemistry and physiology[J]. Food Chemistry, 1996, 57(1): 9-14. |
| [23] |
Choct M, Dersjant-Li Y, et al. Soy oligosaccharides and soluble non-starch polysaccharides:a review of digestion, nutritive and anti-nutritive effects in pigs and poultry[J]. Asian-Australasian Journal of Animal Sciences, 2010, 23(10): 1386-1398. |
| [24] |
Just A, JoséA FJ, Rgensen H. The net energy value of diets for growth in pigs in relation to the fermentative processes in the digestive tract and the site of absorption of the nutrients[J]. Livestock Production Science, 1983, 10(2): 171-186. |
| [25] |
Bourquin LD, Titgemeyer EC, Fahey GC. Vegetable fiber fermentation by human fecal bacteria:cell wall polysaccharide disappearance and short-chain fatty acid production during in vitro fermentation and water-holding capacity of unfermented residues[J]. Journal of Nutrition, 1993, 123(5): 860-869. |
| [26] |
Englyst KN, Liu S, Englyst HN. Nutritional characterization and measurement of dietary carbohydrates[J]. European Journal of Clinical Nutrition, 2007, 12(61): 19-39. |
| [27] |
汪海峰, 朱军莉, 刘建新. 日粮纤维对猪饲料能值评定的影响[J]. 中国畜牧杂志, 2006, 42(23): 45-47. |
| [28] |
Varel VH. Activity of fiber-degrading microorganisms in the pig large intestine[J]. Journal of Animal Science, 1987, 65(2): 488-496. |
| [29] |
Ashida H, Ogawa M, Kim M, et al. Bacteria and host interactions in the gut epithelial barrier[J]. Nature Chemical Biology, 2011, 8(1): 36-45. |
| [30] |
Tilg H, Kaser A. Gut microbiome, obesity, and metabolic dysfunction[J]. The Journal of Clinical Investigation, 2011, 121(6): 2126-2132. |
| [31] |
Walter P, Ron D. The unfolded protein response:from stress pathway to homeostatic regulation[J]. Science, 2011, 334(6059): 1081-1086. |
| [32] |
Wong JMW, De Souza R, Kendall CWC, et al. Colonic health:fermentation and short chain fatty acids[J]. Journal of Clinical Gastroenterology, 2006, 40(3): 235-243. |
| [33] |
Elia M, Cummings JH. Physiological aspects of energy metabolism and gastrointestinal effects of carbohydrates[J]. European Journal of Clinical Nutrition, 2007, 12(61): 40-74. |
| [34] |
Koh A, DeVadder F, Kovatcheva-Datchary P, et al. From dietary fiber to host physiology:short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. |
| [35] |
Cummings JH, Macfarlane GT. The control and consequences of bacterial fermentation in the human colon[J]. Journal of Applied Bacteriology, 1991, 70(6): 443-459. |
| [36] |
Cummings JH, Macfarlane GT, Englyst HN. Prebiotic digestion and fermentation[J]. The American Journal of Clinical Nutrition, 2001, 73(2): 415-420. |
| [37] |
Topping DL, Clifton PM. Short-chain fatty acids and human colonic function:roles of resistant starch and nonstarch polysaccharides[J]. Physiological Reviews, 2001, 81(3): 1031-1064. |
| [38] |
Nie Y, Lin Q, Luo F. Effects of non-starch polysaccharides on inflammatory bowel disease[J]. International Journal of Molecular Sciences, 2017, 18(7): 1372. |
| [39] |
王金全, 蔡辉益, 等. 小麦日粮NSP和木聚糖酶对肉仔鸡肠道微生物区系的影响[J]. 饲料工业, 2004, 25(8): 15-19. |
| [40] |
贺永惠, 王清华, 等. 小麦可溶性非淀粉多糖对大鼠肠道形态与功能的影响[J]. 饲料工业, 2010, 31(17): 13-15. |
| [41] |
Bao YM, Choct M. Dietary NSP nutrition and intestinal immune system for broiler chickens[J]. World's Poultry Science Journal, 2010, 66(3): 511-518. |
| [42] |
Savory CJ. Enzyme supplementation, degradation and metabolism of three U-14 C-labelled cell-wall substrates in the fowl[J]. British Journal of Nutrition, 1992, 67(1): 91-102. |
| [43] |
Gibson GR, Willems A, Reading S, et al. Fermentation of nondigestible oligosaccharides by human colonic bacteria[J]. Proceedings of the Nutrition Society, 1996, 55(3): 899-912. |
| [44] |
Hillman K. Manipulation of the intestinal microflora for improved health and growth in pigs[J]. Proceedings of the UK Branch of World's Poultry Science Association, Scarborough, UK, 1999:59-61.
|
| [45] |
Youngblut ND, Reischer GH, Walters W, et al. Host diet and evolutionary history explain different aspects of gut microbiome diversity among vertebrate clades[J]. Nature Communications, 2019, 10(1): 2200-2214. |
| [46] |
Pluske JR, Kim JC, McDonald DE, et al. Non-starch polysaccharides in the diets of young weaned piglets[J]. The Weaner Pig:Nutrition and Management, 2001(1): 81-112. |
| [47] |
Knudsen KEB, Hedemann MS, Lrke HN. The role of carbohydrates in intestinal health of pigs[J]. Animal Feed Science and Technology, 2012, 173(1-2): 41-53. |
| [48] |
吴维达, 解竞静, 张宏福. 不同日粮纤维对生长猪养分消化率和肠道结构形态的影响[J]. 畜牧与兽医, 2016, 48(6): 57-60. |
| [49] |
Stephen AM, Champ MMJ, Cloran SJ, et al. Dietary fibre in europe:current state of knowledge on definitions, sources, recommendations, intakes and relationships to health[J]. Nutrition Research Reviews, 2017, 30(2): 149-190. |
| [50] |
McRorie JJW. Evidence-based approach to fiber supplements and clinically meaningful health benefits, part 1:What to look for and how to recommend an effective fiber therapy[J]. Nutrition Today, 2015, 50(2): 82. |
| [51] |
Elleuch M, Bedigian D, Roiseux O, et al. Dietary fibre and fibre-rich by-products of food processing:Characterisation, technological functionality and commercial applications:A review[J]. Food Chemistry, 2011, 124(2): 411-421. |
| [52] |
Dhingra D, Michael M, Rajput H, et al. Dietary fibre in foods:a review[J]. Journal of Food Science and Technology, 2012, 49(3): 255-266. |
| [53] |
Kyogashima M, Ginsburg V, Krivan HC. Escherichia coli K99 binds to N-glycolylsialoparagloboside and N-glycolyl-GM3 found in piglet small intestine[J]. Archives of Biochemistry and Biophysics, 1989, 270(1): 391-397. |
| [54] |
张文俊, 贺建华. 仔猪肠道微生态环境的调控[J]. 动物营养学报, 2010, 22(5): 1181-1185. |
| [55] |
Freire JPB, Guerreiro AJG, Cunha LF, et al. Effect of dietary fibre source on total tract digestibility, caecum volatile fatty acids and digestive transit time in the weaned piglet[J]. Animal Feed Science and Technology, 2000, 87(1-2): 71-83. |
| [56] |
Malkki Y. Physical properties of dietary fiber as keys to physiological functions[J]. Cereal Foods World, 2001, 46(5): 196-199. |
| [57] |
Scala J. The physiological effects of dietary fiber[M]. American Chemical Society, 1975.
|
| [58] |
Chen H, Mao X, et al. Dietary fibre affects intestinal mucosal barrier function and regulates intestinal bacteria in weaning piglets[J]. British Journal of Nutrition, 2013, 110(10): 1837-1848. |
| [59] |
Chen H, Mao XB, Che LQ, et al. Impact of fiber types on gut microbiota, gut environment and gut function in fattening pigs[J]. Animal Feed Science and Technology, 2014, 195(9): 101-111. |
| [60] |
于藏游.不同纤维原料非淀粉多糖组分的测定及其对断奶仔猪生长性能、消化率和粪中菌群的影响[D].北京: 中国农业大学, 2015.
|
| [61] |
Karr-Lilienthal LK, Kadzere CT, Grieshop CM, et al. Chemical and nutritional properties of soybean carbohydrates as related to nonruminants:A review[J]. Livestock Production Science, 2005, 97(1): 1-12. |
| [62] |
Moore WE, Moore LV, Cato EP, et al. Effect of high-fiber and highoil diets on the fecal flora of swine[J]. Appl Environ Microbiol, 1987, 53(7): 1638-1644. |
| [63] |
Angkanaporn K, Choct M, Bryden WL, et al. Effects of wheat pentosans on endogenous amino acid losses in chickens[J]. Journal of the Science of Food and Agriculture, 1994, 66(3): 399-404. |
| [64] |
Choct M, Hughes RJ, Wang J, et al. Increased small intestinal fermentation is partly responsible for the anti-nutritive activity of non-starch polysaccharides in chickens[J]. British Poultry Science, 1996, 37(3): 609-621. |
| [65] |
O'Grady J, O'Connor EM, Shanahan F. Dietary fibre in the era of microbiome science[J]. Alimentary Pharmacology & Therapeutics, 2019, 49(5): 506-515. |
| [66] |
龚敏.小麦非淀粉多糖对断奶仔猪肠道菌群区系及糖转运载体的影响研究[D].南昌: 南昌大学, 2011.
|
| [67] |
高阳, 周虚, 于佳鑫, 等. 非淀粉多糖酶对生长育肥猪生长性能、胴体性状和肉品质的影响[J]. 中国兽医学报, 2014(5): 138-142. |
| [68] |
Varel VH, Pond WG, Pekas JC, et al. Influence of high-fiber diet on bacterial populations in intestinal tracts of obese and lean genotype pigs[J]. Applied and Environmental Microbiology, 1982, 44(1): 107-112. |
| [69] |
Castillo M, Martín-Orúe SM, Anguita M, et al. Adaptation of gut microbiota to corn physical structure and different types of dietary fibre[J]. Livestock Science, 2007, 109(1-3): 149-152. |
| [70] |
苗德武. 初产母猪产死胎原因及防范[J]. 四川畜牧兽医, 2018(1): 54-55. |
| [71] |
王小伟, 陈庆莲, 等. 饲粮中添加天然木质纤维和NCG对妊娠母猪繁殖性能的影响[J]. 饲料研究, 2019(8): 21-25. |
| [72] |
刘红宾.母猪微生物垂直传递影响仔猪肠道的微生物定植与功能发育[D].北京: 中国农业大学, 2018.
|
| [73] |
Sonnenburg ED, Smits SA, Tikhonov M, et al. Diet-induced extinctions in the gut microbiota compound over generations[J]. Nature, 2016, 529(7585): 212. |
| [74] |
Ng KM, Aranda-Díaz A, Tropini C, et al. Recovery of the gut microbiota after antibiotics depends on host diet, community context, and environmental reservoirs[J]. Cell Host & Microbe, 2019, 26(5): 650-665. |