高血压是最常见的慢性病之一, 也是心、脑、肾疾病发生发展的主要危险因素, 具有高患病率、高致残率和高死亡率的特点。据《中国心血管病报告2018》概要报道, 我国现有2.45亿高血压患者[1]。当今社会节奏快, 竞争压力大, 长期过度的脑力工作负荷、持续紧张、长期情绪或精神刺激、烦恼、焦虑等心理应激, 使高血压及其并发症心、脑、肾等疾病的发病率持续上升, 严重威胁人群健康, 并且造成巨大的社会和家庭负担。这些与现代生活方式相关的慢性应激, 正在成为新的心血管疾病的风险因素[2]。如果这些应激因素持续存在, 可能引起长期的高血压, 通常称为应激性高血压(Stressinduced hypertension, SIH)[3-4]。近来的研究显示, 高血压的发生与肠道菌群的变化相关[5-6], 菌群对宿主血压有直接影响[7]。无菌鼠的血压相对降低[8]。用16S rRNA检测高血压大鼠和高血压患者粪便的结果显示, 肠道菌群丰度和多样性显著下降, 厚壁菌门(Firmicutes, F)/拟杆菌门(Bacteroidetes, B)的比率增加, 标志肠道菌群紊乱[9]。但慢性应激引起的应激性高血压是否与肠道菌群的变化相关尚不清楚。本研究观察应激情况下, 肠道菌群的变化以及通过四联抗生素制备伪无菌鼠, 研究肠道菌群的变化与应激性高血压发生的相关性, 为预防应激性高血压提供新的思路。
1 材料与方法 1.1 材料 1.1.1 实验动物24只200-250 g雄性Sprague Dawley(SD)大鼠购自上海杰思捷实验动物有限公司[动物生产许可证:SCXK(沪)-2018-0004]。大鼠进行随机编号并称重, 分笼饲养。控制饲料、饮水、室温等条件均相同。保持12 h光照/12 h黑暗日周期, 自由采食和饮水。所有动物实验均经过江苏医药职业学院动物实验伦理委员会同意, 并严格遵守实验动物护理和使用指南开展相关实验。
1.1.2 仪器和试剂应激性高血压造模系统(上海继德教学实验器械厂), Illumina公司的Miseq PE300测序平台(上海美吉生物医药科技有限公司), PowerLab 8/35数据分析处理系统(澳大利亚AD Instruments公司); 氨苄西林、万古霉素、新霉素、甲硝唑购自上海源叶生物科技有限公司, 去甲肾上腺素(NE)的ELISA试剂盒购自上海威奥生物科技有限公司。
1.2 方法 1.2.1 应激性高血压大鼠模型制备大鼠适应性饲养3 d后, 使用计算机控制的足底电击结合噪声的刺激方法, 制备应激性高血压大鼠模型。电击和噪声的间隔时间与组合均随机。电击笼的尺寸为22×22×26 cm3, 底部铺有铜栅, 铜栅上可以通间断性交流电。模型制备时, 电击电压为35-80 V, 同时随机由蜂鸣器发出强度为90-100 db的噪声, 每次持续50 ms。应激性高血压大鼠(stress组)每天上、下午各接受1次(每日2次)应激刺激, 每次2 h, 中间间隔4 h, 共14 d。对照组大鼠(sham组)饲养条件同stress组, 并且每天2次, 每次2 h放入同样的电击笼, 但不给予任何应激刺激。造模结束, 于上午8:00前留取粪便标本, 然后使用PowerLab 8/35数据分析处理系统测量股动脉血压后留取血液等标本备用。
1.2.2 伪无菌鼠模型制备根据文献[10], 使用四联广谱抗生素(Antibiotics, AB)制备伪无菌鼠。12只大鼠分为抗生素组(sham_AB)和应激抗生素组(stress_AB), 每组6只。在饮用水中加入1g/L氨苄西林、500 mg/L万古霉素、1 g/L新霉素、1 g/L甲硝唑四种抗生素(所有抗生素均购自于Sigma公司), 饮用水4 d更换一次。2周后, stress_AB组大鼠和stress组大鼠一起接受应激; 4周之后, 收集大鼠粪便用于后续的测序分析。
1.2.3 酶联免疫吸附实验方法(ELISA)检测血浆去甲肾上腺素(Norepinephrine, NE)根据ELISA试剂盒说明书, 按梯度稀释标准品8个浓度, 用于制作标准曲线。分别设空白对照孔、标准孔和待测样品孔。空白对照孔不加样品及酶标试剂, 其余各步骤操作相同; 标准孔加不同浓度的标准品各100 μL; 待测样品孔加血清100 μL。混匀, 封板, 37℃, 温育30 min。洗涤5次, 拍干。所有标准孔和待测样品孔各加酶标试剂50 μL。37℃, 温育30 min, 洗涤5次, 拍干。空白对照孔、标准孔和待测样品孔按序依次加入显色剂A和B各50 μL, 混匀, 37℃, 避光显色15 min, 加终止液50 μL用于终止反应(此时蓝色立转黄色)。加终止液后15 min内, 使用酶标仪测定各孔OD值。酶标仪设定在450 nm波长。根据标准品浓度和OD值计算标准曲线的直线回归方程式。根据样品的OD值计算样品浓度。
1.2.4 肠道菌群测序及分析每天上午8:00在超净台中采集大鼠的新鲜粪便于无菌冻存管中, 所有样品立即于-80℃保存备用。所有样品干冰保存送至上海美吉生物医药科技有限公司进行16S rRNA的测序。引物名称:338F_806R;F端序列:ACTCCTACGGGAGGCAGCAG; R端序列: GGACTACHVGGGTWTCTAAT; 长度:468;测序方式: PE300。采用Illumina MiSeq测序技术, 测定大鼠粪便中微生物16S rRNA V3-V4区序列, 并对群落结构和多样性进行了比较分析。使用I-Sanger云平台比较分析样品中微生物群落结构、组成和差异[11]。
1.2.5 统计学处理所有实验数据均用GraphPad Prism 6.0软件进行统计分析, 实验数据以均数土标准差(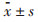
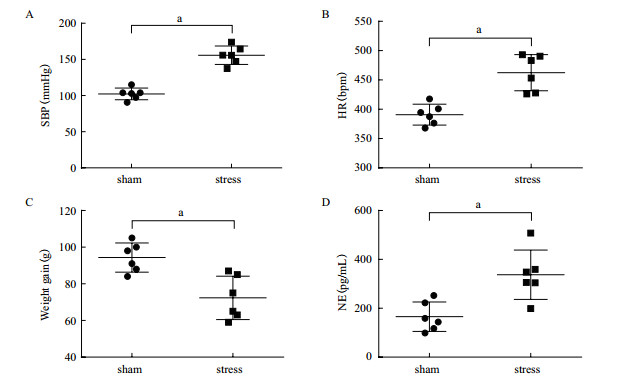
应激性高血压组(stress组)大鼠每天接受2次应激刺激, 每次2 h, 中间间隔4 h, 持续14 d。与对照组(sham组)大鼠相比, stress组大鼠从第2天开始就发生明显的行为方面的改变。表现为高度警觉, 躁动不安。在电击笼中, 呼吸加深加快、体毛竖立, 出现紧张恐惧和逃避行为, 常表现为呈直立状攀附在电击笼侧壁。而sham组大鼠行为正常, 表现为悠闲状态。无论是sham组还是stress组大鼠的体重均呈增长趋势, 但是stress组大鼠的体重增长缓慢。应激造模14 d, 与sham组大鼠相比, stress组大鼠体重增长明显低于sham组大鼠(图 1-C)。造模结束次日, 使用PowerLab 8/35数据分析处理系统测量sham组和stress组大鼠股动脉血压和心率。与sham组相比, stress组大鼠的血压升高、心率增快(图 1-A-B)。大鼠处死前留取静脉血5 mL, 分离血清后-80℃备用。使用ELISA方法检测大鼠血清NE含量, 用于评价大鼠外周交感神经兴奋状态。与sham组相比, stress组大鼠血清NE含量显著增高(图 1-D)。
|
| SPB:收缩压;HR:心率;Weight gain:体重增长;NE:去甲肾上腺素。aP < 0.05 vs对照 图 1 应激性高血压大鼠血压、心率、体重增长及血清去甲肾上腺素的变化 |
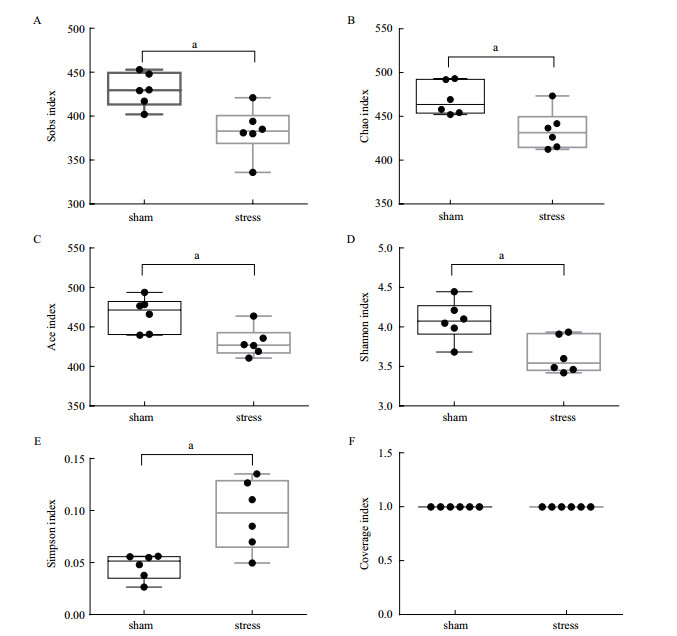
α多样性反映群落中所含物种的种类数目和群落中各物种的相对密度是否均匀。分别取sham组和stress组大鼠粪便, 进行群落多样性测序及交互式分析。α多样性分析显示, 应激性高血压大鼠肠道菌群OTU数目少于对照组(图 2-A); chao和ace指数均小于对照组, 表明群落丰富度低于对照组(图 2-B-C); Shannon指数低于对照组, 而Simpson指数高于对照组, 说明群落多样性高于对照组(图 2-D-E); converge显示对照组和应激组的物种覆盖度没有差异(图 2-F)。结果显示, 引起高血压的慢性应激显著降低了肠道菌群的丰富度。
|
| A:大鼠肠道菌群OUT数目;B-C:大鼠肠道菌群丰度;D-E:大鼠肠道菌群多样性;F:大鼠菌群覆盖指数。aP < 0.05 vs对照组 图 2 慢性应激对大鼠肠道菌群α多样性的影响。 |
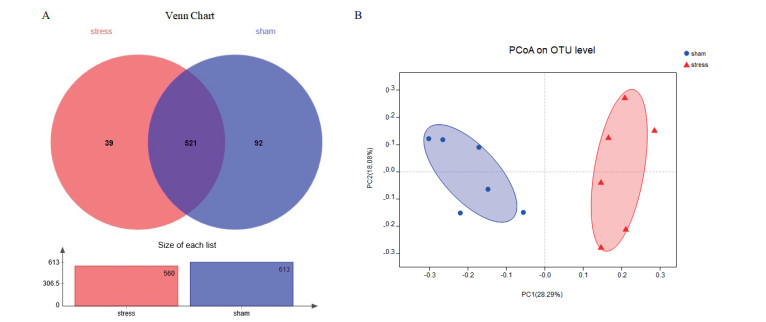
通过Venn图分析应激性高血压大鼠与对照大鼠肠道菌群的物种组成, 应激性高血压大鼠肠道菌群OTU数目为560种, 低于stress组大鼠的613种, 两组共有的OTU数目为521种(图 3-A)。为了进一步评估两组样本间OTU组成的相似性和差异性, 进行β多样性分析, 基于bray_curtis距离PCoA分析, 应激性高血压大鼠各样本在平面图的分布区域与对照组明显不同, 相互距离较远, 分界清楚(图 3-B), 显示了慢性应激降低了大鼠肠道菌群物种数目, 并改变了物种组成。
|
| A:Venn图示大鼠肠道菌群的种类组成和分布情况柱状图示菌群物种数量;B:PCoA图示大鼠肠道菌群生境间多样性 图 3 慢性应激对大鼠肠道菌群组成和多样性的影响 |
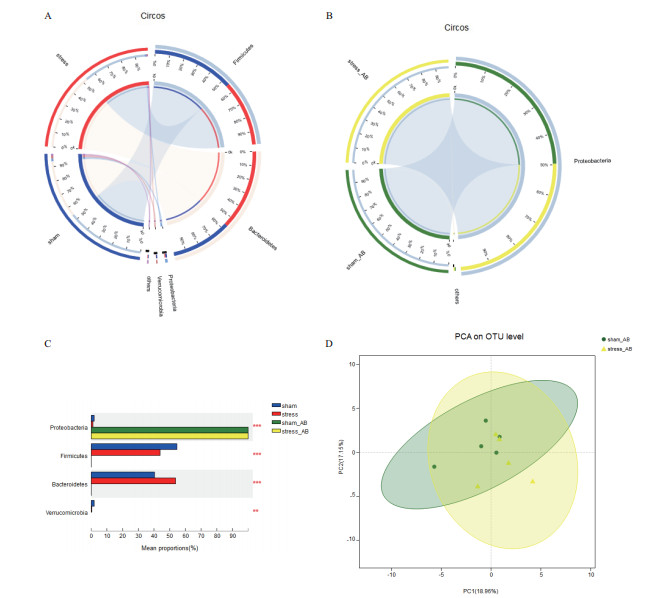
慢性应激14 d大鼠肠道菌群的组成发生显著改变。用Circos图反映各组Phylum(门)分类学水平下物种的分布比例情况, 对照组和应激组样本中物种比较丰富, 以厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为主(图 4-A)。
|
| A:样本和物种之间的关系,左半部分代表应激组和对照组的物种组成。蓝色的带表示对照组,红色的带表示应激组。内部的颜色代表物种。灰色代表厚壁菌门,粉红色代表拟杆菌门。长度表示相应样本中物种的相对丰度。图中右半部分为不同标本在门水平上的物种分布。外带代表物种,内带的颜色代表不同的组,长度代表样本在一个物种中分布的比例;B:不同处理组的物种组成,外层的绿色带代表对照+抗生素组,黄色带代表应激+抗生素组,内部的颜色代表物种,灰色代表变形杆菌;C:不同处理组菌群在门水平上的差异性分析。D:不同处理组肠道菌群生境间多样性,绿色的点代表对照+抗生素组样本,黄色的三角形代表应激+抗生素组组样本 图 4 抗生素对肠道菌群丰度和多样性的作用 |
抗生素制备的伪无菌鼠肠道菌群的丰度和多样性显著下降。Sham_AB和stress_AB组物种单一, 基本均为变形菌门(Proteobacteria)(图 4-B)。用Kruskal-Wallis秩和检验(Kruskal-Wallis H test)对4组样本在Phylum(门)水平下进行显著性差异分析, 与Circos图结果一致, 对照组和应激组大鼠的优势菌是厚壁菌门和拟杆菌门, 而sham_AB和stress_AB组的优势菌是Proteobacteria(图 4-C)。用PCA图比较sham_AB和stress_AB组肠道菌群的β多样性的结果显示, sham_AB和stress_AB组样本点非常接近, 表明两组物种组成在门水平相似(图 4-D), 即饮用抗生素水的大鼠, 肠道除了少量的变形菌门外, 没有其他菌群物种存在, 提示慢性应激不能明显改变伪无菌大鼠的肠道菌群在门水平的组成。
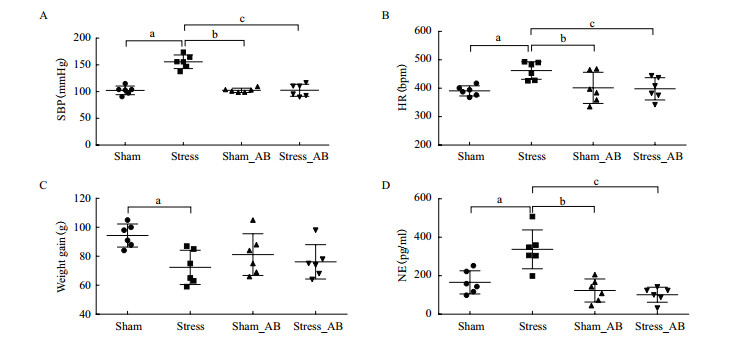
2.5 慢性应激不改变伪无菌鼠BP、HR、体重及血清NE浓度SD大鼠接受14 d的慢性足底电击结合噪声应激后, 血压升高、心率加快、体重增长缓慢及血清去甲肾上腺素浓度增加。饮用含四联抗生素饮用水的伪无菌鼠, 其血压、心率、体重增长及血清去甲肾上腺素浓度与正常饮水组大鼠相比, 无显著变化。饮用四联抗生素水的伪无菌鼠接受相同应激刺激后, 未出现正常大鼠应激后血压升高、心率加快、体重增长缓慢及血清去甲肾上腺素浓度增加的变化(图 5), 显示应激引起的这些变化对肠道菌群的依赖性。
|
| aP < 0.05 vs对照+溶剂;bP < 0.05 vs对照+抗生素;cP < 0.05 vs应激+抗生素 图 5 慢性应激对伪无菌大鼠血压、心率、体重增加及血清去甲肾上腺素浓度的变化 |
本研究采用足底电击结合噪声刺激方法建立应激性高血压动物模型。这一方法是国际上普遍认可的大鼠应激性高血压造模方法[12-13]。本研究结果显示, 这种应激方法, 使大鼠血压升高、心率增快, 体重增长缓慢, 血清NE浓度增加, 表明高血压模型成功。大鼠粪便标本应用16S rRNA测序分析显示, 肠道菌群丰富度、多样性下降, 物种组成数目下降。大鼠饮用含四联广谱抗生素水一个月后, 肠道菌群基本杀灭, 成为伪无菌鼠。给予伪无菌鼠相同的足底电击结合噪声的慢性应激, 不再引起大鼠的血压升高、心率增快和血清NE浓度增加。这些结果提示, 应激性高血压的发生与肠道菌群的紊乱密切相关。
应激可通过激活交感肾上腺髓质系统和下丘脑-垂体-肾上腺皮质轴引起血压升高等应激反应[14-15]。本文通过足底电击结合噪声的方法建立的应激性高血压大鼠模型一般在电击第5天开始, 血压和心率就明显升高, 第10天达到峰值, 持续应激到14 d, 期间的血压和心率维持在最高水平。应激性高血压大鼠除了血压和心率的变化, 在行为上还表现为躁动不安、警觉性增高、且易于激惹; 在饮食上发现饮水增多, 但食用饲料量减少, 有厌食现象, 因此体重增长缓慢[16]。这些现象都显示, 应激引起了交感肾上腺髓质系统和下丘脑-垂体-肾上腺皮质轴的激活。就血压而言, 交感肾上腺髓质系统和下丘脑-垂体-肾上腺皮质轴的激活最终通过增加外周交感神经的活动引起血压升高。外周血中的NE浓度可反映交感活动的状态。我们使用ELISA方法检测大鼠血清NE浓度, 发现应激性高血压大鼠血清NE浓度明显增加, 说明交感神经兴奋性增强, 是应激引起血压升高的机制。
研究表明, 应激改变肠道菌群[17]。菌群介导应激反应得到了用益生菌和/或抗生素处理的无菌小鼠等啮齿类动物实验及临床试验的支持。无菌成年小鼠可放大应激诱导的肾上腺皮质激素和皮质酮的释放, 无菌小鼠的这种应激反应可以通过移植对照动物的粪便部分逆转[18]。益生菌降低大鼠急性应激时的肠道通透性和下丘脑-垂体-肾上腺轴反应[19]; 给予成年人补充益生菌植物乳杆菌P8可缓解压力和焦虑, 提高社会情绪认知、口头学习和记忆能力, 降低血浆皮质醇水平和促炎细胞因子IFN-γ、TNF-α等水平[20]。本实验发现, 应激性高血压大鼠肠道菌群的OTU数目下降, α多样性分析显示应激引起菌群的丰富度下降; 通过β多样性分析发现, 与对照组相比, 应激性高血压大鼠肠道菌群多样性下降, 且引起了菌群物种组成与正常组明显差异。这些改变提示, 应激引起了肠道菌群紊乱。高血压的发生与肠道菌群的变化相关[7]的研究提示, 应激引起的肠道菌群紊乱可能是应激性高血压的原因。为了进一步探讨应激引起的肠道菌群变化与应激性高血压的发生存在因果关系, 我们将四联广谱抗生素加在大鼠饮用水中4周, 制备伪无菌鼠。使用抗生素清除肠道菌群是观察菌群在疾病发生机制中的一种方法, 比直接使用无菌鼠更便于实验的开展。本研究使用抗生素的时间较长, 一是应激性高血压造模周期需2周时间, 二是尽可能清除肠道菌群。本文对使用四联抗生素4周大鼠粪便的进行16S rRNA测序分析显示, 仅存少量的变形菌门, 基本达到无菌的目的。本实验结果显示, 引起正常大鼠产生高血压的慢性应激方法不再引起伪无菌大鼠的交感神经活动增强、血压升高, 这一结果表明, 肠道菌群参与了应激性高血压的发生。虽然许多研究都显示, 肠道菌群紊乱与人和动物高血压的发生密切相关, 但肠道菌群紊乱引起高血压的机制还不清楚[21]。最近的文献表明, 肠道菌群的代谢产物短链脂肪酸(Short-chain fatty acids, SCFAs)参与高血压的调节, 肠道菌群紊乱引起SCFAs减少可能成为血压升高的因素[5, 22]。在血管紧张素II诱发的高血压小鼠模型中, 补充丁酸盐可显著降低血压, 而高血压患者循环丁酸盐降低[23]。SCFAs可通过通过分布在肾脏或血管内膜上的受体对血压进行调节[24]。临床研究显示通过高纤维食物补充SCFAs具有抗高血压的作用[25]。肠道菌群紊乱可能导致交感神经活性增加而成为高血压的机制[26]。我们过去的工作表明, 下丘脑室旁核小胶质细胞激活引起的神经炎症是应激性高血压发生的重要机制[13], 下丘脑室旁核促炎型小胶质细胞增多, 炎症因子表达增加丁酸具有抑制促炎型小胶质细胞的作用, 在应激情况下, 是否由于肠道丁酸的减少, 影响室旁核神经炎症的机制引起血压的改变等, 都有待进一步探讨。
4 结论应激性高血压大鼠肠道菌群丰富度和多样性下降, 菌群物种组成变少, 差异性变大。抗生素处理形成的伪无菌鼠, 肠道菌群物种单一, 仅有少量的变形菌门。给予伪无菌鼠慢性应激, 不再引起大鼠血压升高, 心率增快, 血清去甲肾上腺素浓度未升高。这提示了应激性高血压的发生对肠道菌群的依赖性。
| [1] |
马丽媛, 吴亚哲, 陈伟伟. 《中国心血管病报告2018》要点介绍[J]. 中华高血压杂志, 2019, 27(8): 712-716. |
| [2] |
Franco GP, de Barros AL, Nogueira-Martins LA, et al. Stress influence on genesis, onset and maintenance of cardiovascular diseases :literature review[J]. Journal of Advanced Nursing, 2003, 43(6): 548-554. DOI:10.1046/j.1365-2648.2003.02753.x |
| [3] |
Du D, Hu L, Wu J, et al. Neuroinflammation contributes to autophagy flux blockage in the neurons of rostral ventrolateral medulla in stressinduced hypertension rats[J]. Journal of Neuroinflammation, 2017, 14: 169. DOI:10.1186/s12974-017-0942-2 |
| [4] |
Xiao F, Jiang M, Du D, et al. Orexin A regulates cardiovascular responses in stress-induced hypertensive rats[J]. Neuropharmacology, 2013, 67: 16-24. DOI:10.1016/j.neuropharm.2012.10.021 |
| [5] |
Yang T, Santisteban MM, Rodriguez V, et al. Gut dysbiosis is linked to hypertension[J]. Hypertension, 2015, 65(6): 1331-1340. DOI:10.1161/HYPERTENSIONAHA.115.05315 |
| [6] |
Durgan DJ, Ganesh BP, Cope JL, et al. Role of the gut microbiome in obstructive sleep apnea-induced hypertension[J]. Hypertension, 2016, 67(2): 469-474. DOI:10.1161/HYPERTENSIONAHA.115.06672 |
| [7] |
Li J, Zhao F, et al. Gut microbiota dysbiosis contributes to the development of hypertension[J]. Microbiome, 2017, 5(1): 14. DOI:10.1186/s40168-016-0222-x |
| [8] |
Moghadamrad S, McCoy KD, Geuking MB, et al. Attenuated portal hypertension in germ-free mice :Function of bacterial flora on the development of mesenteric lymphatic and blood vessels[J]. Hepatology, 2015, 61(5): 1685-1695. DOI:10.1002/hep.27698 |
| [9] |
Jama HA, Beale A, et al. The effect of diet on hypertensive pathology :is there a link via gut microbiota-driven immunometabolism?[J]. Cardiovasc Res, 2019, 115(9): 1435-1447. DOI:10.1093/cvr/cvz091 |
| [10] |
Patel RM, Myers LS, Kurundkar AR, et al. Probiotic bacteria induce maturation of intestinal claudin 3 expression and barrier function[J]. Am J Pathol, 2012, 180(2): 626-635. DOI:10.1016/j.ajpath.2011.10.025 |
| [11] |
Song C, Wang B, Tan J, et al. Comparative analysis of the gut microbiota of black bears in China using high-throughput sequencing[J]. Mol Genet Genomics, 2017, 292(2): 407-414. DOI:10.1007/s00438-016-1282-0 |
| [12] |
Wu Q, Mi Y, Cheng W, et al. Infiltrating T helper 17 cells in the paraventricular nucleus are pathogenic for stress-induced hypertension[J]. Biochemical and Biophysical Research Communications, 2019, 515(1): 169-175. DOI:10.1016/j.bbrc.2019.05.121 |
| [13] |
Mi Y, Wu Q, Yuan W, et al. Role of microglia M1/M2 polarisation in the paraventricular nucleus :New insight into the development of stress-induced hypertension in rats[J]. Auton Neurosci, 2018, 213: 71-80. DOI:10.1016/j.autneu.2018.06.003 |
| [14] |
Gameiro GH, Gameiro PH, et al. Nociception- and anxietylike behavior in rats submitted to different periods of restraint stress[J]. Physiology & Behavior, 2006, 87(4): 643-649. |
| [15] |
朱大年. 肾上腺皮质激素在应激性高血压发病中的中枢机制[J]. 生理科学进展, 1996(4): 324-326. DOI:10.3321/j.issn:0559-7765.1996.04.002 |
| [16] |
Sgoifo A, Koolhaas J, De Boer S, et al. Social stress, autonomic neural activation, and cardiac activity in rats[J]. Neurosci Biobehav Rev, 1999, 23(7): 915-923. DOI:10.1016/S0149-7634(99)00025-1 |
| [17] |
Foster JA, Rinaman L, Cryan JF. Stress & the gut-brain axis : Regulation by the microbiome[J]. Neurobiology of Stress, 2017, 7: 124-136. DOI:10.1016/j.ynstr.2017.03.001 |
| [18] |
Sudo N, Chida Y, et al. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice[J]. The Journal of Physiology, 2004, 558(1): 263-275. DOI:10.1113/jphysiol.2004.063388 |
| [19] |
Ait-Belgnaoui A, Durand H, Cartier C, et al. Prevention of gut leakiness by a probiotic treatment leads to attenuated HPA response to an acute psychological stress in rats[J]. Psychoneuroendocrinology, 2012, 37(11): 1885-1895. DOI:10.1016/j.psyneuen.2012.03.024 |
| [20] |
Lew L, Hor Y, et al. Probiotic Lactobacillus plantarum P8 alleviated stress and anxiety while enhancing memory and cognition in stressed adults :A randomised, double-blind, placebo-controlled study[J]. Clinical Nutrition, 2019, 38(5): 2053-2064. DOI:10.1016/j.clnu.2018.09.010 |
| [21] |
Marques FZ, Mackay CR, Kaye DM. Beyond gut feelings :how the gut microbiota regulates blood pressure[J]. Nat Rev Cardiol, 2018, 15(1): 20-32. DOI:10.1038/nrcardio.2017.120 |
| [22] |
Felizardo RJF, Watanabe IKM, Dardi P, et al. The interplay among gut microbiota, hypertension and kidney diseases :The role of short-chain fatty acids[J]. Pharmacological Research, 2019, 141: 366-377. DOI:10.1016/j.phrs.2019.01.019 |
| [23] |
Kim S, Goel R, Kumar A, et al. Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure[J]. Clin Sci, 2018, 132(6): 701-718. DOI:10.1042/CS20180087 |
| [24] |
Natarajan N, Hori D, et al. Microbial short chain fatty acid metabolites lower blood pressure via endothelial G protein-coupled receptor 41[J]. Physiol Genomics, 2016, 48(11): 826-834. DOI:10.1152/physiolgenomics.00089.2016 |
| [25] |
Miura K, Greenland P, Stamler J, et al. Relation of vegetable, fruit, and meat intake to 7-year blood pressure change in middle-aged men :the chicago western electric study[J]. Am J Epidemiol, 2004, 159(6): 572-580. DOI:10.1093/aje/kwh085 |
| [26] |
Santisteban MM, Qi Y, Zubcevic J, et al. Hypertension-linked pathophysiological alterations in the gut[J]. Circ Res, 2017, 120(2): 312-323. DOI:10.1161/CIRCRESAHA.116.309006 |



