纤维素生物质是地球上最丰富的可再生资源之一[1]。我国拥有丰富的纤维素资源, 但因不能得到及时有效的利用, 不仅造成了资源浪费, 也给自然环境带来了巨大威胁[2]。纤维素酶属于一种多酶复合体, 主要包括内切葡聚糖酶(Endoglucanase, EG), 外切β-1, 4-葡聚糖酶(Exglucanase, CBH)和β-1, 4-葡聚糖酶(β-glucosidase, 简称BG) 3种, 只有和组分酶共同作用时才能将纤维素彻底水解为葡萄糖并应用于工业生产[3]。通过微生物产酶降解纤维素具有反应条件温和, 无污染等优点[4]。目前, 从自然界中获取的纤维素降解菌, 由于其酶产量、酶稳定性、酶系组成和酶的催化效率等因素限制, 应用于工业生产的菌株非常有限, 纤维素酶的生产远远不能满足工业的需求。
克氏原螯虾(Procambarus clarkii), 俗称小龙虾, 属甲壳纲(Crustacea)、十足目(Decapoda)、蝲蛄科(Cambaridae)、原螯虾属(Procambarus)动物[5]。目前, 小龙虾养殖产业飞速发展, 由最初的养殖和简单的加工出口不断发展完善, 成为集育苗、养殖、加工、餐饮、销售、休闲旅游、文化等为一体的综合产业。然而, 小龙虾养殖大都仍采用玉米、小麦、野杂鱼等天然饵料或其他虾蟹饲料替代以及一些人工配合饲料产品, 存在饲料利用率低, 粪便污染养殖环境, 小龙虾生长性能低下等问题。从小龙虾肠道中分离高产纤维素酶的土著细菌, 制备小龙虾肠道微生物源微生物制剂, 开发小龙虾专属功能饲料已迫在眉睫。小龙虾为杂食性动物, 在天然条件下主要摄食有机物碎屑、藻类、水生植物的根、叶及碎片, 特别喜食汁多肥嫩的绿色植物, 如水浮莲、绿萍和水葫芦等, 可见小龙虾具有很强的纤维素降解能力。小龙虾肠道微生物是小龙虾降解纤维素和半纤维素的主要驱动力。因此, 在小龙虾肠道内有望筛选到高产纤维素酶的优良菌株, 服务于小龙虾饲料产业。
目前, 国内外对克氏原螯虾的研究主要集中于其行为学[6-7]、种群结构与分布[8-9]及疾病与免疫方面[10-12], 对营养饲料方面的研究也主要集中在蛋白质、脂肪等方面[13], 而对于小龙虾肠道细菌的相关研究却鲜有报道。本研究采用纯培养法, 从小龙虾肠道中分离筛选产纤维素酶的细菌, 进行形态学和分子生物学初步鉴定, 对高活性菌株进行基因组扫描分析, 一方面期望获得全新的高产纤维素酶的优良菌株以及基因资源; 另一方面, 也为研究小龙虾肠道菌群结构和纤维素的降解机制提供理论支撑, 为创制新型小龙虾饲料开辟新途径。
1 材料与方法 1.1 材料 1.1.1 小龙虾取自本校小龙虾养殖基地虾池。养殖基地位于湖北省武汉市汤逊湖旁, 共有8个10 m× 5 m的虾池。投喂饲料购自湖北渴望牧业有限责任公司, 扶龙牌龙虾配合饲料。
1.1.2 主要试剂和仪器以及培养基羧甲基纤维素钠, 国药集团化学试剂有限公司; 2×Taq MasterMix, 北京宝日医生物技术有限公司; PCR仪, Bio-Rad公司。LB培养基:胰蛋白胨10 g, NaCl 10 g, 酵母抽提物5 g, 溶于1 L双蒸水中, 固体培养基加入琼脂粉15 g, 1×105 Pa灭菌20 min。筛选培养基(g/L):胰蛋白胨2.0, NaCl 2.0, 酵母抽提物1.0, pH 7.0, 琼脂粉15.0, 羧甲基纤维素钠10.0, 1×105 Pa灭菌20 min。
1.2 方法 1.2.1 产纤维素酶菌的筛选选取10只小龙虾, 用70%酒精、无菌水依次清洗体表。拉出整个肠道, 放于无菌离心管中。用灭菌的匀浆棒冰上匀浆, 充分匀浆后的液体即为小龙虾全肠菌悬液。将小龙虾全肠菌悬液稀释涂平板, 梯度从10-2-10-7, 每个梯度涂两个平行。在28℃的恒温箱中进行倒置培养2 d。将LB培养基上长出的菌分类标记后, 用牙签点在添加1%羧甲基纤维素钠的筛选培养基上, 28℃的恒温箱中倒置培养24 h。用沾了酒精的纸板轻轻刮去培养基表面的菌体, 刚果红染色15 min, NaCl脱色30 min, 观察水解圈的形成。将有水解圈的菌落在筛选培养基的平板上进行分离纯化。记录水解圈直径和菌落直径大小, 并将纯化的菌种-80℃甘油保藏。
1.2.2 菌株的形态学鉴定对所筛选的菌株13和菌株33分别进行菌落形态观察和显微观察, 进行革兰氏染色和芽孢染色。参照《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》初步判断所筛选菌株的科属。
1.2.3 菌株的分子生物学鉴定采用细菌通用引物27F和1492R进行16S rRNA基因PCR扩增[14]。PCR结束后, 进行琼脂糖凝胶电泳检测PCR扩增结果, 送至上海桑尼生物科技有限公司测序。
1.2.4 菌株33基因组扫描测序提取菌株33基因组DNA, 采用Illumina Hiseq 4000测序技术完成菌株的基因组扫描测序, 构建Illumina PE文库(300 bp-500 bp文库), 对获得的测序数据进行质控后利用生物信息学分析手段完成菌株碳水化合物相关酶基因扫描。
2 结果 2.1 小龙虾肠道产纤维素酶细菌的分离与筛选在筛选培养基平板中, 菌株能够利用培养基中的营养物质进行生长并产生纤维素酶, 使培养基中的羧甲基纤维素水解并形成透明圈。水解圈直径与菌落直径之比较大的菌株产纤维素酶能力比较强, 反之较弱。从表 1中可以看出菌株33产酶能力最大, 其次是菌株13、27、22、25、31, 菌株29产酶能力最小。
选取产酶能力较强的2个菌株13和33号, 进行革兰氏染色以及芽孢染色, 结果如图 1, 13和33号菌株均能产芽孢。菌株13号菌落表面湿润、菌落乳白色, 属革兰氏阳性菌, 产芽孢; 菌株33菌落形态呈现白色、圆形、扁平状态, 菌落均匀不透明且边缘整齐, 属革兰氏阳性菌, 产芽孢。
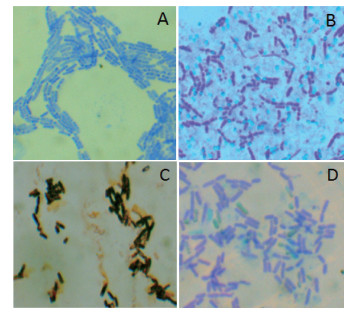
|
| A:菌株13,革兰氏阳性菌;B:菌株13的芽孢染色,绿色为芽孢,红色为菌体;C:菌株33,革兰氏阳性菌;D:菌株33的芽孢染色,绿色为芽孢,红色为菌体 图 1 形态学鉴定结果(×1 000) |
将筛选菌株进行16S rRNA基因扩增, 得到约1 500 bp的PCR产物(图 2)。根据NCBI的BLAST比对以及系统发育树(图 3)可知, 菌株13为贝莱斯芽孢杆菌, 菌株33属于枯草芽孢杆菌, 皆与形态学鉴定结果相吻合。

|
| M:DNA Marker;13、33:16S rRNA基因扩增序列 图 2 PCR产物扩增结果 |

|
| 图 3 菌株13、33的16S rRNA基因系统发育树 |
节点左边的数值是基于邻接法1 000次重复取样数据集的Bootstrap支持率; 比例尺0.01表示1 000个核苷酸中有10个被替换; 括号内的序号表示相应序列在GenBank的登录号。
2.3 菌株33基因组扫描测序 2.3.1 菌株33基因组概况采用Illumina Hiseq4000测序技术对样品的DNA进行paired-end(PE)测序, 构建300 bp-500 bp文库, 利用SOAPdenovo v2.04和velvet拼接软件对优化序列进行组装, 通过Glimmer3.02软件进行细菌的基因预测, 测序数据和基因预测结果见表 2。
CAZy数据库专业收集各种碳水化合物酶类, 目前, 数据库包含糖苷水解酶类(GHs)、糖苷转移酶类(GTs)、多糖裂解酶类(PLs)、糖水化合物酯酶类(CEs)、碳水化合物结合模块(CBMs)和辅助模块酶类(AAs)6大类家族, 其同源家族数目分别达到了149、105、27、16、83和14个。使用HMMs方法在所获得的蛋白质序列中鉴定CAZy数据库中含有的各种酶类的结构信息, 从而鉴定菌株33基因组中碳水化合物相关酶基因, 并将这些按照种类分为6大类, 结果见表 3。菌株33基因组含有较多的碳水化合物相关酶基因, 分属于6大类家族, 其中糖苷水解酶类包含GH1、GH4、GH23、GH26等32个家族, 同源家族数目达69个; 碳水化合物结合模块包含CBM16、CBM16、CBM50等12个家族, 同源家族数目达47个; 糖苷转移酶类包含GT2、GT4、GT26等12个家族, 同源家族数目达43个; 糖水化合物酯酶类包含CE1、CE7、CE12等9个家族, 同源家族数目达30个; 辅助模块酶类包含AA4、AA6和AA7三个家族, 同源家族数目达8个; 多糖裂解酶类包含PL1-6、PL3-1、PL26等6个家族, 同源家族数目达7个。菌株33含有丰富的碳水化合物相关酶基因资源, 通过研究这些基因的表达调控, 可以揭开菌株33降解纤维素的机制, 也有望获得新的高效表达的纤维素酶基因资源。
纤维素由数百至数千个葡萄糖分子聚合而成, 是地球上存在最丰富的有机大分子[15]。纤维素酶能够水解纤维素为葡萄糖并应用于工业生产, 具有十分广阔的应用前景。随着生物技术在工业中的发展, 纤维素酶被广泛应用于饲料生产、食品医药、制浆造纸、能源工业等行业, 创造了巨大的经济价值[16]。然而, 目前工业应用的一些纤维素酶产品, 受到酶的特性限制, 如酶产量、酶稳定性、酶系组成和酶的催化效率等因素, 阻碍了这些纤维素酶产品在一些行业中的推广; 一些产纤维素酶菌株也由于其自身的生理特性而在某些行业得不到应用。因此, 根据行业发展, 筛选新的适合行业需求的高效纤维素降解菌和纤维素酶基因资源, 仍然具有十分重要的意义, 也有望解决纤维素酶产量和活性不高, 纤维素酶降解菌不能定植等问题。以小龙虾行业为例, 小龙虾饲料的产业发展制约着小龙虾行业的革新。目前, 小龙虾养殖大都采用野杂鱼、玉米、小麦等天然饵料或其他虾蟹饲料替代进行饲喂[17], 随着养殖规模的不断扩大, 小龙虾人工配合饲料的开发也越来越受到人们的关注。但是, 迄今为止, 有关小龙虾饲料方面的研究, 主要集中在蛋白质和脂肪需求等方面, 但未见有小龙虾功能性饲料的相关报道。许多研究也表明, 土著微生物对固有环境具有更好的适应性, 土著肠道微生物更容易在宿主肠道中定植, 从而起到和宿主的互利共生作用[18]。从小龙虾肠道中分离高产消化酶的土著细菌, 制备小龙虾肠道微生物源微生物制剂, 开发小龙虾专属功能饲料已迫在眉睫。
肠道不仅是生命体吸收、消化和进行营养物质交换的重要场所, 也是机体与外界环境联系最紧密的器官之一[19]。肠道微生物栖居于肠道内, 与宿主形成共生关系, 在宿主营养吸收、生长代谢和免疫抗病等方面都发挥着重要作用[20-21]。随着人们对肠道微生物的重视程度日益提高, 关于肠道微生物的研究也逐渐增多。关于肠道微生物的功能研究, 主要有两个方面:一是肠道菌群的研究, 可以了解肠道微生物的结构与组成, 为研究微生物的功能以及在肠道中发挥的作用提供指导, 笔者在先前的研究中, 通过高通量测序技术分析了小龙虾肠道细菌菌群的结构发现, 在属水平上, 小龙虾肠道细菌主要是Candidatus Bacilloplasma、拟杆菌属、弧菌属、不动杆菌属、Dysgonomonas、Tyzzerella 3、气单胞菌属细菌, 为小龙虾肠道微生物的功能研究提供了一定参考[22]; 另一方面是肠道功能微生物的研究, 本研究中从小龙虾肠道中筛选出7株产纤维素酶菌株, 对产酶活性较高的2株菌株13、33进行形态学和分子生物学鉴定, 其中菌株13为贝莱斯芽孢杆菌(Bacillus velezensis), 菌株33为枯草芽孢杆菌(Bacillus subtilis)。芽孢杆菌属(Bacillus)是一类产芽孢的革兰氏阳性细菌, 好氧或兼性厌氧生活。芽孢杆菌属不是小龙虾肠道核心菌群, 但是芽孢杆菌属细菌在小龙虾肠道降解纤维素过程中发挥着一定功能。小龙虾以植物根、叶为食, 肠道中生存着大量的纤维素降解细菌, 从小龙虾肠道中筛选产纤维素酶细菌, 有望获得全新的纤维素酶菌株资源和基因资源, 它们对于小龙虾肠道微生物源专属饲料的开发和应用也具有十分重要的意义。菌株33具有多种水解酶活性, 并有较高的纤维素降解能力, 高通量测序结果表明该菌基因组含有许多碳水化合物相关酶基因。通过研究这些基因的表达调控, 可以弄清菌株33降解纤维素的机理, 探明其在小龙虾肠道内降解纤维素过程中发挥的作用。同时, 对这些纤维素酶基因进行克隆和外源表达, 也有望获得可以工业应用的纤维素酶产品。
4 结论本研究从小龙虾肠道中筛选到7株产纤维素酶菌株, 对产酶活性较高的2株菌株13、33进行形态学和分子生物学鉴定, 其中菌株13为贝莱斯芽孢杆菌, 菌株33为枯草芽孢杆菌, 菌株33具有多种水解酶活性, 并有较高的纤维素降解能力, 表明小龙虾肠道中含有丰富的纤维素降解菌, 芽孢杆菌属细菌占据着一定比重, 从小龙虾肠道中有望筛选到可以应用于饲料工业的优良菌株。菌株33高通量测序结果也表明该菌基因组中含有许多碳水化合物相关酶基因, 后续可以对菌株33的纤维素酶基因进行体外分子改良及高产纤维素酶活性内源性益生菌的构建, 以期提高饲料利用率。
| [1] |
李永博, 黄治国, 赵阳, 等. 窖泥中产纤维素酶菌株的筛选鉴定及产酶特性的研究[J]. 食品科技, 2018, 43(2): 9-14. |
| [2] |
刘海艳, 白龙, 赵海波, 等. 纤维素酶高产菌的筛选鉴定及纤维素酶基因的克隆与表达[J]. 中国农业大学学报, 2012, 17(5): 92-98. |
| [3] |
许志, 曾柏全, 宋睿. 高产纤维素酶菌株筛选及诱变选育[J]. 中国农学通报, 2011, 27(24): 108-111. |
| [4] |
张玲秀, 白建华, 郝瑞林, 等. 一株粗糙脉胞菌的鉴定及产纤维素酶发酵工艺优化[J]. 中国饲料, 2018(1): 27-31. |
| [5] |
何亚丁, 华雪铭, 赵朝阳, 等. 克氏原螯虾的脂肪需求量及饲料中脂肪与糖类适宜比例的研究[J]. 动物营养学报, 2013, 25(5): 1017-1024. DOI:10.3969/j.issn.1006-267x.2013.05.017 |
| [6] |
James J, Davidson KE, Richardson G, et al. Reduced aggression and foraging efficiency of invasive signal crayfish(Pacifastacus leniusculus)infested with non-native branchiobdellidans(Annelida: Clitellata)[J]. Parasites & Vectors, 2015, 8: 596. |
| [7] |
Nishijima S, Nishikawa C, Miyashita T. Habitat modification by invasive crayfish can facilitate its growth through enhanced food accessibility[J]. BMC Ecology, 2017, 17: 37. DOI:10.1186/s12898-017-0147-7 |
| [8] |
Stern DB, Breinholt J, Pedraza-Lara C, et al. Phylogenetic evidence from freshwater crayfishes that cave adaptation is not an evolutionary dead-end[J]. Evolution, 2017, 71(10): 2522-2532. DOI:10.1111/evo.13326 |
| [9] |
Cai W, Ma Z, Yang C, et al. Using eDNA to detect the distribution and density of invasive crayfish in the Honghe-Hani rice terrace world heritage site[J]. PLoS One, 2017, 12(5): e0177724. DOI:10.1371/journal.pone.0177724 |
| [10] |
黄素文, 杨文潮, 朱海, 等. 淡水小龙虾主要过敏原原肌球蛋白基因的克隆、表达及其免疫活性鉴定[J]. 中国免疫学杂志, 2011, 27(7): 642-647. DOI:10.3969/j.issn.1000-484X.2011.07.015 |
| [11] |
Lan JF, Li XC, Sun JJ, et al. Prohibitin interacts with envelope proteins of white spot syndrome virus and prevents infection in the red swamp crayfish, Procambarus clarkii[J]. Journal of Virology, 2013, 87(23): 12756-1276. DOI:10.1128/JVI.02198-13 |
| [12] |
Song JH, Dai F, Bai X, et al. Recent incidence of paragonimus westermani metacercariae in freshwater crayfish, cambaroides similis, from two enzootic sites in jeollanam-do, Korea[J]. Korean Journal of Parasitology, 2017, 55(3): 347-350. DOI:10.3347/kjp.2017.55.3.347 |
| [13] |
李强, 谢玲玲, 林郁葱, 等. 克氏原螯虾对饲料中磷的需求量[J]. 华中农业大学学报, 2013, 32(2): 109-115. DOI:10.3969/j.issn.1000-2421.2013.02.019 |
| [14] |
Weisburg WG, Barns SM, Pelletier DA. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 173(2): 697-703. DOI:10.1128/JB.173.2.697-703.1991 |
| [15] |
安琪, 吴雪君, 吴冰, 等. 不同碳源和氮源对金针菇降解木质纤维素酶活性的影响[J]. 菌物学报, 2015, 34(4): 761-771. |
| [16] |
张岩, 王淑琦, 耿雪萌, 等. 纤维素酶促进绿化废弃物堆肥腐熟的初步研究[J]. 环境科学与技术, 2018, 41(2): 144-150. |
| [17] |
王天神, 周鑫, 赵朝阳. 3种饲料对克氏原螯虾生长、免疫酶、氨基酸含量及消化酶活性的影响[J]. 上海海洋大学学报, 2012, 21(6): 1011-1016. |
| [18] |
Deng XH, Chai LY, Yang ZH, et al. Bioleaching mechanism of heavy metals in the mixture of contaminated soil and slag by using indigenous Penicillium chrysogenum strain F1[J]. Journal of Hazardous Materials, 2013, 248-249: 107-114. DOI:10.1016/j.jhazmat.2012.12.051 |
| [19] |
黄钦成, 谭北平, 董晓慧, 等. 饲料中添加壳寡糖和霉菌毒素吸附剂对凡纳滨对虾肠道黏膜形态及菌群结构的影响[J]. 中国水产科学, 2018, 25(2): 373-383. |
| [20] |
Mikaelyan A, Strassert JFH, Tokuda G, et al. The fibre-associated cellulolytic bacterial community in the hindgut of wood-feeding higher termites(Nasutitermes spp.)[J]. Environ Microbiol, 2014, 16(9): 2711-2722. DOI:10.1111/1462-2920.12425 |
| [21] |
Ni JF, Tokuda G. Lignocellulose-degrading enzymes from termites and their symbiotic microbiota[J]. Biotechnol Adv, 2013, 31(6): 838-850. DOI:10.1016/j.biotechadv.2013.04.005 |
| [22] |
冯光志, 邹颜霓, 王月琳, 等. 小龙虾肠道产木聚糖酶细菌的分离与鉴定[J]. 微生物学通报, 2019, 46(6): 1364-1370. |







