2. 中国农业科学院饲料研究所 农业部饲料生物技术重点实验室,北京 100081;
3. 挪威 - 中国鱼类消化道微生物联合实验室,特隆赫姆,挪威;
4. 北京市畜牧业环境监测站,北京 102200
2. Key Laboratory for Feed Biotechnology of the Ministry of Agriculture, Chinese Academy of Agricultural Sciences, Beijing 100081;
3. Norway-China Joint Lab on Fish Gut Microbiota, Trondheim, Norway;
4. Beijing Monitoring Station for Animal Husbandry Environment, Beijing 102200
肠道菌群是指存在于动物肠道中的数量庞大的微生物群体, 其中超过99%的都属于细菌, 其个体总数为100兆个, 约为体细胞数目的10倍, 其编码基因数目是人类基因组编码数的100-150倍[1]。肠道菌群也被称为肠道微生态系统, 作为最庞大、最复杂的微生态系统, 定殖于动物肠道内, 与宿主共生并互相影响, 参与调控宿主营养代谢和免疫抗病等生理过程[2]。近些年来, 肠道菌群代谢产物逐渐走进研究者的视野, 研究发现肠道菌群代谢产物也会进一步对宿主生理产生重要影响。短链脂肪酸(Short-chain fatty acids, SCFAs)作为肠道微生物重要的代谢物质之一, 也受到越来越多的关注。
改革开放以来, 我国水产养殖行业发展迅速, 据统计, 2018年我国水产品养殖总产量已经达到5×107 t, 已经占到我国全年水产品总产量的78%以上, 目前我国是世界上唯一一个水产品总产量中养殖量超过捕捞量的主要渔业国家[3]。我国水产养殖业的发展势头迅猛, 规模化、规范化、集约化的水产养殖除了带来可观的经济效益外, 也造成了水产养殖动物的应激加剧, 养殖环境日趋恶化, 病害发生率越来越高, 抗生素滥用等问题。水产养殖过程中滥用的抗生素等化学药物不仅增加病原菌的耐药性, 破坏水产动物的肠道菌群稳态, 也造成养殖环境抗生素超标; 同时, 残留在养殖水产动物中的抗生素也会通过食物链富集作用进入人体, 危害到人类的身体健康[4]。因此, 人们对无毒、无副作用、无污染的绿色安全替代物质的需求越来越迫切, 微生态制剂近些年逐渐应用于水产养殖行业, 具有绿色环保的优点, 但微生态制剂在水产养殖应用上也存在不足, 包括运输保存困难, 菌体易失活, 稳定性差等缺点。为实现水产养殖无抗无忧, 笔者所在团队提出益生元件是水产养殖绿色发展的优势策略[5-9]。"益生元件"即益生菌效应分子, 这些益生菌微生物相关的模式分子和特定结构的代谢产物通过影响微生物与宿主代谢信号传导途径, 亦或优化土著微生物菌群的结构, 调控宿主营养代谢及免疫[10]。SCFAs是肠道菌群发酵产生的重要代谢物质之一, 是近年来的研究热点, 对宿主的营养代谢与免疫抗病有重要影响, 有望弥补微生态制剂的不足[11]。
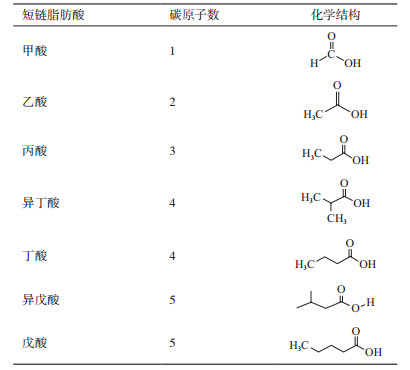
1 水产动物消化道短链脂肪酸的种类、分布与吸收SCFAs一般是不易消化的碳水化合物经肠道菌群厌氧发酵产生, 包括甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸, 其结构图如表 1。据报道, 哺乳动物近端结肠SCFAs含量约为120 mol/L, 远端结肠SCFAs含量为90 mol/L, 其中乙、丙、丁酸三者比例大致为3:1:1, 共占总量的95%, 是主要的SCFAs[12]。Mountfort等[13]研究发现, 水产动物中主要存在的SCFAs也为乙酸、丙酸, 丁酸。海鲤Crinodus lophodon)肠道中乙酸、丙酸、丁酸比例为8:3:1, 鲱鱼(Odax cyanomelas)肠道中乙、丙、丁酸比例为37:13:2, 鲳鱼(O. pullus)肠道中三者比例为20:4:1。SCFAs在3种温水海洋鱼类的不同肠道分区比例变化接近, 与哺乳动物相同的是, 3种鱼类中主要SCFAs也为乙酸, 在鱼类中浓度范围为20-29 mmol/L, 丙酸和丁酸含量较低[14]。不同的是, 水产动物肠道中丙酸的比例较哺乳动物有所提高, 丁酸含量比哺乳动物低。SCFAs可通过两种方式进入肠道, 包括简单扩散方式和主动运输方式, 进而对宿主产生调控作用。其中非游离SCFAs通过简单扩散方式经肠上皮屏障进入肠道细胞, 被肠道细胞吸收利用, 游离SCFAs经单羧酸转运蛋白1(Monocarboxylatetransporter1, MCT-1)和钠耦联单羧酸转运蛋白1(Sodium-coupled monocarboxylate transporter1, SMCT-1)这两种主要的转运体进入肠道, 发挥作用[15]。SCFAs也可通过G蛋白偶联受体(Gprotein-coupled receptor)发挥生物学效应, G蛋白偶联受体也称为游离脂肪酸受体, 能够识别游离脂肪酸, 目前已知的SCFAs受体有GPR41、GPR43和GPR109, 它们可通过短链脂肪酸, 调控动物肠道对营养物质的吸收、能量的吸收利用, 激素分泌、免疫抗病等多种生物学过程[16]。
SCFAs主要由乙酸盐、丙酸盐和丁酸盐组成, 在调节宿主代谢、免疫系统和细胞增殖方面具有关键作用。SCFAs在盲肠和近端结肠中浓度最高, 是结肠细胞能量来源(尤其是丁酸盐), 也可以通过门静脉转运到外周循环中作用于肝脏和外周组织。尽管外周循环中SCFAs水平较低, 但它们作为信号分子参与宿主不同的生物过程, 发挥调控作用[17]。
2.1 营养代谢调控效应SCFAs在肠道中浓度很高, 肠上皮细胞通过被动和主动机制将SCFAs吸收至细胞质中, 参与宿主能量代谢。哺乳动物中研究表明, SCFAs是肠上皮细胞重要的能量来源, SCFAs氧化后可为结肠黏膜细胞提供近70%的能量[18], 对混合SCFAs产生的二氧化碳的研究表明, 细胞利用SCFAs的顺序是丁酸、丙酸、乙酸[19]。乙酸作为动物肠道内含量最多的SCFAs, 可随血液进入全身循环, 肝可利用乙酸合成谷氨酰胺、长链脂肪酸、谷氨酸和β-羟丁酸; 乙酸盐也可通过中枢稳态机制穿过血脑屏障并降低食欲。丙酸可被肝脏吸收, 参与糖异生并抑制胆固醇合成, 约50%的丙酸在肝内是糖异生的底物。丁酸除了是结肠黏膜上皮细胞的主要能量来源, 也参与糖类代谢和脂类代谢。尽管丙酸和丁酸在外周循环的浓度较低, 但它们通过激素和神经系统间接影响外周器官[20]。总之, 作为肠道菌群产生的一种重要的代谢物质, SCFAs对宿主的营养代谢有着重要的调控作用。
在水产动物饲料中添加不同种类的SCFAs, 也可促进水产动物生长, 调控水产动物营养代谢。如乙酸, 饲料中添加1 g/kg的乙酸钠可以显著提高贝尔湖红点鲑(Salvelinus alpinus)增重率[21]。如丙酸, 在水产动物饲料中添加丙酸盐, 结果发现丙酸盐在改善水产动物能量吸收方面具有重要作用, 据报道, 丙酸钠添加可增加南美白对虾(Litopenaeus vannamei)对能量和磷的表观消化系数, 改变其肠道微生物并促进南美白对虾生长[22-23], 同时, 在罗非鱼(Oreochromis spp.)的研究中发现丙酸盐能提高罗非鱼饲料利用效率, 蛋白质产值和蛋白质效率等[24], 另外丙酸盐的添加也会提高水产动物生长表现, 促进水产动物生长。研究表明丙酸盐的添加可促进鲤鱼(Cyprinus carpio L.)生长, 提高鲤鱼生长基因表达水平[25], 显著性提高里海白鱼(Rutilus frisii kutum)饲料利用效率, 促进里海白鱼生长等[25], 并能提高斑马鱼生长与促进食欲调节相关基因的表达水平, 促进其生长[27]。在水产动物饲料中添加乙酸盐、丙酸盐能够促进水产动物对营养物质的吸收利用, 促进水产动物的生长。在丁酸盐的研究中发现, 丁酸盐对不同水产动物生长也有着促进作用, 如在海鲷(Sparus aurata)日粮中添加丁酸发现, 丁酸会显著性提高其增重率, 通过对海鲷生长的机理进行进一步研究, 发现丁酸添加组核苷酸衍生物和几种常见氨基酸的利用率有所提高[28], 同样地, 研究表明丁酸盐的添加能够显著提高商业虾采食量, 改善其生长[29], 并显著提升罗非鱼(Oreochromis spp)终末体重、增重率和特定生长率[30]。并且其他形式的丁酸盐也能提高水产动物生产性能, 如3%(W/W)的PHB(Poly-b-hydroxybutyrate)添加可改善太平洋白虾的生长性能, 肠道消化酶活性及免疫功能, 并增加太平洋白虾肠道SCFAs含量[31]。在蓝蟹饲料中添加乙酸钠、柠檬酸钠、丁酸钠或2%丙酸钠这几种不同种类的有机酸, 均能够促进蓝蟹生长, 显著提高其终末干重和特定生长率, 并能够加速螃蟹蜕皮, 同时也能改善蓝蟹存活率[32]。
总之, 在水产动物饲料中添加3种主要的SCFAs, 对提高鱼虾类增重率和促进饲料转化均具有积极作用, 促进其生长。但是也存在与其相悖的研究结果, 如北极嘉鱼(Salvelinus alpinus)饲料中添加10 g/kg的丙酸钠, 发现丙酸钠的添加抑制北极嘉鱼生长[33]。将2 g/kg丁酸钠添加到鲶鱼(Silurus asotus)饲料中, 结果发现丁酸钠添加组并不能显著性改善鲶鱼生长, 并伴随着鲶鱼饲料转化效率的降低, 此外, 脱脂大豆饲料中添加丁酸钠则没有正向效果[34]。不同的实验结果可能与试验动物种类, SCFAs饲喂浓度以及饲喂方式的差异有关。尽管有较多的实验结果证实SCFAs在介导水产动物营养调控方面起着重要作用, 但SCFAs在水产动物中营养调控途径、调控机理的研究还是相对匮乏因而有待于进一步研究, 以便为未来SCFAs在饲料添加中的应用提供理论支撑, 进而促进水产养殖行业的健康可持续发展。
2.2 免疫抗病调控效应在哺乳动物中, SCFAs也可以作为免疫刺激分子, 通过激活G蛋白偶联受体GPR41, GPR43和GPR109A提高淋巴细胞功能, 从而发挥免疫相关作用[35]。SCFAs作用于肠上皮细胞、单核吞噬细胞、淋巴细胞等, 可以修饰包括基因表达、趋化、分化、增殖和凋亡在内的多种细胞过程, 是沟通肠道菌群和肠免疫系统的重要分子[36]。研究发现, 生理剂量的乙酸、丙酸、丁酸可对结直肠肿瘤细胞的生长增殖起抑制作用, 促进肿瘤细胞的分化, 通过多种途径诱导肿瘤细胞凋亡, 起到抗肿瘤作用[37]。目前, SCFAs在临床上已经开始应用于肠道炎症性疾病的治疗, 通过补充食物中膳食纤维的含量, 增加肠道内SCFAs的水平, 能有效治疗溃疡性结肠炎, 控制腹部症状。
水产动物肠道致病菌是引起水产动物死亡的主要因素, 每年给水产动物养殖造成巨大损失。随着水产动物SCFAs研究的不断深入, 大量研究者也发现SCFAs对水产动物免疫抗病方面有着重要的调控作用。如甲酸, 在太平洋白虾(Litopenaeus vannamei)饲料中添加甲酸, 可以提高太平洋白虾对副溶血性弧菌的抵抗能力[38]。如乙酸, 发现其能够较好的抑制南美白对虾(L. vannamei)肠道弧菌属, 改善其肠道健康[39]。如丙酸, 斑马鱼(Danio rerio)日粮中添加丙酸钠能改善黏膜免疫参数[26], 提高免疫和抗氧化生长相关基因的表达[40], 也能显著提高里海白鱼(Rutilus frisii kutum)的血清溶菌酶和免疫球蛋白水平, 并提升补体活性[41], 改善鲤鱼(Cyprinus carpio)皮肤黏液免疫参数以及血清免疫参数[25, 40]。并且丙酸也能够减少南美白对虾(L. vannamei)肠道弧菌数目, 降低虾血清凝集系数[42-43]。如丁酸, 研究发现鲤鱼(C.carpio)饲料中添加丁酸钠与氧化豆油(Microencapsulated sodium butyrate, MSB), 其中丁酸钠以装入微型胶囊的形式添加, 发现饲喂此饲料会显著提高促炎因子(IL-β、TNF-ɑ)、抑炎因子(TGF-β)和肠道热休克蛋白的表达水平, 而且丁酸钠能够保护肠道免受伤害和修复细胞组织损伤[44]。通过乙酸、丙酸、丁酸在水产动物中的研究可以发现, SCFAs在水产动物中主要表现为对肠道致病菌有一定的抑制能力, 并且对于非特异性免疫参数有一定程度的改善, 最终改善水产动物的生长。对于其他形式短链脂肪酸:如二甲酸钾和羟基丁酸, 研究表明将不同浓度二甲酸钾添加到罗非鱼日粮中, 随着添加剂量的提升罗非鱼存活率也显著提高, 而且二甲酸钾的添加也伴随着罗非鱼摄食量, 饲料转化系数, 蛋白质能效比的提高[45-46]。同时, 欧洲黑鲈(Dicentrarchus labrax)日粮中添加20%羟基丁酸, 使黑鲈肠道微生物组成发生改变[47]。河蟹幼苗饲喂封装有羟基丁酸的卤虫和轮虫, 羟基丁酸的添加使河蟹幼苗存活率、孵化率及渗透胁迫显著提高[48]。其他形式的SCFAs对水产动物的生长也具有促进作用, 未来还需要我们对不同种类的SCFAs进行探索研究, 阐明SCFAs免疫抗病的具体机理, 以期在生产上实现更广泛的应用。通过以上实验发现SCFAs在水产动物中主要通过抑制有害病原菌生长, 提高水产动物非特异性免疫能力, 从而改善肠道健康, 调控水产动物免疫抗病。
3 总结与展望SCFAs对水产动物生长和免疫抗病有着重要作用, 了解SCFAs的具体生理功能以及调控方式对SCFAs的高效利用至关重要。哺乳动物研究表明, SCFAs可作为信号分子发挥作用, SCFAs的受体主要有GPCR41, GPCR43, GPCR109A。G蛋白偶联受体(G protein coupled receptors, GPCRs)是指与G蛋白偶联的一大类膜蛋白受体的统称, 有7个跨膜α螺旋, 且其肽链的C端以及连接第5和第6个跨膜螺旋的胞内环上都有G蛋白(鸟苷酸结合蛋白)的结合位点[49]。GPCRs能够跨越细胞膜, 激活细胞外的信号分子(如蛋白酶、核酸、肽类, 生物胺和脂质等), 然后触发细胞内部反应, 介导了包括正常和疾病在内的众多生理反应[50-51]。目前, 哺乳动物SCFAs研究相对较多, 水产动物的研究主要集中于表型, 对其调控机制的研究相对较少, 因此, SCFAs的调控机制是未来水产研究上重要方向。
饮食、肠道微生物与SCFAs三者相互联系。SCFAs调控哺乳动物以及水产动物营养代谢、免疫抗病等生理过程即通过调控动物饮食组成, 改变动物肠道内SCFAs含量从而调控鱼类和哺乳动物的健康。研究表明膳食纤维的添加可影响动物体内SCFAs含量, 尽管不同实验研究膳食纤维投喂的浓度和实验动物的饲料组成成分信息不同, 但是我们也可以从中得出一些结论。据报道, 不同浓度的菊粉添加到小鼠半纯化饲料中, 结果发现菊粉添加会引起小鼠肠道SFCAs浓度升高, 但当菊粉添加量增加到20%时, 反而会减少小鼠肠道内SCFAs浓度。与其他类型纤维不同的是, 在小鼠饲料中添加菊粉会改变小鼠肠道内不同类型SCFAs比例, 促进乙酸向丙酸和丁酸转化[52-53]。在小鼠日粮中添加微晶纤维素, 微晶纤维素和低聚果糖、微晶纤维素和果寡糖, 微晶纤维素和纤维寡糖, 与基础饲料组及仅微晶纤维素添加组相比, 低聚果糖、果寡糖以及纤维寡糖添加组的小鼠盲肠SCFAs含量以及总SCFAs含量(盲肠以及粪便SCFAs之和)均显著增加, 此外纤维的类型以及纤维的日摄入量同样会影响SCFAs的含量[52]。小鼠日粮中添加纤维素、果胶、抗性淀粉和大麦外壳等不同类型的不易消化碳水化合物, 结果表明纤维素、果胶、抗性淀粉添加组小鼠盲肠和空肠SCFAs含量都显著提高[54]。因此可以推测, 在供给动物富含蛋白质或脂肪的饮食的同时补充膳食纤维会促进有益微生物的生长, 改变肠道微生物组成, 促进SCFAs的产生, 改善动物的生长。但是目前水产动物上相关研究还比较缺乏, 因此, 这可能是未来SCFAs研究的方向之一, 也是推进水产养殖的绿色可持续发展的有效方式。
| [1] |
Qin JJ, Li RQ, Raes JJ, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65. |
| [2] |
Bäckhed F, Ley RE, Sonnenburg JL, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307(5717): 1915. |
| [3] |
李慧. 水产养殖业绿色发展是大势所趋[J]. 食品界, 2019(3): 30-31. |
| [4] |
李蓉, 韦良孟, 柴同杰.动物微生态制剂的研究进展[C].中国畜牧兽医学会动物微生态学分会第十一次全国学术研讨会论文集, 2014.
|
| [5] |
Cerezuela R, Meseguer J, Esteban MA. Current knowledge in synbiotic use for fish aquaculture :A Review[J]. Journal of Aquaculture Research & Development, 2011, 153-175. |
| [6] |
Lauzon HL, Merrifield DL, Ringø E, et al. Probiotic applications in cold water fish species[M]. 2014: 223-252.
|
| [7] |
Ringø E, Olsen RE, Gifstad TØ, et al. Prebiotics in aquaculture :a review[J]. Aquaculture Nutrition, 2010, 16(2): 117-136. |
| [8] |
Dimitroglou A, Merrifield DL, Carnevali O, et al. Microbial manipulations to improve fish health and production - A Mediterranean perspective[J]. Fish Shellfish Immunol, 2011, 30(1): 1-16. |
| [9] |
Carnevali O, Yun HS, Merrifield DL, et al. Probiotic applications in temperate and warm water fish species[M]. 2014.
|
| [10] |
Shenderov BA. Metabiotics :novel idea or natural development of probiotic conception[J]. Microbial Ecology in Health & Disease, 2013. DOI:10.3402/mehd.v24i0.20399 |
| [11] |
Liu Z, Liu W, Ran C, et al. Abrupt suspension of probiotics administration may increase host pathogen susceptibility by inducing gut dysbiosis[J]. Scientific Reports, 2016, 6: 23214. |
| [12] |
Chambers ES, Morrison DJ, Gary F. Control of appetite and energy intake by SCFA :what are the potential underlying mechanisms?[J]. Proceedings of the Nutrition Society, 2015, 74(3): 328-336. |
| [13] |
Mountfort DO, Campbell J, Clements KD. Hindgut fermentation in three species of marine herbivorous fish[J]. Appl Environ Microbiol, 2002, 68(3): 1374-1380. |
| [14] |
Clements KD, Gleeson VP, Slaytor M. Short-chain fatty acid metabolism in temperate marine herbivorous fish[J]. Journal of Comparative Physiology B, 1994, 164(5): 372-377. |
| [15] |
Kaji I, Iwanaga T, Watanabe M, et al. SCFA transport in rat duodenum[J]. American Journal of Physiology Gastrointestinal & Liver Physiology, 2015, 308(3): 188-197. |
| [16] |
刘小华, 李舒梅, 熊跃玲. 短链脂肪酸对肠道功效及其机制的研究进展[J]. 肠外与肠内营养, 2012, 19(1): 56-58. |
| [17] |
Makki K, Deehan EC, Walter J, et al. The impact of dietary fiber on gut microbiota in host health and disease[J]. Cell Host Microbe, 2018, 23(6): 705-715. |
| [18] |
Zhang X. The microbiome and butyrate regulate energy metabolism and autophagy in the mammalian colon[J]. Cell Metabolism, 2011, 13(5): 517-526. |
| [19] |
范秋丽, 马现永. 短链脂肪酸对畜禽肠道生理功能及生长性能的影响[J]. 广东饲料, 2016, 25(8): 33-35. |
| [20] |
Sousa-Ferreira L, de Almeida LP, Cavadas C. Role of hypothalamic neurogenesis in feeding regulation[J]. Trends in Endocrinology & Metabolism, 2014, 25(2): 80-88. |
| [21] |
Ringø E. Effects of dietary formate and acetate on growth and lipid digestibility in Arctic charr, Salvelinus alpinus(L.)[J]. Fisk Dir Skr ser Ernæring, 1992, 5: 17-24. |
| [22] |
da Silva BC, Vieira FN, Mouriño JLP, et al. Butyrate and propionate improve the growth performance of Litopenaeus vannamei[J]. Aquaculture Research, 2016, 47(2): 612-623. |
| [23] |
Silva BCD, Vieira FDN, Mouriño JLP, et al. Salts of organic acids selection by multiple characteristics for marine shrimp nutrition[J]. Aquaculture, 2013, 384(6): 104-110. |
| [24] |
Hassaan MS, Wafa MA, Soltan MA, et al. Effect of dietary organic salts on growth, nutrient digestibility, mineral absorption and some biochemical indices of Nile tilapia; Oreochromis niloticus L[J]. World Applied Sciences Journal, 2014, 29(1): 47-55. |
| [25] |
Safari R, Hoseinifar SH, Nejadmoghadam S, et al. Non-specific immune parameters, immune, antioxidant and growth-related genes expression of common carp(Cyprinus carpio L[J]. Aquaculture Research, 2017, 48: 4470-4478. |
| [26] |
Hoseinifar SH, Zoheiri F, Caipang CM. Dietary sodium propionate improved performance, mucosal and humoral immune responses in Caspian white fish(Rutilus frisii kutum)fry[J]. Fish Shellfish Immunol, 2016, 55: 523-528. |
| [27] |
Hoseinifar SH, Safari R, Dadar M. Dietary sodium propionate affects mucosal immune parameters, growth and appetite related genes expression :Insights from zebrafish model[J]. General & Comparative Endocrinology, 2017, 243: 78-83. |
| [28] |
De Schryver P, Sinha AK, Kunwar PS, et al. Poly-β-hydroxybutyrate(PHB)increases growth performance and intestinal bacterial range-weighted richness in juvenile European sea bass, Dicentrarchus labrax[J]. Applied Microbiology and Biotechnology, 2010, 86(5): 1535-1541. |
| [29] |
Silva BC, Nolasco Soria H, Magallón Barajas F, et al. Improved
digestion and initial performance of whiteleg shrimp using organic
salt supplements[J]. Aquaculture Nutrition, 2016, 22(5): 997-1005. |
| [30] |
Ahmed HA, Sadek KM. Impact of dietary supplementation of sodium butyrate and/or protexin on the growth performance, some blood parameters, and immune response of Oreochromis niloticus[J]. International Journal of Agriculture Innovations & Research, 2015, 22(10-11): 579-584. |
| [31] |
Duan Y, Zhang Y, Dong H, et al. Effect of dietary poly-β- hydroxybutyrate(PHB)on growth performance, intestinal health status and body composition of Pacific white shrimp Litopenaeus vannamei(Boone, 1931)[J]. Fish & Shellfish Immunology, 2017, 60: 520-528. |
| [32] |
Ringø E. Effects of dietary lactate and propionate on growth and digesta in Arctic charr, Salvelinus alpinus(L.)[J]. Aquaculture, 1991, 96(3-4): 321-333. |
| [33] |
Sukor SA, Taher S, Ehteshamei F, et al. Effects of different dietary organic acids on the survival, growth, and hepatopancreatic histopathology of the blue swimmer crab portunus pelagicus[J]. Nutrients, 2007, 6(9): 3913-3928. |
| [34] |
Itziar E, Gabriel BL, Laura BP, et al. Dietary butyrate helps to restore the intestinal status of a marine teleost(Sparus aurata) fed extreme diets low in fish meal and fish oil[J]. PLoS One, 2016, 11(11): e0166564. |
| [35] |
Louis P, Hold GL, Flint HJ. The gut microbiota, bacterial metabolites and colorectal cancer[J]. Nature Reviews Microbiology, 2014, 12(10): 661-672. |
| [36] |
Kabat AM, Srinivasan N, Maloy KJ. Modulation of immune development and function by intestinal microbiota[J]. Trends Immunol, 2014, 35(11): 507-517. |
| [37] |
Hague A, Elder DJE, Hicks DJ, et al. Apoptosis in colorectal tumour cells :Induction by the short chain fatty acids butyrate, propionate and acetate and by the bile salt deoxycholate[J]. International Journal of Cancer, 1995, 60(3): 400-406. |
| [38] |
Chuchird N, Rorkwiree P, Rairat T. Effect of dietary formic acid and astaxanthin on the survival and growth of Pacific white shrimp(Litopenaeus vannamei)and their resistance to Vibrio parahaemolyticus[J]. Springerplus, 2015, 4(1): 1-12. |
| [39] |
da Silva BC, do Nascimento Vieira F, Mouriño JLP, et al. Salts of organic acids selection by multiple characteristics for marine shrimp nutrition[J]. Aquaculture, 2013, 384: 104-110. |
| [40] |
Safari R, Hoseinifar SH, Kavandi M. Modulation of antioxidant defense and immune response in zebra fish(Danio rerio)using dietary sodium propionate[J]. Fish Physiology and Biochemistry, 2016, 42(6): 1733-1739. |
| [41] |
Hoseinifar SH, Zoheiri F, Caipang CM. Dietary sodium propionate improved performance, mucosal and humoral immune responses in Caspian white fish(Rutilus frisii kutum)fry[J]. Fish Shellfish Immunol, 2016, 55: 523-528. |
| [42] |
Silva BC, Vieira FDN, Mouriño JLP, et al. Butyrate and propionate improve the growth performance of Litopenaeus vannamei[J]. Aquaculture Research, 2016, 47(2): 612-623. |
| [43] |
Silva BC, Jatobá A, Schleder DD, et al. Dietary supplementation with butyrate and polyhydroxybutyrate on the performance of pacific white shrimp in biofloc systems[J]. Journal of the World Aquaculture Society, 2016, 47(4): 508-518. |
| [44] |
Liu W, Yang Y, Zhang J, et al. Effects of dietary microencapsulated sodium butyrate on growth, intestinal mucosal morphology, immune response and adhesive bacteria in juvenile common carp(Cyprinus carpio)pre-fed with or without oxidised oil[J]. British Journal of Nutrition, 2014, 112(1): 15-29. |
| [45] |
Ramli N, Heindl U, Sunanto S. Effect of potassium-diformate on growth performance of tilapia challenged with Vibrio anguillarum[M]. 2005: 9-13.
|
| [46] |
Zhou Z, Liu Y, He S, et al. Effects of dietary potassium diformate (KDF)on growth performance, feed conversion and intestinal bacterial community of hybrid tilapia(Oreochromis niloticus x O[J]. Aquaculture, 2009, 291(1): 89-94. |
| [47] |
Schryver P, Sinha A, Kunwar P, et al. Poly-?2-hydroxybutyrate (PHB)increases growth performance and intestinal bacterial range-weighted richness in juvenile European sea bass, Dicentrarchus labrax[J]. Applied Microbiology & Biotechnology, 2010, 86(5): 1535-1541. |
| [48] |
Sui L, Liu Y, Sun H, et al. The effect of poly-β-hydroxybutyrate on the performance of Chinese mitten crab(Eriocheir sinensis MilneEdwards)zoea larvae[J]. Aquaculture Research, 2014, 45(3): 558-565. |
| [49] |
Palczewski K, Kumasaka T, Hori T, et al. Crystal structure of rhodopsin :A G protein-coupled receptor[J]. Science, 2000, 289(5480): 739-745. |
| [50] |
Howard AD, Mcallister G, Feighner SD, et al. Orphan G-proteincoupled receptors and natural ligand discovery[J]. Trends in Pharmacological Sciences, 2001, 22(3): 132. |
| [51] |
Kirkham DM, Murphy GJ, Young P. Demonstration of inhibitory guanine nucleotide regulatory protein(Gi)function in liver and hepatocyte membranes from streptozotocin-treated rats[J]. European Journal of Immunology, 1992, 40(8): 2236-2247. |
| [52] |
Campbell JM, Fahey Jr GC, Wolf BW. Selected indigestible oligosaccharides affect large bowel mass, cecal and fecal short-chain fatty acids, pH and microflora in rats[J]. The Journal of Nutrition, 1997, 127(1): 130-136. |
| [53] |
Levrat MA, Rémésy C, Demigné C. High propionic acid fermentations and mineral accumulation in the cecum of rats adapted to different levels of inulin[J]. Journal of Nutrition, 1991, 121(11): 1730. |
| [54] |
Hedemann MS, Theil PK, Bach Knudsen KE. The thickness of the intestinal mucous layer in the colon of rats fed various sources of non-digestible carbohydrates is positively correlated with the pool of SCFA but negatively correlated with the proportion of butyric acid in digesta[J]. British Journal of Nutrition, 2009, 102(1): 117-125. |