2. 上海海洋大学 水产与生命学院,上海 201306;
3. 西北农林科技大学动物科技学院,杨凌 712100
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
3. College of Animal Science and Technology, Northwest A&F University, Yangling 712100
鲤疱疹病毒3型,又称为锦鲤疱疹病毒(Koi herpesvirus,KHV),是引起鲤(Cyprinus carpio Linnaeus)、锦鲤及其变种锦鲤疱疹病毒病(Koi herpesvirus disease,KHVD)的病原。自1997年在德国首次发现以来,截至目前,已经在以色列、美国等全球多个国家报道。KHVD死亡率高达80%以上,对全世界多个国家地区的鲤鱼及锦鲤养殖产业造成了巨大的经济损失[1]。
目前,锦鲤疱疹病毒病没有药物可以防控,疫苗是控制疾病最有效的方法。有5种基本的疫苗概念:活疫苗、减毒疫苗、灭活疫苗、亚单位疫苗和DNA疫苗。在实验室条件下,活疫苗能够提供较好保护,但其可能造成毒力较大残留,应用于实际存在一定的安全风险[2]。大多数可用于水产养殖的疫苗是灭活的非复制疫苗[3]。然而,与大多数细菌疫苗所达到的保护相比,灭活疫苗实际的免疫保护性相对较低[4]。亚单位疫苗是去除病原体中与激发机体保护性免疫无关甚至有害的成分,但保留有效免疫原成分制作的疫苗。关于KHV亚单位疫苗研究的报道不多,张子鹏等[5]利用pET原核表达系统表达KHV ORF030和ORF131,注射免疫鲤鱼后进行攻毒检测,保护率20%-60%不等。DNA疫苗是由裸质粒DNA组成,会导致疫苗接种的鱼肌肉组织中致病蛋白的基因表达,引起机体免疫应答产生相关抗体,从而起到免疫保护作用[6]。相比传统疫苗具有高效性、易于制备、稳定性高等优点,缺点是需要通过注射免疫,只适合个体注射,不适合大规模的接种,在实际养殖中具有一定的限制性。DNA疫苗首次在鱼类中利用并产生功效是虹鳟鱼对感染性造血坏死病毒的免疫实验[7]。随后,有学者对病毒性出血性败血症[8]、病毒性神经坏死病毒[9]、感染性胰腺坏死病毒[10]、病毒性出血热败血症病毒[11]和鲤春病毒[12]的DNA疫苗进行了大量研究。Zhou等[13-14]分别以KHV ORF25、ORF81为靶基因制备的DNA疫苗经证明能显著降低死亡率(小于20%),表明DNA疫苗具有较好的防控效果。
CyHV-3隶属于疱疹病毒目异疱疹病毒科鲤疱疹病毒属,是具有囊膜的双链DNA病毒[15],病毒颗粒直径为167-200 nm,基因组全长295 kb,共编码164个开放阅读框(Open reading frame,ORF),是已知基因组最大的疱疹病毒[16-18]。生物质谱技术鉴定结果表明,CyHV-3含有46个结构蛋白,包括16个囊膜蛋白、3个衣壳蛋白、2个皮层蛋白和25个未知蛋白[19]。纯化的CyHV-3病毒颗粒的质谱分析检测到40种编码的基因产物,包括13种预测的包膜蛋白[20]。然而,到目前为止,仅使用特异性抗血清或单克隆抗体(mAb)鉴定和表征了少数CyHV-3蛋白。采用KHV阳性血清识别纯化病毒粒子,再通过质谱分析产生抗体的主要免疫原性蛋白,筛选出ORF92、ORF66、ORF72和ORF81。另外,德国KHV OIE参考实验室验证ORF149蛋白具有较强的免疫原性,这些是本研究中疫苗研制的重要候选抗原。Michel等[21]借助液相色谱串联质谱分析,确定了KHV基因组中有13个ORF编码囊膜蛋白,包括ORF132、ORF059、ORF65、ORF136和ORF149等,在此之前,通过试验唯一能确定编码囊膜蛋白的仅有ORF81[22]。
ORF149基因全长2 100 bp,含699个氨基酸,理论分子量为72.0 kD,只包含一个潜在的N-糖基化位点,93个O-糖基化位点。Fuchs等[23]在细菌和昆虫细胞中成功表达ORF149,产生多克隆/单克隆抗体(PAbs/MAb),以此来研究它的免疫原性。此外,通过间接免疫荧光和免疫电镜分析发现,ORF149识别CyHV-3病毒粒子能够产生特异的中和Mab,证明ORF149可能是其主要免疫显性蛋白之一[20]。Torrent等[24]通过新型ELISA方法发现ORF149编码的蛋白质具有抗原性,并将其免疫显性表位定位于蛋白质氨基末端部分。ORF149编码的包膜糖蛋白,具有中和表位,可能在病毒附着和细胞穿透中发挥作用,因此是疫苗开发和诊断测试的良好目标抗原[25]。
碳纳米管(Carbon nanotubes,CNTs)作为一些特定结构的药物载体,具表面积大、体积小、表面反应活性高、易于表面修饰和优良跨膜作用。纳米载体是以纳米尺度材料制成的,能够携带具有诊断和治疗用途的药物和基因分子的载体。纳米载药系统能够改善药物理化性质、极易穿透细胞膜、组织屏障,可高剂量的实现靶向给药到细胞内发挥生物学效应,已经成为动物疫苗的重要载体,成为国内外研究的热点。关于鱼类纳米载体疫苗的研制,也是近年来水产疫苗的研究热点,并且主要以纳米包裹颗粒的形式出现。Adomako等[26]制备了PLGA纳米载传染性造血坏死病毒DNA疫苗,口服免疫虹鳟可刺激免疫应答;Rivas-Aravena等[27]用壳聚糖纳米载传染性鲑鱼贫血病DNA疫苗口服免疫大西洋鲑鱼,能够显著提高免疫保护率。
因此,本研究在克隆、分析KHV囊膜蛋白ORF149基因的基础上,将其完整编码序列插入PcDNA-3.1(+),构建重组质粒,再与氨化的单壁碳纳米管进行连接,构建单壁碳纳米管载ORF149核酸疫苗,旨为探索KHV疫苗的增效机制、开发新型KHV核酸疫苗奠定基础。
1 材料与方法 1.1 材料鲤鱼脑细胞系(CCB)由德国动物健康研究院(FLI)病原学研究所KHV参考实验室Sven M. Bergmann博士馈赠;鲤疱疹病毒3型GZ1301株由本实验室分离和保存;载体pMD18-T及E. coli DH5α购自日本TaKaRa公司;pcDNA-3.1(+)由本实验室保存;单壁碳纳米管(SWCNTs)样品由西北农林科技大学王高学教授惠赠。
琼脂糖凝胶DNA回收试剂盒(DP209-03)、质粒小提试剂盒(DP103)、DAB显色试剂盒购自天根生化科技有限公司;rTaq Mix、限制性酶Xho Ⅰ和EcoR Ⅰ、DNA-Tailing Kit(6109)、DNA marker、T4 Liqase和Liqase buffer购自TaKaRa公司;X-treme gene HP DNA transfection Reagaent购自Roche公司(瑞士);兔抗KHV抗体由本实验室制备和保存;SDS-PAGE试剂盒、Alexa Fluor 488标记的羊抗兔IgG(H+L)购自Life Science公司(美国)。其他试剂均为国产分析纯。
1.2 方法 1.2.1 基因克隆根据GenBank中CyHV-3 ORF149基因序列,用Primer Premier5.0设计特异性引物(F:CAGAATTCCTGAGGACCATGCTCCGTC;R:CACTCGAGCAAGCAAGCAAAAGCAC;划线部分分别为限制性内切酶EcoR Ⅰ和Xho Ⅰ酶切位点)并由生工生物公司合成。
PCR反应体系:12.5 µL rTaq Mix、上下游引物各1 µL(10 µmol/L)和2 µL DNA模板,补灭菌水至25 µL。反应程序如下:94℃,5 min;94℃,30 s,55℃,30 s,72℃,45 s,30个循环;72℃,10 min。将PCR产物进行1%琼脂糖凝胶电泳,切胶回收后与pMD18-T载体连接,转化至DH5α感受态细胞,筛选阳性克隆进行菌液PCR和双酶切鉴定,并由艾基生物公司测序验证。
1.2.2 重组表达质粒构建对重组克隆载体pMD18-T-ORF149、真核表达载体pcDNA-3.1(+)进行双酶切,琼脂糖凝胶电泳、切胶、回收、DNA纯化试剂盒纯化,再将目的片段和双酶切后的真核载体进行连接。酶切体系为:10×buffer 2 µL,EcoR Ⅰ和Xho Ⅰ各1 µL,质粒1 µg,补ddH2O水至20 µL。37℃水浴酶切2 h。连接体系:T4 Liqase 1.5 µL,10×T4 Liqase buffer 1.5 µL,pcDNA-3.1(+)3 µL,目的片段9 µL。16℃连接过夜。将连接产物转化至DH5α感受态细胞,筛选阳性克隆进行菌液PCR和双酶切鉴定并由艾基生物公司测序验证,该重组真核载体命名为pcDNA-ORF149。
1.2.3 获取大量重组质粒将含pcDNA-ORF149重组质粒的大肠杆菌DH5α,37℃振荡培养1 h,涂于LB平板(含氨苄青霉素)培养,37℃过夜。挑取单菌落于LB液体培养基(含氨苄青霉素),37℃振荡培养,过夜,从中另取1%菌液于新培养基中扩大培养,至OD600为0.6。参照说明书操作,采用无内毒素质粒提取试剂盒提取pcDNA-ORF149重组质粒。并通过琼脂糖凝胶电泳和微量核酸分析仪检测提取重组质粒的纯度和含量。
1.2.4 质粒DNA瞬时转染将1个75 cm2细胞培养瓶的RK13单层细胞用胰酶消化后,用含10%犊牛血清的DMEM营养液吹打分散细胞,然后以一定密度接种于1个48孔细胞培养板(0.3 mL/well,用于做间接免疫荧光试验)和1个6孔细胞培养板中(2 mL/well,用于免疫印迹分析(Western blotting)检测,置37℃、5% CO2培养箱中培养。待培养细胞长至70%-80%单层时,用于真核表达质粒的转染,本研究采用Roche公司的X-treme gene HP DNA transfection Reagaent进行转染,具体转染步骤参照说明书进行。
1.2.5 SDS-PAGE与Western blotting转染72 h后,收集6孔板转染各种质粒和空白对照的细胞,进行West-blotting检测。制备好1块分离胶浓度为12%的SDS-PAGE胶;弃去细胞培养基,用PBS将细胞洗涤1次,然后用细胞刮刀将细胞从培养板上刮下来,分别放入到1.5 mL离心管中,6 000 r/min离心2 min;在细胞沉淀中加入适量的1× SDS- PAGE上样缓冲液混匀,煮沸处理5 min;15 000 r/min离心3 min;将样品加入到SDS- PAGE胶的对应孔中,200 V电泳45 min,进行蛋白分离;采用半干转膜仪将蛋白移转至硝酸纤维膜,转膜条件是25 V作用2 h;用含5%的脱脂乳的PBS室温下封闭1 h或者4℃封闭过夜;加入20 mL含5%脱脂乳的PBST稀释的(1:1 000)兔抗KHV全病毒多抗,室温下孵育1 h或者4℃封闭过夜;TBS-T洗涤3次,每次10 min;加入用TBST稀释的(1:5 000)HRP标记的二抗,避光作用60 min;避光用PBS-T洗涤5次,每次5 min;采用荧光信号扫描成像系统进行扫描,检测特异性荧光信号。
1.2.6 间接免疫荧光(Indirect immunofluorescent assay,IFA)在48孔板中转染后72 h的细胞,将培养基弃掉,用PBS(pH7.4)洗2次,然后每孔加入100 μL甲醇和丙酮(1:1)混合液,-20℃固定30 min;倒掉固定液,在温箱中晾干,大约干燥30 min;室温下PBS洗涤3次,每次5 min,洗涤时放在小型摇床上轻微摇晃;用含有10% FBS(胎牛血清)的PBS室温下封闭1 h;弃去封闭液,每孔加入100 μL用含10% FBS的PBS 1:100稀释的兔抗锦鲤疱疹病毒全病毒多抗,轻微摇晃室温下孵育1 h;室温下PBS洗涤3次,每次5 min;加入用PBS稀释的(1:10 000稀释)alexa fluor 488 anti-rabbit IgG二抗,轻微摇晃室温下孵育1 h;室温下PBS洗涤4次,每次5 min;加入适量的碘化丙啶(PI)进行染核,室温下孵育20 min;在荧光显微镜下观察荧光并拍照。
1.2.7 单壁碳纳米管载重组质粒表达系统构建采用空气氧化法[28],将SWCNTs样品置于马弗炉中450℃加热30-40 min,使样品中的无定型碳转变成CO2。采用混酸氧化法[29],将上述空气氧化法处理的SWCNTs样品放入混酸(浓H2SO4:浓HNO3=3:1(V/V))中60℃加热酸化处理12 h。碳纳米管混酸混合物经微孔滤膜抽滤、纯水洗涤至pH不再变化后置于80℃条件下干燥至恒重,即可获得氧化单壁碳纳米管(o-SWCNTs)。
通过1,3-偶极环加成反应法[30]对氧化修饰的o-SWCNTs样品进行共价修饰。参照碳纳米管和DNA质粒交联方法[31],将氨基化修饰单壁碳纳米管超声分散于PBS(pH7.4)缓冲液中,配成4 mg/mL的溶液。根据重组质粒pcDNA-ORF149的浓度,将其分散于PBS(pH7.4)溶液中,配成1 mg/mL的溶液。随后分别各取上述单壁碳纳米管溶液0.5 mL缓慢滴加到0.5 mL重组质粒pcDNA-ORF149溶液中,28℃恒温搅拌30 min,制备单壁碳纳米管载pcDNA-ORF149核酸疫苗系统(SWCNTs-pcDNA-ORF149)。
1.2.8 单壁碳纳米管载重组质粒合成效果检测 1.2.8.1 核酸琼脂糖凝胶电泳单壁碳纳米管,全部由碳原子构成,几何结构可以视为由单层石墨烯卷曲而成,结构决定性质,因此单壁碳纳米管具有优异的电子、机械、力学等性能。在本研究中,经氨基化修饰后的SWCTs与质粒在超声作用下进行共价偶联,形成单壁碳纳米管载重组质粒系统。由于质粒的带电性,在琼脂糖凝胶电泳中会形成泳迹条带,而质粒与单壁碳纳米管共价结合后不能穿透琼脂糖凝胶。所以,通过核酸琼脂糖凝胶电泳可以检测单壁碳纳米管载重组质粒系统的合成效果。
1.2.8.2 扫描电镜观察将制备的单壁碳纳米管载pcDNA-ORF149核酸疫苗样品10 000×g下离心10 min,然后真空冷冻干燥至粉末状态,通过场发射扫描电子显微镜(FE-SEM,JSM-7500F,JEOL,Tokyo,Japan)直观检测单壁碳纳米管载pcDNA-ORF149核酸疫苗系统(SWCNTs-pcDNA-ORF149)合成效果。
2 结果 2.1 目的基因克隆PCR产物琼脂糖凝胶电泳,可见1条2 100 bp左右的片段,与预期的片段大小符合(图 1)。测序后经BLAST比对,与GenBank中登录的KHV ORF149基因(NC_009127.1)核苷酸一致性为99%,本研究成功克隆了KHV ORF149基因。

|
| 1:ORF149基因PCR产物;2:重复样;M:DNA Marker DL 5000 图 1 PCR扩增ORF149基因产物电泳图 |
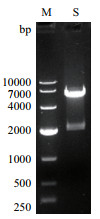
将构建的重组原核载体pcDNA-ORF149进行双酶切鉴定,获得与预期大小相符的两条条带,表明重组原核载体构建成功(图 2)。
|
| M:DNA Marker DL 10000;S:重组质粒pcDNA-ORF149双酶切产物 图 2 重组质粒pcDNA-ORF149双酶切鉴定结果电泳图 |
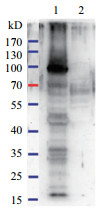
Western-blotting检测结果显示(图 3),pcDNA3.1-ORF149真核表达质粒在转染RK13细胞后,显现出特异性条带,即能检测到特异性荧光信号,而未转染质粒的空白对照细胞没有检测到荧光信号,表明重组质粒转染后可成功表达目的蛋白。
|
| 1:pcDNA3.1-ORF149转染组;2:空白细胞 图 3 真核重组表达载体pcDNA3.1-ORF149转染细胞后Western-blot检测结果 |
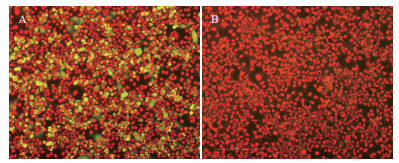
IFA结果显示(图 4),pcDNA3.1-KO149真核表达质粒在RK13细胞中能检测到特异性荧光信号,而未转染质粒的空白对照细胞没有检测到荧光信号,再次验证重组质粒转染后可成功表达目的蛋白。
|
| A:pcDNA3.1-ORF149转染组;B:空白细胞 图 4 pcDNA-ORF149转染后IFA检测结果 |
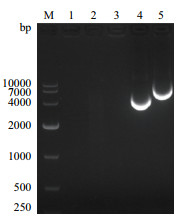
将合成的不同浓度单壁碳纳米管载重组质粒表达系统进行琼脂糖凝胶电泳,结果显示连接后的表达系统在电泳图谱上未出现条带(图 5),说明连接成功。
|
| M:NA Marker DL 10000;1:单壁碳纳米管载重组质粒(1 μg);2:单壁碳纳米管载重组质粒(5 μg);3:单壁碳纳米管载重组质粒(10 μg);4:pcDNA-3.1空载质粒;5:重组质粒 图 5 单壁碳纳米管载重组质粒合成检测电泳 |
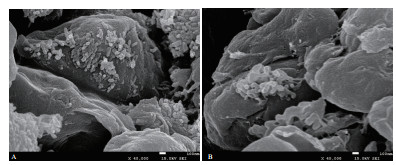
从FE-SEM观测结果中可以看出,单壁碳纳米管载重组质粒系统中呈细管状的o-SWCNT聚集性更好(图 6-A),与未加质粒的o-SWCNTs(图 6-B)差异明显,而正是由于带电荷的DNA基团的加入,才会改变其聚集状态,因此说明单壁碳纳米管与重组质粒连接成功。
|
| A:单壁碳纳米管载重组质粒;B:单壁碳纳米管 图 6 单壁碳纳米管载重组质粒合成FE-SEM观察结果 |
锦鲤疱疹病毒病是20世纪末确定的一种疾病,现已在全球范围内爆发,严重威胁鲤和锦鲤养殖产业安全,是世界动物卫生组织(OIE)规定必须申报的疾病,为我国二类疫病。目前对该病的防治已经取得了一些进展,以色列科学家曾通过细胞培养的方式获得传代细胞系和致病力弱的毒株[32],直接接种锦鲤和普通鲤,可以起到很好的免疫作用。而我国对该病的防治主要停留在使用抗生素阶段,治疗效果并不理想。大剂量抗生素的使用导致病毒产生耐药性和变异,从而更难彻底根除此病。疫苗是控制病毒性疾病最有效的途径,在一些常见的水产动物病毒病防控上应用广泛。对于锦鲤疱疹病毒的防控,国内外专家都展开了积极研究。减毒疫苗和改良的活疫苗在实验中证明具有显著的抗病效果,对鲤鱼具有一定的保护作用。但疱疹病毒的特点之一是在初次感染后具有潜伏宿主的能力,在一定的应激条件下,潜伏的病毒可被激活导致宿主发病。现有的减毒疫苗存在毒力返强的风险,因此安全隐患令人担忧。KHV全病毒灭活疫苗保护效果不佳,用KHV灭活病毒制备的脂质体疫苗免疫后鲤鱼后,一定程度上提高了其免疫保护率,但成本较高。其他疫苗如灭活疫苗、普通DNA疫苗、亚单位疫苗亦存在安全性、免疫保护率低、成本高等缺点,不利于临床应用和推广。因此研制安全高效低成本的疫苗成为有效防治锦鲤疱疹病毒的重要手段之一。
疫苗载体系统已被广泛研究,因为它们能有效地递送抗原/ DNA分子,将肽/ DNA转运到所需的位置并保持较高的浓度[33]。碳纳米管(CNTs)作为一种新型纳米载体所具有的特性,有利于其作为DNA疫苗复合物中的运载体[34]。这些特征包括低毒性、体内稳定性、较低的自身免疫原性及附加多个抗原的能力[34]。此外,碳纳米管的颗粒性质和它们能够快速进入抗原呈递细胞(如树突状细胞)的优越特性,使得它们具有极高的潜力作为抗原/DNA载体[35-37]。
我国关于鱼类纳米载体疫苗的研究,Wang等[38]首先发现单壁碳纳米管(Single-walled carbon nanotubes,SWCNTS)在水体中能够高效穿透鱼体表组织,能够利用化学键将功能化修饰的碳纳米管与草鱼呼肠孤病毒(Grass carp reovirus,GCRV)多种蛋白和嗜水气单胞菌aerA蛋白偶联制备的亚单位疫苗[39],通过浸浴免疫夏花草鱼均可提高免疫保护率,免疫相关基因和抗体水平显著提高。Zhang等[40]用单壁碳纳米管连接pET32a-G蛋白重组亚单位疫苗,在针对鲤春病毒(Spring viremia of carp virus,SVCV)浸泡及注射免疫中均能提高免疫保护率。在碳纳米管载重组质粒的研究方面,Zhang等[41]用编码基质蛋白的M基因成功构建SWCNTs-pcDNA-M核酸疫苗,在对鲤春病毒的肌肉注射免疫中可以增强约17.5%的保护率。研究结果证实,碳纳米管不同于其它包裹颗粒形式的纳米材料仅具缓释、佐剂增效的作用,碳纳米管偶联疫苗呈管状,不但具有缓释、佐剂增效的同时,而且更重要的是穿透鱼体表组织、细胞膜及细胞器的功能,并以化学合成的化学键连接蛋白及核酸疫苗,通过浸浴免疫和注射免疫,可以达到高效免疫效果。
本研究构建的单壁碳纳米管核酸疫苗,相较于传统的KHV减毒疫苗[42]、亚单位疫苗[43]、常规核酸疫苗[44]等,由于碳纳米管的特性,理论上能够更好的递送抗原,达到更强的免疫保护作用。此外,传统的疫苗一般通过注射免疫才能达到较好的保护效果,碳纳米管疫苗因其微粒性和较强的体表渗透能力,可通过浸泡免疫产生相近的保护效果,这将极大降低疫苗操作和应用成本。单壁碳纳米管载KHV ORF149核酸疫苗,能否起到免疫增效作用,有待于进一步实验验证。
4 结论本实验通过制备pcDNA-ORF149重组真核表达质粒,在验证其能够稳定表达后,将其成功与氨化后的单壁碳纳米管连接,组成了单壁碳纳米管载ORF149表达系统。
| [1] |
Hedrick RP, Gilad O, Yun S, et al. A herpesvirus associated with mass mortality of juvenile and adult koi, a strain of common carp[J]. Journal of Aquatic Animal Health, 2000, 12(1): 44-57. DOI:10.1577/1548-8667(2000)012<0044:AHAWMM>2.0.CO;2 |
| [2] |
Gudding R, Van Muiswinkel WB. A history of fish vaccination:science-based disease prevention in aquaculture[J]. Fish Shellfish Immunol, 2013, 35(6): 1683-1689. DOI:10.1016/j.fsi.2013.09.031 |
| [3] |
Sommerset I, Krossoy B, Biering E, et al. Vaccines for fish in aquaculture[J]. Expert Rev Vaccines, 2005, 4(1): 89-101. DOI:10.1586/14760584.4.1.89 |
| [4] |
Hastein T, Gudding R, Evensen O. Bacterial vaccines for fish-An update of the current situation worldwide[J]. Fish Vaccinology, 2005, 25(3): 55-74. |
| [5] |
张子鹏, 余涛. 锦鲤疱疹病毒ORF30和ORF131蛋白的原核表达及纯化[J]. 中国农业信息, 2015, 10(5): 135-142. |
| [6] |
Evensen O, Leong JA. DNA vaccines against viral diseases of farmed fish[J]. Fish Shellfish Immunol, 2013, 35(6): 1751-1763. DOI:10.1016/j.fsi.2013.10.021 |
| [7] |
Anderson ED, Mourich DV, Fahrenkrug SC, et al. Genetic immunization of rainbow trout(Oncorhynchus mykiss)against infectious hematopoietic necrosis virus[J]. Mol Mar Biol Biotechnol, 1996, 5(2): 114-122. |
| [8] |
Lorenzen N, Lorenzen E, Einer-Jensen K, et al. Protective immunity to VHS in rainbow trout(Oncorhynchus mykiss, Walbaum)following DNA vaccination[J]. Fish Shellfish Immunol, 1998, 8(4): 261-270. DOI:10.1006/fsim.1997.0134 |
| [9] |
Sommerset I, Skern R, Biering E, et al. Protection against Atlantic halibut nodavirus in turbot is induced by recombinant capsid protein vaccination but not following DNA vaccination[J]. Fish Shellfish Immunol, 2005, 18(1): 13-29. DOI:10.1016/j.fsi.2004.03.006 |
| [10] |
Mikalsen AB, Torgersen J, Alestrom P, et al. Protection of Atlantic salmon Salmo salar against infectious pancreatic necrosis after DNA vaccination[J]. Diseases of Aquatic Organisms, 2004, 60(1): 11-20. |
| [11] |
Lorenzen E, Einer-Jensen K, Rasmussen JS, et al. The protective mechanisms induced by a fish rhabdovirus DNA vaccine depend on temperature[J]. Vaccine, 2009, 27(29): 3870-3880. DOI:10.1016/j.vaccine.2009.04.012 |
| [12] |
Emmenegger EJ, Kurath G. DNA vaccine protects ornamental koi(Cyprinus carpio koi)against north American spring viremia of carp virus[J]. Vaccine, 2008, 26(50): 6415-6421. DOI:10.1016/j.vaccine.2008.08.071 |
| [13] |
Zhou JX, Wang H, Li XW, et al. Construction of KHV-CJ ORF25 DNA vaccine and immune challenge test[J]. Journal of Fish Diseases, 2014, 37(4): 319-325. DOI:10.1111/jfd.12105 |
| [14] |
Zhou J, Xue J, Wang Q, et al. Vaccination of plasmid DNA encoding ORF81 gene of CJ strains of KHV provides protection to immunized carp in vitro[J]. Cell Dev Biol Anim, 2014, 50(6): 489-495. DOI:10.1007/s11626-014-9737-2 |
| [15] |
Davison AJ, Eberle R, Ehlers B, et al. The order herpesvirales[J]. Arch Virol, 2009, 154(1): 171-175. DOI:10.1007/s00705-008-0278-4 |
| [16] |
Aoki T, Hirono I, Kurokawa K, et al. Genome sequences of three koi herpesvirus isolates representing the expanding distribution of an emerging disease threatening koi and common carp worldwide[J]. Journal of Virology, 2007, 81(10): 5058-5065. DOI:10.1128/JVI.00146-07 |
| [17] |
Zhang Q, Gui JF. Virus genomes and virus-host interactions in aquaculture animals[J]. Science China Life Sciences, 2015, 58(2): 156-169. DOI:10.1007/s11427-015-4802-y |
| [18] |
Zeng XT, Chen ZY, Deng YS, et al. Complete genome sequence and architecture of crucian carp Carassius auratus herpesvirus(CaHV)[J]. Archives of Virology, 2016, 161(12): 3577-3581. DOI:10.1007/s00705-016-3037-y |
| [19] |
Yi Y, Zhang H, Lee X, et al. Extracellular virion proteins of two Chinese CyHV-3/KHV isolates, and identification of two novel envelope proteins[J]. Virus Research, 2014, 191(5): 108-116. |
| [20] |
Michel B, Leroy B, Stalin Raj V, et al. The genome of cyprinid herpesvirus 3 encodes 40 proteins incorporated in mature virions[J]. J Gen Virol, 2010, 91(2): 452-462. DOI:10.1099/vir.0.015198-0 |
| [21] |
Micheal S, Hogewind BF, Khan MI, et al. Variants in the PRPF8 gene are associated with glaucoma[J]. Mol Neurobiol, 2018, 55(5): 4504-4510. |
| [22] |
Kattlun J, Menanteau-Ledouble S, Gotesman M, et al. Immunogenic potential of a membrane protein encoded by the viral gene located at ORF 81 of Cyprinid Herpes-virus-3[J]. Wien Tierarz Monats, 2016, 103(3-4): 57-67. |
| [23] |
Fuchs W, Granzow H, Dauber M, et al. Identification of structural proteins of koi herpesvirus[J]. Arch Virol, 2014, 159(12): 3257-3268. DOI:10.1007/s00705-014-2190-4 |
| [24] |
Torrent F, Villena A, Lee PA, et al. The amino-terminal domain of ORF149 of koi herpesvirus is preferentially targeted by IgM from carp populations surviving infection[J]. Arch Virol, 2016, 161(10): 2653-2665. DOI:10.1007/s00705-016-2934-4 |
| [25] |
Monaghan SJ, Thompson KD, Bron JE, et al. Expression of immunogenic structural proteins of cyprinid herpesvirus 3 in vitro assessed using immunofluorescence[J]. Vet Res, 2016, 47: 8. DOI:10.1186/s13567-015-0297-6 |
| [26] |
Adomako M, St-Hilaire S, Zheng Y, et al. Oral DNA vaccination of rainbow trout, Oncorhynchus mykiss(Walbaum), against infectious haematopoietic necrosis virus using PLGA[Poly(D, L-Lactic-Co-Glycolic Acid)]nanoparticles[J]. J Fish Dis, 2012, 35(3): 203-214. DOI:10.1111/j.1365-2761.2011.01338.x |
| [27] |
Rivas-Aravena A, Fuentes Y, Cartagena J, et al. Development of a nanoparticle-based oral vaccine for Atlantic salmon against ISAV using an alphavirus replicon as adjuvant[J]. Fish Shellfish Immunol, 2015, 45(1): 157-166. DOI:10.1016/j.fsi.2015.03.033 |
| [28] |
Tang N, Zhong W, Au C, et al. Large-scale synthesis, annealing, purification, and magnetic properties of crystalline helical carbon nanotubes with symmetrical structures[J]. Advanced Functional Materials, 2007, 17(9): 1542-1550. DOI:10.1002/adfm.200600767 |
| [29] |
Deng X, Wu F, Liu Z, et al. The splenic toxicity of water soluble multi-walled carbon nanotubes in mice[J]. Carbon, 2009, 47(6): 1421-1428. DOI:10.1016/j.carbon.2008.12.032 |
| [30] |
Georgakilas V, Tagmatarchis N, Pantarotto D, et al. Amino acid functionalisation of water soluble carbon nanotubes[J]. Chem Commun(Camb), 2002, 56(24): 3050-3051. |
| [31] |
Pantarotto D, Singh R, McCarthy D, et al. Functionalized carbon nanotubes for plasmid DNA gene delivery[J]. Angew Chem Int Ed Engl, 2004, 43(39): 5242-5246. DOI:10.1002/anie.200460437 |
| [32] |
Perelberg A, Ronen A, Hutoran M, et al. Protection of cultured Cyprinus carpio against a lethal viral disease by an attenuated virus vaccine[J]. Vaccine, 2005, 23(26): 3396-3403. DOI:10.1016/j.vaccine.2005.01.096 |
| [33] |
Foldvari M, Bagonluri M. Carbon nanotubes as functional excipients for nanomedicines:Ⅱ. Drug delivery and biocompatibility issues[J]. Nanomedicine, 2008, 4(2): 183-200. |
| [34] |
Scheinberg DA, Mr M, Dao T, et al. Carbon nanotubes as vaccine scaffolds[J]. Adv Drug Deliv Rev, 2013, 65(13): 2016-2022. |
| [35] |
Yandar N, Pastorin G, Prato M, et al. Immunological profile of a Plasmodium vivax AMA-1 N-terminus peptide-carbon nanotube conjugate in an infected Plasmodium berghei mouse model[J]. Vaccine, 2008, 26(46): 5864-5873. DOI:10.1016/j.vaccine.2008.08.014 |
| [36] |
Parra J, Abad-Somovilla A, Mercader JV, et al. Carbon nanotube-protein carriers enhance size-dependent self-adjuvant antibody response to haptens[J]. Journal of Controlled Release, 2013, 170(2): 242-251. DOI:10.1016/j.jconrel.2013.05.019 |
| [37] |
Villa CH, Dao T, Ahearn I, et al. Single-walled carbon nanotubes deliver peptide antigen into dendritic cells and enhance IgG responses to tumor-associated antigens[J]. ACS Nano, 2011, 5(7): 5300-5311. DOI:10.1021/nn200182x |
| [38] |
Wang Y, Liu GL, Li DL, et al. The protective immunity against grass carp reovirus in grass carp induced by a DNA vaccination using single-walled carbon nanotubes as delivery vehicles[J]. Fish Shellfish Immunol, 2015, 47(2): 732-742. DOI:10.1016/j.fsi.2015.10.029 |
| [39] |
Gong YX, Zhu B, Liu GL, et al. Single-walled carbon nanotubes as delivery vehicles enhance the immunoprotective effects of a recombinant vaccine against Aeromonas hydrophila[J]. Fish Shellfish Immunol, 2015, 42(1): 213-220. DOI:10.1016/j.fsi.2014.11.004 |
| [40] |
Zhang C, Li LH, Wang J, et al. Enhanced protective immunity against spring viremia of carp virus infection can be induced by recombinant subunit vaccine conjugated to single-walled carbon nanotubes[J]. Vaccine, 2018, 36(42): 6334-6344. DOI:10.1016/j.vaccine.2018.08.003 |
| [41] |
Zhang C, Zhao Z, Liu GY, et al. Immune response and protective effect against spring viremia of carp virus induced by intramuscular vaccination with a SWCNTs-DNA vaccine encoding matrix protein[J]. Fish Shellfish Immunol, 2018, 79(12): 256-264. |
| [42] |
Perelberg A, Ilouze M, Kotler M, et al. Antibody response and resistance of Cyprinus carpio immunized with cyprinid herpes virus 3(CyHV-3)[J]. Vaccine, 2008, 26(30): 3750-3756. |
| [43] |
Cui LC, Guan XT, Liu ZM, Tian CY, et al. Recombinant lactobacillus expressing G protein of spring viremia of carp virus(SVCV)combined with ORF81 protein of koi herpesvirus(KHV):A promising way to induce protective immunity against SVCV and KHV infection in cyprinid fish via oral vaccination[J]. Vaccine, 2015, 33(27): 3092-3099. DOI:10.1016/j.vaccine.2015.05.002 |
| [44] |
Embregts CWE, Tadmor-Levi R, Veselý T, Pokorová D, et al. Intra-muscular and oral vaccination using a Koi Herpesvirus ORF25 DNA vaccine does not confer protection in common carp(Cyprinus carpio L.)[J]. Fish Shellfish Immunol, 2019, 85: 90-98. DOI:10.1016/j.fsi.2018.03.037 |




