RNA干扰(RNA interference,RNAi)是指由内源或外源性的双链RNA引发的同源靶基因的mRNA特异性降解,而导致基因沉默的现象,属于转录后基因沉默,具有清除体内异常基因的表达、抵抗病毒等外源异物侵害的功能。在植物、真菌(Fungus)、线虫(Caenorhabditis elegans)、果蝇(Drosophila melanogaster)、斑马鱼(Barchydaniorerio)和小鼠(Musmusculus)等多种生物中均存在RNA干扰现象[1-6]。近年来,由于双链RNA合成技术的改进,RNA干扰这一技术迅速被应用在各个领域,从而加速了基因功能、信号转导通路、基因治疗、新药开发等方面的研究。
近年来随着水产养殖业的迅速发展,水产品已成为世界上一个主要的经济和粮食来源[7]。与此同时,由于养殖规模的扩大和养殖密度的增加,由病毒、细菌和寄生虫引起的水产动物疾病也频繁爆发,给水产养殖业带来极大的危害,因此如何有效防控水产动物疾病是我们急需解决的问题。RNA干扰可以特异性的沉默目的基因,不仅可以用来研究基因的功能,还可以用来识别药物靶点和候选疫苗,并且通过干扰宿主体内病原体的传播、发育和增殖来控制疾病。因此,本文对RNA干扰在水产动物抗病毒和抗寄生虫治疗等方面的应用进行了综述,以期为有效地进行水产动物的病害防治提供参考。
1 RNA干扰的发现和作用机制1990年,Napoli等[1]将一个能产生色素的基因导入矮牵牛(Phellodeneron hybrida vilm)中,试图加深花瓣的紫颜色,结果多数花并不是紫色而是花斑色,甚至是白色,他们将这种现象命名为共抑制(Cosuppression)。1995年,Guo和Kempheus[8]尝试用反义RNA技术阻断线虫par-1基因的表达以研究该基因的功能,结果注射的反义RNA阻断了基因的表达,奇怪的是,注射正义RNA也出现了同样的结果。1998年,Fire等[3]首次将双链RNA——正义链和反义链的混合物注入线虫体内,结果诱发了比单独注射正义链或反义链都要强得多的基因沉默,他们将这种现象称为RNA干扰。2000年,Zamore等[9]使用体外培养的果蝇细胞进行研究发现,外源性dsRNA通过耗能过程降解成21-23 nt的小干扰RNA(siRNA)引发干扰。2017年,在人类体细胞及动物体细胞内发现人肠道病毒71型(EV71)感染可以使细胞产生具有抗病毒功能的vsiRNA,确证了RNAi在哺乳动物中是一种先天性抗病毒免疫的方式[10]。
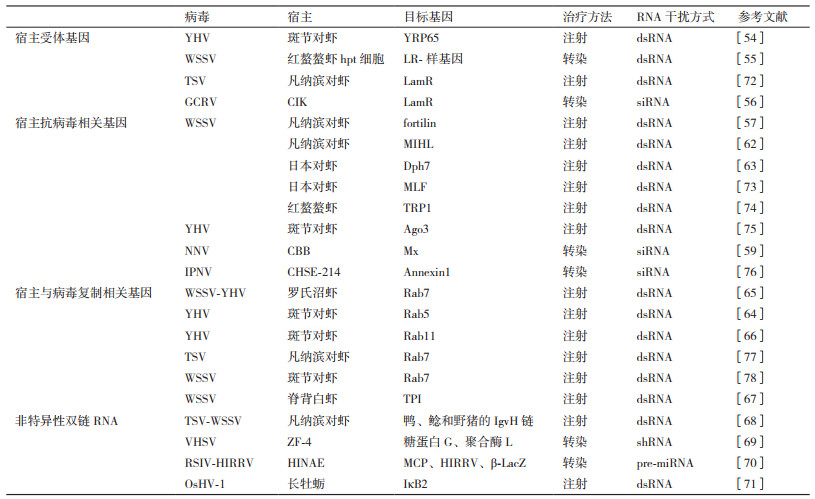
RNA干扰的作用机制见图 1。在RNA干扰过程中,内源或外源性的双链RNA被宿主Dicer蛋白识别并在协助蛋白TRBP(TAR-RNA binding protein)和PACT(Protein activator of PKR)的作用下,被切割成21-23 nt、5'端含有一个磷酸基团、3'端含有一个羟基并且突出2 nt的siRNA。siRNA随后在Dicer的帮助下与含AGO2蛋白的核酶复合物结合,构成RNA诱导沉默复合体(RNA-induced silencing complex,RISC)。RISC中的siRNA经AGO2作用分解成两条单链,正义链被释放出去,反义链则留在RISC中。仅含反义链的RISC被激活,在反义链的引导下通过碱基互补配对原则与靶基因结合,在距离反义链3'端12个碱基的位置将mRNA切断,断裂的mRNA随后被核酸酶降解,从而诱导靶基因的沉默[11]。siRNA还可以作为引物与mRNA结合,在RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)的作用下扩增产生新的双链RNA,双链RNA又被切割成siRNA进入RNA干扰循环,从而使得RNA干扰的效果级联放大[12]。外源性shRNA重组质粒转染进入细胞后,在RNA聚合酶Ⅲ的作用下转录产生初始的短发夹RNA前体,这些初始结构又被Drosha加工形成pre-shRNA。pre-shRNA随后在转运蛋白Exportin-5的作用下转运出核,在细胞质中被Dicer和协助蛋白TRBP、PACT识别并剪切,去除发夹结构,产生双链siRNA[13-14]。
|
| 图 1 RNA干扰机制图 |
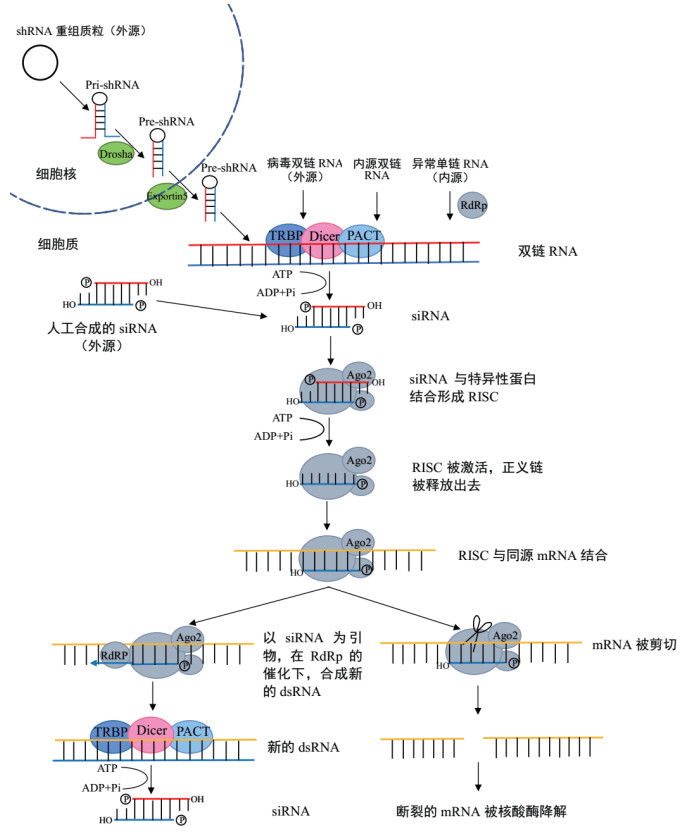
病毒是水环境中数量最多的生物,可引发22.6%的水产养殖相关疾病,一旦爆发会给水产养殖户带来巨大的经济损失,因此如何抗病毒感染成为急需解决的问题[15-16]。目前,利用RNA干扰技术在水产动物抗病毒中的研究主要集中在鱼虾中,包括虾病毒中的对虾白斑综合症病毒(White spot syndrome virus,WSSV)、黄头病毒(Yellow head virus,YHV)、桃拉综合症病毒(Taura syndrome virus,TSV);鱼病毒中的草鱼呼肠孤病毒(Grass carp reovirus,GCRV)、出血性败血症病毒(Viral hemorrhagic septicemia virus,VHSV)、神经坏死病毒(Nervous necrosis virus,NNV)、真鲷虹彩病毒(Red sea bream iridovirus,RSIV)等。
病毒感染宿主,首先吸附到宿主细胞表面,通过细胞介导的内吞作用进人细胞后,利用宿主细胞提供低分子物质合成大量的病毒核酸和蛋白组分,并装配成完整的病毒颗粒释放到胞外[17]。参与病毒复制的基因至关重要,利用RNA干扰沉默病毒基因或与病毒复制有关的宿主基因,可以抑制病毒的复制。利用RNA干扰技术在水产动物抗病毒感染中的研究应用在表 1和表 2中列出。
根据病毒基因编码的蛋白是否参与构成病毒粒子,可以分为两大类:结构蛋白和非结构蛋白。结构蛋白是组装成完整的病毒颗粒所必需的蛋白成分;非结构蛋白是病毒在感染细胞过程中表达的蛋白。研究人员通过抑制病毒的结构蛋白或非结构蛋白来抑制病毒的复制。在虾病毒中,针对白斑综合症病毒的非结构基因orf89、wsv191和结构基因vp28、vp26设计的dsRNA注射凡纳滨对虾(Litopenaeus vannamei),虾感染病毒后的累积死亡率分别为10%、83%、10%和21%,而对照组全部死亡,结果表明干扰orf89、vp28和vp26对抑制病毒复制非常有效。同时也发现非结构性的WSSV基因,如orf89,可以作为新的靶标来设计RNA干扰分子以对抗WSSV感染[18]。Yodmuang等[19]将靶向黄头病毒蛋白酶的dsRNA注射到斑节对虾(Penaeus monodon)体内,人工感染YHV 10 d后,注射dsRNA组对虾未发生死亡,而对照组死亡率达90%,表明该dsRNA抑制了对虾体内病毒的复制。在鱼病毒中,陈芸[20]以草鱼呼肠孤病毒的外衣壳蛋白VP7为靶位点设计siRNA注射稀有鮈鲫(Gobiocypris rarus),实验组死亡率仅30%,且病程延长至20 d,而对照组死亡率达100%,病程为12 d,说明siRNA通过降解稀有鮈鲫体内病毒的mRNA,从而抑制病毒粒子的形成。马杰等[21]针对GCRV-JX0901(GCRV Ⅰ型)和HGDRV(GCRV Ⅱ型)设计了两个siRNA多表达载体,一个表达载体靶向两种病毒的VP2基因、另一个靶向GCRV-JX0901的VP7基因和HGDRV的VP6基因,每个siRNA多表达载体均可以同时抑制细胞内GCRV-JX0901和HGDRV的复制,表明该多重siRNA表达系统具有治疗由多种基因型GCRV引起的草鱼出血性疾病的可能性。神经坏死病毒非结构蛋白B2被干扰后,促凋亡基因Bax表达下调,NNV感染的细胞获救[22]。在蛙病毒中,通过转染针对病毒53R基因的siRNA,可以抑制蛙虹彩病毒(Rana grylio virus,RGV)的复制[23]。通过化学合成大鲵蛙病毒(Chinese giant salamander Ranavirus,CGSRV)主要衣壳蛋白基因(MCP)、甲基转移酶基因(MTase)、DNA多聚酶基因(DNA polymerase)特异的siRNA,转染鲤鱼上皮瘤细胞(EPC)后感染大鲵蛙病毒,这些特异性siRNA推迟了细胞病变效应(CPE)出现的时间并降低了病毒毒力[24]。这些研究均证实利用RNA干扰抑制病毒的结构蛋白和非结构蛋白的表达可以有效抑制病毒的复制,并且可能为水产动物疫苗研制提供有效的靶点。
2.2 RNA干扰宿主基因研究表明不仅病毒自身的基因参与病毒对宿主的感染,而且宿主基因在病毒感染过程中也起到重要作用。在病毒侵染宿主的过程中,病毒通过与宿主表面的受体结合进入细胞,然后开始复制,细胞中有些宿主基因的表达有利于病毒复制,而有些宿主基因则能够抑制病毒复制。利用RNA干扰技术抑制宿主受体基因、宿主与病毒复制相关基因和宿主抗病毒相关基因的表达,可以研究各个基因在病毒感染过程中的功能,为进一步了解病毒侵染机制和抗病毒研究提供理论参考。
2.2.1 RNA干扰宿主受体基因病毒只有与细胞表面的病毒受体结合后,才能入侵细胞,因此细胞表面的受体对病毒的感染至关重要,我们可以通过抑制受体的表达来减少病毒进入细胞的机会,以此抑制病毒的感染。YRP65(Yellow head virus receptor protein)是YHV受体,Assavalapsakul等[54]利用dsRNA沉默斑节对虾的YRP65基因,结果抑制了YHV复制,并且虾全部存活。层黏连蛋白受体是一种细胞表面受体,是指导细胞间、细胞与细胞外基质相互作用的重要蛋白,红螯螯虾(Cherax quadricarinatus)体内层黏连蛋白受体样基因(Laminin receptor-like gene,LR样基因)的表达被抑制后,造血组织细胞中WSSV的进入和复制明显减少,并且通过研究发现病毒包膜蛋白VP28通过与之结合而吸附并侵入细胞[55]。Wang等[56]同样针对草鱼(Ctenopharyngodon idella)层黏连蛋白受体基因设计的siRNA,将其转染CIK细胞,被转染细胞抵抗草鱼呼肠孤病毒感染的能力得到提高。利用RNA干扰技术阻断宿主受体基因的表达,使病毒不能与受体结合,从而不能入侵细胞,是一种很好的抗病毒方法。
2.2.2 RNA干扰宿主抗病毒相关基因病毒入侵后,机体可调节自身的一系列基因抵抗病毒的感染,通过增加抗病毒相关基因的表达,可减少水产动物感染病毒的机会,提高机体的抵抗力、抑制病毒的复制,从而减少水产动物的死亡率。现今水产动物抗病毒相关基因的功能还未完全了解,而RNA干扰技术是研究基因功能的有力工具,因此可以利用RNA干扰技术研究水产动物抗病毒相关基因的功能。在斑节对虾中,Sinthujaroen等[57]干扰翻译控制肿瘤蛋白(The translationally controlled tumor protein,TCTP/fortilin)的表达后,实验组虾感染病毒后7 d内表现出100%的死亡率,而fortilin基因未被干扰的对照组在感染后12 d虾的死亡率仅为37.50%,此后作者给另一重要的商业品种凡纳滨对虾饲喂含有1%和5% fortilin重组蛋白饲料后,用WSSV攻毒,最终虾的存活率分别为66.7%和91.7%,证明fortilin在水产养殖的实际应用中也能发挥抗病毒作用,是一种有应用前景的饲料添加剂。Mx蛋白是一种由干扰素诱导的蛋白,对多种病毒具有抗病毒活性[58]。尖吻鲈(Lates calcarifer)的Mx基因被siRNA沉默后,病毒的RNA、蛋白质和子代病毒滴度的表达水平远高于对照组,表明Mx基因抑制NNV的表达[59]。在哺乳动物中,神经肽参与调节一系列免疫过程,如抗体合成、细胞因子的产生和释放、炎症和抗炎症、免疫记忆、免疫耐受和自身免疫反应等[60-61]。凡纳滨对虾体内的的神经肽蜕皮抑制激素(Molting-inhibiting hormones,MIHs)被干扰后,由WSSV感染的虾的死亡率及病毒在组织中的拷贝数明显增加,说明了MIHs可以在虾的抗病毒免疫反应中发挥积极作用[62]。白喉酰胺生物合成蛋白7(Diphthamide biosynthesis protein 7,Dph7)是古生菌和真核生物合成白喉酰胺的重要蛋白,Wang等[63]用双链RNA敲除日本对虾(Marsupenaeus japonicus)的白喉酰胺生物合成蛋白7基因,研究结果表明Dph7通过调节细胞凋亡、血细胞数量、酚氧化酶(Phenoloxidase,PO)活性和超氧化物歧化酶(Superoxide dismutase,SOD)活性来应对WSSV病毒感染。通过研究免疫相关基因的功能,能够为更深入的了解水产动物抗病毒免疫机制和防治病毒性疾病提供参考。
2.2.3 RNA干扰宿主与病毒复制相关基因此外,宿主基因也可以参与病毒入侵过程,Rab是一种GTP结合蛋白,与病毒的细胞内转运有关,Chalermporn等[64-66]针对Rab5、Rab7和Rab11设计dsRNA注射虾,然后感染白斑综合症病毒(WSSV)或黄头病毒(YHV),病毒的表达均被抑制。磷酸丙糖异构酶(Triosephosphate isomerase,TPI)是糖酵解途径中的重要酶,其可催化甘油醛-3-磷酸(GAP)和磷酸二羟丙酮(DHAP)的相互转化,其中DHAP参与脂质代谢和磷脂合成。TPI基因的干扰导致WSSV感染的脊背白虾(Exopalaemon carinicauda)体内的病毒拷贝数显著降低,表明WSSV感染可能通过调节糖酵解途径,使其产生更多磷脂,来促进病毒的复制[67]。这些研究结果表明通过干扰宿主体内与病毒入侵、复制相关基因的表达,可有效抑制病毒的复制。
2.3 非特异性双链RNA干扰研究人员已经证明针对病毒设计的特异性双链RNA可以抑制病毒复制,非特异性双链RNA有些情况下也表现出抑制作用。Robalino等[68]在感染白斑综合症病毒和桃拉病毒的凡纳滨对虾中分别注射绿头鸭(Anas platyrhynchos)、鲶(Ictalurus punctatus)和野猪(Sus scrofa)的免疫球蛋白基因dsRNA,结果显示,注射异源物种dsRNA组的死亡率远低于对照组,由于凡纳滨对虾体内不存在上述脊椎动物的免疫球蛋白基因,所以这些dsRNA分子不可能参与到凡纳滨对虾的抗病毒干扰体系中去,引起染病对虾死亡率降低的原因可能是异源物种dsRNA激活了对虾的先天免疫反应。此后的一系列实验均证实了这一点,Clarke等[69]靶向VHSV糖蛋白(G)或聚合酶(L)基因设计shRNA,其中五种特异性shRNA可以显著减少斑马鱼(Brachydanio rerio)细胞中VHSV的复制,而一种错误折叠的shRNA,通过诱导干扰素和Mx基因产生非特异性的抗病毒应答降低病毒的感染。针对RSIV的主要衣壳蛋白(MCP)基因,以及靶向牙鲆弹状病毒(Hirame rhabdovirus,HIRRV)设计的干扰RNA都抑制了病毒的复制,而靶向β-半乳糖苷酶基因(β-LacZ)的对照组细胞中也观察到对病毒复制的抑制作用,针对病毒的干扰不仅能触发microRNA相关的途径,而且还能激活干扰素途径,以增加细胞对病毒的抵抗力[70]。在长牡蛎(Crassostrea gigas)中,抑制NF-κB抑制蛋白(IκB2)的表达后,感染牡蛎疱疹病毒1(Ostreid herpesvirus 1,OsHV-1)的长牡蛎全部存活,而对照组注射绿色荧光蛋白的双链RNA,存活率也为100%,并且对照组中免疫相关基因的表达均增加[71]。以上结果均表明不仅只有特异性的双链RNA可以抑制病毒复制,而非特异性的双链RNA也具有干扰病毒复制的作用。
3 RNAi技术在水产动物抗寄生虫研究中的应用随着水产动物养殖业的扩大,寄生虫病的出现也日益增多。被寄生虫侵犯的鱼体呈现不安状态,严重影响食欲,日渐消瘦,并且还容易引发白皮病、赤皮病等各种病症[79]。寄生虫感染的问题亟待解决,应用RNA干扰技术抑制寄生虫的生殖、生长发育、运动、宿主识别等相关基因的表达,观察寄生虫的表征变化,从而进一步了解寄生虫侵袭宿主的机制,为抗寄生虫感染提供参考。RNA干扰技术在水产动物抗寄生虫研究中的应用在表 3中列出。
Ohashi等[80]第一次成功地在鱼寄生虫体内用dsRNA介导了基因沉默,通过浸泡引入新贝尼登虫(Neobenedenia girellae)血管相关基因vlg1或vlg2的dsRNA,可以使生殖细胞部分或完全丧失,孵化率降低,说明RNA干扰技术可以成功干扰新贝尼登虫基因,并且可以研究该寄生虫基因的功能。
此后RNA干扰技术的抗寄生虫研究主要集中在鱼虱(Lepeophtheirus salmonis)的基因功能研究上。大西洋鲑是世界著名经济鱼类,而鱼虱是危害大西洋鲑鱼(Salmo salar)的主要寄生虫之一,因而受到广泛研究[81-82]。鱼虱的控制很大程度上依赖抗鱼虱药物,但是经常使用会导致鱼虱的抗药性[83-84]。近年来应用RNA干扰技术在研究鱼虱生殖、生长、运动等具体机制以及参与调控的基因等方面也取得了大量进展,从而为寻找新的药物靶点及控制鱼虱感染提供理论参考。Dalvin等[85]首次尝试用RNA干扰技术研究鱼虱卵黄相关蛋白基因(Yolk-associated protein,YAP)的功能,被干扰后的未成熟雌性通常会在体外产卵,但大多数胚胎要么无法孵化,要么产生了严重畸形的幼虫,这表明YAP在鱼虱的胚胎发育中起着至关重要的作用。在寄生的生命阶段,鱼虱会摄取大量的宿主血液,其中含有大量的铁,铁虽是一种必须的微量营养元素,但在高剂量时是有毒性的,而铁调节蛋白(Iron regulatory protein 1B,IRP1B)在调节体内铁含量过程中发挥重要作用。干扰IRP1B的双链RNA注射鱼虱后,铁蛋白(Ferritin)表达增加,卵串变短,后代数量减少,可用来控制寄生虫后代数量[86]。维甲酸X受体(Retinoid X receptor,RXR),属于核受体超家族,参与控制个体的遗传发育以及包括生殖和代谢途径在内的多个过程。雌虱的维甲酸X受体被干扰后,产生卵子的数量大幅减少或不产生,而幼虫几乎全部死亡[87]。雷帕霉素靶蛋白(Target of rapamycin,TOR)信号通路存在于所有后生动物中,是根据营养多寡调节细胞活动的主要调控因子。RNA干扰鱼虱的TOR通路,抑制了卵子的发育和成熟,后代存活数量减少,证实TOR通路在鱼虱卵黄蛋白产生和卵发育中存在极其重要的作用[88]。黏液样精子包膜蛋白1 & 2(Mucin-like spermatophore wall protein 1 & 2,MLSWP1 & 2)基因被干扰后,雌体携带的精子包囊减少,可以通过干扰该基因以减少受精率[89]。
甲壳动物由于独特的身体构造,在个体发育过程中存在蜕皮现象。蜕皮素在介导蜕皮过程中发挥重要作用。蜕皮素受体(Ecdysone receptor,EcR)单独被干扰导致鱼虱营养不良、发育迟缓、死亡率增加,而蜕皮素受体和维甲酸X受体同时被干扰,幼虫蜕皮停滞,说明EcR对鱼虱的蜕皮和发育具有重要的作用[90]。Eichner等[91]干扰几丁质酶2(Chitinases2,Chi2)基因,引起鱼虱的背部肌肉变短,整体形态发生改变,运动能力降低,并且不能感染宿主,表明Chi2可能与鱼虱的生长发育有关。Carpio等[92]用双链RNA介导的干扰来研究鱼虱my32基因的功能,结果表明,与对照组相比,用my32-dsRNA浸泡的鱼虱的my32转录本下调了70%,鱼虱后代发育迟缓,数量减少,这表明my32蛋白有希望作为疫苗的开发目标,以对抗鱼虱的侵扰。
寄生虫具有高度的宿主特异性,鱼虱的离子型受体(Ionotropic receptors,IRs)被特异性dsRNA干扰后,改变了对宿主识别的特异性,一部分鱼虱寄生到非宿主体表,停留一段时间后离开,表明IRs的缺乏降低了鱼虱对寄生宿主的特异性,使其感染非宿主鱼,这一新的发现为将来利用宿主识别系统控制寄生虫开辟了道路[93]。
鱼虱识别宿主后,通过运动吸附于宿主体表,开始寄生生活。几丁质酶2(Chitinases 2,Chi2)基因和血红素过氧化物酶(Heme peroxidase 1,HPX1)基因的干扰均引起鱼虱幼虫活动减少、游泳速度减慢[94]。表明这些基因参与调节鱼虱的运动功能。
寄生虫感染可引起水产动物死亡,降低水产养殖的经济效益。通过研究寄生虫的生长发育、生殖、运动、宿主识别相关基因的功能,深入了解寄生虫的寄生机制,可以为寻找更加有效的控制寄生虫感染的药物奠定理论基础。
4 RNAi在水生动物中的研究与应用前景随着水产养殖品种的增多和养殖规模的增大,各种传染性疾病的暴发和流行已经严重威胁了水产养殖的健康持续发展。目前水产动物病毒性疾病的防治可供利用的有效药物和疫苗非常有限,而RNA干扰技术是目前研究基因沉默的热门技术,已广泛应用于植物、动物和人类基因的功能研究及疾病治疗方面的探索,利用RNAi技术关闭目标基因,结合转基因技术,将有望成为探索水产动物疾病防治方法的新途径。
现阶段,人们主要通过注射、浸泡及转染等手段将dsRNA/siRNA分子传递到水产动物或细胞内以用于水产动物抗病毒和抗寄生虫感染研究,但RNA干扰技术在应用研究中仍存在许多问题,如沉默效率低、脱靶、稳定性差、引起免疫反应、安全性。对于脱靶效应可以通过针对同一个基因选择多个靶位点,靶位点选择在不易突变的区域,用软件预测是否含有脱靶效应,选择合适的siRNA浓度,利用化学修饰或用特殊物质封装siRNA分子等方法来解决,但如何更大程度甚至完全消除毒副作用,还有待于进一步研究。
随着对分子生物学研究的不断深入,RNAi技术作为一种新的基因阻断技术,必将从实验阶段走向实际应用,广泛应用于水产动物基因功能分析、免疫机制研究、病原抑制与疾病控制等方面。RNAi技术在充满挑战的后基因组时代将有广阔的应用前景,它将会在水产动物医学中带来一次新的技术革命。
| [1] |
Napoli C, Lemieux C, Jorgensen R. Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans[J]. Plant Cell, 1990, 2(4): 279-289. DOI:10.2307/3869076 |
| [2] |
Romano N, Macino G. Quelling:Transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences[J]. Molecular Microbiology, 1992, 6(22): 3343-3353. DOI:10.1111/j.1365-2958.1992.tb02202.x |
| [3] |
Fire A. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391: 806-811. DOI:10.1038/35888 |
| [4] |
Hammond SM, Boettcher S, Caudy AA, et al. Argonaute2, a link between genetic and biochemical analyses of RNAi[J]. Science, 2001, 293(5532): 1146-1150. DOI:10.1126/science.1064023 |
| [5] |
Wargelius A, Ellingsen S, Fjose A. Double-stranded RNA induces specific developmental defects in zebrafish embryos[J]. Biochemical & Biophysical Research Communications, 1999, 263(1): 156-161. |
| [6] |
Wianny F, Zernicka-Goetz M. Specific interference with gene function by double-stranded RNA in early mouse development[J]. Nature Cell Biology, 2000, 2(2): 70-75. DOI:10.1038/35000016 |
| [7] |
Biacchesi S. The reverse genetics applied to fish RNA viruses[J]. Veterinary Research, 2011, 42(1): 12. DOI:10.1186/1297-9716-42-12 |
| [8] |
Guo S, Kemphues KJ. Par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed[J]. Cell, 1995, 81(4): 611-620. DOI:10.1016/0092-8674(95)90082-9 |
| [9] |
Zamore PD, Tuschl T, Sharp PA, et al. RNAi:double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals[J]. Cell, 2000, 101(1): 25-33. DOI:10.1016/S0092-8674(00)80620-0 |
| [10] |
Qiu Y, Xu Y, Zhang Y, et al. Human virus-derived small RNAs can confer antiviral immunity in mammals[J]. Immunity, 2017, 46(6): 992-1004. DOI:10.1016/j.immuni.2017.05.006 |
| [11] |
Stevenson M. Therapeutic potential of RNA interference[J]. N Engl J Med, 2004, 351(17): 1772-1777. DOI:10.1056/NEJMra045004 |
| [12] |
Hannon GJ. RNA interference[J]. Nature, 2002, 418(6894): 244-251. DOI:10.1038/418244a |
| [13] |
Pereira P, Queiroz JA, Figueiras A, et al. Affinity approaches in RNAi-based therapeutics purification[J]. Journal of Chromatography B, 2016, 1021: 45-56. DOI:10.1016/j.jchromb.2016.01.022 |
| [14] |
Paddison PJ, Caudy AA, Bernstein E, et al. Short hairpin RNAs(shRNAs)induce sequence-specific silencing in mammalian cells[J]. Genes & Development, 2002, 16(8): 948-958. |
| [15] |
Fuhrman JA. Marine viruses and their biogeochemical and ecological effects[J]. Nature, 1999, 399(6736): 541-548. DOI:10.1038/21119 |
| [16] |
Hall SJ, Delaporte A, Phillips MJ, et al. Blue frontiers: managing the environmental costs of aquaculture[R]. Working Papers, 2011.
|
| [17] |
郭帅, 李家乐, 吕利群, 等. 草鱼呼肠孤病毒的致病机制及抗病毒新对策[J]. 渔业现代化, 2010, 37(1): 37-42. DOI:10.3969/j.issn.1007-9580.2010.01.009 |
| [18] |
Escobedo-Bonilla CM, Vega-Peña S, Mejía-Ruiz CH. Efficacy of double-stranded RNA against white spot syndrome virus(WSSV)non-structural(orf89, wsv191)and structural(vp28, vp26)genes in the Pacific white shrimp Litopenaeus vannamei[J]. Journal of King Saud University-Science, 2015, 27(2): 182-188. DOI:10.1016/j.jksus.2014.11.004 |
| [19] |
Yodmuang S, Tirasophon W, Roshorm Y, et al. YHV-protease dsRNA inhibits YHV replication in Penaeus monodon and prevents mortality[J]. Biochem Biophys Res Commun, 2006, 341(2): 351-356. DOI:10.1016/j.bbrc.2005.12.186 |
| [20] |
陈芸.用RNA干扰(RNAi)抗草鱼出血病病毒的初步研究[D].北京: 中国科学院研究生院, 2005. http://cdmd.cnki.com.cn/article/cdmd-80119-2005152042.htm
|
| [21] |
Ma J, Zeng L, Fan Y, et al. Significant inhibition of two different genotypes of grass carp reovirus in vitro using multiple shRNAs expression vectors[J]. Virus Research, 2014, 189: 47-55. DOI:10.1016/j.virusres.2014.05.009 |
| [22] |
Su YC, Wu JL, Hong JR. Betanodavirus non-structural protein B2:a novel necrotic death factor that induces mitochondria-mediated cell death in fish cells[J]. Virology, 2009, 385(1): 143-154. DOI:10.1016/j.virol.2008.11.036 |
| [23] |
Kim YS, Ke F, Lei XY, et al. Viral envelope protein 53R gene highly specific silencing and iridovirus resistance in fish cells by AmiRNA[J]. PLoS One, 2010, 5(4): e10308. DOI:10.1371/journal.pone.0010308 |
| [24] |
周燕. RNA干扰对大鲵蛙病毒(CGSRV)主要功能基因表达与増殖影响的研究[D].雅安: 四川农业大学, 2015.
|
| [25] |
Wu Y, Ling L, Yang LS, et al. Inhibition of white spot syndrome virus in Litopenaeus vannamei shrimp by sequence-specific siRNA[J]. Aquaculture, 2007, 271(1): 21-30. |
| [26] |
Rattanarojpong T, Khankaew S, Khunrae P, et al. Recombinant baculovirus mediates dsRNA specific to rr2 delivery and its protective efficacy against WSSV infection[J]. Journal of Biotechnology, 2016, 229: 44-52. DOI:10.1016/j.jbiotec.2016.05.007 |
| [27] |
周俊芳, 杨先乐, 万夕和, 等. 不同靶点shRNA干扰对虾白斑综合征病毒增殖效果分析[J]. 华中农业大学学报, 2011, 30(1): 105-108. DOI:10.3969/j.issn.1008-3456.2011.01.018 |
| [28] |
Robalino J, Bartlett T, Shepard E, et al. Double-stranded RNA induces sequence-specific antiviral silencing in addition to nonspecific immunity in a marine shrimp:convergence of RNA interference and innate immunity in the invertebrate antiviral response[J]. Journal of Virology, 2005, 79(21): 13561-13571. DOI:10.1128/JVI.79.21.13561-13571.2005 |
| [29] |
Mejía CH, Vega S, Alvarez P, et al. Double-stranded RNA against white spot syndrome virus(WSSV)vp28 or vp26 reduced susceptibility of Litopenaeus vannamei to WSSV, and survivors exhibited decreased susceptibility in subsequent reinfections[J]. Journal of Invertebrate Pathology, 2011, 107(1): 65-68. DOI:10.1016/j.jip.2011.02.002 |
| [30] |
Thammasorn T, Sangsuriya P, Meemetta W, et al. Large-scale production and antiviral efficacy of multi target double stranded RNA for the prevention of white spot syndrome virus(WSSV)in shrimp[J]. BMC Biotechnology, 2015, 15(1): 1-7. |
| [31] |
Westenberg M, Heinhuis B, Zuidema D, et al. siRNA injection induces sequence-independent protection in Penaeus monodon against white spot syndrome virus[J]. Virus Research, 2005, 114(1): 133-139. |
| [32] |
Sarathi M, Simon MC, Venkatesan C, et al. Oral administration of bacterially expressed VP28 dsRNA to protect Penaeus monodon from white spot syndrome virus[J]. Marine Biotechnology, 2008, 10(3): 242-249. DOI:10.1007/s10126-007-9057-6 |
| [33] |
Attasart P, Kaewkhaw R, Chimwai C, et al. Inhibition of white spot syndrome virus replication in Penaeus monodon by combined silencing of viral rr2 and shrimp PmRab7[J]. Virus Research, 2009, 145(1): 127-133. |
| [34] |
Alenton RR, Kondo H, Hirono I, et al. Gene silencing of VP9 gene impairs WSSV infectivity on Macrobrachium rosenbergiii[J]. Virus Research, 2016, 214: 65-70. DOI:10.1016/j.virusres.2016.01.013 |
| [35] |
Jariyapong P, Weerachatyanukul W, Direkbusarakom S, et al. Enhancement of shrimp immunity against white spot syndrome virus by Macrobrachium rosenbergiii, nodavirus-like particle encapsulated VP28 double-stranded RNA[J]. Aquaculture, 2015, 446: 325-332. DOI:10.1016/j.aquaculture.2015.05.016 |
| [36] |
Zhu F, Zhang X. The antiviral vp28-siRNA expressed in bacteria protects shrimp against white spot syndrome virus(WSSV)[J]. Aquaculture, 2011, 319(3): 311-314. |
| [37] |
张衡, 谷力, 杨丰. 对虾白斑综合症病毒vp15基因的RNA干扰研究[J]. 应用海洋学学报, 2012, 31(1): 47-52. |
| [38] |
Saksmerprome V, Charoonnart P, Gangnonngiw W, et al. A novel and inexpensive application of RNAi technology to protect shrimp from viral disease[J]. Journal of Virological Methods, 2009, 162(1): 213-217. |
| [39] |
Saksmerprome V, Thammasorn T, Jitrakorn S, et al. Using double-stranded RNA for the control of Laem-Singh Virus(LSNV)in Thai P. monodon[J]. Journal of Biotechnology, 2013, 164(4): 449-453. DOI:10.1016/j.jbiotec.2013.01.028 |
| [40] |
Thammasorn T, Somchai P, Laosutthipong C, et al. Therapeutic effect of Artemia enriched with Escherichia coli expressing double-stranded RNA in the black tiger shrimp Penaeus monodon[J]. Antiviral Res, 2013, 100(1): 202-206. DOI:10.1016/j.antiviral.2013.08.005 |
| [41] |
李兵, 范玉顶, 李艳秋, 等. 化学合成小干扰RNA分子高效抑制草鱼呼肠孤病毒复制[J]. 病毒学报, 2009, 25(5): 388-394. |
| [42] |
马杰. RNA基因干扰技术抑制草鱼呼肠孤病毒复制的研究[D].武汉: 华中农业大学, 2013.
|
| [43] |
Schyth BD, Lorenzen N, Pedersen FS. Antiviral activity of small interfering RNAs:specificity testing using heterologous virus reveals interferon-related effects overlooked by conventional mismatch controls[J]. Virology, 2006, 349(1): 134-141. DOI:10.1016/j.virol.2006.01.009 |
| [44] |
Ruiz S, Schyth BD, Encinas P, et al. New tools to study RNA interference to fish viruses:Fish cell lines permanently expressing siRNAs targeting the viral polymerase of viral hemorrhagic septicemia virus[J]. Antiviral Research, 2009, 82(3): 148-156. DOI:10.1016/j.antiviral.2009.02.200 |
| [45] |
Kim MS, Kim KH. Inhibition of viral hemorrhagic septicemia virus replication using a short hairpin RNA targeting the G gene[J]. Archives of Virology, 2011, 156(3): 457-464. DOI:10.1007/s00705-010-0882-y |
| [46] |
Kim MS, Jee BY, Cho MY, et al. Fugu double U6 promoter-driven long double-stranded RNA inhibits proliferation of viral hemorrhagic septicemia virus(VHSV)in fish cell lines[J]. Archives of Virology, 2012, 157(6): 1029-1038. DOI:10.1007/s00705-012-1275-1 |
| [47] |
Bohle H, Lorenzen N, Schyth BD. Species specific inhibition of viral replication using dicer substrate siRNAs(DsiRNAs)targeting the viral nucleoprotein of the fish pathogenic rhabdovirus viral hemorrhagic septicemia virus(VHSV)[J]. Antiviral Research, 2011, 90(3): 187-194. DOI:10.1016/j.antiviral.2011.03.174 |
| [48] |
Wu HC, Wu JL, Chu HL, et al. RGNNV induces mitochondria-mediated cell death via newly synthesized protein dependent pathway in fish cells[J]. Fish & Shellfish Immunology, 2010, 29(3): 451-463. |
| [49] |
Wu HC, Chiu CS, Wu JL, et al. Zebrafish anti-apoptotic protein zfBcl-xL can block betanodavirus protein alpha-induced mitochondria-mediated secondary necrosis cell death[J]. Fish & Shellfish Immunology, 2008, 24(4): 436-449. |
| [50] |
Dang LT, Kondo H, Hirono I, et al. Inhibition of red seabream iridovirus(RSIV)replication by small interfering RNA(siRNA)in a cell culture system[J]. Antiviral Research, 2008, 77(2): 142-149. DOI:10.1016/j.antiviral.2007.10.007 |
| [51] |
Zenke K, Nam YK, Kim KH. Development of siRNA expression vector utilizing rock bream beta-actin promoter:a potential therapeutic tool against viral infection in fish[J]. Appl Microbiol Biotechnol, 2010, 85(3): 679-690. DOI:10.1007/s00253-009-2177-3 |
| [52] |
Fouad AM, Soliman H, Abdallah ESH, et al. In-vitro inhibition of spring viremia of carp virus replication by RNA interference targeting the RNA-dependent RNA polymerase gene[J]. Journal of Virological Methods, 2019, 263: 14-19. DOI:10.1016/j.jviromet.2018.10.008 |
| [53] |
Xie J, Lü L, Deng M, et al. Inhibition of reporter gene and Iridovirus-tiger frog virus in fish cell by RNA interference[J]. Virology, 2005, 338(1): 43-52. |
| [54] |
Assavalapsakul W, Kiem HK, Smith DR, et al. Silencing of PmYPR65 receptor prevents yellow head virus infection in Penaeus monodon[J]. Virus Research, 2014, 189: 133-135. DOI:10.1016/j.virusres.2014.05.022 |
| [55] |
Liu LK, Li WD, Gao Y, et al. A laminin-receptor-like protein regulates white spot syndrome virus infection by binding to the viral envelope protein VP28 in red claw crayfish Cherax quadricarinatus[J]. Developmental & Comparative Immunology, 2018, 79: 186-194. |
| [56] |
Wang H, Yu F, Li J, et al. Laminin receptor is an interacting partner for viral outer capsid protein VP5 in grass carp reovirus infection[J]. Virology, 2016, 490: 59-68. DOI:10.1016/j.virol.2016.01.011 |
| [57] |
Sinthujaroen P, Tonganunt-Srithaworn M, Eurwilaichitr L, et al. Protection of Litopenaeus vannamei, against the white spot syndrome virus using recombinant Pm-fortilin expressed in Pichia pastoris[J]. Aquaculture, 2015, 435: 450-457. DOI:10.1016/j.aquaculture.2014.10.024 |
| [58] |
Haller O, Frese M, Kochs G. Mx proteins:mediators of innate resistance to RNA viruses[J]. Rev Sci Tech, 1998, 17(1): 220-230. DOI:10.20506/rst.17.1.1084 |
| [59] |
Wu YC, Lu YF, Chi SC. Anti-viral mechanism of barramundi Mx against betanodavirus involves the inhibition of viral RNA synthesis through the interference of RdRp[J]. Fish & Shellfish Immunology, 2010, 28(3): 467-475. |
| [60] |
Sternberg EM. Neural regulation of innate immunity:a coordinated nonspecific host response to pathogens[J]. Nature Reviews Immunology, 2006, 6(4): 318-328. DOI:10.1038/nri1810 |
| [61] |
Hagen PMV, Hofland LJ, Bokum AMCT, et al. Neuropeptides and their receptors in the immune system[J]. Annals of Medicine, 1999, 31(S2): 15-22. |
| [62] |
Zuo H, Yuan J, Niu S, et al. A molting-inhibiting hormone-like protein from Pacific white shrimp, Litopenaeus vannamei, is involved in immune responses[J]. Fish & Shellfish Immunology, 2018, 72: 544-551. |
| [63] |
Wang Z, Sun B, Zhu F. Molecular characterization of diphthamide biosynthesis protein 7 in Marsupenaeus japonicus and its role in white spot syndrome virus infection[J]. Fish & Shellfish Immunology, 2018, 75: 8-16. |
| [64] |
Posiri P, Ongvarrasopone C, Panyim S. Rab5, an early endosomal protein required for yellow head virus infection of Penaeus monodon[J]. Aquaculture, 2016, 459: 43-53. DOI:10.1016/j.aquaculture.2016.03.026 |
| [65] |
Ongvarrasopone C, Chanasakulniyom M, Sritunyalucksana K, et al. Suppression of PmRab7 by dsRNA inhibits WSSV or YHV infection in shrimp[J]. Marine Biotechnology, 2008, 10(4): 374-381. DOI:10.1007/s10126-007-9073-6 |
| [66] |
Kongprajug A, Panyim S, Ongvarrasopone C. Suppression of PmRab11 inhibits YHV infection in Penaeus monodon[J]. Fish Shellfish Immunol, 2017, 66: 433-444. DOI:10.1016/j.fsi.2017.05.039 |
| [67] |
Liu F, Li S, Liu G, et al. Triosephosphate isomerase(TPI)facili-tates the replication of WSSV in Exopalaemon carinicauda[J]. Developmental & Comparative Immunology, 2017, 71: 28-36. |
| [68] |
Robalino J, Browdy CL, Prior S, et al. Induction of antiviral immunity by double-stranded RNA in a marine invertebrate[J]. Journal of Virology, 2004, 78(19): 10442-10448. DOI:10.1128/JVI.78.19.10442-10448.2004 |
| [69] |
Clarke BD, Mccoll KA, Ward AC, et al. ShRNAs targeting either the glycoprotein or polymerase genes inhibit Viral haemorrhagic septicaemia virus replication in zebrafish ZF4 cells[J]. Antiviral Research, 2017, 141: 124-132. DOI:10.1016/j.antiviral.2017.02.012 |
| [70] |
Dang LT, Kondo H, Aoki T, et al. Engineered virus-encoded pre-microRNA(pre-miRNA)induces sequence-specific antiviral response in addition to nonspecific immunity in a fish cell line:convergence of RNAi-related pathways and IFN-related pathways in antiviral response[J]. Antiviral Res, 2008, 80(3): 316-323. DOI:10.1016/j.antiviral.2008.07.005 |
| [71] |
Pauletto M, Segarra A, Montagnani C, et al. Long dsRNAs promote an anti-viral response in Pacific oyster hampering ostreid herpesvirus 1 replication[J]. The Journal of Experimental Biology, 2017, 220: 3671-3685. DOI:10.1242/jeb.156299 |
| [72] |
Senapin S, Phiwsaiya K, Anantasomboon G, et al. Knocking down a Taura syndrome virus(TSV)binding protein Lamr is lethal for the whiteleg shrimp Penaeus vannamei[J]. Fish & Shellfish Immunology, 2010, 29(3): 422-429. |
| [73] |
冯肖舞.髓样白血病因子(MLF)在日本囊对虾抗病毒抗细菌免疫中的功能研究[D].济南: 山东大学, 2018. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=1018094320.nh
|
| [74] |
Li DL, Chang XJ, Xie XL, et al. A thymosin repeated protein1 reduces white spot syndrome virus replication in red claw crayfish, Cherax quadricarinatus[J]. Developmental & Comparative Immunology, 2018, 84: 109-116. |
| [75] |
Phetrungnapha A, Ho T, Udomkit A, et al. Molecular cloning and functional characterization of Argonaute-3 gene from Penaeus monodon[J]. Fish & Shellfish Immunology, 2013, 35(3): 874-882. |
| [76] |
Hwang HJ, Chang HM, Han GK, et al. Identification and functional analysis of salmon annexin 1 induced by a virus infection in a fish cell line[J]. Journal of Virology, 2007, 81(24): 13816-13824. DOI:10.1128/JVI.02822-06 |
| [77] |
Ongvarrasopone C, Saejia P, Chanasakulniyom M, et al. Inhibition of Taura syndrome virus replication in Litopenaeus vannamei through silencing the LvRab7 gene using double-stranded RNA[J]. Archives of Virology, 2011, 156(7): 1117-1123. DOI:10.1007/s00705-011-0952-9 |
| [78] |
Attasart P, Kaewkhaw R, Chimwai C, et al. Inhibition of white spot syndrome virus replication in Penaeus monodon by combined silencing of viral rr2 and shrimp PmRab7[J]. Virus Research, 2009, 145(1): 127-133. DOI:10.1016/j.virusres.2009.06.018 |
| [79] |
战文斌. 水产动物病害学[M]. 北京: 中国农业出版社, 2006.
|
| [80] |
Ohashi H, Umeda N, Hirazawa N, et al. Expression of vasa(vas)-related genes in germ cells and specific interference with gene functions by double-stranded RNA in the monogenean, Neobenedenia girellae[J]. International Journal for Parasitology, 2007, 37(5): 515-523. DOI:10.1016/j.ijpara.2006.11.003 |
| [81] |
Pike AW. Sea lice-Major pathogens of farmed atlantic salmon[J]. Parasitology Today, 1989, 5(9): 291-297. DOI:10.1016/0169-4758(89)90020-3 |
| [82] |
Pike AW, Wadsworth S L. Sealice on salmonids:their biology and control[J]. Advances in Parasitology, 1999, 44: 233-337. DOI:10.1016/S0065-308X(08)60233-X |
| [83] |
Torrissen O, Jones S, Asche F, et al. Salmon lice-impact on wild salmonids and salmon aquaculture[J]. Journal of Fish Diseases, 2013, 36(3): 171-194. DOI:10.1111/jfd.12061 |
| [84] |
Aaen SM, Helgesen KO, Bakke MJ, et al. Drug resistance in sea lice:a threat to salmonid aquaculture[J]. Trends in Parasito-logy, 2015, 31(2): 72-81. DOI:10.1016/j.pt.2014.12.006 |
| [85] |
Dalvin S, Frost P, Biering E, et al. Functional characterisation of the maternal yolk-associated protein(LsYAP)utilising systemic RNA interference in the salmon louse(Lepeophtheirus salmonis)(Crustacea:Copepoda)[J]. International Journal for Parasitology, 2009, 39(13): 1407-1415. DOI:10.1016/j.ijpara.2009.04.004 |
| [86] |
Tröβe C, Kongshaug H, Dondrup M, et al. Characterisation of iron regulatory protein 1A and 1B in the blood-feeding copepod Lepeophtheirus salmonis[J]. Experimental Parasitology, 2015, 157: 1-11. DOI:10.1016/j.exppara.2015.06.010 |
| [87] |
Eichner C, Dalvin S, Skern-Mauritzen R, et al. Characterization of a novel RXR receptor in the salmon louse(Lepeophtheirus salmonis, Copepoda)regulating growth and female reproduction[J]. BMC Genomics, 2015, 16(1): 81. DOI:10.1186/s12864-015-1277-y |
| [88] |
Sandlund L, Kongshaug H, Nilsen F, et al. Molecular characteriza-tion and functional analysis of components of the TOR pathway of the salmon louse, Lepeophtheirus salmonis(Krøyer, 1838)[J]. Experimental Parasitology, 2018, 188: 83-92. DOI:10.1016/j.exppara.2018.04.004 |
| [89] |
Borchel A, Nilsen F. A novel gene-family involved in spermato-phore generation in the economically important salmon louse Lepeo-phtheirus salmonis[J]. Molecular Reproduction and Develop-ment, 2018, 85: 478-489. |
| [90] |
Sandlund L, Nilsen F, Male R, et al. The ecdysone receptor(EcR)is a major regulator of tissue development and growth in the marine salmonid ectoparasite; Lepeophtheirus salmonis(Copepoda; Caligidae)[J]. Molecular and Biochemical Parasitology, 2016, 208(2): 65-73. DOI:10.1016/j.molbiopara.2016.06.007 |
| [91] |
Eichner C, Harasimczuk E, Nilsen F, et al. Molecular characterisa-tion and functional analysis of LsChi2, a chitinase found in the salmon louse(Lepeophtheirus salmonis salmonis, Krøyer 1838)[J]. Experimental Parasitology, 2015, 151-152: 39-48. DOI:10.1016/j.exppara.2015.01.011 |
| [92] |
Carpio Y, Basabe L, Acosta J, et al. Novel gene isolated from Caligus rogercresseyi:A promising target for vaccine development against sea lice[J]. Vaccine, 2011, 29(15): 2810-2820. DOI:10.1016/j.vaccine.2011.01.109 |
| [93] |
Komisarczuk AZ, Grotmol S, Nilsen F. Ionotropic receptors signal host recognition in the salmon louse(Lepeophtheirus salmonis, Copepoda)[J]. PLoS One, 2017, 12(6): e0178812. DOI:10.1371/journal.pone.0178812 |
| [94] |
Eichner C, Nilsen F, Grotmol S, et al. A method for stable gene knock-down by RNA interference in larvae of the salmon louse(Lepeophtheirus salmonis)[J]. Experimental Parasitology, 2014, 140: 44-51. DOI:10.1016/j.exppara.2014.03.014 |
| [95] |
Øvergård AC, Eichner C, Nilsen F, et al. Molecular characterization and functional analysis of a salmon louse(Lepeophtheirus salmonis, Krøyer 1838)heme peroxidase with a potential role in extracellular matrixes[J]. Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology, 2017, 206: 1-10. |
| [96] |
Heggland EI, Tröβe C, Eichner C, et al. Heavy and light chain homologs of ferritin are essential for blood-feeding and egg production of the ectoparasitic copepod Lepeophtheirus salmonis[J]. Molecular and Biochemical Parasitology, 2019, 232: 111197. DOI:10.1016/j.molbiopara.2019.111197 |
| [97] |
Campbell EM, Pert CC, Bowman AS. RNA-interference methods for gene-knockdown in the sea louse, Lepeophtheirus salmonis:studies on a putative prostaglandin E synthase[J]. Parasitology, 2009, 136: 867-874. DOI:10.1017/S0031182009990357 |