2. 中国林业科学研究院天津林业科学研究所,天津 300457
2. Tianjin Institute of Forestry Science, Chinese Academy of Forestry, Tianjin 300457
种子萌发是种胚从生命活动相对静止恢复到生理活跃状态的生长发育过程,受其内部生理和外部环境条件的影响,种子只有自身具有生命活力,且外部环境适宜的条件下才能正常萌发[1]。影响种子萌发的外部环境条件包括水分[2]、氧气[3]、温度[4]、光照[5]、CO2[6]、土壤酸碱度和盐分含量[7]等,其中盐碱胁迫是最重要的限制因素之一。世界五大洲及其主要岛屿都有盐碱地分布,涉及100多个国家和地区,据联合国教科文组织和粮农组织不完全统计,全世界盐碱地面积约10亿hm2,占全球陆地总面积7%;中国盐碱地总面积约1亿hm2,占全国土地面积10%,主要分布于三北和滨海地区[8]。因此,盐碱逆境是我国植物生长发育的主要生态限制因子。盐碱地土壤盐分对种子萌发的影响主要有渗透和离子效应,渗透效应使溶液渗透势降低,种子吸水困难,抑制萌发[9];离子效应可造成直接毒害抑制萌发(高盐浓度),也可被种子吸收,降低渗透势,促进种子吸水和萌发(低盐浓度)[10],但盐胁迫对大多数植物种子的萌发起抑制作用[11]。此外,盐碱地过高或过低的pH值均影响植物种子内部物质转化,抑制呼吸和光合作用,降低酶活性,进而抑制种子萌发[1]。
种子萌发是植物成功建植的第一步,但也是植物生活周期中抗逆性最弱的阶段[12],耐盐碱性最弱的时期。如白榆1a生苗可耐土壤盐含量为0.6%的胁迫强度[13],而种子在土壤含盐量0.2%或以上,萌发出苗率急剧下降,当土壤盐浓度达到0.4%时,出苗成活率仅约5%[14]。狼尾草苗期半致死盐浓度是其种子萌发期的2.7倍[15]。高盐度也可抑制大多数盐生植物种子萌发,直至胁迫减轻时才解除抑制[16]。可见,盐碱逆境下种子萌发受阻已成为我国盐碱地植物天然更新和农林业生产的首要障碍因子[17]。为此,本文综述了植物种子萌发期耐盐碱性提高技术,提出进一步开展工作的建议,以期为解决我国盐碱地植物种子萌发受阻难题、实现盐碱地低成本规模化的生物修复和盐碱地区农林业生产提供参考。
1 物理方法在提高植物种子萌发期耐盐碱性中的作用 1.1 种子引发种子引发(Seed priming)是控制种子吸水速度,为萌发提前进行生理准备,再让种子缓慢回干的一种播前种子处理,可有效打破休眠,增加活力,提高出苗率和出苗整齐度,增强抗逆性[18]。因此,种子引发在提高种子萌发期耐盐碱性方面得到了应用。例如,4种引发溶液H2O、20%聚乙二醇(Polyethylene glycol,PEG)(分子量6 000 u)、2%KNO3和2%KNO3-KH2PO3引发处理,均可促进盐胁迫下紫花苜蓿种子萌发和幼苗生长,显著提高过氧化氢酶(Catalase,CAT)、α-淀粉酶(α-amylase,α-AL)活性[19]。用300 mmol/L NaCl溶液引发番茄种子,可激活赤霉素(Gibberellin,GA)合成相关基因表达,提高GA含量促进种子萌发[20]。珍珠岩引发处理(V 珍珠岩: V 蒸馏水:V 种子 =0.5:1.5:0.6),可提高盐胁迫下青椒种子萌发指数和幼苗干重、鲜重,提高幼苗的超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)和CAT的活性,降低丙二醛(Malondialdehyde,MDA)含量,提高游离脯氨酸(Pro)、可溶性蛋白质和可溶性糖含量[21]。可见,引发处理除打破种子休眠、提高发芽率和出苗整齐度外,可通过激活相关基因,提高种子萌发期激素含量、淀粉酶和抗氧化酶活性、渗透调节物质含量等,增强耐盐碱性,提高盐碱胁迫下种子萌发成活率。
1.2 低温处理低温预处理有助于打破种子休眠,增强种子活力[22],在提高萌发期耐盐碱性方面有所应用。例如,在低于0.5%盐浓度下,3-5℃低温预处理5 d能显著提高刺槐种子发芽率、发芽势、发芽指数与活力指数,低温处理组可溶性蛋白含量、SOD活性普遍提高[23]。研究表明低温预处理可通过提高抗氧化酶活性和可溶性蛋白含量,降低氧化水平,缓解盐碱胁迫对种子萌发的抑制。
1.3 其它物理方法磁场、电场、超声波、微波等物理因素会对植物表现出一定的生物学效应。例如,超声波处理水稻种子5 min,可增强α-AL、SOD和POD活性,降低MDA含量,提高盐胁迫下种子发芽率[24];超声波处理毛竹种子15 min,可提高SOD、POD等活性,降低MDA含量,提高盐胁迫下种子发芽率,促进幼苗生长[25]。用2.0 kV/cm电场处理赤葵种子,可提高盐胁迫下种子发芽率[26]。研究表明物理因素处理可通过提高种子萌发期抗氧化酶和淀粉酶活性,降低氧化水平,提高物质转化效率,增强耐盐碱性。
2 化学调控在提高植物种子萌发期耐盐碱性中的作用 2.1 无机外源物 2.1.1 无机盐无机盐类物质溶解后,释放离子,可做营养元素供给植物生长,也可做信号物质对植物的生长发育进行调控,参与植物对盐碱胁迫的感受、适应和抵抗。例如,盐胁迫下施加25-300 mmol/L的氯化钙(CaCl2),黑果枸杞种子萌发指标升高,幼苗含水量、叶绿素含量和POD活性下降幅度变小,MDA、相对电导率上升幅度变小[27];盐碱胁迫下施加20 mmol/L的硫酸钙(CaSO4),可提高油葵种子萌发指数及胚根长、下胚轴长、胚根鲜质量、下胚轴及子叶鲜质量[28]。盐胁迫下施加0.15 mmol/L的硫酸锰(MnSO4),可增强辣椒种子对盐胁迫环境的适应性[29];1 000 mg/L氯化锌(MnCl2)和200 mg/L钼酸(H2MoO4)混合液浸种24 h可明显提高棉花种子发芽的耐盐性[30]。施加10-15 mg/L硝酸钾(KNO3)和10-15 mg/L硫酸镁(MgSO4)对盐胁迫下荞麦种子萌发及幼苗生长有明显促进作用[31]。3 mmol/L硅酸钾(K2SiO3)浸种24 h可显著提高麻疯树种子发芽率、发芽指数和活力指数[32]。盐胁迫时施加10 mg/L硝酸铈铵[Ce(NH4)2(NO 3)6]能够降低小麦种子,可溶性糖和MDA含量[33];0.004 mmol/L亚硒酸钠(Na2SeO3)浸种12 h可提高番茄种子的发芽率、发芽指数、活力指数和抗氧化酶系统的活性,降低MDA含量[34];番茄种子经150 mg/L稀土(Rare earth,RE)浸种24 h,受碱性盐胁迫的发芽率、发芽势和子叶展开率均有所升高[35]。研究表明无机盐可通过激活抗氧化酶活性,提高渗透调节物质含量,降低膜脂过氧化水平,供给营养,促进光合作用和生长,缓解盐碱胁迫对植物种子及幼苗产生的伤害。
2.1.2 一氧化氮(NO)、一氧化碳(CO)、硫化氢(H2S)等活性气体NO、CO、H2S等是广泛存在于植物体内的活性气体信号分子,具有多种生理功能,可调控植物生长,增强抗逆性。例如,盐胁迫下施加0.1 mmol/L NO供体硝普钠(Sodium nitroprusside,SNP)显著提高长春花种子发芽率、发芽指数、活力指数和叶片Pro含量,降低MDA含量,增强硝酸还原酶(Nitrate reductase,NR)活性[36];盐胁迫下施加0.1-0.2 mmol/L SNP,可显著缓解盐胁迫对桑种子萌发的抑制,提高发芽势和活力指数,促进幼苗生长[37]。盐胁迫下施加0.1-0.05 μmol/L CO供体高铁血红蛋白显著提高决明种子发芽势、发芽率、萌发指数和活力指数,提高叶片叶绿素a、叶绿素b、总叶绿素、可溶性糖、可溶性蛋白、Pro含量及相对含水量,增强SOD、POD和CAT活性,降低MDA含量[38];施加1.0 μmol/L高铁血红蛋白或5%CO水溶液,可有效缓解盐胁迫对水稻种子萌发期的抑制[39]。0.05 mmol/L H 2S供体硫氢化钠(NaHS)浸种48 h可缓解盐胁迫对小麦种子萌发率、发芽指数、活力指数和幼苗生长的抑制[40]。此外,NO可与乙烯协同作用,调控植物应对萌发期的盐碱胁迫,提高萌发率,促进幼苗生长[41]。因此,NO、CO、H2S等活性气体可通过激活抗氧化酶活性,提高渗透调节物质含量,增强光合作用,减轻氧化损伤,缓解盐碱胁迫对植物种子萌发及幼苗产生的伤害(表 1)。
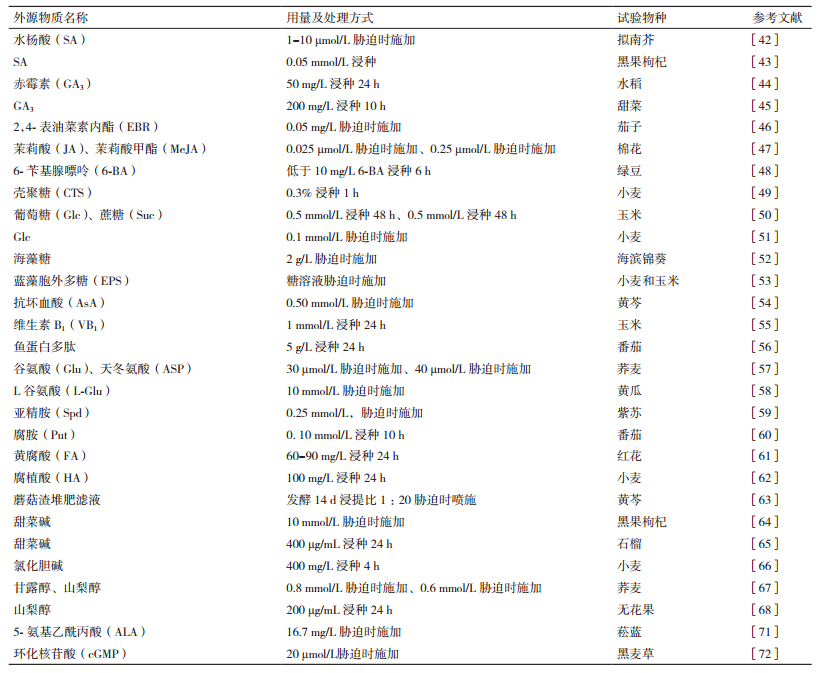
激素是广泛存在于植物体内的生长调节物质,在生长发育、盐碱等逆境响应方面发挥重要作用。例如,高盐胁迫下施加1-10 μmol/L水杨酸(Salicylic acid,SA),可减轻氧化损伤,提高拟南芥萌发期耐盐性[42];0.05 mmol/L SA浸种可提高黑果枸杞种子萌发期耐盐性[43]。50 mg/L赤霉素(Gibberellic acid,GA3)浸种24 h可提高盐胁迫下水稻种子发芽率,增加叶片叶绿素总量和叶绿素a含量,降低MDA含量、超氧阴离子自由基含量和相对电导率[44];200 mg/L GA3浸种10 h可缓解盐胁迫对甜菜种子萌发和幼苗生长的抑制[45]。盐胁迫下施加0.05 mg/L 2,4-表油菜素内酯(2,4-Epibrassinolide,EBR),可提高茄子种子发芽率、发芽势、发芽指数、活力指数,促进生长,提高抗氧化酶(SOD、POD、CAT和抗坏血酸过氧化物酶(Ascorbic acid Peroxidase,APX))活性、Pro和可溶性糖含量,降低MDA含量、O2ˉ产生速率[46]。盐胁迫下添加0.025 μmol/L茉莉酸(Jasmonic acid,JA)或0.25 μmol/L茉莉酸甲酯(Methyl jasmonate,MeJA)均可提高棉花种子发芽率、发芽势、发芽指数和活力指数,提高幼苗的Pro含量,降低MDA含量[47]。低于10 mg/L 6-苄基腺嘌呤(6-Benzyladenine,6-BA)浸种6 h可提高SOD和POD活性,降低Pro和MDA含量,缓解盐胁迫对绿豆种子萌发和幼苗生长的抑制[48]。因此,激素主要通过提高抗氧化酶活性,增强光合作用,调节渗透调节物质含量,减轻氧化损伤,缓解盐碱胁迫对植物种子萌发及幼苗生长的伤害。
2.2.2 糖糖可作为一种信号分子调节植物细胞内碳水化合物含量、新陈代谢相关酶活性等,在抵御逆境胁迫过程中发挥重要作用。例如,盐胁迫下0.3%壳聚糖(Chitosan,CTS)浸种1 h,可提高小麦种子发芽势、发芽率、发芽指数、活力指数和α-AL活性,提高幼苗SOD、POD活性和Pro含量以及根系活力,降低MDA含量[49]。0.5 mmol/L葡萄糖(Glucose,Glc)和0.5 mmol/L蔗糖(Sucrose,Suc)浸种48 h,可促进盐胁迫下玉米种子萌发及幼苗早期生长,减少胚芽中硫代巴比妥酸反应物(Thiobarbituric acid reactive substances,TBARS)和过氧化氢(H2O2)含量,提高胚芽SOD、APX、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)、谷胱甘肽还原酶(Glutathione reductase,GR)活性,并诱导葡萄糖6-磷酸脱氢酶(Glucose 6-phosphate Dehydrogenase,G6PDH)活性的升高,提高胚芽中K+/Na+[50];盐胁迫下施加0.1 mmol/L Glc,可提高小麦K+含量和K+/Na+,增强抗氧化酶活性,减轻盐胁迫对种子萌发的抑制[51]。盐胁迫下施加2 g/L海藻糖(Trehalose),可提高海滨锦葵种子萌发特性,促进生长,适应盐胁迫的环境[52]。盐胁迫下施加蓝藻胞外多糖(Extracellular polysaccharides,EPS)溶液,可提高小麦、玉米萌发期耐盐性、促进生长[53]。可见,外源糖可提高植物抗氧化能力、物质转化效率、渗透调节物质含量、K+含量和K+/Na+,减轻氧化损伤,缓解盐碱胁迫对植物种子萌发的抑制。
2.2.3 维生素大多数维生素可通过植物自身合成,对植物的生长发育和抵御逆境胁迫具有重要作用。例如,盐胁迫下外源施加0.50 mmol/L抗坏血酸(Ascorbic acid,AsA),可提高黄芩种子的萌发指数、根系总黄酮、可溶性糖和Pro含量,提高幼苗根系活力和SOD活性,降低MDA含量[54]。1 mmol/L维生素B1(Vitamin B1,VB1)浸种24 h可提高玉米种子的α,β-淀粉酶(α-amylase,α-AL;β-amylase,β-AL)活性和可溶性糖含量,有效缓解盐胁迫对玉米种子萌发的抑制作用[55]。研究表明维生素通过提高抗氧化酶活性、渗透调节物质含量和物质转化效率,促进种子萌发和幼苗生长,增强耐盐碱性。
2.2.4 蛋白多肽和氨基酸鱼蛋白多肽是鱼蛋白的水解产物,具有植物生长调节功能,可在植物生长发育和抵御逆境胁迫中发挥作用。例如,盐胁迫下5 g/L鱼蛋白多肽(Fish protein polypeptide)对樱桃番茄浸种24 h,可提高发芽率、发芽势、发芽指数等指标及抗氧化酶(SOD和POD)活性,显著降低MDA含量[56]。氨基酸对盐胁迫下植物种子萌发及幼苗生长具有促进作用。例如,盐胁迫下施加30 μmol/L谷氨酸(Glutamate,Glu)和40 μmol/L天冬氨酸(Aspartic acid,ASP),可提高荞麦种子发芽率、发芽指数、幼苗根长、幼苗鲜重、幼苗根系活力和幼苗叶片叶绿素含量[57];盐胁迫下施加10 mmol/L L谷氨酸(L-Glutamate,L-Glu),可缓解盐胁迫对黄瓜种子萌发和幼苗生长的抑制[58]。因此,蛋白多肽和氨基酸可提高种子抗氧化酶活性,增强光合能力,降低氧化水平,缓解盐碱胁迫对种子萌发的影响,促进幼苗生长。
2.2.5 多胺多胺(Polyamine)是生物代谢过程中产生的一类具有较高活性的低相对分子质量脂肪族含氮碱,是一种植物生长调节物质,参与植物的生长发育和抵御逆境胁迫等生理过程。例如,盐胁迫下施加0.25 mmol/L亚精胺(Spermidine,Spd),可提高紫苏种子萌发指数及SOD、POD和CAT活性,降低叶片MDA含量,减缓叶片相对含水量和总黄酮降低趋势[59]。0.10 mmol/L腐胺(Putrescine,Put)浸种10 h可提高盐胁迫下番茄种子的发芽率、发芽势、发芽指数和活力指数,降低MDA含量[60]。研究结果说明多胺可通过提高植物抗氧化能力,降低氧化水平,减缓盐碱胁迫对植物种子及幼苗产生的伤害。
2.2.6 腐植酸、黄腐酸等有机肥腐植酸、黄腐酸等有机肥具有较高的生理活性,可调节植物的多种生理活动,包括生长发育和抵御逆境胁迫等生理过程。例如,60-90 mg/L黄腐酸(Fulvic acid,FA)浸种24 h可提高盐胁迫下红花种子的发芽率,降低幼苗叶片MDA含量,促进叶绿素合成,提高幼苗SOD、POD、CAT活性,增加细胞膜结构的稳定性[61]。100 mg/L腐植酸(Humic acid,HA)浸种24 h可提高小麦叶片总可溶性糖和根系蔗糖含量,降低根系总可溶性糖和叶片蔗糖含量,降低叶片和根系浸出液电导率[62]。盐胁迫时喷施发酵14 d浸提比1:20的蘑菇渣堆肥滤液,可提高黄芩种子发芽势、发芽率、发芽指数,促进幼苗生长,提高幼苗叶绿素a、叶绿素b、类胡萝卜素、可溶性糖含量和SOD、POD活性[63]。由此可见,腐植物、黄腐酸等有机肥可通过提高抗氧化酶活性,调控可溶性糖浓度变化,降低氧化水平和质膜损伤,增加细胞膜结构稳定性,增强光合作用,提高种子及幼苗的耐盐碱性。
2.2.7 其它有机物甜菜碱(Betaine)是一类季胺型生物碱,是植物体内的一种渗透调节物质,在植物抵御逆境胁迫过程中发挥重要作用,研究表明外源施加甜菜碱可有效提高植物耐盐碱性。例如,盐胁迫下施加10 mmol/L甜菜碱,可提高黑果枸杞种子的SOD、POD和CAT活性[64];400 μg/mL甜菜碱浸种24 h可促进石榴种子萌发和幼苗生长,增加叶片SOD、POD、CAT活性,提高可溶性糖和脯氨酸含量,降低MDA和H2O2含量[65]。氯化胆碱(Choline chloride)是一种季胺盐,对植物生长具有生理效应,外源氯化胆碱在植物体内可转化为甜菜碱或磷脂酰胆碱,缓解盐胁迫引起的失水伤害以及膜脂过氧化,提高植物耐盐碱性。例如,400 mg/L氯化胆碱浸种4 h可提高盐胁迫下小麦种子萌发率,缓解幼苗叶绿素降解,增加可溶性糖含量,提高根系活力,降低叶片质膜透性,减少MDA和Pro积累[66]。因此,甜菜碱和氯化胆碱可通过提高植物抗氧化能力,调节渗透物质含量,降低氧化损伤,增加质膜稳定性,维持光合作用,提高种子及幼苗的耐盐碱能力。
甘露醇(Mannitol)既是重要的渗透调节物质,也是一种自由基清除剂,研究表明外源施加可显著促进盐胁迫下植物种子萌发及幼苗生长。例如,盐胁迫下施加0.8 mmol/L甘露醇和0.6 mmol/L山梨醇(Sorbitol),均能提高荞麦种子的发芽率、发芽指数和活力指数,提高幼苗NR、SOD、APX活性,降低质膜透性,增加叶绿素含量和净光合速率[67];200 μg/mL山梨醇浸种24 h也可促进盐胁迫下无花果种子萌发[68]。因此,甘露醇和山梨醇可通过提高植物抗氧化能力,增加质膜稳定性,增强光合作用,减轻氧化损伤,提高种子及幼苗的耐盐碱能力。
5-氨基乙酰丙酸(5-Aminolevulinic acid,ALA)是生物体内卟啉化合物生物合成的关键前体,是植物体内天然存在的生理活性物质,可在植物生长发育及胁迫响应过程中发挥作用[69-70]。例如,盐胁迫下外源施加16.7 mg/L ALA,可提高菘蓝种子萌发率、自然含水量及SOD、POD和CAT活性,降低可溶性糖和MDA的含量[71]。表明ALA可通过提高植株的抗氧化能力,降低氧化水平,调节渗透物质含量,增强植物种子萌发期耐盐碱性。
环化核苷酸(Cyclic guanosine monophosphate,cGMP)是一种具有广泛生物学活性的环核苷酸,是在细胞内起信息传递作用的第二信使,外源施加可缓解盐胁迫对植物种子的伤害、提高耐盐碱性。例如,外源施加20 μmol/L cGMP,可提高盐胁迫下黑麦草种子发芽率、发芽势、发芽指数、活力指数,提高可溶性糖、可溶性蛋白和Pro含量及淀粉酶活性,降低淀粉含量、MDA含量、电导率、O2-产生速率[72]。因此,cGMP可通过提高植株抗氧化能力、渗透调节物质含量、物质转化效率,降低氧化损伤,增强植物萌发期耐盐碱性(表 2)。
有机和无机外源物质联用,在提高植物种子萌发期耐盐碱性上可能具有更好的效果。例如,高盐浓度下6 mmol/L无机硅硅酸钠(Na2SiO3)和3 mmol/L有机硅正硅酸乙酯(Tetraethyl orthosilicate,TEOS)浸种12 h,可有效提高水稻种子萌发速度、萌发率,增加胚根、胚芽的伸长长度,并使复水后种子萌发率分别增加61.33%和43.33%[73]。120 μmol/L氯化血红素(Hemin chloride)和1.5 mmol/L氯化钙联用或80 μmol/L氯化血红素和10 mmol/L脯氨酸(Proline,Pro)联用,可有效提高大豆种子在盐胁迫条件下的萌发指数、淀粉酶和POD活性,比单独处理效果更好[74]。3 mg/L赤霉素(Gibberellin,GA)和200 mg/kg氯化锰(MnCl2)联用浸种24 h,可显著缓解盐胁迫对棉花种子萌发和幼苗生长的抑制作用,且优于单独使用GA或氯化锰[75]。可见,不同种类外源物质联用往往具有更好的效果,可能是因为不同种类外源物质在相同或不同方面共同起作用,进而产生了叠加或互为补充的效果。
3 生物途径在提高植物种子萌发期耐盐碱性中的作用 3.1 细菌植物促生细菌是一类能促进植物生长的细菌的总称,可在植物生长和抵御逆境胁迫过程中发挥重要作用。例如,从受盐胁迫的棉花根际土壤中分离出的解盐促生细菌Rs-5(克雷伯氏菌属)和Rs-198(假单胞菌属),两株菌处理的棉花种子在含盐土壤中的发芽率分别比对照提高了26.3%和34.4%,研究表明两株菌产酸溶磷与分泌生长素的性能是在盐胁迫下提高棉花发芽和出苗率的主要原因[76]。经解盐促生菌Rs15-4(节杆菌属)处理后,盐胁迫下棉花种子发芽率比对照提高了11.8%,棉花子叶CAT和POD活性高峰值提前出现,SOD活性提高[77]。从柳枝稷根茎中分离根际促生菌Pseudomonas sp.(P)和Rhizobium sp.(R)可促进盐胁迫下柳枝稷种子萌发和幼苗生长[78]。接种具有1-氨基环丙烷-1-羧酸脱氨酶活性的耐盐细菌RS15和RS341可通过调节乙烯释放,缓解盐胁迫对油菜种子萌发和幼苗生长的抑制[79]。可见,植物促生细菌主要通过分泌激素、提高抗氧化酶活性、供给营养等方式,促进种子萌发和幼苗生长,缓解盐碱胁迫对植物的毒害,提高植物萌发期耐盐碱性。
3.2 真菌感染内生真菌的植物在自然界中广泛存在,内生真菌可与宿主共生,并提高宿主的抗逆能力,促进宿主生长。例如,对带有内生真菌和不带内生真菌的德兰臭草种子进行盐胁迫处理,发现高浓度盐胁迫下带有内生真菌植株比不带内生真菌植株细胞膜透性降低减少了12.87%,丙二醛含量减少了49.29%,游离Pro含量减少了12.26%[80]。以低内生真菌侵染率和高内生真菌侵染率的多年生黑麦草种子为材料,发现高浓度盐胁迫下高内生真菌侵染率种子相对发芽率、相对活力指数、相对苗长均显著大于低内生真菌侵染率的品种[81]。表明内生真菌可通过增加细胞膜稳定性,降低氧化水平,对宿主起增益作用,缓解盐碱胁迫对宿主种子萌发的影响。
4 育种技术在提高植物种子萌发期耐盐碱性中的作用 4.1 耐盐碱性鉴定筛选植物种间及种内均存在着广泛的遗传变异,通过耐盐性鉴定与筛选,有望获得萌发期耐盐性强的品种,其中确定科学的植物萌发期耐盐碱性鉴定标准,快速、准确地鉴定植物萌发期耐盐碱性,对当前植物资源的合理利用具有重要的指导意义。例如,通过分析不同NaCl质量分数下的11个苜蓿审定品种的发芽势、发芽率、苗高、根长等指标的差异,确定了苜蓿种子萌发期耐盐性鉴定的质量分数标准[82]。通过分析盐胁迫条件下7种地被植物种子发芽率、胚根长度、发芽速度以及耐盐指数,对其耐盐性做出了客观的评价和排序[83]。检测盐碱胁迫下33个油用向日葵品种发芽指标,通过隶属函数值和聚类分析,对其耐盐碱性进行综合评价,筛选出耐盐碱性最强的品种(系)2个,耐盐碱能力较强的品种(系)9个[84]。可见,在具有丰富变异的种质资源的基础上,开展耐盐碱性鉴定筛选,是一种行之有效的方法,可快速获得耐盐碱性相对较强的植物种或品种。
4.2 转基因技术随着生物技术的迅速发展,通过转基因技术,增强植物抵御外界胁迫能力已成为现实。例如,在拟南芥中表达棉花PLATZ1基因,可通过调节脱落酸(Abscisic acid,ABA)、GA和乙烯的生物合成途径,降低萌发期和苗期对盐胁迫的敏感性[85]。高盐胁迫条件下转CsNMAPK基因烟草萌发率和幼苗生长都显著高于野生型烟草[86]。因此,外源基因转入植物体内后,可通过调节特定的生物学过程,增强种子萌发期耐盐碱性。
5 总结与展望当前,在研究对象上,国内外研究植物种子萌发期耐盐碱性提高技术集中于草本植物,且多为农作物,而木本植物研究较少。林木个体寿命长,在生态环境中具有重要和特殊的地位,应加强木本植物种子萌发期耐盐性提高技术的研究。在研究角度上,多集中于中性盐胁迫。而对碱性盐胁迫或中性盐和碱性盐混合胁迫的研究较少。盐碱地土壤种类多样、类型复杂,多为混合盐碱类型,建议今后模拟各植物物种在自然或生产条件下受到的盐碱胁迫类型进行胁迫处理,筛选最适技术方法,可为生产提供更具参考性的数据。在研究方法上,多通过检测抗氧化酶活性,解释种子萌发期耐盐性提高的作用机理,少数文献检测了植物体内Na+、K+离子含量、淀粉酶活性和幼苗光合作用等指标。种子萌发期耐盐碱性提高技术种类多、覆盖面广,但检测指标类别少,很难发现不同技术在提高种子萌发期耐盐碱性上的特殊作用机理,今后应多利用转录组、蛋白组、代谢组等组学技术,开展多层次高通量的系统研究,以发现不同技术提高耐盐碱性的特有机理,为进一步研究奠定理论基础。
种子引发技术虽然在提高植物萌发期耐盐碱性上起到一定作用,但其主要功能仍然是打破种子休眠、提高种子活力和萌发率等;低温、超声波、微波、电场等物理处理方式还多处于试验阶段,作用机理尚不清晰。物理处理技术突破方向:(1)将种子引发技术与化学调控等技术方法结合,作为一种常规技术加以使用;(2)继续筛选提高植物种子萌发期耐盐性的高效物理处理方式,并揭示其作用机理。
化学调控方面开展的研究工作最多,取得的成果也最多,在植物萌发期耐盐碱性提高上起到作用最突出。化学调控技术突破方向:在不同种类外源物质联用方面进一步开展工作,以期在提高植物萌发期耐盐碱性程度上有所突破。
通过耐盐碱性鉴定筛选获得了一批萌发期耐盐碱性较高的植物种或品种,已对实际生产起到促进作用;利用转基因技术,也成功将耐盐基因转入多种植物,种子萌发期耐盐性获得提高,但还多停留在试验阶段。育种技术突破方向:(1)继续加强萌发期耐盐性鉴定筛选,同时利用萌发期耐盐性强的植物种质材料,开展种内及近缘种间杂交育种,以期选育出萌发期耐盐性更强的优良新品种;(2)植物耐盐性是一个复杂过程,受多基因控制,应加强多种类耐盐基因共转化研究,尤其是涉及抗氧化系统、渗透调节、离子转运、物质转化等多方面耐盐基因的联合转化。
在提高植物萌发期耐盐碱性菌种筛选上开展了一些工作,对植物种子萌发期耐盐性起到一定的促进作用,但多停留在理论阶段。生物途径突破方向:继续开展筛选植物种子萌发期耐盐性提高的高效菌种,并研究促生菌与不同植物、不同盐碱类型土壤最佳匹配的高效稳定组合。
| [1] |
张红生, 胡晋. 种子学[M]. 第2版: 北京:科学出版社, 2015.
|
| [2] |
Yuan X, Wen B. Seed germination response to high temperature and water stress in three invasive Asteraceae weeds from Xishuangbanna, SW China[J]. PLoS One, 2018, 13(1): e0191710. DOI:10.1371/journal.pone.0191710 |
| [3] |
熊元基, 姚帮松, Ninghu S, 等. 不同加氧处理对超级稻种子萌发和幼苗农艺性状的影响[J]. 江西农业大学学报, 2014, 36(2): 256-260. |
| [4] |
Liu J, Hasanuzzaman M, Wen H, et al. High temperature and drought stress cause abscisic acid and reactive oxygen species accumulation and suppress seed germination growth in rice[J]. Protoplasma, 2019, 256(5): 1217-1227. DOI:10.1007/s00709-019-01354-6 |
| [5] |
Merai Z, Graeber K, Wilhelmsson P, et al. Aethionema arabicum :a novel model plant to study the light control of seed germination[J]. Journal of Experimental Botany, 2019, 70(12): 3313-3328. DOI:10.1093/jxb/erz146 |
| [6] |
王爱国, 关云凌, 刘淑娴, 等. 氧和二氧化碳对水稻萌发的影响[J]. 植物生理学通讯, 1981(2): 20-24. |
| [7] |
Ye X, Wang H, Cao X, et al. Transcriptome profiling of Puccinellia tenuiflora during seed germination under a long-term saline-alkali stress[J]. BMC Genomics, 2019, 20: 589. DOI:10.1186/s12864-019-5860-5 |
| [8] |
王遵亲, 祝寿泉, 俞仁培, 等. 中国盐渍土[M]. 北京: 科学出版社, 1993.
|
| [9] |
刘晓威, 杨秀艳, 武海雯, 等. NaCl胁迫对红砂萌发的影响及萌发期耐盐性评价[J]. 生物技术通报, 2019, 35(1): 27-34. |
| [10] |
刘晓威, 杨秀艳, 武海雯, 等. NaCl胁迫下红砂种子萌动期差异表达基因的转录组分析[J]. 南京林业大学学报:自然科学版, 2019, 43(3): 28-36. |
| [11] |
刘晓威, 杨秀艳, 刘正祥, 等. MicroRNA在植物抵御盐胁迫过程中的作用[J]. 生物技术通报, 2017, 33(12): 12-21. |
| [12] |
马红媛, 梁正伟. 不同pH值土壤及其浸提液对羊草种子萌发和幼苗生长的影响[J]. 植物学通报, 2007, 24(2): 181-188. |
| [13] |
李庆贱, 陈志强, 时瑞亭, 等. 白榆家系苗期耐盐碱研究[J]. 北京林业大学学报, 2010, 32(5): 74-81. |
| [14] |
刘炳响, 王志刚, 杨敏生, 等. 模拟盐胁迫对白榆种子发芽、出苗及幼苗生长的影响[J]. 草业学报, 2012, 21(5): 39-46. |
| [15] |
袁小环, 武菊英, 杨学军, 等. 基于半致死浓度的观赏草萌发期和幼苗期耐盐性评价[J]. 中国草地学报, 2012(6): 49-53. |
| [16] |
渠晓霞, 黄振英. 盐生植物种子萌发对环境的适应对策[J]. 生态学报, 2005(9): 2389-2398. DOI:10.3321/j.issn:1000-0933.2005.09.035 |
| [17] |
叶小齐, 吴明, 王琦, 等. 杭州湾4种植物盐胁迫下种子萌发能力与分布的关系[J]. 浙江农林大学学报, 2012, 29(5): 739-743. |
| [18] |
Jisha KC, Vijayakumari K, Puthur JT. Seed priming for abiotic stress tolerance :an overview[J]. Acta Physiologiae Plantarum, 2013, 35(5): 1381-1396. DOI:10.1007/s11738-012-1186-5 |
| [19] |
楼坚锋, 解秀娟, 胡晋, 等. 不同引发处理对紫花苜蓿种子在盐逆境下发芽及幼苗生理生化变化的影响[J]. 上海农业学报, 2004(3): 86-89. |
| [20] |
Nakaune M, Hanada A, Yin YG, et al. Molecular and physiological dissection of enhanced seed germination using short-term lowconcentration salt seed priming in tomato[J]. Plant Physiology and Biochemistry, 2012, 52: 28-37. DOI:10.1016/j.plaphy.2011.11.005 |
| [21] |
杨若鹏, 赵欣, 李许华, 等. 珍珠岩引发对盐胁迫下青椒种子萌发和幼苗生长的影响[J]. 云南农业大学学报:自然科学版, 2018, 33(3): 468-473. |
| [22] |
宰学明, 吴国荣, 陆长梅, 等. 低温预处理对大豆萌芽活力及其活性氧代谢的影响[J]. 大豆科学, 2001, 20(3): 163-166. |
| [23] |
曹帮华, 翟明普, 吴丽云. 低温预处理对刺槐种子抗盐萌发的影响[J]. 北京林业大学学报, 2005, 27(4): 39-42. DOI:10.3321/j.issn:1000-1522.2005.04.008 |
| [24] |
李妹娟, 唐湘如, 聂俊, 等. 在盐胁迫下超声波处理对籼稻种子萌发的影响[J]. 西南农业学报, 2014, 27(6): 2440-2443. |
| [25] |
宋沁春, 魏开, 漆冬梅, 等. 盐胁迫下超声波处理对毛竹种子萌发及幼苗生长的影响[J]. 种子, 2018, 37(3): 83-85. |
| [26] |
袁德正, 杨体强. 电场处理对赤葵种子萌发期发芽率抗盐性的影响[J]. 内蒙古大学学报:自然科学版, 2009, 40(5): 630-633. |
| [27] |
韩多红, 李善家, 王恩军, 等. 外源钙对盐胁迫下黑果枸杞种子萌发和幼苗生理特性的影响[J]. 中国中药杂志, 2014, 39(1): 34-39. |
| [28] |
毛桂莲, 马春燕, 谢亚军, 等. CaSO4对盐碱胁迫下油葵种子萌发的影响[J]. 农业科学研究, 2009, 30(3): 21-23, 43. |
| [29] |
文锦芬, 邓明华, 赵凯. 外源Mn2+对盐胁迫下辣椒种子萌发的影响[J]. 辣椒杂志, 2009, 7(4): 26-29. |
| [30] |
汤菊香, 王振河, 苏长涛, 等. Mn2+和Mo6+对棉花种子发芽耐盐性的影响[J]. 安徽农业科学, 2005(9): 1589-1600. |
| [31] |
纪灵霄, 杨洪兵. K+和Mg2+对盐胁迫下荞麦种子萌发及幼苗生长的影响[J]. 广东农业科学, 2013, 40(17): 52-53, 56. |
| [32] |
樊哲仁, 王晓东, 唐琳. 硅对盐胁迫下麻疯树种子萌发及幼苗生长的影响[J]. 中国油料作物学报, 2010, 32(2): 217-221. |
| [33] |
吕春晖, 牛红军, 齐菲, 等. 铈对盐胁迫下小麦种子萌发过程中生理指标的影响[J]. 农业科技与装备, 2014(6): 8-9, 11. |
| [34] |
韩广泉, 李俊, 宋曼曼, 等. 硒对盐胁迫下加工番茄种子萌发及抗氧化酶系统的影响[J]. 石河子大学学报:自然科学版, 2010, 28(4): 422-426. |
| [35] |
赵秋月, 邓蓉, 蒲巧. 稀土微肥对盐胁迫下番茄种子萌发的影响[J]. 绵阳师范学院学报, 2018, 37(5): 55-60. |
| [36] |
赵晓菊, 张丽霞, 满秀玲. NO对盐胁迫下长春花种子萌发和幼苗生理代谢的影响[J]. 植物研究, 2018, 38(5): 669-674, 681. |
| [37] |
董亚茹, 赵东晓, 杜建勋, 等. 外源NO对NaCl胁迫下桑树种子萌发及幼苗生理生化特性的影响[J]. 蚕业科学, 2018, 44(6): 821-82. |
| [38] |
张春平, 何平, 刘海英, 等. 外源CO供体高铁血红蛋白对盐胁迫下决明种子萌发及幼苗生理特性的影响[J]. 中国中药杂志, 2012, 37(2): 189-197. |
| [39] |
Liu K, Xu S, Xuan W, et al. Carbon monoxide counteracts the inhibition of seed germination and alleviates oxidative damage caused by salt stress in Oryza sativa[J]. Plant Science, 2006, 172(3): 544-555. |
| [40] |
鲍敬, 丁同楼, 贾文娟, 等. 外源H2S对盐胁迫下小麦种子萌发的影响[J]. 现代农业科技, 2011(20): 40-42. |
| [41] |
Li X, Pan Y, Chang B, et al. NO promotes seed germination and seedling growth under high salt may depend on EIN3 protein in Arabidopsis[J]. Frontiers in Plant Science, 2016, 6: 1203. |
| [42] |
Lee S, Kim SG, Park CM. Salicylic acid promotes seed germination under high salinity by modulating antioxidant activity in Arabidopsis[J]. New Phytologist, 2010, 188(2): 626-637. |
| [43] |
李永洁, 李进, 吕海英, 等. 不同浓度水杨酸(SA)浸种对盐旱交叉胁迫下黑果枸杞种子萌发的影响[J]. 种子, 2014, 33(8): 34-38, 43. |
| [44] |
张丽丽, 倪善君, 张战, 等. 外源赤霉素对盐胁迫下水稻种子萌发及幼苗生长的缓释效应[J]. 中国稻米, 2018, 24(2): 42-46. |
| [45] |
Muhammad J, Shik RE. Gibberellic acid(GA3)enhance seed water uptake, germination and early seedling growth in sugar beet under salt stress[J]. Pakistan Journal of Biological Sciences, 2007, 10(4): 654-658. DOI:10.3923/pjbs.2007.654.658 |
| [46] |
吴雪霞, 查丁石, 朱宗文, 等. 外源24-表油菜素内酯对盐胁迫下茄子种子萌发和幼苗生理特性的影响[J]. 植物生理学报, 2011, 47(6): 607-612. |
| [47] |
杨艺, 常丹, 王艳, 等. 盐胁迫下茉莉酸(JA)及茉莉酸甲酯(MeJA)对棉花种子萌发及种苗生化特性的影响[J]. 种子, 2015, 34(1): 8-13, 18. |
| [48] |
刘建霞, 张晓丹, 王润梅, 等. 6-BA浸种对盐胁迫下绿豆萌发及幼苗生理特性的影响[J]. 作物杂志, 2018(1): 166-172. |
| [49] |
王玉萍, 于丹, 李成, 等. 壳聚糖对盐胁迫下小麦种子萌发及幼苗生理特性的影响[J]. 干旱地区农业研究, 2016, 34(1): 180-185. |
| [50] |
赵莹, 杨克军, 李佐同, 等. 外源糖浸种缓解盐胁迫下玉米种子萌发[J]. 应用生态学报, 2015, 26(9): 2735-2742. |
| [51] |
Hu M, Shi Z, Zhang Z, et al. Effects of exogenous glucose on seed germination and antioxidant capacity in wheat seedlings under salt stress[J]. Plant Growth Regulation, 2012, 68(2): 177-188. DOI:10.1007/s10725-012-9705-3 |
| [52] |
杨巧玲, 杨晓梅, 闫道良, 等. 外源海藻糖对盐胁迫下海滨锦葵种子萌发的影响[J]. 江西林业科技, 2014, 42(2): 1-4, 33. |
| [53] |
Arora M, Kaushik A, Rani N, et al. Effect of cyanobacterial exopolysaccharides on salt stress alleviation and seed germination[J]. Journal of Environmental Biology, 2010, 31(5): 701-704. |
| [54] |
江绪文, 李贺勤, 王建华. 盐胁迫下黄芩种子萌发及幼苗对外源抗坏血酸的生理响应[J]. 植物生理学报, 2015, 51(2): 166-170. |
| [55] |
孙西丽, 赵方贵, 张英昊, 等. 外源维生素对盐胁迫下玉米种子萌发和某些生理指标的影响[J]. 青岛农业大学学报:自然科学版, 2009, 26(4): 313-317. |
| [56] |
刘金龙, 辛寒晓, 范学明, 等. 盐胁迫下鱼蛋白多肽对樱桃番茄种子发芽特性的影响[J]. 江苏农业学报, 2017, 33(3): 662-666. |
| [57] |
杨洪兵. 氨基酸对盐胁迫荞麦种子萌发及幼苗生长的影响[J]. 贵州农业科学, 2014, 42(8): 30-33. |
| [58] |
Chang C, Wang B, Shi L, et al. Alleviation of salt stress-induced inhibition of seed germination in cucumber(Cucumis sativus L.) by ethylene and glutamate[J]. Journal of Plant Physiology, 2010, 167(14): 1152-1156. DOI:10.1016/j.jplph.2010.03.018 |
| [59] |
张春平, 何平, 喻泽莉, 等. 亚精胺对盐胁迫下紫苏种子萌发和幼苗生理特性的影响[J]. 中草药, 2011, 42(7): 1407-1412. |
| [60] |
胡晓辉. 腐胺对盐胁迫下番茄种子萌发的影响[J]. 安徽农业科学, 2009, 37(4): 1432-1433. |
| [61] |
张元, 冯琼, 杨小方, 等. 黄腐酸对盐胁迫下红花种子萌发及幼苗生理特性的影响[J]. 河南农业科学, 2015, 44(11): 24-27. |
| [62] |
郭伟, 于立河. 腐植酸浸种对盐胁迫下小麦萌发种子及幼苗生理特性的影响[J]. 麦类作物学报, 2012, 32(1): 90-96. |
| [63] |
陈智坤, 邓娴, 王峰伟, 等. 蘑菇渣堆肥滤液对盐胁迫下黄芩种子萌发和幼苗生长的影响[J]. 北方园艺, 2016(18): 149-153. |
| [64] |
李善家, 韩多红, 王恩军, 等. 外源甜菜碱对盐胁迫下黑果枸杞种子萌发和幼苗保护酶活性的影响[J]. 草业科学, 2016, 33(4): 674-680. |
| [65] |
范春丽, 曲金柱. 甜菜碱浸种对盐胁迫下石榴种子萌发及幼苗生理特性的影响[J]. 中国果树, 2015(6): 51-54. |
| [66] |
陈楚, 张云芳, 荆小燕. 氯化胆碱浸种处理对盐胁迫下小麦种子萌发以及幼苗生长的影响[J]. 麦类作物学报, 2013, 33(5): 1030-1034. |
| [67] |
杨洪兵. 外源多元醇对盐胁迫下荞麦种子萌发及幼苗生理特性的影响[J]. 华北农学报, 2013, 28(4): 98-104. |
| [68] |
赵京刚, 张苍梅. 山梨醇浸种对盐胁迫下无花果发芽及幼苗生长的影响[J]. 中国果菜, 2016, 36(7): 19-22. |
| [69] |
Bindu RC, Vivekanandan M. Hormonal activities of 5-aminolevulinic acid in callus induction and micropropagation[J]. Plant Growth Regulation, 1998, 26(1): 15-18. DOI:10.1023/A:1006098005335 |
| [70] |
Eiji N, Kensuke K, Mohammad Masud P, et al. Role of 5-aminolevulinic acid(ALA)on active oxygen-scavenging system in NaCltreated spinach(Spinaciaoleracea)[J]. Journal of Plant Physiology, 2003, 160(9): 1085-1091. DOI:10.1078/0176-1617-00991 |
| [71] |
吕婷婷, 肖云华, 吴群, 等. 外源5-氨基乙酰丙酸对盐胁迫下菘蓝种子萌发及幼苗抗氧化酶活性的影响[J]. 西北植物学报, 2013, 33(10): 2037-2042. |
| [72] |
宿梅飞, 魏小红, 辛夏青, 等. 外源cGMP调控盐胁迫下黑麦草种子萌发机制[J]. 生态学报, 2018, 38(17): 6171-6179. |
| [73] |
戚乐磊, 陈阳, 贾恢先. 盐胁迫下有机及无机硅对水稻种子萌发的影响[J]. 甘肃农业大学学报, 2002(3): 272-278. |
| [74] |
陈昀, 郑焕明, 张竞, 等. 以hemin为基础的物质联用缓解盐胁迫对大豆种子萌发的抑制[J]. 大豆科学, 2013, 32(5): 640-646. |
| [75] |
汤菊香, 高扬帆, 陈军. GA和Mn2+对盐渍土棉花种子发芽影响的研究[J]. 种子, 2006(8): 7-9. |
| [76] |
郑元元, 岳海涛, 石在强, 等. 盐胁迫下解盐促生细菌Rs-5和Rs-198促进棉花种子发芽的机理探讨[J]. 中国农业科学, 2008(5): 1326-1332. |
| [77] |
莫文萍, 李春, 郑元元, 等. 盐胁迫下解盐促生菌对棉花种子发芽过程的影响[J]. 农业工程学报, 2006(8): 260-263. |
| [78] |
马晓敏, 张红娟, 顾沐宇, 等. 促生菌的分离鉴定及其对柳枝稷种子在盐胁迫下的萌发促进作用[J]. 家畜生态学报, 2015, 36(6): 46-52. |
| [79] |
Siddikee MA, Sundaram S, Chandrasekaran M, et al. Halotolerant bacteria with ACC deaminase activity alleviate salt stress effect in canola seed germination[J]. Journal of the Korean Society for Applied Biological Chemistry, 2015, 58(2): 237-241. DOI:10.1007/s13765-015-0025-y |
| [80] |
张晶晶, 安沙舟, 施宠, 等. 内生真菌侵染对盐胁迫下德兰臭草种子萌发及幼苗生理特性的影响[J]. 中国草地学报, 2017, 39(2): 59-64. |
| [81] |
张萍萍, 胡龙兴, 傅金民. 内生真菌侵染对盐胁迫下黑麦草种子萌发的影响[J]. 草业科学, 2012, 29(7): 1094-1099. |
| [82] |
王瑞峰, 王铁梅, 金晓明, 等. 11个审定苜蓿品种种子萌发期耐盐性评价[J]. 草业科学, 2012, 29(2): 213-218. |
| [83] |
史燕山, 骆建霞, 黄家珍, 等. 盐胁迫对7种草本地被植物种子萌发的影响[J]. 天津农学院学报, 2007(4): 1-4. |
| [84] |
张庆昕, 张玉霞, 刘庆鹏, 等. 33个油用向日葵品种种子萌发期抗盐碱性的综合评价[J]. 种子, 2015, 34(11): 23-25, 30. |
| [85] |
Zhang S, Yang R, Huo F, et al. Expression of cotton PLATZ1 in transgenic Arabidopsis reduces sensitivity to osmotic and salt stress for germin-ation and seedling establishment associated with modification of the abscisic acid, gibberellin, and ethylene signalling pathways[J]. BMC Plant Biology, 2018, 18(1): 218. DOI:10.1186/s12870-018-1416-0 |
| [86] |
Xu H, Li K, Yang F, et al. Overexpression of CsNMAPK in tobacco enhanced seed germination under salt and osmotic stresses[J]. Mol Biol Rep, 2010, 37(7): 3157-3163. DOI:10.1007/s11033-009-9895-6 |