2. 上饶师范学院,上饶 334100
2. Shangrao Normal University, Shangrao 334100
近年来,海水养殖业因其具有养殖效率高、占地面积少、方式多样化、节约水资源等优点而蓬勃发展,但在高密度、集约化养殖模式下,饵料投放、排出的粪便和鱼药滥用都会直接或间接影响水质平衡。氨氮、亚硝酸盐、硫化物及COD等是养殖海水中常见的有害物质。目前主要采用化学、物理和生物的方法进行去除。与传统方法相比较,微生态制剂成本低,能够彻底净化水体并且对海产品有益。美国商品型养殖海水菌剂可以有效减少换水需求,在一定时间内消除水体中的氨氮和亚硝酸盐。微生物在生态系统中对环境变化比较敏感[1],不同时期不同环境下使用菌剂处理养殖海水可能会产生不同效果,因此研究将菌剂投入到养殖海水后,水体中细菌群落结构和多样性可以在一定程度上反映其效果和变化趋势,对合理利用微生态制剂和实现海水养殖的可持续发展具有重要意义。
高通量测序技术现在已被广泛应用于环境微生物研究等方面[2],通过16S rRNA可以分析出微生物多样性。吕宁[3]测定对虾养殖水体连续5个月的理化指标、微生物群落结构组成及其变化,得出水质因子和微生物生态结构存在相关性,李可[4]对对虾养殖环境微生物多样性进行了分析并从中筛选出了有益的菌株开发微生态制剂。但很少有针对于在不同时期使用完菌剂,再对养殖海水中微生物群落进行测定的研究。本文将美国商品型菌剂分别于冬、春、夏3个季节投入到养殖海水中,基于IonS5TMXL测序平台研究微生物群落结构组成和多样性,旨在揭示菌剂的功能随季节变化趋势以及水体中细菌和环境因子的关系,为以后养殖海水治理和微生态制剂的研制与应用提供科学依据。
1 材料与方法 1.1 材料微生态制剂:美国商品型养殖海水净水剂
1.2 方法 1.2.1 样品采集为检测不同季节养殖海水在净水剂投入后微生物菌群的变化和多样性,分别于2019年1月、2019年4月、2019年7月在天津某海水养殖厂投入商品型菌剂,3 d后采集样品(不同时期同时取3个样品作为平行)。海水样品的温度、盐度、溶解氧和pH当场使用仪器测定并记录,然后使用灭菌的玻璃瓶收集海水样品,在低温下运回实验室[5]。
1.2.2 总基因组DNA提取将2 h内运回实验室现场收集的海水样品立即进行处理:取1 L海水,经灭菌后的3 μm和0.22 μm微孔滤膜两级过滤后,弃去3 μm微孔滤膜,0.22 μm微孔滤膜上即压载水微生物,使用灭菌的镊子,将0.22 μm滤膜转移到1.5 mL离心管中,对3个季节收集的养殖海水样品进行编号,冬季样品标记为RZ1,春季样品标记为RZ2,夏季样品标记为RZ3,然后立即放入-80℃冰箱中冷冻4 h,取出冷冻后放有微生物滤膜的离心管,使用灭菌剪刀和镊子,将0.22 μm滤膜剪碎转移到1.5 mL灭菌离心管中,然后使用试剂盒对微生物的DNA进行提取[5]。
1.2.3 细菌16S rRNA的高通量测序将提取的DNA样品稀释至20 ng/μL后作为PCR模板,使用带有Barcode标签的特定16S rRNA V3、V4区引物(515F和806R)进行扩增,然后通过琼脂糖凝胶电泳对PCR产物进行检测,并用Thermo Scientific公司GeneJET胶回收试剂盒纯化回收产物后,使用Thermofisher公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,经过Qubit定量和文库检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序[1, 6]。利用Qimme对有效序列进行质量过滤,并通过Mothur去除嵌合体,得到最终用于后续分析的优质序列,然后使用UCLUST对优质序列进行聚类成为OTU,最后,通过blast将OTU代表序列与Greengenes数据库比对,对OTU代表序列进行注释,获得每个OTU的分类学信息。去掉原始OTU中可信度较低的序列,所得数据进行后续分析。最后进行OTU丰度与Alpha多样性计算,以得到样品内物种丰富度和均匀度信息[7-8]。
1.2.4 数据分析采用Excel处理数据,用SPSS 25.0进行相关性和显著性差异分析,水质理化指标采用One-way ANOVA(单变量因素方差分析),与细菌多样性指数之间的关系采用Pearson相关性分析;门和属分类水平柱形图使用Origin8.0完成;通过Canoco 4.5对优势属的相对丰度和环境因子进行冗余分析(RDA)。
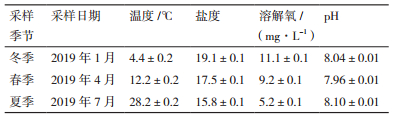
2 结果 2.1 养殖海水环境特征经测定养殖海水在冬季到夏季3个季节中温度变化范围为4.4-28.2℃,盐度变化范围为15.8-19.1,溶解氧变化范围为5.2-11.1mg/L,pH变化范围为7.96-8.10,如表 1所示。可以看出冬季和夏季养殖海水温差比较大,但是冬季盐度和溶解氧却相对来说较高。采用SPSS 25.0软件对水环境指标分别进行One-way ANOVA(单变量因素方差分析)显著性检验和Person相关性分析,结果显示除夏季和冬季pH没有显著差异(P=0.05),其余3个季节中温度、盐度、溶解氧和pH两两之间均存在显著性差异(P < 0.05),温度和溶解氧呈极显著负相关(P < 0.01)。
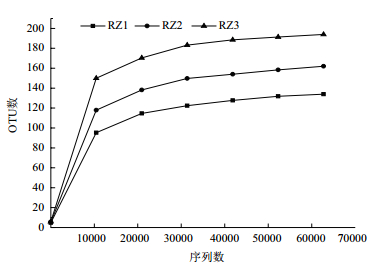
从冬季RZ1、春季RZ2、夏季RZ3样本中随机抽取一定测序量的数据,根据它们所代表的OTUs数目,以抽取的测序数据量与对应的物种数来构建曲线(图 1)。稀释曲线可直接反映测序数据量的合理性,并间接反映样本中物种丰富程度,从图中可以看出在97%相似性水平下冬季RZ1、春季RZ2、夏季RZ3随着测序深度增加,曲线趋于平坦,说明测序数据量渐进合理,更多的序列数只会产生少量新的OTU,测序深度足以覆盖大多数菌。3条曲线RZ3位于最上方,表明RZ3在这3种菌中物种丰富度是最高的,夏季的养殖海水环境和条件可能更有利于微生物菌群的生长和繁殖。
|
| 图 1 97%相似水平下样品的稀释性曲线 |
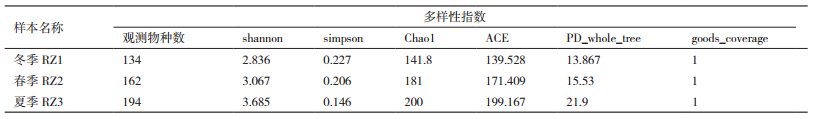
Alpha Diversity用于分析样本内(Within-community)的微生物群落多样性,通过对样本的多样性分析可以反映样本内微生物群落的丰富度和多样性。Alpha Diversity分析指数包括shannon、simpson、chao1、ACE、goods_ coverage、PD_whole_tree。冬季RZ1、春季RZ2、夏季RZ3三种复合菌的Alpha多样性分析见表 2。观测物种数、Chao1指数和ACE指数值越大,表示样品中群落丰富度越高,Shannon指数反映群落的多样性,Simpson指数反映群落中优势种的集中程度,Shannon指数越大,Simpson指数越小,说明样品中的物种多样性越高[9]。上述结果显示微生物丰富度和多样性整体情况夏季>春季>冬季,夏季物种丰富,而冬季和春季物种相对单一。PD_whole_tree指数反应了样品中物种对进化历史保存的差异,PD_ whole_tree指数越大说明物种对进化历史保存的差异越大[10]。goods_coverage指数反应了测序的深度,goods_coverage指数越接近于1,说明测序深度已经基本覆盖到样本中所有的物种。
冬季养殖海水RZ1通过16S rDNA高通量测序技术过滤掉低质量碱基后共得到原始序列78 148条,然后进行嵌合体过滤,最终用于后续分析的有效序列67 069条。按照上述筛选方法,春季RZ2过滤掉低质量碱基后的原始序列为84 025条,用于后续分析的有效序列为67 743条,夏季RZ3分别为76 206条和62 732条。为了研究各样本的物种组成,对所有样本的有效序列以97%的一致性进行OTUs聚类,RZ1、RZ2、RZ3分别有134、162、194个OTUs。通过OTUs聚类的结果表明,RZ1混合菌分属于13个门,18个纲,38个目,65个科,89个属;RZ2混合菌分属于15个门,19个纲,43个目,60个科,77个属;RZ3混合菌分属于16个门,22个纲,47个目,48个科,58个属,以上分析结果如表 3所示。
利用RDP classifier对各样品OTU从门到属依次进行分类信息分析,挖掘在3个季节中加入复合菌剂后养殖海水样品在各个水平上的菌群结构。选取每个分组在门、属分类水平上最大丰度排名前十的物种并进行对比,生成物种相对丰度柱形图(图 2)。

|
| 图 2 养殖海水样品细菌类群门(A)和属(B)水平分布图 |
在门分类水平上,3种养殖海水样品中共同相对丰度较高的菌门依次为变形菌门(Proteobacteria,55.16%-72.18%)、拟杆菌门(Bacteroidetes,18.86%- 40.34%),另外放线菌门(Actinobacteria,2.8%)为冬季RZ1样品中的优势菌门,厚壁菌门(Firmicutes,1.24%-2.13%)是冬季RZ1和春季RZ2样品的共有优势菌门,夏季RZ3样品中丰度相对较高的还有绿弯菌门(Chloroflexi,2.82%)和疣微菌门(Verrucomicrobia,1.40%)。在已分类的优势门中,只有放线菌门和厚壁菌门为革兰氏阳性细菌,其余菌门均是革兰氏阴性细菌。在不同时期的养殖海水样品中,变形菌门作为丰度最大的优势菌门,包含γ-变形菌纲(Gammaproteobacteria,14.47%-61.12%)、α-变形菌纲(Alphaproteobacteria,8.48%-62.99%),可以看出RZ1、RZ2、RZ3在纲水平优势菌丰度所占百分比相差较大。
在属分类水平上,冬季RZ1的优势菌为Tenacibaculum(38.28%),卓贝尔氏菌属(Zobellella,30.78%)、盐单胞菌属(Halomonas,13.55%)。春季RZ2优势菌为Glycocaulis(34.00%)、盐单胞菌属(11.36%)、Planktosalinus(9.67%)。与RZ1相比,RZ2优势菌占整体相对丰度值并不大。夏季RZ3优势菌为Pseudofulvimonas(28.94%)、Zobellella(17.51%)、Planktosalinus(15.86%)、海杆菌属(Marinobacter,12.30%)。
2.3.3 细菌多样性和群落结构与环境因子的关系将3个季节的养殖海水样品细菌多样性指数与环境因子之间进行相关性分析(表 4),Shannon指数和Simpson指数与温度呈显著正相关,与溶解氧呈显著负相关;ACE指数与盐度呈显著负相关,Chao1指数和PD_whole_tree与其它环境因子间的相关性均未达到显著性水平。说明在投入菌剂之后,3个季节养殖海水样品中的细菌多样性和丰富度主要受温度、盐度、溶解氧的影响,在此过程中pH变化并不大,所以pH对群落结构可能没有显著影响。
用RDA分析细菌主要群落与水质环境因子之间的关系,如图 3所示,Planktosalinus、Pseudofulvimonas、海杆菌属与温度和pH呈显著正相关,卓贝尔氏菌属、Tenacibaculum、Pseudomonas也与pH呈正相关,但与温度呈负相关;Lactococcus、盐单胞菌属、Pseudomonas、Tenacibaculum、卓贝尔氏菌属与盐度和溶解氧呈正相关,而Acinetobacter、Glycocaulis也与溶解氧呈正相关。

|
| 图 3 细菌群落与环境因子的RDA图 |
水温、盐度、溶解氧和pH不仅是水环境物理参数,还是养殖海水中不可或缺的环境因子,而且会影响水生生物的生理状态[11]。李润玲[11]在研究海水环境因子变化对辽宁湾贝类免疫相关酶活性影响时,表明水温变化会影响水体溶解氧和pH的变化。Ludlam等[12]认为水温是决定溶解氧饱和度的重要因素,水温越低,水中溶解氧含量越高,另外pH值也和二者有很高的相关性[13]。
在海洋生态系统中,海水温度、盐度和营养盐等是影响细菌群落分布的最主要因素[14-15]。李丽娜[16]在研究环境因素对水稻土中发酵微生物群落的影响时,提出了不同初始pH和培养温度都可以改变物种丰富度指数和Shannon指数。由此可以推断物种多样性指数可能和养殖海水的环境因子有关,温度较高,盐度和溶解氧偏低增加了微生物多样性,夏季观测物种数大约是冬季的1.5倍。
拟杆菌门、变形菌门、厚壁菌门、放线菌门、绿弯菌门广泛存在于虾蟹贝养殖池塘中[17],这也和天津塘沽某海水养殖厂实际情况相符合。不同时期养殖海水菌群结构相对稳定,只是主要菌种存在一定差异,3个季节样品中优势菌群分配不均,可能是加入微生态制剂之后菌群随温度、盐度、溶解氧、pH的不同出现了变化,除此以外养殖海水中初始菌群也应该是使细菌多样性发生变化的一个重要因素,微生物之间存在竞争和互利共生的关系导致相互作用产生影响[18-19],而且养殖海水中可能还有丰富的有机质。Tenacibaculum是一个新的属,它在养殖过程中可导致大菱鲆发生屈挠杆菌病[20]。Zobellella为革兰氏阴性菌,中度嗜盐,分布在海水好氧反硝化,对高浓度亚硝酸盐具有较好的耐受性,可以有效的去除硝酸盐、亚硝酸盐氮,因此被应用于处理养殖废水的过程中。有研究表明对来自不同生境的污水污泥样品进行筛菌,反硝化效果较好的菌株主要为γ-变形菌纲的盐单胞菌属和卓贝尔氏菌属[21],盐单胞菌是盐单胞菌科(Halomonadaceae)中最大的一个属,在海水等盐度较高的环境中占有较高比例[22],而冬季RZ1养殖海水样品盐度值高,可能更有利于盐单胞菌属的生长。Glycocaulis为革兰氏阴性菌,具有运动性、需氧性、嗜温性和中度嗜盐性特点,可从石油污染盐渍土和海洋中分离出来,养殖海水对碳氢化合物的值有一定限制,此菌种能够有效降解碳氢化合物。属于拟杆菌门黄杆菌科的Planktosalinus参与有机物降解、异养反硝化、自养反硝化和氨氧化过程。γ-变形菌纲的Pseudofulvimonas也具有异养硝化和好氧反硝化功能[23-24]。海杆菌属是中度嗜盐菌的重要组成部分,主要分布在不同的海洋环境中,如海沙、海滩淤泥、北极冰面、有壳的海洋生物表面等[25]。微生物在氮循环过程中发挥着重要作用,亚硝酸盐对人体及养殖动物都存在较大的毒害,对某些细菌亦是如此,随着亚硝酸盐含量升高,菌株生长速度减缓甚至生长会被完全抑制[26]。目前针对养殖环境及污水等环境中与氮循环有关的微生物多样性的报道有很多,研究表明反硝化效率高,对硝酸盐和亚硝酸盐耐受性好的菌株在处理高浓度亚硝态氮废水的应用中具有一定价值。假单胞菌属、盐单胞菌属、海杆菌属中的一些种可以进行反硝化[27],并且盐单胞菌属、卓贝尔氏菌属为高效反硝化菌,在最适条件下能将硝酸盐、亚硝酸盐完全去除[21],Planktosalinus、Pseudofulvimonas也表现出异养硝化和好氧反硝化的能力,这些菌属在含氮废水和高浓度亚硝酸盐废水处理方面有很大应用潜力。RZ1、RZ2、RZ3在优势菌属水平方面有所区别,但也有一定相似性,由于3个季节样品中的优势菌能够降解氨氮、亚硝酸盐,因此推测出将微生态制剂投入到养殖海水中,不同时期细菌组成结构和多样性跟随环境因子表现出变化,但可能仍具有调节养殖海水水质的能力。
微生物在生态系统中对环境变化比较敏感,而温度、盐度和营养盐是影响细菌群落分布的最主要因素。在温度较低,盐度较高的冬季,出现了丰度较高的致病菌Tenacibaculum,但另外一些有益菌也发挥了相应的优势。盐单胞菌属适应能力强,对盐度依赖大[28],春季和夏季盐度依次递减,盐单胞菌属的生长也不断受到限制,说明水体盐度在微生物多样性方面起到了一定作用。除此以外假单胞菌属对营养要求简单,能够在低温下生长[29],潜在益生菌乳酸菌属会降低致病菌等危害因素。春季RZ2水质指标处在中间水平,Planktosalinus与温度呈显著正相关,所以夏季此菌属相对丰度高于春季,Planktosalinus也是春季和夏季发挥异养硝化、好氧反硝化功能的主要菌属。夏季RZ3中假单胞菌属是3个季节中丰度最低的,有研究推测假单胞菌的分布与季节性温度变化有关[30],这也就表明水体温度是影响群落结构组成和多样性的主要因素。从RDA图可以看出夏季优势菌种和pH呈显著正相关,3个季节养殖海水都偏弱碱性,pH值几乎接近,而且丰富度指数、多样性指数都和pH没有显著相关性,推测此养殖海水样品中的菌群受季节pH变化影响不大。水体温度和溶解氧呈极显著负相关性,冬季溶解氧含量较高,RZ1样品优势菌种与溶解氧呈正相关性,所以夏季和冬季菌种丰度有所差别。整体来看3个季节大多数菌种都具有去除氨氮、亚硝酸盐的能力,说明水质环境因子虽然改变了微生物的多样性,但微生态制剂依然保持相应的作用,只是可能会在不同时期表现出不同的效果,3个季节下微生态制剂净化养殖海水的功能在以后还需进行深一步的测定。
4 结论(1)不同季节的环境因子,温度、盐度、溶解氧、pH都会对投入微生态制剂后的养殖海水菌群结构组成和多样性产生影响,但由于3个季节的pH值相差不大,所以pH在决定优势菌群和物种相对丰度方面并不占据主要地位。
(2)3个季节的细菌结构组成和多样性有所差别,但优势菌属具备去除氨氮和对高浓度硝酸盐、亚硝酸盐耐受性的能力,说明微生态制剂在环境因子的影响下菌群发生变化,可能依然保持相应的作用,只是可能会产生不同效果。
(3)微生态制剂的应用对维持养殖海水稳定起重要作用,不同季节下微生物群落结构有一定差异,但也发挥了各自的调控能力,这为以后微生态制剂的研制和应用提供了新方向、新思路,而且通过此项研究某些菌株的特性和能力也被发现,根据其独特生理代谢、功能特征,对治理其它废水和生物修复有重要价值。
| [1] |
赵祥, 刘红玲, 杨盼, 等. 滴灌对苜蓿根际土壤细菌多样性和群落结构的影响[J]. 微生物学通报, 2019, 46(10): 2579-2590. |
| [2] |
Huang ZB, Li XY, Wang LP, et al. Changes in the intestinal bacterial community during the growth of white shrimp, Lito penaeus vannamei[J]. Aquaculture Research, 2014, 47(6): 1737-1746. |
| [3] |
吕宁.虾蟹养殖水体中微生物群落多样性分析[D].青岛: 中国海洋大学, 2014.
|
| [4] |
李可.对虾养殖环境微生物多样性分析和微生态制剂的研究与应用[D].厦门: 厦门大学, 2007.
|
| [5] |
薛俊增, 肖南燕, 王琼, 等. 洋山港海域细菌群落多样性的季节变化[J]. 生态学报, 2016, 36(23): 7758-7767. |
| [6] |
Xiong JB, Liu YQ, Lin XG, et al. Geographic distance and pH drivebacterial distribution in alkaline lake sediments across Tibetan Plateau[J]. Environmental Microbiology, 2012, 14(9): 2457-2466. DOI:10.1111/j.1462-2920.2012.02799.x |
| [7] |
Schloss PD, Westcott SL, Ryabin T, et al. Introducingmothur : open-source, platform-independent, community-supported software fordescribing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
| [8] |
成敏玲, 刘陈飞, 程丹逸, 等. 春夏季节东湖不同富营养化区域水体细菌群落的动态变化[J]. 华中农业大学学报, 2017, 36(5): 52-59. |
| [9] |
刘小改, 杨亚军, 廖秋菊, 等. 稻纵卷叶螟肠道细菌群落结构与多样性分析[J]. 昆虫学报, 2016, 59(9): 967-968. |
| [10] |
骆杰伟, 吴永希, 黄昉萌, 等. 不同中医证型原发性失眠患者肠道菌群差异研究[J]. 中国中医药信息杂志, 2018, 25(4): 28-34. DOI:10.3969/j.issn.1005-5304.2018.04.007 |
| [11] |
李润玲.海冰和海水环境因子变化及其对辽东湾贝类免疫相关酶活性的影响[D].大连: 大连理工大学, 2016. 2020, 36(2)王永妍等: 不同季节使用微生态制剂后养殖海水细菌群落特征133
|
| [12] |
Ludlam SD. The comparative limnology of high arctic, coastal, meromictic lakes[J]. Journal of Paleolimnology, 1996, 16: 111-131. |
| [13] |
Boto KG, Bunt JS. Dissolved oxygen and pH relationship in northern Australian mangrove waterways[J]. Limnology and Oceangraphy, 1981, 26(6): 1176-1178. DOI:10.4319/lo.1981.26.6.1176 |
| [14] |
白洁, 张昊飞, 李岿然, 等. 海洋异养浮游细菌生物量及生产力的制约因素[J]. 中国海洋大学学报, 2004, 34(4): 594-602. |
| [15] |
Lozupone CA, Knight R. Global patterns in bacterial diversity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(27): 11436-11440. DOI:10.1073/pnas.0611525104 |
| [16] |
李丽娜.环境因素对水稻土中发酵微生物群落及铁还原过程的调控[D].杨凌: 西北农林科技大学, 2018.
|
| [17] |
王琦.海水多营养层次生态养殖池塘细菌群落分析及与环境因子相关性研究[D].青岛: 中国海洋大学, 2013.
|
| [18] |
Molloy S. Environmental microbiology :Disentangling syntrophy[J]. Nature Reviews Microbiology, 2014, 12(1): 7. |
| [19] |
Hibbing ME, Fuqua C, Parsek MR, et al. Bacterial competition : surviving and thriving in the microbial jungle[J]. Nature Reviews Microbiology, 2010, 8(1): 15-25. DOI:10.1038/nrmicro2259 |
| [20] |
Avendano HR, Toranzo AE, Romalde JL, et al. Iron uptake mechanisms in the fish pathogen Tenacibaculum maritimum[J]. Appl Environ Microbio, 2005, 71(11): 6947-6953. DOI:10.1128/AEM.71.11.6947-6953.2005 |
| [21] |
李小义, 王丽萍, 杜雅萍, 等. 好氧反硝化微生物多样性及其反硝化功能初步研究[J]. 氨基酸和生物资源, 2016, 38(2): 37-45. |
| [22] |
Arahal DR, Vreeland RH, Litchfield CD, et al. Recommended minimal standards for describing new taxa of the family Halomonadaceae[J]. Int J Syst Evol Microbiol, 2007, 57(10): 2436-2446. DOI:10.1099/ijs.0.65430-0 |
| [23] |
Daum M, Zimmer W, Papen H, et al. Physiological and molecular biological characterization of ammonia oxidation of the heterotrophic nitrifier Pseudomonas putida[J]. Current Microbiology, 1998, 37(4): 281-288. DOI:10.1007/s002849900379 |
| [24] |
Zhang JB, Wu PX, Hao B, et al. Heterotrophic nitrificationand aerobic denitrification by the bacterium Pseudomonas stutzeriYZN- 001[J]. Bioresource Technology, 2011, 102(21): 9866-9869. DOI:10.1016/j.biortech.2011.07.118 |
| [25] |
孙晓玲, 王柏玲, 刘东波, 等. 一株中度嗜盐菌的分离及生物学特性[J]. 应用与环境生物学报, 2012, 18(3): 477-481. |
| [26] |
聂欢欢, 赵群芬, 李长红, 等. 一株高效去除亚硝酸盐氮细菌的分离鉴定及其脱氮特性研究[J]. 微生物学通报, 2013, 40(11): 2146-2155. |
| [27] |
肖晶, 郭萍, 霍炜洁, 等. 反硝化微生物在污水脱氮中的研究及应用进展[J]. 环境科学与技术, 2009, 32(12): 97-102. DOI:10.3969/j.issn.1003-6504.2009.12.022 |
| [28] |
Vreeland RH, Litchfield CD, Martin EL, et al. Halomonas elongata, a new genus and species of extremely salt-tolerant bacteria[J]. International Journal of Systematic Bacteriology, 1980, 30(2): 485-495. DOI:10.1099/00207713-30-2-485 |
| [29] |
杨光富, 魏云林. 假单胞菌研究现状及应用前景[J]. 生物技术通报, 2011(1): 37-39, 49. |
| [30] |
陈丽萍, 侯付景, 张迪骏, 等. 宁波沿海陆源排污口假单胞菌属(Pseudomonas)分布特点[J]. 海洋与湖沼, 2013, 44(4): 926-930. |