2. 昆嵛山森林生态系统国家定位观测研究站,烟台 264100
2. Kunyushan Forest Ecosystem Research Station, Yantai 264100
松枯梢病是世界范围内针叶树上最常见和分布最广的重要病害之一。该病的病原真菌为松球壳孢菌(Sphaeropsis sapinea),主要通过伤口侵染寄主,也可从针叶气孔侵入或直接侵染嫩梢和嫩叶,越冬芽上潜伏的病菌可导致翌春芽腐和枯梢[1]。Stanosz等[2]对Pinus resinosz和Pinus banksiana的研究中首次发现无病斑的梢和叶上存在潜伏侵染。刘艳和叶建仁[3]对多个松属树种进行套袋隔离的试验,发现表面无病斑的梢上存在松枯梢病菌进行越冬,可造成来年春梢发病。
植物内生微生物在其生活史的一定阶段或全部阶段定殖于植物的各种组织和器官内部,并与植物建立共生关系,其中的某些类群可以产生各种化学物质,并且能通过竞争或其他作用来抑制或杀死某些致病菌。经Martinez-Klimova统计,在植物中共分离得到具有拮抗活性或可分泌抑菌性代谢物质的内生真菌36属、内生细菌10属,其中内生真菌包括Basidiomycota、Ascomycota等,内生细菌包括放线菌门、拟杆菌门、厚壁菌门和变形菌门等[4]。
本研究选取无病斑与感染枯梢病的赤松(Pinus densiflora Sieb. et Zucc.)针叶为研究对象,利用高通量测序技术研究不同枯梢病发病状态下P. densiflora针叶的内生真菌多样性以及群落结构的差异,为松枯梢病的微生物防控提供数据基础。
1 材料与方法 1.1 村料 1.1.1 研究区概况昆嵛山(121°41'34''- 121°48'04''N,37°11'50''-37°17'49''E)地处山东半岛东部,属暖温带季风气候,林区土壤属森林棕壤,以沙质壤土为主。昆嵛山是我国和东北亚P. densiflora原生地和天然分布中心,P. densiflora在该区域与落叶阔叶林共同组成地带性天然次生林植被。共选取3块样地,样地地理坐标及海拔为121°43'35.0″N,37°17'30.9″E,184 m;121°45'08.4″N,37°17'37.8″E,124 m;121°43'19″N,37°17'30.2″E,290 m。样地立地条件均为中坡位,坡度为17°-26°,林分结构均为针阔混交林,由P. densiflora和麻栎(Quercus acutissima Carruth.)构成。
1.1.2 样品采集于2018年9月在3块样地内进行采样,分别采集样地内无病斑P. densiflora上无病斑针叶ZK1与染病P. densiflora上无病斑针叶ZK2、染病较轻针叶ZK3(病斑长度为针叶长度1/2以下)、染病较重针叶ZK4(病斑长度为针叶长度1/2以上)针叶,共4类。采用五点采样法采集样本,冲洗晾干后用75%乙醇浸泡1 min,无菌水冲洗3次,0.5%次氯酸钠溶液浸泡2 min后,再用无菌水冲洗3次,样品-20℃保存[5]。将冲洗后的无菌水稀释至MEA培养基上,以确保针叶外表无真菌残留,结果部分不再赘述。
1.2 方法 1.2.1 内生真菌多样性测定利用CTAB法对样本DNA进行抽提,完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测[6]。将DNA样品在冰上融化后,离心并充分混匀,Nanodrop检测样品质量,取30 ng进行PCR扩增。PCR扩增体系:DNA样品,1.0 μL;Forward Primer(5.0 μmol/L),1.0 μL;Reverse Primer(5.0 μmol/L),1.0 μL;BSA(2.0 ng/μL),3.0 μL;2 × Taq Plus Master Mix,12.5 μL;ddH 2O,6.5 μL。进行ITS扩增。ITS1区扩增引物序列为(5'-CTTGGTCATTTAGAGGAAGTAA-3')和(5'-TGCGTTCTTCATCGATGC-3')。
PCR采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱,2%琼脂糖电泳检测。扩增产物采用Illumina Miseq PE300平台,并构建Miseq文库以及Miseq上机测序。
1.2.2 测序数据处理与分析OTU(Operational taxonomic units)是在系统发生学或群体遗传学研究中,为了便于进行分析,人为给某一个分类单元(品系、属、种、分组等)设置的同一标志。用uclust(Version 1.2.22)按照97%相似性将全部序列聚类,去除singleton的OTU,并得到代表序列和OTU表[7]。用usearch按照97%相似性序列进行OTU聚类(不含单序列),得到代表序列再将其全部序列按照97%相似度比对到OTU上形成OTU列表[8-9]。使用Mothur软件计算丰富度指数Chao1和多样性指数Shannon[10]。使用R软件(v2.15.3)绘制PCA图。
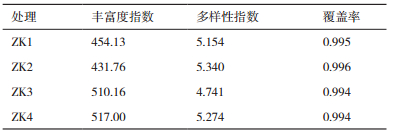
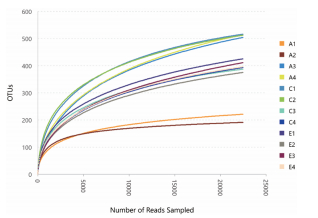
2 结果 2.1 微生物测序数据及稀释曲线通过高通量测序技术,在12个样品中共获得内生真菌有效序列433 814条,共计1 196个OTU。各样品OTU稀释曲线趋于平坦(图 1),样本的Coverage测序深度指数统计分析结果见表 1(内生真菌),结果显示采集针叶样本中覆盖率均大于99%,说明各样本中的微生物物种信息被充分检测,结果能够代表各类针叶中内生真菌的真实水平。
|
| 图 1 赤松样品内生真菌OTU稀释曲线 |
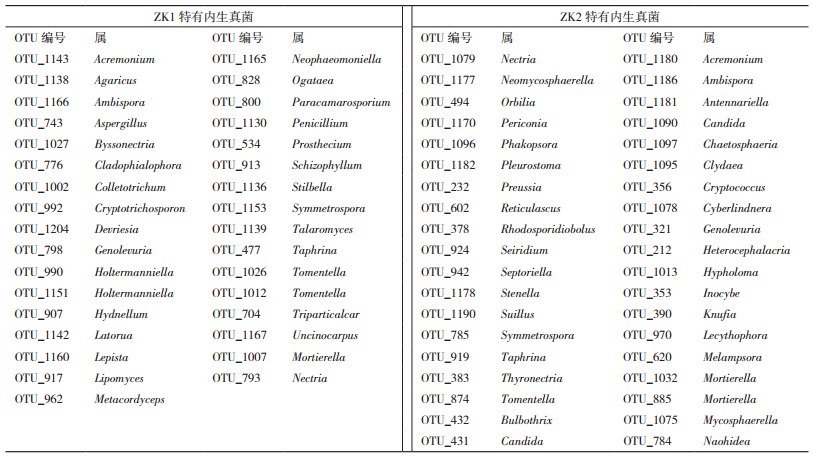
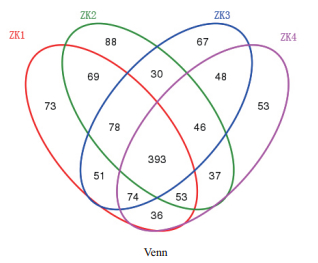
根据真菌OTU数目,对样品中OTU组成进行分析,构建Venn图(图 2)和群落结构柱状图(图 3)。Venn图显示,针叶中共有相同的OTU 393个,占OTU总数的32.86%,4类针叶中特有的OTU数目分别为73、88、87、53个,以ZK2中特有OTU数目最多。无病斑针叶的可注释特有OTU及对应属见表 2。
|
| 图 2 不同染病级别的赤松针叶内生真菌OTU分类Venn图 |
|
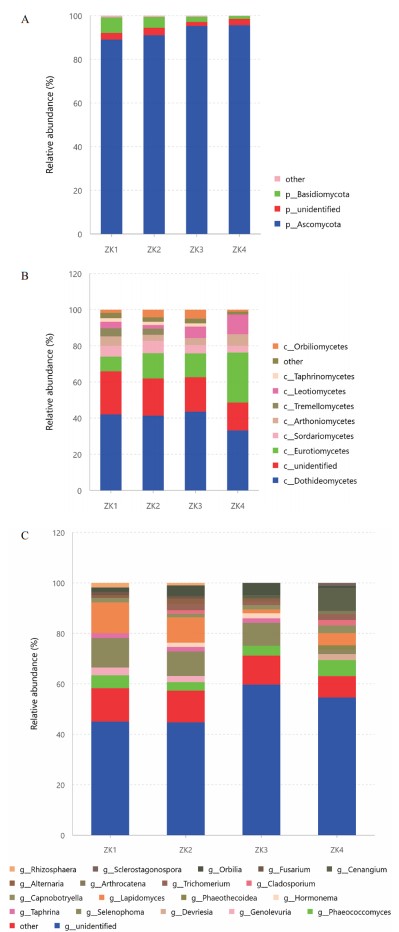
| 图 3 不同染病级别的赤松针叶内生真菌优势真菌门(A)、纲(B)、属(C)组成 |
样本内生真菌的Chao1指数和Shannon指数统计分析结果见表 1,ZK4的Chao1最高,即测得OTU数最高,其次分别为ZK3(病斑长度为针叶长度二分之一以下的P. densiflora针叶)、ZK1(无病斑P. densiflora上的针叶)、ZK2(染病P. densiflora上的无病斑针叶),随着病害的加重,内生真菌丰富度呈现出上升的趋势。ZK1与ZK2的内生真菌多样性指数均高于ZK3,而之后ZK4的多样性指数升高。
对1 196个OTU序列进行门和纲水平上的归类,可划分分属13个门以及40个纲。在门水平上(图 3-A),Ascomycota占比最高,分别达到89.01%、90.90%、95.29%、95.55%,其次为Basidiomycota,分别占比7.78%、4.82%、1.85%和1.29%,Ascomycota与Basidiomycota为针叶内生真菌中的优势菌群,且在样本中的相对丰度存在差异,Ascomycota相对丰度逐渐升高,而Basidiomycota相对丰度占比下降。
在纲水平上(图 3-B),内生真菌均以座囊菌纲(Dothideomycetes)相对丰度最高(32.83%- 43.12%),其次相对丰度较高的还有散囊菌纲(Eurotiomycetes)(8.23%-27.83%),以及丰度较高的unidentified菌类,锤舌菌纲(Leotiomycetes)、星裂菌纲(Arthoniomycetes)在无病斑与染病针叶中均占不同的比例。ZK1、ZK2、ZK3中的Dothideomycetes相对丰度相近,均高于ZK4中所占比例;ZK1中Eurotiomycetes占比最低,Eurotiomycetes相对丰度随着病害的严重程度而逐渐升高;Leotiomycetes和Arthoniomycetes分别以ZK3、ZK4中占比最高,ZK1、ZK2中相对丰度相近且较低。银耳纲(Tremellomycetes)和外囊菌纲(Taphrinomycetes)仅在ZK1、ZK2、ZK3中占比大于1%,在ZK4中相对丰度为0。
在属水平上(图 3-C),相对丰度最高的属为Lapidomyces,其次为Selenophoma,两个属的相对丰度均随着病害的加重而减小。在无病斑针叶ZK1、ZK2中,Rhizosphaera、Fusarium、Myriangium、Genolevuria的相对丰度均高于1%,在染病针叶中相对丰度为0。而染病针叶中特有的属有Cenangium、Arthrocatena、Trichomerium、Cladosporium、Phaeothecoidea等,其中Phaeothecoidea仅在发病较重的ZK4中占比超过1%。
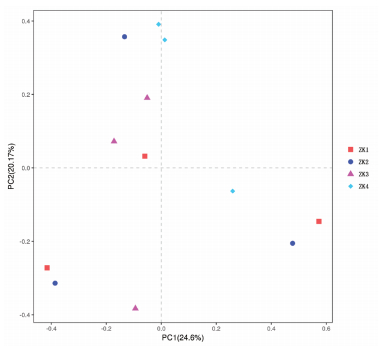
2.3 赤松针叶内生真菌Beta多样性差异分析基于PCA主成分分析样品间的Beta多样性差异评估不同染病级别的P. densiflora针叶内生真菌的差异性,结果(图 4)表明,主成分PC1与主成分PC2的贡献率分别为24.6%和20.17%,在3个样地中,同一样地内的无病斑针叶距离较近,而染病后的样本ZK4相聚较集中,说明样地内P. densiflora针叶的内生真菌存在差异,而在枯梢病的侵染下,内生真菌的构成趋于一致。
|
| 图 4 不同染病级别的赤松针叶内生真菌主成分分析 |
通过高通量测序技术,对针阔混交林内的P. densiflora针叶内生真菌多样性与群落结构进行分析,结果表明,P. densiflora针叶内生微生物多样性丰富,无病斑针叶与染病针叶均为优势真菌为Ascomycota和Basidiomycota,无病斑针叶与染病针叶多样性、群落结构等方面均存在差异。
松枯梢病是针叶树上最常见和分布最广的重要病害之一。国内对松枯梢病的研究不仅在病原发生、传播、侵染、防治等方面[11-12],而且在病原菌的多样性、生物学特征等方面均有进展[3, 11, 13],此外,近年来通过拮抗菌对病害的控制也取得了较多的成果[14-16],也证实了可通过对寄主植物的微生物调控,达到控制枯梢病爆发的目的。健康植物组织中的内生真菌群落更加稳定,从而抑制病原菌的发展。张丽娜等[17]通过PDA平板培养法对不同季节内的无病斑山茶及感病山茶叶片内生真菌群落的差异进行了比较,对灰斑病与山茶叶部内生真菌多样性的关系进行了分析,结果表明:无病斑叶片的内生真菌数量、多样性、均匀度高于染病叶片,染病程度对叶片内生真菌多样性等指标的影响显著。还有研究表明两个品种染病后的内生真菌变化趋势也不同,高抗品种内生真菌多样性逐渐减少,而高感品种多样性呈现上升的趋势[18]。有研究对漆树感染溃疡病的枝干部内生真菌进行培养,比对不同染病情况、不同部位的真菌多样性,结果表明无病斑枝干的内生真菌多样性显著高于受损伤组织,溃疡病菌的侵染对内生真菌群落结构的影响显著[19]。
本研究中,内生真菌在无病斑针叶中表现为较高的多样性,高于染病较轻的针叶,这与先前的研究结论一致,而在染病较重的针叶中多样性指数再次升高,可能是因为针叶防御侵染的机制被破坏。在病原菌入侵植物组织时,寄主植物的防御机制被破坏,内部平衡被打破,其它病原微生物以及腐生微生物更容易进入植物组织内,使得内部的微生物多样性升高。在无病斑棉花和黄萎病侵染后的棉花根部内生真菌的研究中,黄萎病侵染后的棉花根部内生真菌多样性等指标也均高于无病斑植株根部,说明病原菌的侵染提高了棉花内部微生物的多样性,影响其群落结构[20]。这可能是由于其它病原菌或腐生真菌对染病组织进行了入侵[21],或是由于观察到的真菌群落中存在可引发潜伏侵染病原菌的模式[22]。
松类树种的针叶内生微生物分析大都通过纯培养法进行,对樟子松、红松、兴安落叶松等树种的内生真菌或内生细菌进行分离培养,初步证实了松针叶内生微生物的多样性及其中对内生微生物多样性的影响因素,如针叶叶龄[23-24]。在P. densiflora的内生真菌研究中[25-26],分离获得了Lophodermium complex、Sydowia polyspora、Hymenula sp.、Sistotrema brinkmannii、Septoria pini-thunbergii、Earliella sp.和Lophodermium spp.等多株优势菌株。随着对内生微生物认识的不断提高以及研究水平的提升,第二代测序技术已经常用于微生物多样性的研究中。Bullington和Larkin[6]对针叶树种内生真菌多样性进行了研究,对山白松Pinus monticola针叶进行接种,并通过新一代高通量测序手段对其中的内生真菌多样性和群落结构的变化进行测定,研究内生真菌相互间的种间竞争、共生模式等,证实了接种真菌与潜在病原菌的相互竞争。
本研究结果得到内生真菌的优势菌为Ascomycota和Basidiomycota。Ascomycota和Basidiomycota均为常见植物内生真菌[27-28],与先前P. densiflora纯培养内生真菌研究[25]结论一致。Rhizosphaera、Fusarium和Myriangium曾在茅苍术茎、叶中分离发现,是常见的内生真菌[30]。Fusarium不仅是内生真菌,可分泌多种具有研究价值的次生代谢物质[30],还是多种植物病害的病原菌[31-32]。因此,对于Fusarium需要进一步研究。在染病较重的针叶中特有的数个属中,Cenangium为常见的松类病害病原菌,该属被证实与枯梢病病原菌的侵染具有紧密的联系[33]。
4 结论在针阔混交林中,P. densiflora叶部内生真菌的多样性及群落结构组成受到枯梢病侵染的影响,染病前期程度较轻时微生物多样性降低,在染病后期多样性指数上升。无病斑针叶中内生真菌的优势菌为Lapidomyces和Selenophoma,在枯梢病菌的侵染后两种优势菌相对丰度均下降,内生真菌群落结构组成趋于一致。本研究明确了枯梢病不同发病程度P. densiflora针叶内生微生物的多样性及群落结构组成,为松枯梢病的真菌群落结构调控提供了基础。
| [1] |
叶建仁, 贺伟. 林木病理学[M]. 北京: 中国林业出版社, 2011.
|
| [2] |
Stanosz GR, Smith DR, Guthmiller MA, et al. Persistence of Sphaeropsis sapinea on or in asymptomatic shoots of red and jack pines[J]. Mycologia, 1997, 89(4): 525-530. |
| [3] |
刘艳, 叶建仁. 松树枯梢病潜伏侵染的研究[J]. 林业科学, 2003, 39(4): 67-72. |
| [4] |
Martinez-Klimova E, Rodríguez-Peña K, Sánchez S. Endophytes as sources of antibiotics[J]. Biochemical Pharmacology, 2016, 134: 1-17. |
| [5] |
刘学周, 赵智灵, 李绍宾, 等. 西洋参内生菌群落结构与多样性[J]. 微生物学报, 2015, 55(3): 330-340. |
| [6] |
Bullington LS, Larkin BG. Using direct amplification and nextgeneration sequencing technology to explore foliar endophyte communities in experimentally inoculated western white pines[J]. Fungal Ecology, 2015, 17: 170-178. |
| [7] |
Youssef N, Shelk CS, Krumholz LR, et al. Comparison of species richness estimates obtained using nearly complete fragments and simulated pyrosequencing-generated fragments in 16S rRNA genebased environmental surveys[J]. Applied and Environmental Microbiology, 2009, 75(16): 5227-5236. |
| [8] |
Hess M, Sczyrba A, Egan R, et al. Metagenomic discovery of biomass-degrading genes and genomes from cow rumen[J]. Science, 2011, 331: 463-467. |
| [9] |
陈泽斌, 高熹, 胡昳, 等. Illumina MiSeq高通量测序分析花生仁内生细菌多样性[J]. 昆明学院学报, 2018, 40(3): 92-95. |
| [10] |
Caporaso JG, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. |
| [11] |
刘满光, 张娣, 路文雅, 等. 松枯梢病病原菌的研究进展[J]. 中国农学通报, 2018, 34(27): 97-101. |
| [12] |
陈洁, 刘雪峰, 郝昕, 等. 接种点柄乳牛肝菌对樟子松枯梢病抗病性的影响[J]. 东北林业大学学报, 2019, 47(3): 94-99. |
| [13] |
王婧, 崔建州, 任晓婧, 等. 油松枯梢病病原菌的分离鉴定[J]. 中国森林病虫, 2016, 3: 17-21. |
| [14] |
刘秀嶶, 刘雪峰, 王鹏, 等. 利用三种梢栖真菌生物防治落叶松枯梢病的研究[J]. 林业科学研究, 2012, 25(6): 685-690. |
| [15] |
王凤各, 叶建仁. JK-JS8菌株对松树枯梢病菌的拮抗作用及机理[J]. 辽东学院学报:自然科学版, 2016, 23(2): 117-121. |
| [16] |
蒋萍, 叶建仁. 松枯梢病拮抗细菌的分离和筛选[J]. 南京林业大学学报:自然科学版, 2007, 31(4): 144-146. |
| [17] |
张丽娜, 朱天辉, 杨佐忠, 等. 灰斑病对山茶叶部真菌群落的影响[J]. 四川农业大学学报, 2011, 29(3): 378-385. |
| [18] |
白维晓, 孙玮宏, 肖瑞桐, 等. 两种不同白粉病抗性野生蔷薇内生真菌群落结构[J]. 微生物学通报, 2019, 46(6): 1300-1308. |
| [19] |
Takemoto S, Masuya H, Tabata M. Endophytic fungal communities in the bark of canker-diseased Toxicodendron vernicifluum[J]. Fungal Ecology, 2014, 7: 1-8. |
| [20] |
刘政, 李燕, 孙艳, 等. 黄萎病侵染后棉花根部内生真菌群落结构分析[J]. 西北农业学报, 2016, 25(1): 42-47. |
| [21] |
Arnold AE. Understanding the diversity of foliar endophytic fungi : progress, challenges, and frontiers[J]. Fungal Biology Reviews, 2007, 21(2): 51-66. |
| [22] |
Steinrucken TV, Bissett A, Powell JR, et al. Endophyte community composition is associated with dieback occurrence in an invasive tree[J]. Plant and Soil, 2016, 405(2): 311-323. |
| [23] |
王立祥, 任利利, 游崇娟, 等. 松树蜂入侵樟子松的内栖真菌区系[J]. 菌物学报, 2017, 36(4): 444-453. |
| [24] |
王立祥, 刘晓博, 任利利, 等. 松树蜂入侵的混交林中针叶树种内生真菌多样性[J]. 林业科学, 2017, 53(9): 81-89. |
| [25] |
Eo JK, Park H, Eom AH. Diversity of endophytic fungi isolated from Pinus densiflora and Juniperus rigida distributed in Mt. Johangsan, Korea[J]. The Korean Journal of Mycology, 2018, 4: 437-446. |
| [26] |
Gil YJ, Eo JK, Eom AH. Molecular identification and diversity of endophytic fungi isolated from Pinus densiflora in Boeun, Korea[J]. The Korean Journal of Mycology, 2009, 2: 130-133. |
| [27] |
席刚俊, 李警保, 史俊, 等. 白芨内生真菌的多样性[J]. 浙江农业学报, 2017, 29(12): 2077-2083. |
| [28] |
黄彩微, 廖映辉, 张琪, 等. 凉山州龙肘山锈红杜鹃与薄叶马银花根部真菌分子检测[J]. 微生物学通报, 2017, 44(5): 1108-1120. |
| [29] |
曹益鸣, 陶金华, 江曙, 等. 茅苍术内生真菌生物多样性与生态分布研究[J]. 南京中医药大学学报, 2010, 26(2): 137-139. |
| [30] |
解飞翔, 袁伟钰, 石佩星, 等. 竹子内生真菌Fusarium oxysporum次级代谢产物的研究[J]. 安徽农业科学, 2019, 47(5): 174-175, 189. |
| [31] |
Shikha S, Chris K, Janice YU. Fusarium species as pathogen on orchids[J]. Microbiological Research, 2018, 207: 188-195. |
| [32] |
Rocheleau H, Al-harthi R, Ouellet T. Degradation of salicylic acid by Fusarium graminearum[J]. Fungal Biology, 2019, 123(1): 77-86. |
| [33] |
Halina K, Piotr L. Therrya fuckelii and other fungi on stems and branches of Pinus sylvestris following lightning damage[J]. Acta Mycologica, 2011, 46(1): 109-114. |