木质纤维素主要由纤维素和半纤维素组成[1],因其结构的复杂性,几乎不能被非反刍动物直接吸收利用。我国是畜牧养殖大国,每年需要大量的动物饲料,而饲料中丰富的木质纤维素却未能得到有效的利用,降低饲料的营养价值,如果能将其转化为易吸收能源物质,不仅能提高饲料的营养价值,而且向非反刍动物饲料中引入农业秸秆及副产物变废为宝可降低饲料的生产成本,对解决我国粮食危机和饲料短缺有着重要的意义[2]。然而商业酶的高成本和活力偏低,造成我国木质纤维素生物转化的瓶颈[3]。
纤维素酶和木聚糖酶是能够水解木质纤维素的重要工具酶。纤维素酶能够将纤维素水解为葡萄糖;木聚糖酶能够将半纤维素水解成为木寡糖、木糖等小分子化合物,而木寡糖和木糖作为双歧因子,可以提高动物体内双歧杆菌的繁殖能力,改善胃肠道微环境,增强免疫力[4]。研究发现半纤维素紧紧地包围着纤维素,限制了纤维素酶与纤维素的接触,产生阻塞效应,木聚糖酶在纤维素酶降解纤维素过程中可以起协同作用,促进纤维素酶的水解效率[5]。因此,筛选同步分泌高效纤维素酶和木聚糖酶菌株,可以提高木质纤维素的生物转化,降低工业生产成本,提高饲料的营养价值。本研究从荔枝林腐败落叶中分离出一株能同步分泌纤维素酶和木聚糖酶的菌株,对其进行碳源筛选和酶学性质测定,旨为木质纤维素酶菌株的生产应用提供一定理论依据。
1 材料与方法 1.1 材料 1.1.1 样品与试剂用于菌株分离的荔枝腐败落叶取自广州市番禺区广州大学城荔枝林。木聚糖(xylan)、D(+)-木糖分析纯(AR)和刚果红指示剂均购买于Maicklin公司。
1.1.2 培养基 1.1.2.1 固体活化培养基[6](g/L)葡萄糖20 g、酵母浸粉5 g、CaCl2 0.2 g、KH2PO4 0.5 g、维生素B1 10 mg、MgSO4·7H2O 0.1 g、琼脂18 g。
1.1.2.2 刚果红木质纤维素选择培养基[7](g/L)刚果红3.0 g、CMC-Na或木聚糖2.0 g、硫酸铵0.5 g、NaCl 0.5 g,琼脂18 g。
1.1.2.3 液体产酶培养基[8](g/L)碳源20 g、硫酸铵6 g、酵母浸粉0.4 g、MgSO4 ·7H2O 0.3 g、CaCl2 0.5 g、KH2PO4 1.0 g、FeSO4·7H2O 5.0 mg、MnSO4·H2O 1.6 mg、ZnSO4·7H2O 1.4 mg、CoCl2·6H2O 2.0 mg、维生素B1 10 mg、0.05% Tween 80。
1.2 方法 1.2.1 木质纤维素降解菌的分离与鉴定将荔枝腐叶在无菌环境下研碎,称取1.0 g样品,加入50 mL的无菌水,振荡2 h后,梯度稀释[9],取0.1 mL上清液涂布在刚果红CMC-Na选择培养基上,进行纤维素降解菌筛选,于28℃培养48 h,用无菌牙签挑取产生透明圈的不同形态的菌落,接种到刚果红木聚糖选择培养基上,于28℃培养48 h,将具有透明圈的菌落进行液体产酶发酵,通过测定酶活比较各菌株的纤维素酶和木聚糖酶的活力,选择两种酶活力均最高的菌株进行下一步研究。菌种的形态学观察,鉴定参照《真菌鉴定手册》进行。采用DNA提取试剂盒进行DNA提取。应用真菌核糖体DNA内转录间隔区引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCGCCTTATTGATATGC-3')为引物进行PCR扩增,PCR产物由北京睿博兴科生物技术公司测定,将菌株的ITS-rDNA序列在NCBI上用Blast程序与已知的相关序列进行比对,并利用Mega 5.0软件构建系统发育树[10]。
1.2.2 不同碳源对菌株产酶的影响用接种环刮取约1 cm2活化琼脂培养基上目标菌株的孢子,接种到种子液摇瓶中,28℃,120 r/min条件下培养24 h,作为后续试验的种子液。移取2 mL种子液到碳源分别为麦皮、玉米芯、玉米秸秆、CMC-Na等粉末(过18目筛)的液体产酶培养基中,28℃,120 r/min条件下培养120 h。发酵结束后,先将发酵液过120目滤布,除去菌丝体和大部分颗粒较大的碳源粉末,再4 000 r/min离心10 min,上清液即为粗酶液,纤维素酶活力的测定参考王刚等[11]的方法,木聚糖酶活力的测定参考吴萍等[12]的方法。
1.2.3 发酵时间对菌株产酶的影响移取2 mL种子液到玉米秸秆液体产酶培养基中,28℃,120 r/min条件下培养,每24 h取样测定酶活力。
1.2.4 酶的分离纯化 1.2.4.1 SDS-PAGE与酶谱分析粗酶液进行酶谱分析参考李源涛等[13]的方法:电泳前将粗酶液与2×上样缓冲液混合,沸水浴5 min,低温电泳,结束后将胶体分为两部分,含蛋白质分子量标记部分用考马斯亮蓝染色,另一部分用30%异丙醇乙酸缓冲液浸泡45 min(每15 min更换一次),蒸馏水冲洗2次,浸泡在乙酸缓冲溶液中,50℃,孵育20 min,刚果红染色后,用NaCl溶液脱色,直到出现透明条带时,用5%(V/V)的乙酸浸泡停止反应[14]。
1.2.4.2 不同饱和度的硫酸铵对酶部分纯化的影响取7只试管,每只试管中加入5 mL粗酶液,依次加入不同质量的硫酸铵,缓慢振荡溶解,使硫酸铵的饱和度分别为:30%、40%、50%、60%、70%、80%和90%。放入4℃冰箱保存2 h,4 000 r/min离心10 min。弃上清,沉淀用0.5 mL乙酸缓冲液(0.05 mol/L,pH 5.0)溶解,即得到部分纯化的粗酶浓缩液,测定相对酶活力。
1.2.4.3 DEAE Sepharose Fast Flow阴离子交换层析将1.2.4.2中50%-80%硫酸铵沉淀所得酶液经冰水浴透析除盐(过0.45 μm滤膜),上样于经0.02 mol/L、pH 8.0的Tris -HCl缓冲液平衡后的DEAE Sepharose Fast Flow阴离子交换层析柱(1 cm×70 cm)。先用缓冲液进行洗脱,再用含0.1-0.5 mol/L的NaCl缓冲液进行梯度洗脱,流速为0.5 mL/min,每6 min收集一管(流动相全程冰水浴)。测定每个蛋白质峰的酶活力,收集有酶活力的洗脱峰,对其进行SDS-PAGE纯度检测。
1.2.4.4 Sephadex G-100凝胶层析将1.2.4.3中分离不纯的目标酶液透析、冷冻干燥、浓缩,过0.45 μm滤膜得清液上样于0.02 mol/L pH5.0柠檬酸缓冲液平衡后的SephadexG-100层析柱(0.5 cm×30 cm),流速为0.5 mL/min,2 min收集一管(流动相全程冰水浴),测定每个蛋白质峰的酶活力,收集有酶活的洗脱峰,并对其进行纯度检测。
1.2.5 酶学性质测定 1.2.5.1 纯化酶的最适反应温度和pH值最适反应温度:将酶液分别置于30、40、50、60和70℃的水浴条件进行酶促反应,以最高酶活力为100%,测定相对酶活力。最适反应pH:用pH值为3.0、4.0、5.0、6.0、7.0和8.0的乙酸缓冲液配制1% CMC-Na或1%木聚糖溶液为底物,在最适温度下测定相对酶活力。
1.2.5.2 纯化酶热稳定性和酸碱稳定性热稳定性:将酶液分别在30、40、50、60和70℃的条件下水浴2 h,快速冷却至室温,在最适反应条件下测定相对酶活力。酸碱稳定性:将粗酶液分别置于pH值分别为3.0、4.0、5.0、6.0、7.0和8.0的乙酸缓冲液中室温放置2 h,在最适反应条件下测定相对酶活力。
1.2.5.3 玉米芯木聚糖样品制备及酶解产物薄层分析采用酸碱处理醇沉法[15]从玉米芯中提取木聚糖,将制备的木聚糖放入60℃烘箱中烘干,研磨成粉末,得到玉米芯木聚糖样品,用粗酶液降解玉米芯木聚糖样品,水解产物进行薄层色谱分析[15-16]。
2 结果 2.1 菌株的筛选与鉴定通过刚果红CMC-Na选择培养基,从荔枝腐叶中共获得5株不同形态的单菌落,分别将其接种在刚果红木聚糖选择培养基上,28℃培养48 h,获得一株生长旺盛透明圈较大的菌株YB。表明菌株YB能分泌纤维素酶和木聚糖酶。菌株YB在刚果红CMC-Na选择培养基上的生长状态(图 1-A),在木聚糖选择培养基上的生长状态(图 1-B)。菌株YB在PDA培养基上生长旺盛,菌丝洁白,呈放射束状生长,中心菌丝变黄出现同心圆(图 1-C),随后菌丝体都逐渐变黄(图 1-D),到第10天菌丝体渐渐消失,产生大量绿色孢子(图 1-E)。显微镜下观察菌丝体粗壮有分枝,孢子为卵圆形(图 1-F),根据《中国真菌志》初步判定菌株为木霉属。目标菌株PCR扩增片段序列长度为592 bp(图 2)。将菌株的ITSrDNA基因序列输入NCBI基因库中进行同源性比较,与绿木霉(Trichoderma virens)KX343100的相似度为99%,初步鉴定该菌为一株Trichoderma virens,命名为Trichoderma virens YB(图 3)。

|
| 图 1 菌株YB的形态学观察 |

|
| 图 2 菌株YB的18S rDNA PCR产物电泳图 |

|
| 图 3 菌株YB的系统发育树 |
菌株YB在4种碳源中,以玉米秸秆为碳源时,两种酶的活力都远高于其它碳源,木聚糖酶活力为:18 218.36±432.56 U/mL。纤维素酶活力为:220.59±18.73 U/mL。木聚糖酶活力顺序:玉米秸秆>麦皮>玉米芯粉>CMC-Na。纤维素酶活力顺序:玉米秸秆>玉米芯粉>麦皮>CMC-Na(图 4),因此选择玉米秸秆为碳源进行下一步试验。

|
| 图 4 不同碳源对菌株YB产酶的影响 |
在发酵过程中菌株YB在前72 h,纤维素酶活力快速增长,到72 h纤维素酶活力达到最大313.53±26.78 U/mL,72 h后纤维素酶活力逐渐缓慢下降。木聚糖酶活力在前72 h快速增长,72-120 h缓慢增加达到18 120.87±500.37 U/mL,120 h后木聚糖酶活力降低。综合考虑两种酶的总酶活力,故选择发酵周期为72 h(图 5)。

|
| 图 5 发酵时间对菌株YB产酶的影响 |
菌株YB能分泌多种纤维素酶组分,其中有3 114生物技术通报Biotechnology Bulletin 2020, Vol.36, No.2种为耐热性质的纤维素酶组分;3种不耐热纤维素酶组分(图 6-A箭头指示)。从粗酶液中提取到1种具有耐热性质的木聚糖酶活力的蛋白带,未经高温处理的粗酶液(稀释10倍),冰浴电泳的条件下有一段非常透明的谱带(图 6-B)。

|
| A:纤维素酶酶谱(M:Protein Marker;1:粗酶液考马斯亮蓝染色;2:经沸水浴的粗酶液刚果红染色;3:未经高温处理的粗酶液刚果红染色);B:木聚糖酶酶谱(1:经沸水浴的粗酶液刚果红染色;2:未经高温处理的粗酶液刚果红染色) 图 6 菌株YB发酵上清液的SDS-PAGE与酶谱分析 |
硫酸铵盐的饱和度由30%增加到40%时,浓缩酶液的酶活力均急剧上升,当饱和度为50%时,木聚糖酶活力最大。当饱和度为70%时,纤维素酶活力最大,因此,盐析木聚糖酶和纤维素酶(CMC酶)的最佳硫酸铵饱和度分别为50%和70%(图 7)。

|
| 图 7 不同饱和度硫酸铵盐析对酶活力的影响 |
由图 8可知,洗脱出5个明显的蛋白质峰,经酶活力检测发现,Ⅰ既有CMC酶活力又有木聚糖活力,峰形不对称,需要进一步分离纯化;Ⅱ、III只具有较低的CMC酶活力和酶含量;Ⅳ具有较高CMC酶活力且峰形对称性较好,表明含杂蛋白少可进行纯度鉴定;V不具有酶活性;故只收集Ⅰ和Ⅳ组分,有利于下一步的分离纯化。

|
| 图 8 粗酶液DEAE Sepharose Fast Flow阴离子交换层析洗脱图谱 |
由图 9可知,图 8中Ⅰ组分经Sephadex G-100凝胶层析洗脱出3个比较明显的蛋白质峰,分别命名为Ⅰ a、Ⅰ b、Ⅰ c;经酶活力检测发现,Ⅰ a只具有木聚糖酶活力;Ⅰ b只具有CMC酶活力;Ⅰ c未检测出酶活性,为杂蛋白质。故收集Ⅰ a和Ⅰ b组分进行蛋白质纯度鉴定。

|
| 图 9 组分Ⅰ Sephadex G-100凝胶层析洗脱图谱 |
绘制标准蛋白分子量曲线,计算标准蛋白Marker的相对迁移率,并将其作为横坐标,其分子量大小的对数为纵坐标,绘制标准曲线得y=-0.848 9x+2.068 3,R2=0.98。图 10为纯化后的酶液进行SDS-PAGE电泳鉴定。由电泳结果可知,Ⅳ组分中含有少量的杂蛋白,通过与图 6-A纤维素酶活性电泳对照,可以排除少量杂蛋白的干扰。CMC酶Ⅰ b、木聚糖酶Ⅰ a均为单一条带,纯度较高。通过标准蛋白分子量曲线计算得到Ⅳ、Ⅰ b、Ⅰ a分子质量分别为22.8 kD、58.5 kD和44.5 kD。

|
| M:Protein Marker;1:硫酸铵沉淀的粗酶液;2:过DEAE Sepharose FastFlow柱得到的t;3:由组分Ⅰ Sephadex G-100凝胶层析得到的Ⅰ b;4:组分析得Ⅰ Sephadex G-100凝胶层析得到的Ⅰ a 图 10 目的蛋白酶纯化后SDS-PAGE电泳图 |
由表 1可知,对木质纤维素酶进行3步纯化:(NH4)2 SO4分级沉淀、DEAE Sepharose Fast Flow、Sephadex G-100凝胶层析,最终CMC酶Ⅳ、Ⅰ b、木聚糖酶Ⅰ a纯化倍数分别为3.65、5.45和11.33倍。回收率分别为37.45%、10.09%和28.73%。比酶活分别为9.06 U/mg、13.53 U/mg、1595.93 U/mg。其中(NH4)2 SO4分级沉淀的纯化倍数较低,可能是选择的沉淀区间较宽造成的。
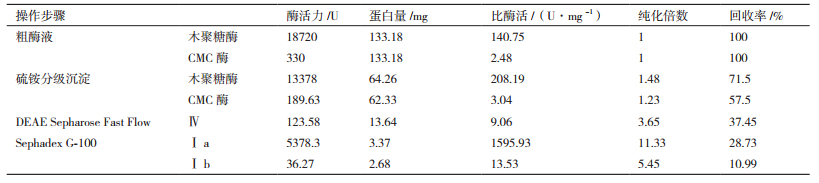
3种酶的最适酶促反应条件均为:50℃,pH 5.0。温度对酶活力的影响:在30℃时,3种酶的活力较低,随着温度的升高,3种酶的活力快速上升,当温度达到50℃时,3种酶的活力均达到最大,随着温度的继续上升,3种酶的活力均迅速下降(图 11-A)。pH对酶活力的影响:pH小于5.0时随着pH值的增加,3种酶的活力均逐渐上升,当pH为5.0时,3种酶的活力均达到最大,当pH超过5.0时,3种酶的活力陡然下降(图 11-B)。
|
| 图 11 温度与pH值对酶促反应酶活力的影响 |
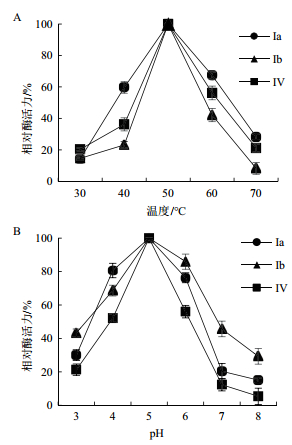
木聚糖酶Ⅰ a与CMC酶Ⅳ在30-50℃较稳定;而CMC酶Ⅰ b耐热性较差,当温度高于50℃时Ⅰ b残余酶活力快速下降(图 12-A)。Ⅰ b在pH4-6范围内稳定性较强,其酶活力在80%左右;当pH值高于6.0时,Ⅳ其残余酶活力快速下降,在pH值为8.0时,Ⅳ酶活力大约为15%。而Ⅰ a只在pH 5.0有较好的酶活力,当pH值高于或者低于5.0时,Ⅰ a酶活力损失较大(图 12-B)。
|
| 图 12 酶的热稳定性和pH稳定性 |
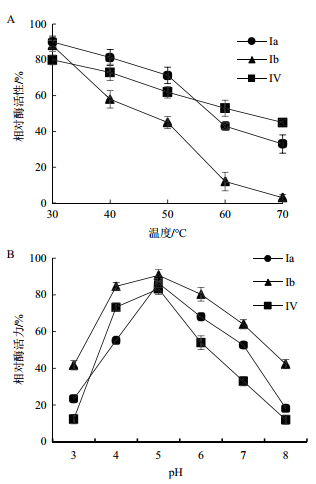
玉米芯粉经酸碱处理醇沉,获得大量的玉米芯木聚糖(图 13-A)。菌株YB分泌的木聚糖酶对玉米芯木聚糖水解产物薄层分析。在前0.5 h木聚糖被降解成为木糖和极少的木寡糖,当水解1 h时,产物中逐渐积累不同大小的木寡糖,随着水解时间的延长,产物中的木寡糖种类也不断的增加。到第4 h时,木聚糖被水解成了多种木寡糖(图 13-B)。
|
| A:从玉米芯中提取的木聚糖样品;B:M:X1=木糖、X2=木二糖、X3=木三糖(标准品X1、X2、X3的混合样品) 图 13 粗酶液降解木聚糖薄层色谱 |
研究发现自然界中存在多种木质纤维素酶的产酶菌,主要有细菌、放线菌和丝状真菌。其中真菌分泌的木质纤维素酶具有酶活高,酶系全,多为胞外酶利于分离提取等优点,广泛地用于工业生产。工业生产纤维素酶的主要真菌多为木霉属、青霉属、曲霉属等。在木质纤维素生物转化的研究中,研究发现木聚糖酶在纤维素酶降解纤维素过程中起协同作用,促进纤维素酶的水解效率,同时木聚糖酶降解半纤维素过程中生成的生物活性小分子化合物(木寡糖),能够提高动物的免疫力,降低疾病的发生[5]。因此,人们越来越关注于能够产生多种木质纤维素复合酶的新型微生物来降解木质纤维素。刘新育等[17]以斜卧青霉为出发菌,经紫外诱变获得了高产纤维素酶(19.71 IU/mL)和木聚糖酶(215.4 IU/mL)的菌株;Jampala等[18]对里氏木霉NCIM 1186同步生产纤维素酶和木聚糖酶发酵条件进行优化(培养周期为5 d,产纤维素酶3 055.65 U/L,产木聚糖酶444.94 U/L);Tian等[19]从15株真菌中筛选到一株能同步高产纤维素酶(28.81 U/g)和木聚糖酶(213 U/g)的黑曲霉菌株,吴萍[12]筛选到一株高产木聚糖酶菌株,其酶活力达到7 088.54 U/mL。倪大伟等[20]筛选到一株高产木聚糖酶的黑曲霉菌株,其酶活为12 664 U/mL。本次试验从荔枝林腐败落叶中筛选到一株能同步分泌纤维素酶和木聚糖酶的菌株,经形态学和分子生物学鉴定为Trichoderma virens,命名为Trichoderma virens YB。菌株YB利用玉米秸秆进行液体发酵,培养周期为3 d,其纤维素酶活达到313.53 U/mL,木聚糖酶活高达18 120.87 U/mL。可知菌株YB分泌木聚糖酶的能力较强,属于高产木质纤维素酶,具有生长快,培养周期短等优点,具有一定的应用前景。
碳源筛选结果发现,菌株YB以玉米秸秆为碳源时,两种酶活力均远高于其它碳源的酶活。麦皮、玉米芯、CMC-Na为碳源时产生的酶活性偏低,其可能的原是因麦皮中含有大量的淀粉和蛋白质,麦皮既作碳源又作氮源导致菌株YB快速进行营养生长,酶分泌量降低。玉米芯粉中含有的木聚糖含量高达35%[21]远高于玉米秸秆,一般微生物易于吸收葡萄糖,导致培养基中,木聚糖酶降解木聚糖产生的木糖在发酵液中积累,木糖的积累抑制了木聚糖酶的分泌。CMC-Na为碳源时,培养基经高温灭菌后,发酵液黏度较大,可能造成发酵液中的菌体缺氧,酶的分泌能力降低。
通过酶谱法可知,菌株YB可以分泌多种纤维素酶,在分离纯化过程中,只进行了内切葡聚糖甘酶和木聚糖酶的分离,并未对纤维素外切酶进行分离,最终分离出一种木聚糖酶(Ⅰ a)和两种CMC酶(Ⅰ b,Ⅳ)和,其分子量分别为44.5 kD、58.5 kD和22.8 kD;其中分离得到的CMC酶(Ⅰ b 58.5 kD,Ⅳ 22.8 kD)分子量与Zhou等[22]从绿色木霉t100-14突变株分离得到的CMC酶(EG Ⅰ 56.5 kD,EGШ 21 kD)大小相近。酶学性质研究发现,纤维素酶和木聚糖酶在pH5.0时稳定性最强,表明菌株YB分泌的为弱酸性的纤维素酶和木聚糖酶,可以广泛的运用于饲料生产、果汁和食醋的酿造。菌株YB能够利用廉价易得的玉米秸秆为碳源,能够同时分泌酶活性较高的纤维素酶和木聚糖酶,并能将玉米芯木聚糖降解为木糖和多种木寡糖,这对降低工业上生产木质纤维素酶、木寡糖的成本和提高饲料的营养价值有着重大的意义。本实验只进行了碳源的筛选和酶学性质的研究,并未对其具体的发酵培养条件进行优化,这将是我们下一步要展开的试验。
4 结论从荔枝林腐败落叶中筛选出一株能同步分泌高效纤维素酶和木聚糖酶的绿木霉菌株,命名为Trichoderma virens YB,其最佳产酶碳源为玉米秸秆,酶谱分析可知Trichoderma virens YB能够分泌高效木聚糖酶和多种纤维素酶组分。用DEAE Sepharose Fast Flow阴离子交换层析和Sephadex G-100凝胶层析分离纯化得到CMC酶Ⅰ b、Ⅳ和木聚糖酶Ⅰ a;纯化倍数分别为3.65、5.45和11.33倍。回收率分别为37.45%、10.09%和28.73%。比酶活分别为9.06 U/mg、13.53 U/mg和1595.93 U/mg。通过SDSPAGE检测,其分子量分别为58.5 kD、22.8 kD和44.5 kD。3种酶的最适酶促条件均为:pH 5.0,温度50℃。盐析木聚糖酶和CMC酶的最佳硫酸铵饱和度分别为50%和70%。菌株YB分泌的木聚糖酶,能将玉米芯木聚糖降解为木糖和多种木寡糖。
| [1] |
李洋, 高晓蓉, 张健. 草酸青霉菌生产纤维素酶的反应条件优化[J]. 生物技术通报, 2016, 32(2): 152-157. |
| [2] |
芦光新, 陈秀蓉, 王军邦, 等. 一株筛选自高寒草地木聚糖酶产生真菌的鉴定及酶学特性研究[J]. 生物技术通报, 2014(5): 162-169. |
| [3] |
李永丽, 刘占英, 张冬艳, 等. 稀土离子对绿色木霉产纤维素酶的影响[J]. 食品科技, 2017, 42(1): 40-44. |
| [4] |
Ding C, Li M, Hu Y. High-activity production of xylanase by Pichia stipitis :Purification, characterization, kinetic evaluation and xylooligosaccharides production[J]. International Journal of Biological Macromolecules, 2018, 117(1): 72-77. |
| [5] |
Ang SK, Mohamad SE, Yahya A, et al. Production of cellulases and xylanase by Aspergillus fumigatus SK1 using untreated oil palm trunk through solid state fermentation[J]. Process Biochemistry, 2013, 48(9): 1293-1302. |
| [6] |
于慧娟, 郭夏丽. 秸秆降解菌的筛选及其纤维素降解性能的研究[J]. 生物技术通报, 2019, 35(2): 58-63. |
| [7] |
刘起丽, 张建新, 徐瑞富, 等. 纤维素刚果红培养基筛选产纤维素酶菌株的影响因素研究[J]. 西北农业学报, 2007(5): 279-281. |
| [8] |
赵连娣, 孟顺利, 史兆国, 等. 绿色木霉液态发酵产纤维素酶条件的优化[J]. 浙江农业学报, 2015, 27(3): 442-447. |
| [9] |
蒋明星, 丁晓帆. 纤维素降解细菌的筛选及其酶活测定[J]. 中国农学通报, 2015, 31(36): 161-164. |
| [10] |
张秀英, 尹大川, 邓勋, 等. 一株绿木霉的rDNA ITS序列测定及其菌株的培养特性[J]. 安徽农业科学, 2013, 41(36): 13838-13839, 13854. |
| [11] |
王刚, 丛子添, 郭明珠, 等. 绿色木霉Fn10-1纤维素酶的分离纯化及酶学特性测定[J]. 湖北农业科学, 2014, 53(16): 3874-3876, 3881. |
| [12] |
吴萍, 史钧, 骆丙国. 真菌木聚糖酶产生菌的筛选及酶学性质研究[J]. 食品科学, 2009, 30(1): 159-163. |
| [13] |
李源涛.木霉来源纤维素酶的分离纯化及其酶学性质研118生物技术通报Biotechnology Bulletin 2020, Vol.36, No.2究[D].福州: 福州大学, 2013.
|
| [14] |
Lin C, Shen Z, Qin W. Characterization of xylanase and cellulase produced by a newly isolated Aspergillus fumigatus N2 and its efficient saccharification of barley straw[J]. Applied Biochemistry & Biotechnology, 2016, 182(2): 559-569. |
| [15] |
Ghosh A, Sutradhar S, Baishya D. Delineating thermophilic xylanase from Bacillus licheniformis DM5 towards its potential application in xylooligosaccharides production[J]. World Journal of Microbiology and Biotechnology, 2019, 35(2): 34. |
| [16] |
Rahmani N, Kahar P, Lisdiyanti P, et al. GH-10 and GH-11 Endo- 1, 4-β-xylanase enzymes from Kitasatospora sp. produce xylose and xylooligosaccharides from sugarcane bagasse with no xylose inhibition[J]. Bioresource Technology, 2019, 272(1): 315-325. |
| [17] |
刘新育, 靖梅贞, 宋安东, 等. 斜卧青霉纤维素酶和木聚糖酶高产菌株的选育[J]. 微生物学杂志, 2010, 30(3): 59-62. |
| [18] |
Jampala P, Tadikamalla S, Preethi M, et al. Concurrent production of cellulase and xylanase from Trichoderma reesei NCIM 1186 : enhancement of production by desirability-based multi-objective method[J]. 3 Biotech, 2017, 7(1): 14. |
| [19] |
Tian MM, Wai A, Guha TK, et al. Production of endoglucanase and xylanase using food waste by solid-state fermentation[J]. Waste and Biomass Valorization, 2018, 9: 2391-2398. |
| [20] |
倪大伟, 李瑞云, 白爱枝, 等. 黑曲霉木聚糖酶的同源表达及其高产木聚糖酶发酵条件的优化[J]. 食品与发酵工业, 2015, 41(4): 48-53. |
| [21] |
朱运平, 禇文丹, 李秀婷, 等. 一株产木聚糖酶放线菌的液体发酵条件优化及水解特性研究[J]. 食品科学, 2012, 33(21): 177-182. |
| [22] |
Zhou J, Wang YH, Chu J, et al. Identification and purification of the main components of cellulases from a mutant strain of Trichoderma viride T 100-14[J]. Bioresource Technology, 2008, 99(15): 6826-6833. |