2. 江南大学无锡医学院,无锡 214122
2. Wuxi School of Medicine, Jiangnan University, Wuxi 214122
光学纯环氧化物和邻位二醇具有较高的附加值,是合成一些农药、医药以及材料等精细化学品的重要手性砌块[1]。例如,(S)-环氧苯乙烷可以用来合成杀线虫剂[2],而(R)-苯乙二醇是液晶材料制造过程中重要的手性添加剂[3]。利用(R)-对氯环氧苯乙烷制备的一种神经保护剂(R)-依利罗地,较其S型对映体具有更强的疗效[4]。本研究中所涉及到的(R)-间硝基苯乙二醇(m-nitrophenyl-1,2-ethanediol,mNPED)则是α-羟基酸以及具有阿尔茨海默病疗效的β-分泌酶抑制剂的重要合成子[5-6]。
通过Jacobsen环氧化及Sharpless不对称双羟基化等传统化学合成法制备的手性环氧化物和邻位二醇,有时存在产物光学纯度和产率低的问题[7]。此外,在反应过程中通常需要使用有毒的高价重金属催化剂,给环境带来了严重的威胁[8]。近年来,生物制备法作为一种低成本且环境友好的补充或替代方案而备受关注[9],其符合国内外社会所倡导的“绿色工业”和“可持续发展”,以及国家“十三五”规划中关于“加快改善生态环境”的相关内容。
环氧水解酶(Epoxide hydrolase,EH)广泛存在于微生物与动、植物体内,能够立体选择性的催化廉价的外消旋(racemic,rac-)环氧化物发生开环水解,保留单一构型的环氧化物和/或生成邻位二醇[10]。但是,不同EH与环氧化物的反应组合往往表现出不同的立体选择性。根据这种差异性,可以将EH催化的不对称反应划分为动力学拆分和对映归一性水解两大类[11],前者的理论产率仅有50%,而后者可达100%[12]。目前,基于EH的归一性水解反应来制备手性邻位二醇的途径主要有:双酶协同催化法[13-14]、酶与化学酸串联催化法[15-16]及单酶催化法[17-18]。其中,仅利用单酶实现外消旋环氧化物的归一性转化被认为是一种理想的催化方法[19]。然而,这要求EH针对于目标环氧化物S与R两种对映体同时表现出高且互补的区域选择性,即区域选择性系数αS和βR均接近于100%[20]。因此,同拆分反应相比,归一性水解相关的报道则相对较少[21]。
本研究将菜豆来源的EH基因pveh2插入至冷休克表达载体,在大肠杆菌中实现酶的胞内表达。随后,以rac-间硝基环氧苯乙烷(m-nitrostyrene oxide,mNSO)为底物,利用工程菌E. coli/pveh2全细胞测定其EH活性和区域选择性。将水溶性有机试剂作为底物助溶剂,并依据助溶剂的种类与剂量对全细胞EH活性的影响,筛选出最适的缓冲液/助溶剂反应体系,显著提高了归一性水解中底物rac-mNSO的最高反应浓度。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和培养基E. coli JM109、Rosetta(DE3)以及含有重组质粒pET28a-pveh2的工程菌E. coli/pET28a-pveh2由实验室保藏;克隆质粒pUCm-T购自上海生工公司;表达质粒pCold Ⅱ购于TaKaRa公司;Luria-Bertani(LB)液体培养基:蛋白胨10 g/L,氯化钠10 g/L和酵母提取物5 g/L,pH 7.0。
1.1.2 试剂盒与工具酶柱式质粒提取试剂盒和DNA胶回收试剂盒均为康为世纪产品;限制性内切酶Nco Ⅰ、Nde Ⅰ和Sal Ⅰ,T4 DNA连接酶以及ExTaq DNA聚合酶均购自于TaKaRa公司。
1.2 方法 1.2.1 基因扩增以pET28a-pveh2作为PCR模板,pveh2-F(5′-CATATGGAATACATAGTACACAGAAC-3′,下划线为Nde Ⅰ的酶切位点)和pveh2-R(5′-GTCGACTCAGAACTTGTTGATAAAATC-3′,下划线为Sal Ⅰ的酶切位点)为上下游引物进行扩增反应:94℃预变性5 min;94℃变性30 s,50℃退火30 s,72℃延伸60 s,30个循环;72℃充分延伸10 min。PCR产物经1%琼脂糖凝胶电泳纯化后切胶回收目的基因pveh2,17℃与pUCm-T连接10 h,利用热激法转化E. coli JM109感受态细胞,最后经蓝白斑筛选、Nco Ⅰ单酶切验证和DNA测序,将结果正确的重组质粒命名为pUCm-T-pveh2。
1.2.2 基因表达使用Nde Ⅰ和Sal Ⅰ分别处理pUCm-T-pveh2和pCold Ⅱ,并混匀酶切产物进行连接反应,用连接液转化E. coli Rosetta(DE3)感受态细胞,经过氨苄青霉素抗性平板筛选与DNA测序,获得重组工程菌E. coli Rosetta(DE3)/pCold Ⅱ-pveh2,即E. coli/pveh2。将E. coli/pveh2的单菌落接种于含有0.1 mg/mL氨苄青霉素的LB培养基中,于37℃、220 r/min培养10 h,之后按2%(V/V)的接种量转接至新鲜LB培养基内,同样于37℃振荡培养,并在OD600达到0.8-1.0时加入异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)至其终浓度为0.2 mmol/L,在15℃下诱导24 h后低温离心收集菌体。湿菌体再经真空冷冻干燥处理,获得的干细胞粉块用于后续的生物催化实验和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.2.3 细胞EH活性的测定用适量的Na2HPO4-NaH2PO4缓冲液(50 mmol/L,pH7.0)重新悬浮干细胞,配制成均匀的细胞悬浮液,从中量取500 μL置于25℃下预热5 min。然后加入rac-mNSO(终浓度为5 mmol/L)开始反应,10 min后向体系中加入1.0 mL乙酸乙酯(含有约8 mmol/L正己醇作为内标物质)进行萃取。上层有机相经无水硫酸镁脱水后,借助搭载有Chiralcel® OD-H手性色谱柱(4.6 mm Φ×250 mm L)与Waters 2489紫外检测器的e2695高效液相色谱(High performance liquid chromatography,HPLC)系统进行检测和分析。检测条件:流动相为正己烷:异丙醇= 9:1(V/V),流速0.8 mL/min,柱温30℃,检测波长254 nm。HPLC用于检测样品中底物rac-mNSO、水解产物(R)-与(S)-mNPED的含量,保留时间分别为9.65、16.24和18.46 min左右。细胞的EH活性则定义为每分钟催化水解1.0 μmol rac-mNSO所需要的细胞量。
1.2.4 区域选择性系数的测定向2.0 mL适当稀释的细胞悬浮液中加入rac-mNSO至其终浓度达到5 mmol/L,于25℃下振荡反应2 h,期间从反应混合物中定时取样100 μL,然后按照1.2.3所述方法处理样品。样品的分析采用气相色谱(Gas chromatography,GC)仪2010 Plus(日本岛津),配备有手性毛细色谱柱CP-ChiralSil-DEX CB(安捷伦)。检测条件:检测器和气化室温度250℃,载气为氮气,吹扫流量为3 mL/min,分流比为1:40。检测期间柱温由100℃以5℃/min的速率上升至190℃。GC用于检测底物rac-mNSO中R与S两种构型的含量,其保留时间分别为14.01和15.05 min左右。最后,各构型产物的含量由HPLC检测。
用来表征底物和产物光学纯度的对映体过剩率(enantiomer excess,ee)分别为:ees =[(R-S)/(R+S)]×100%;eep =[(Rd-Sd)/(Rd+Sd)]×100%。其中,R、S、Rd和Sd分别代表(R)-、(S)-mNSO和(R)-、(S)-mNPED的浓度。根据公式eep = αS+βR-1+[(βR-αS)×ees×(1-c)]· c-1,以ees×(1-c)]· c-1为横坐标,eep为纵坐标通过线性回归法推导出区域选择性系数αS与βR值[18],c代表底物rac-mNSO的转化率,为被水解消耗的rac-mNSO与初始量的百分比。
1.2.5 缓冲液体系中的归一性水解反应向4组含有40 mg/mL E. coli/pveh2干细胞的20 mL磷酸盐缓冲液中分别加入不同终浓度(5、10、15和20 mmol/L)的rac-mNSO,于25℃反应12 h,期间定时取样,按照1.2.3所述处理样品,进行HPLC检测,计算不同时间点rac-mNSO的c值。
1.2.6 助溶剂种类与剂量的筛选选取5种常见的水溶性有机试剂作为底物助溶剂:甲醇、二甲基亚砜(Dimethyl sulfoxide,DMSO)、二甲基甲酰胺(N,N-dimethylformamide,DMF)、异丙醇和丙三醇。利用磷酸盐缓冲液分别配制含有2%、5%和8%(V/V)上述助溶剂的细胞悬浮液。按照1.2.3所述方法测量细胞的EH活性,对照组不添加任何助溶剂。
1.2.7 缓冲液/助溶剂体系中的归一性水解反应在确定最适助溶剂与剂量后,构建4组含有40 mg/mL干细胞的20 mL缓冲液/助溶剂体系,将底物rac-mNSO的浓度分别提高至20、30、40和50 mmol/L,于25℃反应12 h,按照1.2.3所述处理样品,进行HPLC分析。产物(R)-mNPED的产率=反应终止时产物浓度/底物初始浓度×100%。
2 结果 2.1 PvEH2基因的生物信息学分析根据pveh2的测序结果,在GenBank数据库中查找到编码PvEH2的基因组DNA序列(图 1),其位于菜豆(品种G19833)第6号染色体上,包含两段长度分别为465 bp和239 bp的内含子以及951 bp的开放阅读框,共编码316个氨基酸。利用BDGP启动子在线分析工具Promoter预测的转录起始位点是位于起始密码子ATG中腺嘌呤上游143 bp处的鸟嘌呤。使用程序PlantCARE预测在转录起始位点-30和-135处分别存在真核生物典型的TATA-box(TATAAAT)和CAAT-box(CAATTA)序列。此外,PvEH2基因的启动子中还存在与诱导作用相关的元件ARE、GCN4和circadian,在-617位存在增强子(TA-rich region),以及sp1、GT1和GAG等多个光感应调控元件。以上预测结果表明该基因的转录水平可能受植物体外环境胁迫及光信号诱导的影响。

|
| 图 1 PvEH2基因组DNA序列和氨基酸序列 |
以rac-mNSO为底物测得E. coli/pveh2的EH活性为15.4 U/g干细胞,较E. coli/pET28a-pveh2的8.1 U/g干细胞有了较为显著的提高,而经IPTG诱导后的E. coli/pCold Ⅱ(含有pCold Ⅱ空质粒的E. coli转化子)未检测出EH活性。SDS-PAGE结果(图 2)显示,相较于E. coli/pCold Ⅱ,E. coli/pET28a-pveh2与E. coli/pveh2均在约38.1 kD处存在明显的特异蛋白条带,与预测的重组PvEH2的理论值37 898 Da基本一致。此外,E. coli/pveh2产酶活性的升高可能与PvEH2表达量的提高有关(泳道2和3)。

|
| M:蛋白质Marker; 1-3:分别为经IPTG诱导的E. coli/pCold Ⅱ、E. coli/pET28a-pveh2与E. coli/pveh2的细胞裂解液 图 2 重组E. coli转化子的SDS-PAGE分析 |
由线性回归分析推导出水解反应的区域选择性系数αS和βR分别为90.3%和96.4%,即PvEH2以90.3%的概率进攻(S)-mNSO含氧三元环上的α碳原子,使构型在反应前后发生翻转,生成(R)-mNPED。相反地,针对(R)-mNSO的情况,PvEH2则以96.4%的概率进攻β碳原子,使构型得以保持,同样生成(R)-mNPED(图 3)。说明E. coli/pveh2或PvEH2拥有归一性水解rac-mNSO的优良特性。

|
| 图 3 E. coli/pveh2针对于(R)-和(S)-mNSO的区域选择性 |
不同rac-mNSO浓度下的转化率c随反应进程的变化趋势见图 4。当反应进行到6 h时,10 mmol/L的rac-mNSO几乎完全水解,即c值在95.0%以上,生成82.4% eep的(R)-mNPED。然而,当底物浓度继续提高至15和20 mmol/L时,即使反应延长至12 h,rac-mNSO也不能被完全地转化。因此,需要筛选合适的水解体系。

|
| 图 4 缓冲液体系中不同浓度底物转化率随时间的变化 |
测定E. coli/pveh2在不同缓冲液/助溶剂体系中的EH活性,以对照组的相对活性作为100%,结果如图 5所示。总体上,按照E. coli/pveh2的EH活性由高到低依次为含有丙三醇、异丙醇、DMSO、DMF和甲醇的缓冲液。其中,5%和8%(V/V)的丙三醇均使E. coli/pveh2的EH活性较对照组略微提高8.2%和8.9%。综合考虑后选择含有5%(V/V)丙三醇的缓冲液作为反应体系。
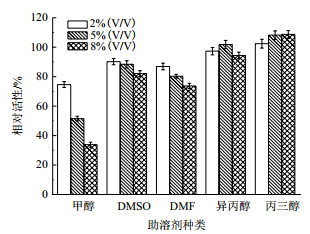
|
| 图 5 底物助溶剂对E. coli/pveh2全细胞EH活性的影响 |
基于上述筛选的结果,构建含有5%(V/V)丙三醇的缓冲液反应体系,并研究了20-50 mmol/L rac-mNSO的水解情况(表 1)。当反应进行到12 h时,40 mmol/L及以下浓度底物的c值超过95.0%,且(R)-mNPED的产率均超过90.0%。但是,当rac-mNSO继续提升至50 mmol/L时,高细胞浓度(40 mg干细胞/mL约相当于250 mg湿细胞/mL)的E. coli/pveh2无法有效将其水解。因此,在缓冲液/丙三醇体系内,最高底物浓度由原先单缓冲液体系的10 mmol/L提高至40 mmol/L。另外,底物在归一性水解反应进程中的代表性HPLC色谱图如图 6所示。

|
| 图 6 底物rac-mNSO(40 mmol/L)的c值分别达到0%(a),45.0%(b)和95.2%(c)时的HPLC谱图 |
绝大多数植物来源的EH属于α/β折叠型水解酶超家族[22],尽管在氨基酸组成和三维结构等方面存在一定的相似性,但是这些植物EH的底物谱各具特色,其中也不乏拥有良好立体选择性的野生型酶与环氧化物底物的反应组合。例如,赤豆EH与苯基缩水甘油醚[8]、绿豆EH与对硝基环氧苯乙烷[17]以及马铃薯EH与环氧苯乙烷[23]等。
大多数已报道的组合是关于环氧化物的拆分反应,而借助于单酶实现特定环氧化物归一性水解的案例则相对较少[21]。就rac-mNSO而言,利用经过突变改造后的菜豆PvEH1进行10 mmol/L底物的反应,也仅使(R)-mNPED的eep从14.7%提升至52.3%[12]。使用同样是菜豆来源的野生型PvEH2作为催化剂,所得二醇的eep可超过80.0%,这主要归因于该酶针对S和R型底物高且互补的区域选择性(αS=90.3%,βR=96.4%),均好于PvEH3(αS=64.4%,βR=71.5%)[20]、mbEHA(αS=82.0%,βR=93.0%)[24]和VrEH3(αS=74.2%,βR=89.0%)[25]。迄今为止,也仅有很少的借助于生物法制备(R)-mNPED的报道。Jin等[26]利用100 mg/mL表达有EH的Aspergillus niger湿细胞水解12.1 mmol/L rac-mNSO,但是(R)-mNPED的产率和eep仅有48%和66%。本研究采用全细胞代替其破碎液或纯酶作为催化剂,主要是由于前者容易获得且一般情况下比后者稳定[27-28]。目前已有很多使用表达有EH的全细胞来转化环氧化物的报道[13, 25, 29]。此外,由实验中的对照组可知,宿主E.coli/Rosetta(DE3)中未检测到rac-mNSO的水解活性,结果与先前报道相一致[30-31]。
由EH介导的不对称水解被认为是一种颇具研究与应用价值的生物催化途径,但是目前能够实现大规模催化的反应却很少[32],其主要问题在于环氧化物底物在水中的溶解度低以及底物、产物对EH的抑制作用等[33-35]。为了克服上述瓶颈,一些有机试剂被添加到水相反应体系内,作为底物的助溶剂。憎水性的有机试剂与水相形成双相体系[36-37],而一定量的亲水性有机试剂则与水互溶保持为单相体系[38-39]。在双相体系内,有机试剂分子和相界面的毒性容易使酶失活[40]。向反应体系中加入适量的亲水性有机试剂是一种较为温和而有效的策略。本研究基于E. coli/pveh2的催化活性,从预先构建好的15种含有不同种类和剂量亲水性有机试剂的缓冲液中,筛选到最适的反应体系为缓冲液/5%(V/V)丙三醇。这可能是由于体系内的丙三醇一方面起到了助溶底物的作用;另一方面增加了酶的稳定性。在相同的反应条件下,将rac-mNSO的最高反应浓度较原先的缓冲液体系提高了3倍。
4 结论PvEH2的基因来源于菜豆中,其转录水平可能与植物体外环境条件的诱导有关。SDS-PAGE与全细胞EH的测定结果表明,冷休克表达体系能够提高PvEH2在E. coli中的表达量,进而提高了重组工程菌的EH活性。区域选择性分析显示,E. coli/pveh2或PvEH2针对于R和S两种构型的底物同时表现出高且互补的区域选择性,结合底物的水解结果,证实了E. coli/pveh2具有很好的对映归一性水解rac-mNSO的能力。针对磷酸缓冲液中底物浓度低的问题,本研究构建并优化了一种缓冲液/有机助溶剂体系,显著的提高了底物的最高反应浓度。
| [1] |
de Oliveira GS, Adriani PP, et al. Epoxide hydrolase of Trichoderma reesei:biochemical properties and conformational characterization[J]. Int J Biol Macromol, 2016, 89(8): 569-574. |
| [2] |
Wu SK, Li AT, Chin YS, et al. Enantioselective hydrolysis of racemic and meso-epoxides with recombinant Escherichia coli expressing epoxide hydrolase from Sphingomonas sp. HXN-200:preparation of epoxides and vicinal diols in high ee and high concentration[J]. ACS Catal, 2013, 3(4): 752-759. DOI:10.1021/cs300804v |
| [3] |
Cao L, Lee J T, et al. Enantioconvergent production of(R)-1-phenyl-1, 2-ethanediol from styrene oxide by combining the Solanum tuberosum and an evolved Agrobacterium radiobacter AD1 epoxide hydrolases[J]. Biotechnol Bioeng, 2006, 94(3): 522-529. DOI:10.1002/bit.20860 |
| [4] |
Manoj KM, Archelas A, et al. Microbiological transformations. Part 45:A green chemistry preparative scale synthesis of enantiopure building blocks of Eliprodil:elaboration of a high substrate concentration epoxide hydrolase-catalyzed hydrolytic kinetic resolution process[J]. Tetrahedron, 2001, 57(4): 695-701. DOI:10.1016/S0040-4020(00)01032-2 |
| [5] |
Chinthapally K, et al. A chemoselective oxidation of monosubstituted ethylene glycol:facile synthesis of optically active α-hydroxy acids[J]. Org Biomol Chem, 2014, 12(25): 4305-4309. DOI:10.1039/C4OB00601A |
| [6] |
Butini S, Gabellieri E, Brindisi M, et al. A stereoselective approach to peptidomimetic BACE1 inhibitors[J]. Eur J Med Chem, 2013, 70(12): 233-247. |
| [7] |
Kotik M, Archelas A, Wohlgemuth R. Epoxide hydrolases and their application in organic synthesis[J]. Curr Org Chem, 2012, 16(4): 451-482. DOI:10.2174/138527212799499840 |
| [8] |
Kamble MP, et al. Kinetic resolution of(R, S)phenyl glycidyl ether by red mung beans(Vigna angularis)epoxide hydrolases[J]. Biocatal Agric Biotechnol, 2017, 12(10): 260-265. |
| [9] |
Li FL, Zheng YC, Li H, et al. Preparing β-blocker(R)-Nifenalol based on enantioconvergent synthesis of(R)-p-nitrophenylglycols in continuous packed bed reactor with epoxide hydrolase[J]. Tetrahedron, 2019, 75(12): 1706-1710. DOI:10.1016/j.tet.2019.01.034 |
| [10] |
Woo JH, Kang KM, Kwon TH, et al. Isolation, identification and characterization of marine bacteria exhibiting complementary enantioselective epoxide hydrolase activity for preparing chiral chlorinated styrene oxide derivatives[J]. J Ind Eng Chem, 2015, 28(8): 225-228. |
| [11] |
Bala N, Chimni SS. Recent developments in the asymmetric hydrolytic ring opening of epoxides catalysed by microbial epoxide hydrolase[J]. Tetrahedron:Asymmetry, 2010, 21(24): 2879-2898. DOI:10.1016/j.tetasy.2010.11.013 |
| [12] |
Ye HH, Hu D, Shi XL, et al. Directed modification of a novel epoxide hydrolase from Phaseolus vulgaris to improve its enantioconvergence towards styrene epoxides[J]. Catal Commun, 2016, 87(12): 32-35. |
| [13] |
Wang R, Hu D, Zong XC, et al. Enantioconvergent hydrolysis of racemic styrene oxide at high concentration by a pair of novel epoxide hydrolases into(R)-phenyl-1, 2-ethanediol[J]. Biotechnol Lett, 2017, 39(12): 1917-1923. DOI:10.1007/s10529-017-2433-z |
| [14] |
Lin S, Horsman GP, Shen B. Characterization of the epoxide hydrolase NcsF2 from the neocarzinostatin biosynthetic gene cluster[J]. Org Lett, 2010, 12(17): 3816-3819. DOI:10.1021/ol101473t |
| [15] |
Wu YW, Kong XD, Zhu QQ, et al. Chemoenzymatic enantioconvergent hydrolysis of p-nitrostyrene oxide into(R)-p-nitrophenyl glycol by a newly cloned epoxide hydrolase VrEH2 from Vigna radiate[J]. Catal Commun, 2015, 58(1): 16-20. |
| [16] |
Simeó Y, Faber K. Selectivity enhancement of enantio-and stereocomplementary epoxide hydrolases and chemoenzymatic deracemization of(±)-2-methylglycidyl benzyl ether[J]. Tetrahedron:Asymmetry, 2006, 17(3): 402-409. DOI:10.1016/j.tetasy.2005.12.018 |
| [17] |
Zhu QQ, He WH, Kong XD, et al. Heterologous overexpression of Vigna radiata epoxide hydrolase in Escherichia coli and its catalytic performance in enantioconvergent hydrolysis of p-nitrostyrene oxide into(R)-p-nitrophenyl glycol[J]. Appl Microbiol Biotechnol, 2014, 98(1): 207-218. |
| [18] |
Kotik M, Štěpánek V, et al. Access to enantiopure aromatic epox-ides and diols using epoxide hydrolases derived from total biofilter DNA[J]. J Mol Catal B:Enzym, 2010, 65(1): 41-48. |
| [19] |
Li C, Zhao J, et al. Multiple site-directed mutagenesis of a Phaseolus vulgaris epoxide hydrolase to improve its catalytic performance towards p-chlorostyrene oxide based on the computer-aided re-design[J]. Int J Biol Macromol, 2019, 121(1): 326-332. |
| [20] |
王瑞, 许耀辉, 等. 环氧化物水解酶PvEH3的表达及手性邻二醇的合成[J]. 化工进展, 2018, 37(5): 1933-1939. |
| [21] |
叶慧华, 胡蝶, 李闯, 等. 新型菜豆环氧化物水解酶的异源表达及对映归一性催化特性[J]. 中国生物工程杂志, 2016, 36(10): 21-27. |
| [22] |
Holmquist M. Alpha/beta-hydrolase fold enzymes:structure, functions and mechanism[J]. Curr Protein Pept Sc, 2000, 1(2): 209-235. DOI:10.2174/1389203003381405 |
| [23] |
Monterde MI, et al. Enzymatic transformations. Part 58:enantioconvergent biohydrolysis of styrene oxide derivatives catalysed by the Solanum tuberosum epoxide hydrolase[J]. Tetrahedron:Asymmetry, 2004, 15(18): 2801-2805. DOI:10.1016/j.tetasy.2004.06.032 |
| [24] |
Xu W, Xu JH, Pan J, et al. Enantioconvergent hydrolysis of styrene epoxides by newly discovered epoxide hydrolases in mung bean[J]. Org Lett, 2006, 8(8): 1737-1740. DOI:10.1021/ol060407u |
| [25] |
Hu D, Tang CD, Li C, et al. Stereoselective hydrolysis of epoxides by reVrEH3, a novel Vigna radiata epoxide hydrolase with high enantioselectivity or high and complementary regioselectivity[J]. J Agric Food Chem, 2017, 65(45): 9861-9870. DOI:10.1021/acs.jafc.7b03804 |
| [26] |
Jin H, Li ZY, Dong XW. Enantioselective hydrolysis of various substituted styrene oxides with Aspergillus niger CGMCC 0496[J]. Org Biomol Chem, 2004, 2(3): 408-414. DOI:10.1039/b312469j |
| [27] |
Lee EY, Shuler ML. Molecular engineering of epoxide hydrolase and its application to asymmetric and enantioconvergent hydrolysis[J]. Biotechnol Bioeng, 2007, 98(2): 318-327. DOI:10.1002/bit.21444 |
| [28] |
Solares LF, Mateo C. Improvement of the epoxide hydrolase properties for the enantioselective hydrolysis of epoxides[J]. Curr Org Chem, 2013, 17(7): 744-755. DOI:10.2174/1385272811317070008 |
| [29] |
Liang YX, Jiao S, Wang MM, et al. Overexpression of epoxide hydrolase in Rhodococcus ruber with high robustness for the synthesis of chiral epichorohydrin[J]. Process Biochem, 2019, 79(4): 49-56. |
| [30] |
Hu D, Tang CD, Yang B, et al. Expression of a novel epoxide hydrolase of Aspergillus usamii E001 in Escherichia coli and its performance in resolution of racemic styrene oxide[J]. J Ind Microbiol Biotechnol, 2015, 42(5): 671-680. DOI:10.1007/s10295-015-1604-y |
| [31] |
石小玲, 阚婷婷, 李闯, 等. 菜豆环氧化物水解酶的表达及其催化特性的研究[J]. 微生物学通报, 2018, 45(4): 797-804. |
| [32] |
Saini P, Sareen D. An overview on the enhancement of enantiosel-ectivity and stability of microbial epoxide hydrolases[J]. Mol Biotechnol, 2017, 59(2): 98-116. |
| [33] |
Chen WJ, Lou WY, Yu CY, et al. Use of hydrophilic ionic liquids in a two-phase system to improve Mung bean epoxide hydrolases-mediated asymmetric hydrolysis of styrene oxide[J]. J Biotechnol, 2012, 162(2): 183-190. |
| [34] |
Li C, Hu BC, Hu D, et al. Stereoselective ring-opening of styrene oxide at elevated concentration by Phaseolus vulgaris epoxide hydrolase, PvEH2, in the organic/aqueous biphasic system[J]. Catal Commun, 2019, 123(4): 1-5. |
| [35] |
Gao PF, Wu SK, Prashant P, et al. Enhancing productivity for cascade biotransformation of styrene to(S)-vicinal diol with biphasic system in hollow fiber membrane bioreactor[J]. Appl Microbiol Biot, 2017, 101(5): 1857-1868. DOI:10.1007/s00253-016-7954-1 |
| [36] |
Hu D, Wang R, Shi XL, et al. Kinetic resolution of racemic styrene oxide at a high concentration by recombinant Aspergillus usamii epoxide hydrolase in an n-hexanol/buffer biphasic system[J]. J Biotechnol, 2016, 236(10): 152-158. |
| [37] |
Gong PF, Xu JH. Bio-resolution of a chiral epoxide using whole cells of Bacillus megaterium ECU1001 in a biphasic system[J]. Enzyme Microb Tech, 2005, 36(2): 252-257. |
| [38] |
Yoo SS, Park S, Lee EY. Enantioselective resolution of racemic styrene oxide at high concentration using recombinant Pichia pastoris expressing epoxide hydrolase of Rhodotorula glutinis in the presence of surfactant and glycerol[J]. Biotechnol Lett, 2008, 30(10): 1807-1810. DOI:10.1007/s10529-008-9762-x |
| [39] |
Kim HS, Lee JH, Park S, et al. Biocatalytic preparation of chiral epichlorohydrins using recombinant Pichia pastoris expressing epoxide hydrolase of Rhodotorula glutinis[J]. Biotechnol Bioprooc E, 2004, 9(1): 62-64. DOI:10.1007/BF02949324 |
| [40] |
Zou SP, Zheng YG, Du EH, et al. Enhancement of(S)-2, 3-dichloro-1-propanol production by recombinant whole-cell biocatalyst in n-heptane-aqueous biphasic system[J]. J Biotechnol, 2014, 188(10): 42-47. |





