落叶松锈迷孔菌(Porodaedalea laricis(Jacz. ex Pilát)Niemelä),隶属于担子菌门(Basidiomycota),伞菌纲(Agaricomycetes),锈革孔菌目(Hymenoch-aetales),锈革孔菌科(Hymenochaetaceae),锈迷孔菌属(Porodaedalea)[1-3],是一种药用真菌[4-5],同时也是白腐真菌[3, 6]。其能够分解枯枝倒木,加速生态系统中物质元素的循环,促进森林树木的天然更新,参与改变森林组分及演替路径,同时给野生动植物提供适宜的营养物质,并与其他生物相互作用,共同维系着生态系统的动态平衡[7]。
之所以能够在森林生态系统中扮演着重要的氧化还原角色,主要是由于P. laricis可分泌多种木质素降解酶系,如木素过氧化物酶(Lignin peroxidase,LiP)、锰过氧化物酶(Manganese peroxidase,MnP)和漆酶(Laccase)等[8]。其中,漆酶(EC 1.10.3.2)是一种多铜氧化酶,可催化分子氧的4个电子还原成水,并伴随有4个活性底物自由基的形成,进而导致解聚、聚合、互变异构、氧化裂解、氧化、脱羧等多个非酶促反应的发生[9-12]。基于上述催化机理,漆酶可作用的底物十分广泛,包括苯酚、双酚、甲氧基类、甲基类、羟基类和氯酚化合物、取代基苯和苯甲酸、苯丙脂类、芳香类和脂肪胺、苯硫醇、多芳香族碳氢化合物、多酚类化合物(抗坏血酸、赖氨酸和一些无机离子)等[13-15]。据此,漆酶由于具有广泛的底物特异性,稳定性高,但对辅因子和环境条件要求低,因而具有非常重要的使用价值,可作为多种工艺过程中有效的生物催化剂:纺织和化妆品行业中对于染料和颜料的降解和修饰;能源领域;生物合成具有新性质的不同药物,如生物聚合物、抗氧化剂、抗癌药物、抗生素、类固醇和其他重要化合物等;污染物降解;食品加工;结合纳米技术制造生物传感器以检测多种酚类化合物、氧分子、叠氮化物、吗啡、可待因、儿茶酚胺和植物类黄酮等[15-29]。
本研究通过液体发酵培养的方式,利用响应面设计优化了P. laricis产胞外漆酶的液体培养基,并对其染料脱色能力进行了分析,以期为充分挖掘和利用该菌资源奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 供试菌株P. laricis菌株Dai 18917,采自内蒙古自治区呼伦贝尔市根河市落叶松(Larix sp.)活树上,经分离纯化获得,现保藏于北京林业大学。
1.1.2 试剂琼脂、蛋白胨、MgSO4·7H2O、MnSO4·H2O、CaCl2·2H2O、酒石酸铵、琥珀酸钠、吐温80、维生素B1、2,2'-连氮-双(3-乙基苯并噻唑-6-磺酸)(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)购自Sigma试剂公司(美国);其他试剂为分析纯。
1.1.3 培养基固体培养基:去皮马铃薯300.0 g/L,蛋白胨5.0 g/L,葡萄糖20.0 g/L,琼脂20.0 g/L,KH2PO4 1.0 g/L,MgSO4·7H2O 0.5 g/L,pH自然,1×105 Pa高压灭菌30 min,待指温可触时加入终浓度为0.01 g/L已过滤除菌的维生素B1,充分混匀备用。
基础液体培养基:去皮马铃薯300.0 g/L,蛋白胨5.0 g/L,葡萄糖20.0 g/L,KH2PO4 1.0 g/L,MgSO4·7H2O 0.5 g/L,pH自然,1×105 Pa高压灭菌30 min,待指温可触时加入终浓度为0.01 g/L已过滤除菌的维生素B1,充分混匀备用。
产漆酶液体培养基:去皮马铃薯300.0 g/L,蛋白胨5.0 g/L,葡萄糖20.0 g/L,KH2PO4 1.0 g/L,MgSO4·7H2O 0.5 g/L,MnSO4·H2O 0.15 g/L,CaCl2·2H2O 0.1 g/L,酒石酸铵2.0 g/L,琥珀酸钠1.5 g/L,吐温80 1.5 mL/L,玉米芯25.0 g/L,pH自然,1×105 Pa高压灭菌30 min,待指温可触时加入终浓度为0.01 g/L已过滤除菌的维生素B1,充分混匀备用。
1.2 方法 1.2.1 活化及培养于固体平板培养基上活化,28℃恒温培养箱培养10 d备用。
1.2.2 种子发酵及液体培养取250 mL三角瓶分装100 mL基础液体培养基,接种5个直径1 cm菌饼,于恒温摇床28℃、150 r/min振荡培养9-10 d。内切式匀浆机以5 000 r/min、1 min将种子发酵菌液制成悬液,充分振荡,以10.0%(V/V)接种量加入含100 mL产漆酶液体培养基的250 mL三角瓶中,于恒温摇床28℃、150 r/min振荡培养,设3个重复。
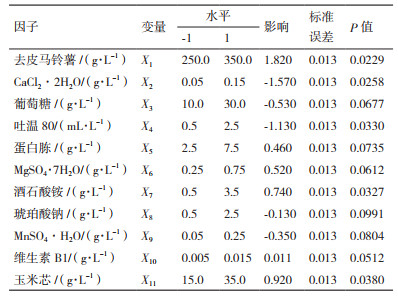
1.2.3 响应面设计优化产漆酶液体培养基 1.2.3.1 Plackett-Burman设计选择对P. laricis产胞外漆酶能力有影响的11个因子为变量,即去皮马铃薯(X1)、CaCl2·2H2O(X2)、葡萄糖(X3)、吐温80(X4)、蛋白胨(X5)、MgSO4·7H2O(X6)、酒石酸铵(X7)、琥珀酸钠(X8)、MnSO4·H2O(X9)、维生素B1(X10)和玉米芯(X11),响应值为胞外漆酶活性,采用Design-Expert 10.0软件进行试验设计和数据分析。每个因子取高(+1)、低(-1)两个水平。试验设计12,重复3次。
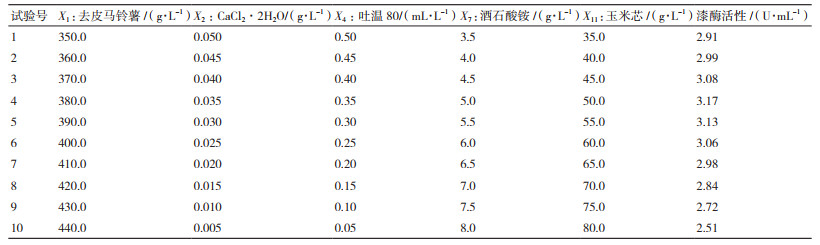
1.2.3.2 最陡爬坡设计通过Plackett-Burman设计试验结果中各个显著因子影响效应的大小设定步长及变化方向,寻找峰值,快速逼近最佳响应区域。
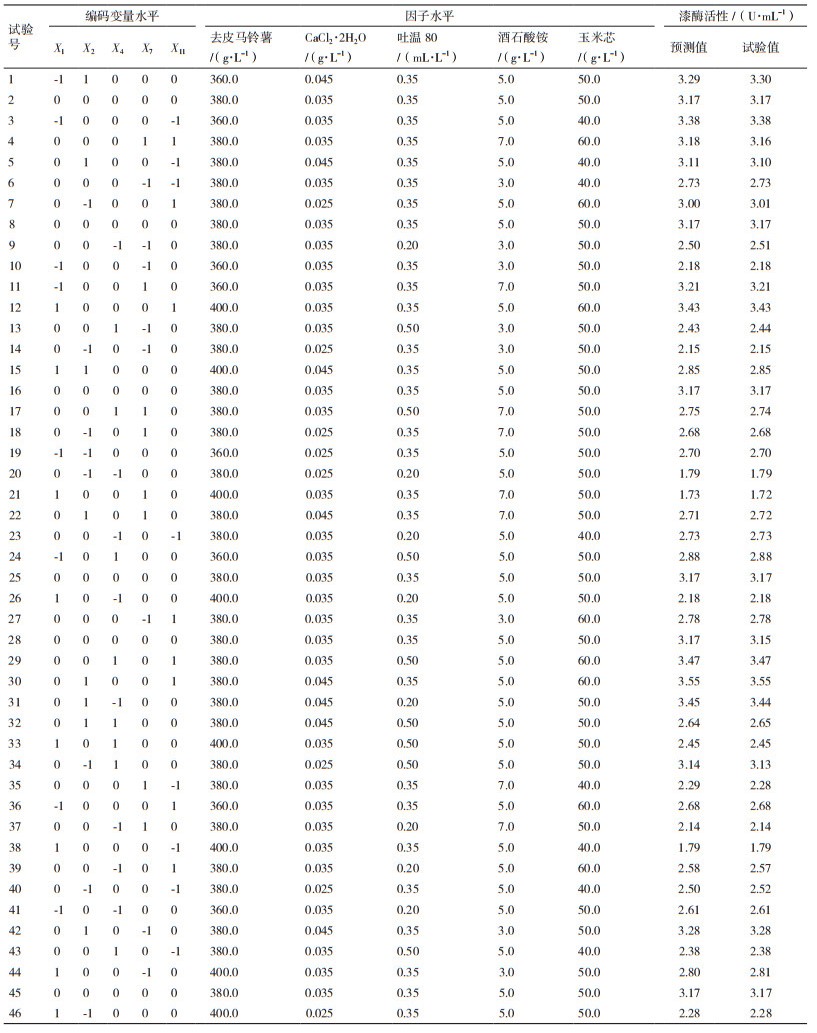
1.2.3.3 Box-Behnken设计通过最陡爬坡设计结果,将漆酶活性最高的一组数据作为Box-Behnken设计的中心点,采用Design-Expert 10.0软件进行优化分析,设计五因子二水平试验。
1.2.3 漆酶提取将整瓶培养物抽滤,所得发酵液经12 000 r/min离心20 min,上清液用于测定漆酶活性。
1.2.4 漆酶活性测定漆酶活性测定参照相关文献[17, 30]。同等条件下分别以去离子水替代上清液、ABTS的反应体系设为空白及对照。定义25℃、1 min内催化氧化1 μmol ABTS所需的酶量为1个漆酶活力单位(U),已知420 nm处ABTS摩尔消光系数ε420 = 3.6×104 L/(mol·cm)。
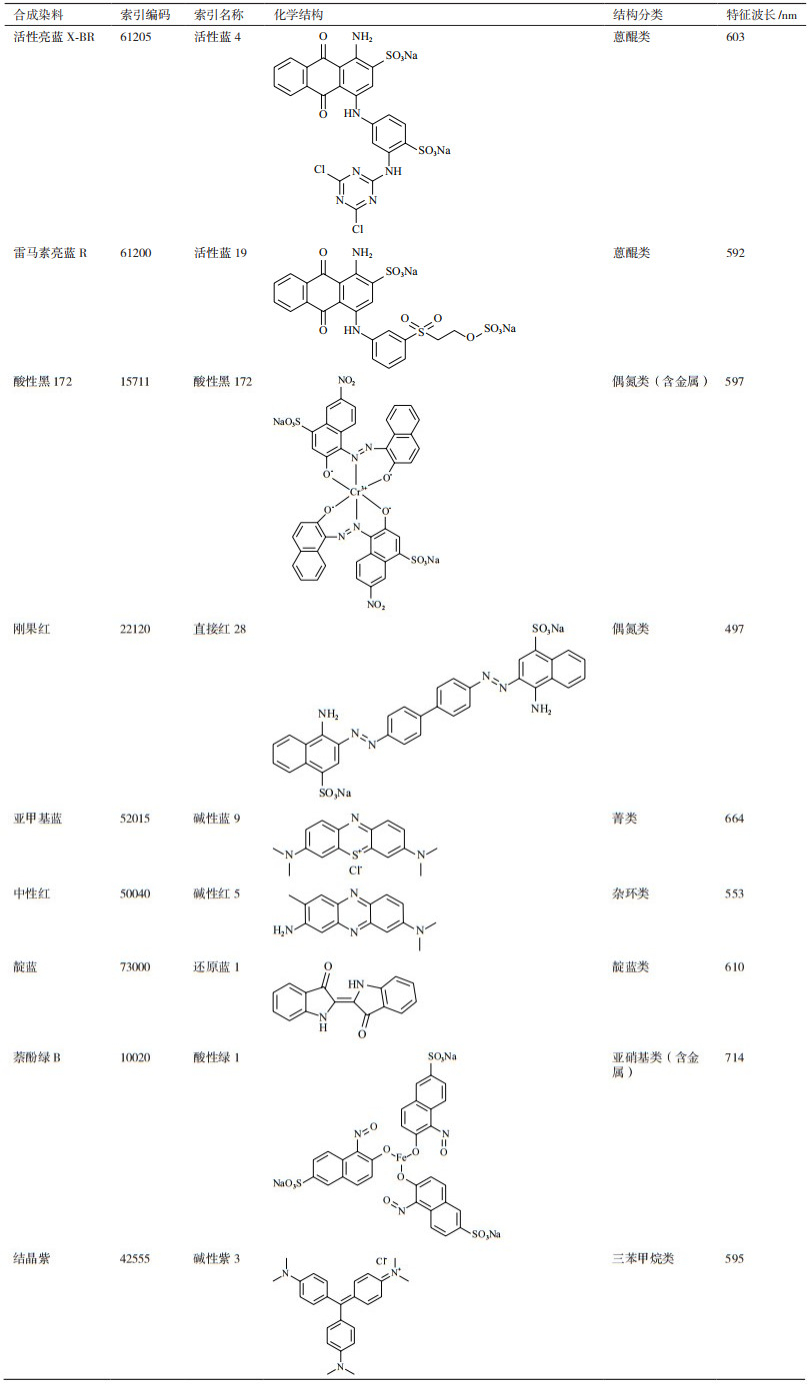
1.2.5 漆酶对合成染料的脱色表 1列出了供试合成染料及其颜色索引编码、索引名称、化学结构、结构类别及特征波长等详细信息。使用时,将合成染料固体粉末配制成浓度为50.0 mg/L的水溶液,经0.22 μm孔径的可换滤膜过滤除菌后即用。共10.0 mL脱色体系中含有50.0 mg/L染料(活性亮蓝X-BR、雷马素亮蓝R、酸性黑172、刚果红、亚甲基蓝、中性红、靛蓝、萘酚绿B和结晶紫)、柠檬酸-磷酸盐缓冲液(pH 5.0)和1.0 U/mL粗酶液,于恒温摇床50℃、150 r/min振荡反应168 h,期间测定反应液吸光值A的变化。设3个重复,求平均值。以同等条件下未添加酶液及未添加染料的体系设为空白及对照。根据下列公式计算P. laricis胞外漆酶对合成染料的脱色率:
染料脱色率(%)=[1-(A样品-A对照)/ A空白]× 100
其中,A空白为以去离子水替代酶液的反应体系的吸光值,A样品为添加酶液的反应体系的吸光值,A对照为以去离子水替代染料的反应体系的吸光值。
1.2.6 数据分析所得结果以x±s表示。利用SPSS 20.0软件对数据进行单因素方差分析(ANOVA)和t-检验。**P < 0.05和*P < 0.01分别为差异显著和差异极显著。
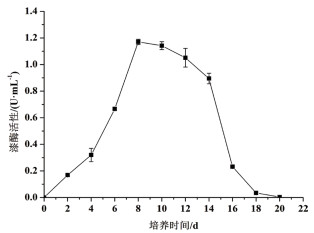
2 结果 2.1 P. laricis在液体培养条件下胞外漆酶活性的变化由图 1可知,在培养的20 d内,P. laricis胞外漆酶呈先上升后下降的趋势,到第8天达到最大值,为1.17 U/mL。以下利用响应面设计优化P. laricis产胞外漆酶液体培养基的试验均设在培养第8天取样。
|
| 图 1 液体培养过程中P. laricis胞外漆酶活性的变化 |
选取试验次数为12的Plackett-Burman设计,对影响P. laricis产胞外漆酶能力的11个因子的显著性进行研究。利用Design-Expert 10.0软件得到单因子线性模型:
Y = + 1.818 + 0.370 × X1 - 0.328 × X2 - 0.125 × X3 - 0.257 × X4 + 0.115 × X5 + 0.138 × X6 + 0.145 × X7 - 0.085 × X8 - 0.105 × X9 + 0.025 × X10 + 0.223 × X11
该模型P值为0.034 6,判定系数R2和校正判定系数R2分别为0.999 6和0.995 6,说明该线性模型与试验数据的拟合程度较高。由表 2可知,去皮马铃薯(X1)、CaCl2·2H2O(X2)、吐温80(X4)、酒石酸铵(X7)和玉米芯(X11)的P值均小于0.05,说明它们对试验结果的影响显著,根据线性模型系数可将因子的影响程度排序为X1 > X2 > X4 > X11 > X7,其中,X1、X7和X11为正效应因子,X2和X4为负效应因子。因此,选取去皮马铃薯、CaCl2·2H2O、吐温80、酒石酸铵和玉米芯进行最陡爬坡设计。
去皮马铃薯(X1)、CaCl2·2H2O(X2)、吐温80(X4)、酒石酸铵(X7)和玉米芯(X11)这5个因子的变化方向及步长的试验设计及结果见表 3。可以看到,第4组试验的胞外漆酶活性最高。因此,确定以第4组的数据作为Box-Behnken设计的中心点,即去皮马铃薯(X1)、CaCl2·2H2O(X2)、吐温80(X4)、酒石酸铵(X7)和玉米芯(X11)分别为380.0 g/L、0.035 g/L、0.35 mL/L、5.0 g/L和50.0 g/L。
在Plackett-Burman设计和最陡爬坡设计的试验结果基础上,以漆酶活性为响应值,Box-Behnken设计及结果列于表 4。利用Design-Expert 10.0软件对表 3试验数据进行回归拟合,得到对编码变量的二次多元回归方程:
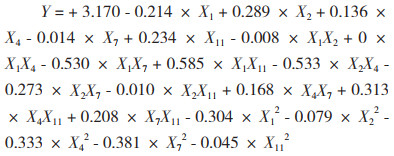
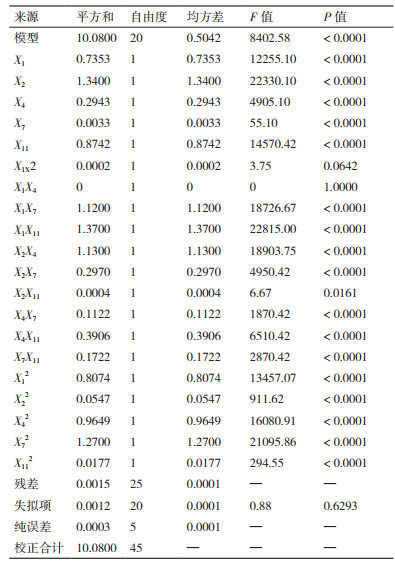
由表 5可知,该模型P < 0.000 1,极显著;一次项X1、X2、X4、X7和X11、交互项X1X7、X1X11、X2X4、X2X7、X2X11、X4X7、X4X11和X7X11、二次项X12、X22、X42、X72和X112对响应值的影响显著(P < 0.05),而交互项X1X2和X1X4的影响不显著(P > 0.05);失拟项P值为0.629 3,不显著,说明该模型不存在失拟因素。回归方程的判定系数R2为0.999 9,校正后的判定系数R2为0.999 7,表明响应值的变化有99.97%来自所选变量,说明该模型拟合度较好,可用于对试验结果进行分析和预测。
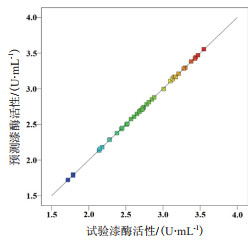
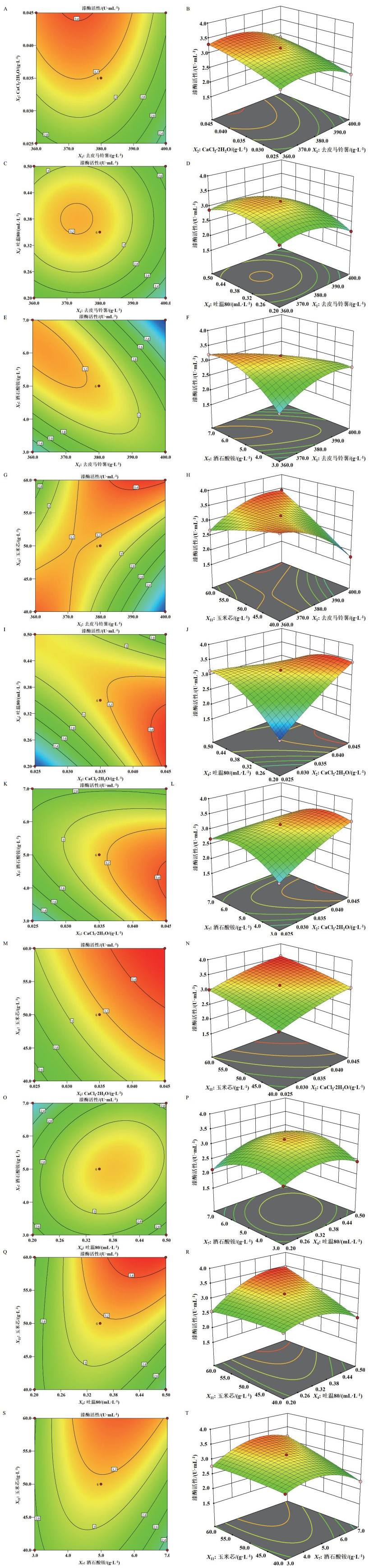
图 2试验值与预测值分布的平价图呈现一条直线,表明该模型预测值与试验值的差异很小。图 3显示了利用回归方程分析结果绘制的P. laricis胞外漆酶活性随各因子变化的等高线图和响应曲面图。
|
| 图 2 P. laricis胞外漆酶活性试验值与预测值分布的平价图 |
|
| A:去皮马铃薯(X1,g/L)和CaCl2·2H2O(X2,g/L)对P. laricis胞外漆酶活性影响的等高线图;B:去皮马铃薯(X1,g/L)和CaCl2·2H2O(X2,g/L)对P. laricis胞外漆酶活性影响的响应曲面图;C:去皮马铃薯(X1,g/L)和吐温80(X4,mL/L)对P. laricis胞外漆酶活性影响的等高线图;D:去皮马铃薯(X1,g/L)和吐温80(X4,mL/L)对P. laricis胞外漆酶活性影响的响应曲面图;E:去皮马铃薯(X1,g/L)和酒石酸铵(X7,g/L)对P. laricis胞外漆酶活性影响的等高线图;F:去皮马铃薯(X1,g/L)和酒石酸铵(X7,g/L)对P. laricis胞外漆酶活性影响的响应曲面图;G:去皮马铃薯(X1,g/L)和玉米芯(X11,g/L)对P. laricis胞外漆酶活性影响的等高线图;H:去皮马铃薯(X1,g/L)和玉米芯(X11,g/L)对P. laricis胞外漆酶活性影响的响应曲面图;I:CaCl2·2H2O(X2,g/L)和吐温80(X4,mL/L)对P. laricis胞外漆酶活性影响的等高线图;J:CaCl2·2H2O(X2,g/L)和吐温80(X4,mL/L)对P. laricis胞外漆酶活性影响的响应曲面图;K:CaCl2·2H2O(X2,g/L)和酒石酸铵(X7,g/L)对P. laricis胞外漆酶活性影响的等高线图;L:CaCl2·2H2O(X2,g/L)和酒石酸铵(X7,g/L)对P. laricis胞外漆酶活性影响的响应曲面图;M:CaCl2·2H2O(X2,g/L)和玉米芯(X11,g/L)对P. laricis胞外漆酶活性影响的等高线图;N:CaCl2·2H2O(X2,g/L)和玉米芯(X11,g/L)对P. laricis胞外漆酶活性影响的响应曲面图;O:吐温80(X4,mL/L)和酒石酸铵(X7,g/L)对P. laricis胞外漆酶活性影响的等高线图;P:吐温80(X4,mL/L)和酒石酸铵(X7,g/L)对P. laricis胞外漆酶活性影响的响应曲面图;Q:吐温80(X4,mL/L)和玉米芯(X11,g/L)对P. laricis胞外漆酶活性影响的等高线图;R:吐温80(X4,mL/L)和玉米芯(X11,g/L)对P. laricis胞外漆酶活性影响的响应曲面图;S:酒石酸铵(X7,g/L)和玉米芯(X11,g/L)对P. laricis胞外漆酶活性影响的等高线图;T:酒石酸铵(X7,g/L)和玉米芯(X11,g/L)对P. laricis胞外漆酶活性影响的响应曲面图 图 3 去皮马铃薯(X1,g/L)、CaCl2·2H2O(X2,g/L)、吐温80(X4,mL/L)、酒石酸铵(X7,g/L)和玉米芯(X11,g/L)的相互作用对P. laricis胞外漆酶活性影响的等高线图和响应曲面图 |
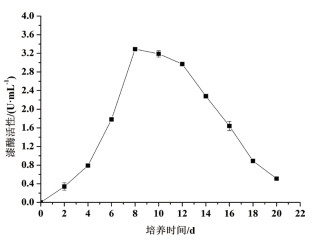
由回归方程得到P. laricis产胞外漆酶的最佳液体培养基为:去皮马铃薯365.61 g/L、蛋白胨5.0 g/L、葡萄糖20.0 g/L、KH2PO4 1.0 g/L、MgSO4·7H2O 0.5 g/L、MnSO4·H2O 0.15 g/L、CaCl2·2H2O 0.03 g/L、酒石酸铵6.68 g/L、琥珀酸钠1.5 g/L、吐温80 0.48 mL/L、玉米芯46.43 g/L、维生素B1 0.01 g/L,此时胞外漆酶活性为3.32 U/mL。按此条件进行验证试验(图 4),重复3次,得到培养第8 d时平均胞外漆酶活性为3.29 U/mL,比优化前提高了2.81倍,与上述预测值非常相近,证实拟合的回归方程准确可靠,能够真实有效地反映各因子对P. laricis胞外漆酶活性的影响。
|
| 图 4 优化液体培养基条件下P. laricis胞外漆酶活性的变化 |
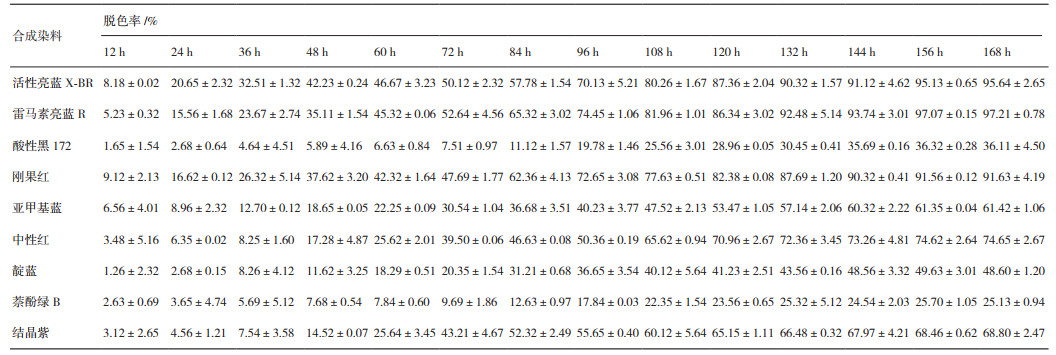
表 6显示了利用优化培养基进行液体培养条件下,P. laricis胞外漆酶对不同化学结构合成染料包括活性亮蓝X-BR、雷马素亮蓝R、酸性黑172、刚果红、亚甲基蓝、中性红、靛蓝、萘酚绿B和结晶紫的脱色能力。其中,P. laricis胞外漆酶对蒽醌类和偶氮类(不含金属)染料的脱色能力最强,反应168 h后,雷马素亮蓝R、活性亮蓝X-BR和刚果红的脱色率均可达到90%以上(97.21%、95.64%和91.63%);对杂环类、三苯甲烷类和菁类染料的脱色能力次之,第168小时中性红、结晶紫和亚甲基蓝的脱色率分别可达到74.65%、68.80%和61.42%;对靛蓝类染料的脱色能力较弱(48.60%);而对结构中含金属的偶氮类和亚硝基类染料的脱色能力最弱,反应168 h后酸性黑172和萘酚绿B的脱色率仅为36.11%和25.13%。
我国生物资源十分丰富,大量具有应用潜力的真菌资源有待挖掘和利用[31-41]。P. laricis作为一种兼具药用价值的白腐真菌,可分泌多种生物酶系以高效利用木质纤维,其中漆酶由于具有独特的降解机理及广泛的底物特异性,因而受到极大关注[42-44]。碳氮源可提供细胞生命活动所需的能量及合成产物的骨架,无机盐和金属离子也在微生物生长代谢过程中起着重要作用,但不同微生物所需最适碳氮源及无机营养不同,且供其生长或合成代谢产物的各个阶段所需的营养物质也不尽相同[17-18, 45-54]。本研究通过液体发酵培养的方式,利用响应面设计优化了P. laricis产胞外漆酶的液体培养基,并分析其对合成染料的脱色能力,以期为真菌漆酶的研究和应用提供技术支持。
即前期先通过常规液体发酵培养确定了P. laricis产胞外漆酶的峰值出现在培养第8天;进而利用Plackett-Burman设计从11个培养基成分中筛选出去皮马铃薯、CaCl2·H2O、吐温80、酒石酸铵和玉米芯剂量5个显著因子,其中去皮马铃薯、酒石酸铵和玉米芯为正效应因子,CaCl2·H2O和吐温80为负效应因子;继而进行最陡爬坡设计,将响应值最高的组合作为Box-Behnken设计的中心点;最后通过Box-Behnken设计进行试验、数据分析及建立模型,得到P. laricis产胞外漆酶的最佳液体培养基组成为:去皮马铃薯365.61 g/L、蛋白胨5.0 g/L、葡萄糖20.0 g/L、KH2PO4 1.0 g/L、MgSO4·7H2O 0.5 g/L、MnSO4·H2O 0.15 g/L、CaCl2·2H2O 0.03 g/L、酒石酸铵6.68 g/L、琥珀酸钠1.5 g/L、吐温80 0.48 mL/L、玉米芯46.43 g/L、维生素B1 0.01 g/L,将漆酶活性由初始的1.17 U/mL提高至3.29 U/mL,证实了利用响应面设计优化确定最优组合的方案切实可行,该种方法可用于发现并准确表达试验因素及其交互作用对目标响应值的影响。
印染工业在经济发展中占据着重要位置,但也成为水污染的关键因素之一,其可排放出大量含有有害化学物质的废水,包括染料、表面活性剂、悬浮物和有机物等,这些物质能够破坏水体的美观,阻碍光照投射、抑制光合作用,进而对营养链各层次的生物体均产生不利影响[55-56]。基于化学结构的不同,合成染料可分为蒽醌类染料、偶氮类染料、菁类染料、杂环类染料、靛蓝类染料、亚硝基类染料、三苯甲烷类染料等,目前已被用于成为合成和天然的纺织纤维、塑料、皮革、食品、染发剂、蜡、药品、油墨和涂料的着色剂等[57-58]。而基于上述发现,漆酶具有独特的降解机理和广泛的底物特异性,稳定性高,不产生二次污染物,将其作为绿色催化剂应用于染料脱色已成为国内外环保领域的研究热点[19, 22-23, 59-67]。本研究中发现,P. laricis胞外漆酶对蒽醌类和偶氮类(不含金属)染料的脱色能力最强;对杂环类、三苯甲烷类和菁类染料的脱色能力次之;对靛蓝类染料的脱色能力较弱;而对结构中含金属的偶氮类和亚硝基类染料的脱色能力最弱,表明所得到的漆酶可被应用于降解蒽醌类染料,具体的降解过程和催化机理还有待进一步深入探讨。
4 结论本研究通过将Plackett-Burman设计、最陡爬坡设计和Box-Behnken设计相结合,获得了P. laricis产胞外漆酶的最适培养基:去皮马铃薯365.61 g/L、蛋白胨5.0 g/L、葡萄糖20.0 g/L、KH2PO4 1.0 g/L、MgSO4·7H2O 0.5 g/L、MnSO4·H2O 0.15 g/L、CaCl2·2H2O 0.03 g/L、酒石酸铵6.68 g/L、琥珀酸钠1.5 g/L、吐温80 0.48 mL/L、玉米芯46.43 g/L、维生素B1 0.01 g/L。在该条件下,P. laricis漆酶活性最高达到3.29 U/mL,相比于优化前提高了2.81倍。此外,将P. laricis胞外漆酶应用于降解多种合成染料,发现该酶液对蒽醌类和偶氮类(不含金属)染料的脱色能力最强;对杂环类、三苯甲烷类和菁类染料的脱色能力次之;对靛蓝类染料的脱色能力较弱;而对结构中含金属的偶氮类和亚硝基类染料的脱色能力最弱,表明所得到的漆酶可被应用于降解蒽醌类染料。
| [1] |
戴玉成. 中国多孔菌名录[J]. 菌物学报, 2009, 28: 315-327. |
| [2] |
戴玉成. 中国木本植物病原木材腐朽菌研究[J]. 菌物学报, 2012, 31: 493-509. |
| [3] |
Dai YC. Hymenochaetaceae(Basidiomycota)in China[J]. Fungal Diversity, 2010, 45: 131-343. DOI:10.1007/s13225-010-0066-9 |
| [4] |
Reis FS, Martins A, Vasconcelos MH, et al. Functional foods based on extracts or compounds derived from mushrooms[J]. Trends in Food Science & Technology, 2017, 66: 48-62. |
| [5] |
杜萍, 何双辉, 钱玺, 等. 落叶松锈迷孔菌产多糖液体培养基的优化及其体外抗氧化活性[J]. 菌物学报, 2019, 38(6): 951-969. |
| [6] |
Stavishenko IV. Monitoring of wood-rotting fungal communities in the natural park Kondinskie Ozera(Konda Lakes)[J]. Contemporary Problems of Ecology, 2008, 1(4): 496-504. DOI:10.1134/S1995425508040164 |
| [7] |
戴玉成. 中国东北地区木材腐朽菌的多样性[J]. 菌物学报, 2010, 29: 801-818. |
| [8] |
魏玉莲, 戴玉成. 木材腐朽菌在森林生态系统中的功能[J]. 应用生态学报, 2004, 15(10): 1935-1938. DOI:10.3321/j.issn:1001-9332.2004.10.046 |
| [9] |
Leontievsky AA, Vares T, Lankinen P, et al. Blue and yellow laccases of ligninolytic fungi[J]. FEMS Microbiology Letters, 1997, 156: 9-14. DOI:10.1016/S0378-1097(97)00393-5 |
| [10] |
Valderrama B, Oliver P, Medrano-Soto A, et al. Evolutionary and structural diversity of fungal laccases[J]. Antonie van Leeuwenhoek, 2003, 84(4): 289-299. DOI:10.1023/A:1026070122451 |
| [11] |
Baldrian P. Fungal laccases-occurrence and properties[J]. FEMS Microbiology Reviews, 2006, 30: 215-242. DOI:10.1111/j.1574-4976.2005.00010.x |
| [12] |
吴怡, 马鸿飞, 曹永佳, 等. 真菌漆酶的性质、生产、纯化及固定化研究进展[J]. 生物技术通报, 2019, 35(9): 1-10. |
| [13] |
Claus H. Laccases:structure, reactions, distribution[J]. Micron, 2004, 35: 93-96. DOI:10.1016/j.micron.2003.10.029 |
| [14] |
Madhavi V, Lele SS. Laccase:properties and applications[J]. BioResources, 2009, 4(4): 1694-1717. |
| [15] |
司静, 李伟, 崔宝凯, 等. 真菌漆酶性质、分子生物学及其应用研究进展[J]. 生物技术通报, 2011(2): 48-55. |
| [16] |
Mayer AM, Staples RC. Laccase:new functions for an old enzyme[J]. Phytochemistry, 2002, 60: 551-565. DOI:10.1016/S0031-9422(02)00171-1 |
| [17] |
司静, 崔宝凯, 戴玉成. 栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J]. 微生物学通报, 2011, 38(3): 405-416. |
| [18] |
司静, 崔宝凯, 贺帅, 等. 微酸多年卧孔菌产漆酶条件优化及其在染料脱色中的应用[J]. 应用与环境生物学报, 2011, 17(5): 736-741. |
| [19] |
Si J, Peng F, Cui BK. Purification, biochemical characterization and dye decolorization capacity of an alkali-resistant and metal-tolerant laccase from Trametes pubescens[J]. Bioresour Technol, 2013, 128: 49-57. DOI:10.1016/j.biortech.2012.10.085 |
| [20] |
Pezzella C, Guarino L, Piscitelli A. How to enjoy laccases[J]. Cellular and Molecular Life Sciences, 2015, 72: 923-940. DOI:10.1007/s00018-014-1823-9 |
| [21] |
Senthivelan T, Kanagaraj J, Panda RC. Recent trends in fungal laccase for various industrial applications:an eco-friendly approach-a review[J]. Biotechnology and Bioprocess Engineering, 2016, 21: 19-38. DOI:10.1007/s12257-015-0278-7 |
| [22] |
Zheng F, Cui BK, Wu XJ, et al. Immobilization of laccase onto chitosan beads to enhance its capability to degrade synthetic dyes[J]. International Biodeterioration & Biodegradation, 2016, 110: 69-78. |
| [23] |
Zheng F, An Q, Meng G, et al. A novel laccase from white rot fungus Trametes orientalis:purification, characterization, and application[J]. International Journal of Biological Macromolecules, 2017, 102: 758-770. DOI:10.1016/j.ijbiomac.2017.04.089 |
| [24] |
Kudanga T, Nemadziva B, Roes-Hill ML. Laccase catalysis for the synthesis of bioactive compounds[J]. Applied Microbiology and Biotechnology, 2017, 101: 13-33. DOI:10.1007/s00253-016-7987-5 |
| [25] |
Ma HF, Meng G, Cui BK, et al. Chitosan crosslinked with genipin as supporting matrix for biodegradation of synthetic dyes:Laccase immobilization and characterization[J]. Chemical Engineering Research and Design, 2018, 132: 664-676. DOI:10.1016/j.cherd.2018.02.008 |
| [26] |
Deska M, Kończak B. Immobilized fungal laccase as "green catalyst" for the decolourization process-state of the art[J]. Process Biochemistry, 2019, 84: 112-123. DOI:10.1016/j.procbio.2019.05.024 |
| [27] |
Ghosh B, Saha R, Bhattacharya D, et al. Laccase and its source of sustainability in an enzymatic biofuel cell[J]. Biotechnology Technology Reports, 2019, 6: 268-278. |
| [28] |
Kolomytseva MP, Myasoedova NM, Chernykh AM, et al. Laccase isoform diversity in basidiomycete Lentinus strigosus 1566:potential for phenylpropanoid polymerization[J]. International Journal of Biological Macromolecules, 2019, 137: 1199-1210. DOI:10.1016/j.ijbiomac.2019.07.056 |
| [29] |
Singh G, Arya SK. Utility of laccase in pulp and paper industry:a progressive step towards the green chemistry[J]. International Journal of Biological Macromolecules, 2019, 134: 1070-1084. DOI:10.1016/j.ijbiomac.2019.05.168 |
| [30] |
Kalyani DC, Patil PS, Jadhav JP, et al. Biodegradation of reactive textile dye Red BL1 by an isolated bacterium Pseudomonas sp. SUK1[J]. Bioresour Technol, 2008, 99: 4635-4641. DOI:10.1016/j.biortech.2007.06.058 |
| [31] |
Kempken F, Rohlfs M. Fungal secondary metabolite biosynthesis-a chemical defence strategy against antagonistic animals[J]. Fungal Ecology, 2010, 3: 107-114. DOI:10.1016/j.funeco.2009.08.001 |
| [32] |
Singh AP, Singh T. Biotechnological applications of wood-rotting fungi:a review[J]. Biomass Bioenergy, 2014, 62: 198-206. DOI:10.1016/j.biombioe.2013.12.013 |
| [33] |
Kües U. Fungal enzymes for environmental management[J]. Current Opinion in Biotechnology, 2015, 33: 268-278. DOI:10.1016/j.copbio.2015.03.006 |
| [34] |
Fisher KJ, Lang GI. Experimental evolution in fungi:an untapped resource[J]. Fungal Genetics and Biology, 2016, 94: 88-94. DOI:10.1016/j.fgb.2016.06.007 |
| [35] |
Kubicek CP, Kubicek EM. Enzymatic deconstruction of plant biomass by fungal enzymes[J]. Current Opinion in Chemical Biology, 2016, 35: 51-57. DOI:10.1016/j.cbpa.2016.08.028 |
| [36] |
Ramesh MA. Inoculating curiosity in fungal biology for a new generation of students[J]. Fungal Biol Rev, 2016, 30: 15-23. DOI:10.1016/j.fbr.2016.03.001 |
| [37] |
Schmidt-Dannert C. Biocatalytic portfolio of basidiomycota[J]. Current Opinion in Chemical Biology, 2016, 31: 40-49. DOI:10.1016/j.cbpa.2016.01.002 |
| [38] |
Wakai S, Arazoe T, Ogino C, et al. Future insights in fungal metabolic engineering[J]. Bioresour Technol, 2017, 245: 1314-1326. DOI:10.1016/j.biortech.2017.04.095 |
| [39] |
Paramjeet S, Manasa P, Korrapati N. Biofuels:production of fungal-mediated ligninolytic enzymes and the modes of bioprocesses utilizing agro-based residues[J]. Biocatalysis and Agricultural Biotechnology, 2018, 14: 57-71. DOI:10.1016/j.bcab.2018.02.007 |
| [40] |
Lange L, Pilgaard B, Herbst FA, et al. Origin of fungal biomass degrading enzymes:evolution, diversity, and function of enzymes of early lineage fungi[J]. Fungal Biol Rev, 2019, 33: 82-97. DOI:10.1016/j.fbr.2018.09.001 |
| [41] |
Sperandio GB, Filho EXF. Fungal co-cultures in the lignocellulosic biorefinery context:a review[J]. International Biodeterioration & Biodegradation, 2019, 142: 109-123. |
| [42] |
Riva S. Laccases:blue enzymes for green chemistry[J]. Trends in Biotechnology, 2006, 24(5): 219-226. DOI:10.1016/j.tibtech.2006.03.006 |
| [43] |
Giardina P, Faraco V, Pezzella C, et al. Laccases:a never-ending story[J]. Cellular and Molecular Life Sciences, 2010, 67: 369-385. DOI:10.1007/s00018-009-0169-1 |
| [44] |
Rivera-Hoyos CM, Morales-Álvarez ED, Poutou-Piñales RA, et al. Fungal laccases[J]. Fungal Biol Rev, 2013, 27: 67-82. DOI:10.1016/j.fbr.2013.07.001 |
| [45] |
Jin XC, Ning Y. Laccase production optimization by response surface methodology with Aspergillus fumigatus AF1 in unique inexpensive medium and decolorization of different dyes with the crude enzyme or fungal pellets[J]. Journal of Hazardous Materials, 2013, 262: 870-877. DOI:10.1016/j.jhazmat.2013.09.024 |
| [46] |
曹可可, 刘宁, 马双新, 等. 大斑刚毛座腔菌高产漆酶条件的响应面优化及酶学特性[J]. 中国农业科学, 2015, 48(11): 2165-2175. DOI:10.3864/j.issn.0578-1752.2015.11.008 |
| [47] |
Ashrafi SD, Nasseri S, Alimohammadi M, et al. Optimization of the enzymatic elimination of flumequine by laccase-mediated system using response surface methodology[J]. Desalination and Water Treatment, 2016, 57(31): 14478-14487. DOI:10.1080/19443994.2015.1063462 |
| [48] |
Mansor AF, Mohidem NA, Zawawi WNIWM, et al. The optimization of synthesis conditions for laccase entrapment in mesoporous silica microparticles by response surface methodology[J]. Microporous and Mesoporous Materials, 2016, 220: 308-314. DOI:10.1016/j.micromeso.2015.08.014 |
| [49] |
Jiménez-Barrera D, Chan-Cupul W, Fan ZL, et al. Fungal co-culture increases ligninolytic enzyme activities:statistical optimization using response surface methodology[J]. Preparative Biochemistry and Biotechnology, 2018, 48(9): 787-798. DOI:10.1080/10826068.2018.1509084 |
| [50] |
马鸿飞, 崔宝凯, 员瑗, 等. 响应面法优化褐腐真菌竹生薄孔菌产纤维素酶的液体培养基[J]. 生物技术通报, 2018, 34(4): 91-101. |
| [51] |
邓诗贵, 杨晨军, 冯加洲, 等. 一株木质素降解白腐菌的筛选、鉴定及其产漆酶培养基的优化[J]. 食品研究与开发, 2019, 40(16): 178-184. DOI:10.12161/j.issn.1005-6521.2019.16.031 |
| [52] |
黑育荣, 陈胜发, 彭修娟, 等. 响应面法优化微波提取桦菌芝三萜类化合物工艺[J]. 化学与生物工程, 2019, 36(9): 30-34. DOI:10.3969/j.issn.1672-5425.2019.09.007 |
| [53] |
霍光明, 张李阳, 朱枳穆, 等. 响应面法优化链霉菌S10A09发酵产纤维素酶条件[J]. 生物加工过程, 2019, 17(2): 138-143. DOI:10.3969/j.issn.1672-3678.2019.02.004 |
| [54] |
Senthivelan T, Kanagaraj J, Panda RC, et al. Screening and production of a potential extracellular fungal laccase from Penicillium chrysogenum:media optimization by response surface methodology(RSM)and central composite rotatable design(CCRD)[J]. Biotechnology Reports, 2019, 23: e00344. DOI:10.1016/j.btre.2019.e00344 |
| [55] |
Wang JY, Yu SY, Feng FJ, et al. Simultaneous purification and immobilization of laccase on magnetic zeolitic imidazolate frameworks:recyclable biocatalysts with enhanced stability for dye decolorization[J]. Biochemical Engineering Journal, 2019, 150: 107285. DOI:10.1016/j.bej.2019.107285 |
| [56] |
Wlizło K, Polak J, Jarosz-Wilkołazka A, et al. Novel textile dye obtained through transformation of 2-amino-3-methoxybenzoic acid by free and immobilised laccase from a Pleurotus ostreatus strain[J]. Enzyme and Microbial Technology, 2020, 132: 109398. DOI:10.1016/j.enzmictec.2019.109398 |
| [57] |
Agrawal K, Verma P. Biodegradation of synthetic dye Alizarin Cyanine Green by yellow laccase producing strain Stropharia sp. ITCC-8422[J]. Biocatalysis and Agricultural Biotechnology, 2019, 21: 101291. DOI:10.1016/j.bcab.2019.101291 |
| [58] |
Jasińska A, Góralczyk-Bińkowska A, Soboń A, et al. Lignocellulose resources for the Myrothecium roridum laccase production and their integrated application for dyes removal[J]. International Journal of Environmental Science and Technology, 2019, 16: 4811-4822. DOI:10.1007/s13762-019-02290-x |
| [59] |
Moon SJ, Kim HW, Jeon SJ. Biochemical characterization of a thermostable cobalt- or copper-dependent polyphenol oxidase with dye decolorizing ability from Geobacillus sp. JS12[J]. Enzyme and Microbial Technology, 2018, 118: 30-36. DOI:10.1016/j.enzmictec.2018.06.011 |
| [60] |
窦欣, 田乔鹏, 王琦, 等. Ganoderma sp. SYBC L48漆酶酶学性质及其对酸性红1的脱色性能[J]. 环境工程学报, 2019, 13(4): 856-864. |
| [61] |
Iark D, Buzzo AJR, Garcia JAA, et al. Enzymatic degradation and detoxification of azo dye Congo red by a new laccase from Oudemansiella canarii[J]. Bioresour Technol, 2019, 289: 121655. DOI:10.1016/j.biortech.2019.121655 |
| [62] |
马倩倩, 赵丽红, 陈威. 漆酶在环境保护中的应用研究进展[J]. 工业安全与环保, 2019, 45(8): 100-103. DOI:10.3969/j.issn.1001-425X.2019.08.024 |
| [63] |
马倩倩, 赵丽红, 聂飞. 糙皮侧耳C1诱变菌株F-13漆酶催化染料脱色[J]. 科学技术与工程, 2019, 19(6): 304-307. DOI:10.3969/j.issn.1671-1815.2019.06.046 |
| [64] |
Nadaroglu H, Mosber G, Gungor AA, et al. Biodegradation of some azo dyes from wastewater with laccase from Weissella viridescens LB37 immobilized on magnetic chitosan nanoparticles[J]. Journal of Water Process Engineering, 2019, 31: 100866. DOI:10.1016/j.jwpe.2019.100866 |
| [65] |
庞乾辉, 吴一鑫, 俞丽萍, 等. 整体型大孔/介孔PDA/SiO2复合材料固定化漆酶及其在染料降解中的应用[J]. 化工进展, 2019, 38(2): 1018-1026. |
| [66] |
谭小珊, 王帅杰, 吴科元, 等. 刺芹侧耳产漆酶条件优化及对偶氮染料甲基橙的脱色[J]. 菌物学报, 2019, 38(9): 1-8. |
| [67] |
Zhuo R, Zhang JW, Yu HB, et al. The roles of Pleurotus ostreatus HAUCC 162 laccase isoenzymes in decolorization of synthetic dyes and the transformation pathways[J]. Chemosphere, 2019, 234: 733-745. DOI:10.1016/j.chemosphere.2019.06.113 |