2. 资源微生物与功能分子河南省高校重点实验室培育基地(河南师范大学),新乡,453007;
3. 河南省道地药材保育及利用工程技术研究中心/绿色药材生物技术河南省工程实验室,新乡 453007
2. Key Laboratory for Microorganisms and Functional Molecules(Henan Normal University), University of Henan Province, Xinxiang 453007;
3. Engineering Technology Research Center of Nursing and Utilization of Genuine Chinese Crude Drugs in Henan Province, Xinxiang 453007
地黄在我国有悠久的药用历史,临床上多用于强心、利尿、镇痛、降血糖及保护肝脏等方面。近年来的研究显示,地黄很可能在抗肿瘤、抗过敏及免疫调节方面也具有潜在的药用价值[1]。优质地黄的生产受到地理条件的巨大限制,河南省焦作地区因为具备适合地黄生长的良好土壤和气候条件,被认为是地黄的道地产区,种植面积将近1.5万hm2,产值达数10亿元。但是,地黄在生长过程中受到多种病害如斑枯病、病毒病和根腐病等的极大威胁。其中,根腐病(枯萎病)主要危害地黄根部和茎部,发病初期,植株靠近地面的根茎和叶柄部分首先出现黄褐色腐烂斑,然后叶片逐渐萎蔫,最终导致地黄死亡。地黄根腐病的发病率通常在10%-20%,严重时高达80%,是道地地黄产量和质量急剧下降的主要原因之一,造成了严重的经济损失。因此,地黄根腐病病原的研究对于地黄质量和产量的提高均具有十分重要的现实意义。
病原性微生物大量繁殖和传播直接诱发了地黄根腐病的发生。较早的报道认为真菌中镰刀霉属的一些成员是地黄根腐病发生的主要致病微生物[2-3],但是,近些年的研究发现,除了镰刀霉外,还有其它多种微生物如真菌立枯丝核菌和恶疫霉等[4]也与地黄根腐病的发生密切相关。因此,造成地黄根腐病的病原菌并未完全被认识。除此之外,大量的研究表明,温度、pH、营养等环境条件对植物病原微生物的生长和致病性有显著的影响[5-9]。例如,Nemergut等[10]指出,夏季高温,植物代谢旺盛,向土壤中释放大量根际分泌物而刺激微生物繁殖;冬季低温,适寒性微生物则大量繁殖。国春菲等[11]研究表明在盐渍地中pH值越高土壤细菌和真菌多样性指数越低,当pH为10时土壤中的Pycnidiophora sp.,Sordariales sp.,Aspergillus versicolor等菌属消失,而Emericellopsis terricola,Fusarium solani,Verticillium dahliae strainF724等菌属出现。本实验室以前的研究发现,地黄在生长过程中通常会分泌大量酚酸类物质到其根际土壤中。这些酚酸类物质将使地黄根际土壤pH降低,导致土壤中微生物群落由细菌型向真菌型转变[12-14]。同时,不能利用或耐受酚酸的微生物逐渐被淘汰,这进一步导致土壤中微生物群落结构的失衡和病原性真菌的生长[15~17]。
围绕地黄病原微生物的研究,前人已取得了一定的进展,但是导致地黄根腐病发生的病原学问题尚未完全清楚。本研究通过传统分离纯化方法对未知根腐病病原菌(尤其是病原真菌)进行分离,并通过回接试验确定其致病能力。进一步,对病原微生物的生长的最佳温度、pH、酚酸(地黄根部分泌物阿魏酸、对羟基苯甲酸和香草酸)耐受能力等生物学特征进行深入阐明,以期为地黄根腐病的控制奠定试验基础。
1 材料与方法 1.1 材料培养基:马铃薯培养基(Potato Dextrose Agar Medium,PDA):马铃薯200 g,葡萄糖20 g,琼脂15-20 g,蒸馏水1 000 mL,自然pH;酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPD):10 g酵母膏,20 g蛋白胨,20 g葡萄糖,蒸馏水1 000 mL,若制固体培养基,加入20 g琼脂粉。
供试菌株:海洋红酵母Rhodotorula paludigena DH5由发病地黄中分离纯化得到,保存于河南师范大学生命科学学院环境与资源微生物实验室。
仪器:Olympus BX51显微镜,日本Olympus公司,Thermo酶标仪,美国Thermo公司;生长曲线测定仪。
1.2 方法 1.2.1 病害怀地黄块根的采集2015年8月,在河南省温县采集地黄块根,此时为地黄根腐病高发期。选取具有典型根腐病症状的地黄植株,挖取其块根放入无菌采样袋,置于冰盒中,带回实验室进行致病真菌分离。
1.2.2 地黄根腐病病原真菌的分离纯化取发病腐烂的怀地黄块根,用流水冲洗掉表面杂质。在无菌条件下,将块根置于75%乙醇中浸泡3 min。用无菌水中冲洗5-7次后,将最后冲洗水涂布在PDA平板上。培养3-5 d检验是否将块根表面的微生物清除干净。将块根放在灭过菌的吸水纸上晾干。无菌条件下,按照常规组织分离[18],将块根切成体积约1 cm3小块,摆放在PDA固体平板上,28℃培养5 d。划线分离至少3次,直至平板上只有一种形态的菌落,显微镜下观察确认是否为单一菌株。
1.2.3 分离纯化所得菌株的鉴定 1.2.3.1 菌株的形态特征及显微镜观察将真菌培养5 d后,无菌条件下从菌落边缘挑取适量菌丝,制成水浸片,在光学显微镜下观察其特征。
1.2.3.2 所筛菌株的分子生物学鉴定从培养的单菌落上挑取适量的菌体,用TaKaRa微生物细胞裂解液裂解细胞,以细胞裂解液为模板,以ITS序列通用引物ITS1、ITS4进行PCR扩增[19]。引物序列如下:
ITS1(5'-TCCGTTAGGTGAACCTGCGG-3'),
ITS4(5'-TCCTCCGCTTATTGATATGC-3')。
引物由上海生工公司合成。PCR反应体系为Mix 12.5 μL,无菌双蒸水9.9 μL,模板1 μL,前后引物各0.8 μL。PCR反应条件:95℃预变性5 min,然后进行35个循环的扩增(94℃/30 s,54℃/30 s,72℃/1 min),最后72℃延伸10 min。PCR反应结束后,取5 μL反应产物,用1%琼脂糖凝胶电泳检测目的条带。将目的片段的PCR产物送到上海生工公司进行测序,利用BLAST与GenBank数据库中真菌ITS序列进行比对分析,通过MEGA4.1软件对同源序列以及相关标准菌株的序列进行多重序列比对,用NJ法构建系统进化树,确定菌株的分类水平。
1.2.4 致病性检测分离所得的酵母菌用YPD液体培养基进行培养,调整浓度至2×107个/mL[20]。将121℃,2 h高压蒸汽灭菌的土壤分装于花盆中,取大小基本一致的健康怀地黄块根,清洗干净,用酒精棉球蘸取75%的酒精擦拭表面,放入花盆中。取10 mL准备好的菌液施加到地黄块根附近,用土壤将怀地黄块根完全埋住,用灭过菌的四层纱布包严花盆的上口,防止外源微生物的污染。将花盆搬到室温30℃的无菌室中,期间不间断浇水以保持花盆中土壤的湿度。待怀地黄块根发病后,再以发病块根组织为材料分离微生物,确认是否能分离得到施加进去的微生物。
1.2.5 生物学特性研究 1.2.5.1 温度对菌生长的影响从YPD固体平板上挑取单个菌落接种到YPD液体培养基中,在28℃恒温摇床上以180 r/min转速培养24 h,吸取1 mL菌液接种到100 mL YPD液体培养基中,分别于19℃、28℃、37℃恒温摇床上以180 r/min培养,并设置3个重复,每2 h测一次菌液的OD600 nm,然后取平均值。
1.2.5.2 pH对菌生长的影响从YPD固体平板上挑取单个菌落接种到YPD液体培养基中,在28℃恒温摇床上以180 r/min转速培养24 h,吸取10 μL菌液接种到290 μLYPD液体培养基中,其pH分别为3、5、7和9,于28℃恒温摇床上以180 r/min培养,并设置3个重复,每8 h测一次菌液的OD600 nm,然后取平均值。
1.2.5.3 酚酸对菌生长的影响从YPD固体平板上挑取单个菌落接种到YPD液体培养基中,在28℃恒温摇床上以180 r/min转速培养24 h,吸取10 μL菌液接种到290 μL YPD添加酚酸的液体培养基中,其中酚酸种类为香草酸、阿魏酸和对羟基苯甲酸,培养基酚酸组合的类型一共7种,分别为只有3种单酚酸、3种两酚酸组合和1种三酚酸组合,酚酸总浓度均为0.01 g/L、0.05 g/L、0.1 g/L、0.5 g/L,设置3个重复,并每8 h测一次菌液的OD600 nm,然后取平均值。
2 结果 2.1 根腐病病原菌的分离纯化及形态特征2015年8月,从种植地黄土地中采集发生根腐病的地黄块根,如图 1-A中箭头所示,块根呈棕黑色腐烂。按照材料方法所述分离根腐病病原真菌,从发病块根周围共挑取潜在致病菌6株,其中一株呈现特殊的色泽。对该菌进一步的分离纯化显示,该菌菌落橙黄色,边缘整齐,表面光滑、湿润。显微镜检测显示,菌体椭圆形,有疑似出芽现象。因此,初步判定其可能为酵母菌。该菌菌落及显微形态如图 1-B、C所示。

|
| A:发生根腐病的怀地黄块根;B:分离所得酵母菌的菌落特征;C:酵母菌的显微形态 图 1 怀地黄根腐病病原菌的分离及显微形态(10×40) |
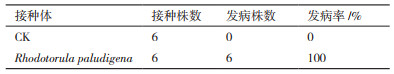
将所得菌株的PCR产物进行凝胶电泳,初步确定其目的基因大小,然后进行ITS测序。测序结果提交到GENEBANK(ID:MF359557)。Blast比对结果显示,该菌与红酵母属中的Rhodotorula paludigena具有100%的相似度。系统进化树分析显示,该酵母菌与Rhodotorula paludigena簇集在一起,置信度为91,遗传距离最近,具有密切的亲缘关系。因此,初步鉴定该菌株为Rhodotorula paludigena,命名为Rhodotorula paludigena DH5(图 2)。
|
| 图 2 基于ITS序列构建Rhodotorula paludigena DH5的系统进化树 |
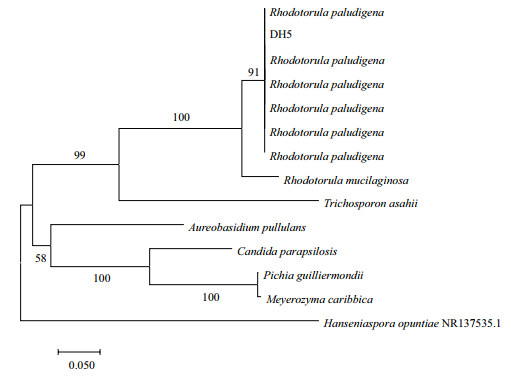
所得酵母菌Rhodotorula paludigena DH5对地黄块根的致病能力通过持续20 d的回接实验进行验证,在第10天和第20天时分别将怀地黄块根挖出来拍照(图 3)。对照组地黄块根在回接后的第10天和第20天,均未发现明显的根腐病表型。接种Rhodotorula paludigena DH5的地黄块根在第10天时开始呈现轻微的棕黑色病变点,第20天时,呈现出明显的棕黑色腐烂。20 d后,将所有的地黄块根挖出,统计致病率,结果(表 1)显示,所有接种Rhodotorula paludigena DH5的地黄块根均发生了明显的根腐病症状。通过平板分离、菌落形态观察、显微镜观察及ITS测序,从腐烂块根中,重新分离到了接种的酵母菌菌株Rhodotorula paludigena DH5,证明该酵母菌确实具有导致地黄根腐病发生的能力。
|
| 图中右上为红色箭头指示部分放大图 图 3 Rhodotorula paludigena DH5对怀地黄块根的致病性 |
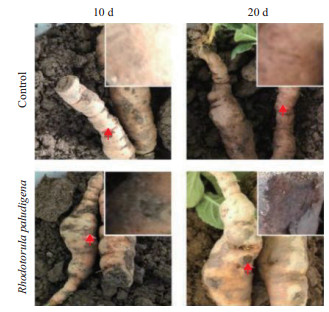
在不同温度下,该菌生长情况有很大的差异。如图 4所示,随着培养时间的延长,Rhodotorula paludigena DH5在28℃条件下的OD值总体呈现明显上升,而在37℃和19℃条件下培养液的OD值呈现明显下降。尤其是在接种9 h后,Rhodotorula paludigena DH5在28℃条件下的OD值高于其在37℃和19℃条件下的OD值,差异达到极显著水平。因此,Rhodotorula paludigena DH5的生长最适温度为28℃,温度过高或过低均会抑制该菌的生长。
|
| 图 4 不同的温度对酵母菌的影响 |
在不同的pH值条件下,Rhodotorula paludigena DH5的生长速度存在较大的差异。如图 5所示,pH为3、5、7、9时,随着生长时间的延长,培养液的OD值总体保持增高的趋势。其中,当培养液的pH为5时,培养液的OD值增长最快,在24 h后,其OD值达到1.252,远高于pH为3、7、9时的OD值。这些结果表明,该致病菌适合在微酸条件下生长,在过酸或碱性条件下均不利于其快速生长。

|
| 图 5 不同的pH对酵母菌生长的影响 |
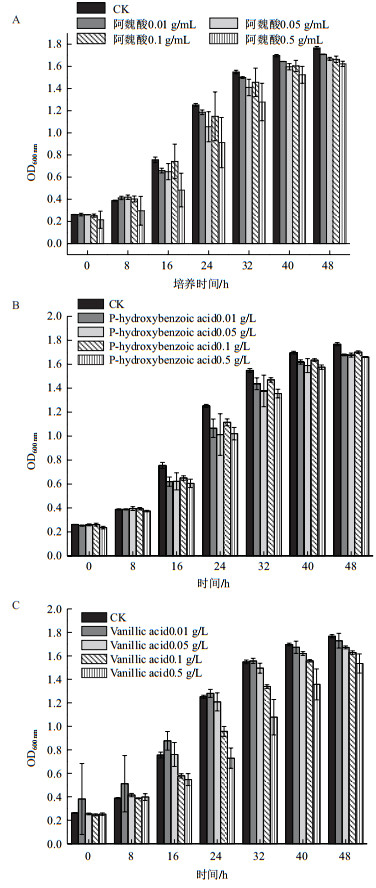
我们首先检测了地黄根际土壤中3种常见酚酸在单一或联合作用下对菌株生长的影响。由图 6可见,随着生长时间的延长,不同浓度的阿魏酸、对羟基苯甲酸和香草酸单独存在对Rhodotorula paludigena DH5的生长均产生一定的抑制作用。但是,即使在最高0.5 g/L的浓度下生长48 h后,该菌株在3种单一酚酸培养液的OD值仍能达到1.6以上(对照为1.767)。这些结果表明,Rhodotorula paludigena DH5对单一酚酸具有良好的耐受能力。
|
| A:阿魏酸;B:对羟基苯甲酸;C:香草酸 图 6 不同浓度的单种酚酸对酵母菌生长的影响 |
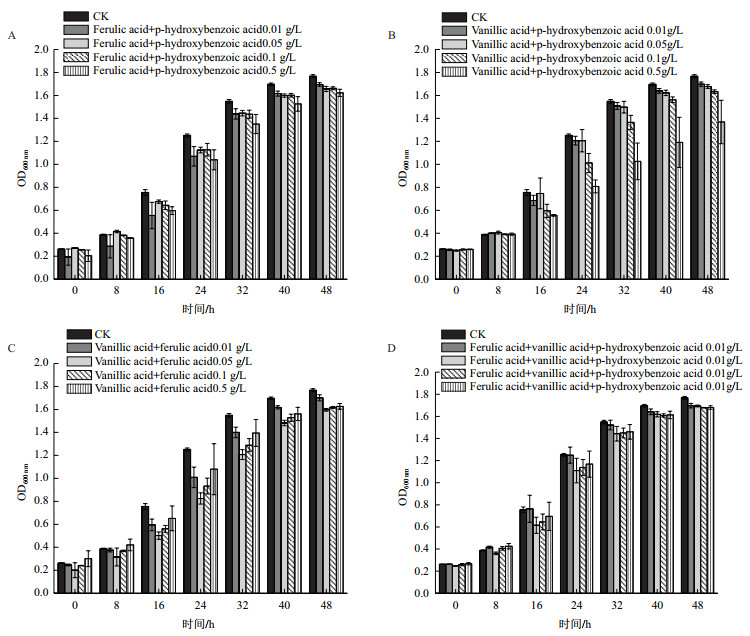
混合酚酸对Rhodotorula paludigena DH5生长影响如图 7所示。当混合酚酸培养液中同时存在两种或3种酚酸(酚酸浓度分别为0.01 g/L、0.05 g/L、0.1 g/L和0.5 g/L)时,Rhodotorula paludigena DH5的生长均受到一定程度的抑制,但是仍能保持较高的生长速率。值得注意的是,在培养16 h后,Rhodotorula paludigena DH5在混合酚酸浓度为0.5 g/L的香草酸和对羟基苯甲酸混合培养液中的OD值(0.556-1.369)总体上低于其在单纯对羟基苯甲酸(0.605-1.665)或香草酸培养液中的OD值(0.546-1.535),但是其在3种酚酸组合培养液中的OD值(0.696-1.680)却高于其在香草酸/对羟基苯甲酸组合培养液中的OD值。推测在0.5 g/L时,香草酸和对羟基苯甲酸组合对Rhodotorula paludigena DH5生长的抑制表现为叠加效应,但是阿魏酸的加入将抵消这种协同作用。
|
| A:对羟基苯甲酸和阿魏酸;B:香草酸和对羟基苯甲酸;C:香草酸和阿魏酸;D:香草酸、对羟基苯甲酸和阿魏酸 图 7 不同浓度的组合酚酸混合对该菌株生长的影响 |
根腐病是主要危害植物根及茎部的一类严重病害。该病易传染、高致死、难防治。因此,根茎类中药一旦感染该疾病,往往出现大面积死亡和减产,造成巨大的经济损失。在本研究中,我们分离获得了一株酵母菌,经测序及遗传进化分析,发现其与Rhodotorula paludigena具有高达100%的相似性,经回接试验证实,该酵母菌能够有效的侵染地黄根部,导致根腐病的发生。
早期的研究显示,植物根腐病的发生主要与真菌镰刀霉属的一些成员如腐皮镰刀霉及尖孢镰刀菌等密切相关[21]。但是,除了镰刀霉外,其它的微生物也极有可能参与了根腐病的发生过程。如王立新等[22]从黄芪根部分离到立枯丝核菌、尖镰孢菌和腐皮镰孢菌,并证明这些菌株均能导致黄芪根腐病的发生;罗文富等[23]从三七腐烂根部分离到的假单胞菌,接种到三七根部,显著提高了三七根腐病的发病率。在地黄根腐病的研究中,已有的报道显示,腐皮镰刀菌是主要的根腐病病原菌,其它病原微生物如立枯丝核菌和恶疫霉等也已经被分离到。在本研究中,初步证实了Rhodotorula paludigena DH5能够引起地黄根腐病。
酚酸类物质是地黄根部分泌物的主要成分之一。已有的研究表明,一些微生物的生长会受到酚酸类物质的影响。比如,酚酸改变pH值,使根际微生物群落发生失衡,细菌与放线菌数量下降,真菌数量上升[24-25]。在失衡的微生物群落中,一些病原性微生物往往能够利用酚酸类物质作为碳源进行生长并成为根际微生物群落的主要微生物类群,导致植物疾病的发生更为严重[15~16]。以前的报道显示,头茬地黄根际土壤中存在多种不同酚酸,其中常见的有对羟基苯甲酸,香草酸和阿魏酸。本研究中,我们检测了这3种酚酸对Rhodotorula paludigena DH5生长的影响。结果表明,酵母菌能够在单一酚酸或混合酚酸的高浓度培养液(酚酸总浓度为0.5 g/L)中很好生长,证明该病原微生物对酚酸具有良好的耐受性。这种耐受性可能与该酵母菌能够利用这些酚酸作为碳源或适应酚酸类物质所诱发的pH改变密切相关。值得注意的是,我们的结果进一步显示,该酵母菌在浓度为0.5 g/L的香草酸和对羟基苯甲酸混合培养液中的生长速率比其在单纯对羟基苯甲酸或香草酸培养液中的生长速率低,但是,其在3种酚酸组合培养液中的生长速率却高于其在香草酸和对羟基苯甲酸组合培养液中的生长速率。以前的报道显示,多种酚酸混合在一起会出现协同、加合和拮抗作用等,其对土壤根际微生物生长的影响比单一酚酸作用更为明显。例如,刘萍等[26]发现对羟基苯甲酸、苯甲酸和邻苯二甲酸对炭疽病菌的生长有拮抗作用。母容等[27]发现阿魏酸和对羟基苯甲酸对土壤中的氨化细菌、硝化细菌和反硝化细菌有协同抑制作用。而且,不同研究组的报道表明,酚酸间的互作效能表现为协同增效还是拮抗与各种酚酸之间的浓度水平密切相关:较低浓度时,各种酚酸之间协同增效;当提高到一定浓度时,协同增效效应逐渐转变为拮抗效应[28]。因此,我们分离所得病原性酵母对混合酚酸的良好耐受性,可能受到不同酚酸间协同效应的影响。其具体的机制仍待进一步的研究确定。
4 结论本研究从腐烂的地黄块根中分离获得一菌株DH5。经形态学及ITS序列同源性分析初步鉴定该菌株与Rhodotorula paludigena具有密切的亲缘关系。回接实验证实,菌株DH5可以导致地黄根部腐烂。生物学特性分析展示,菌株DH5的最适生长温度为28℃,最适pH为5,而且其对单一或混合酚酸具有很好的耐受性,最高耐受浓度可达0.5g/L。
| [1] |
Yang Q, Wang R, Xu Y, et al. Dynamic change of the rhizosphere microbial community in response to growth stages of consecutively monocultured Rehmanniae glutinosa[J]. Biologia, 2016, 71(12): 1320-1329. |
| [2] |
Jung DL, Song JY, ILL MC, et al. Resveratrol synthase transgene expression and accumulation of resveratrolglycoside in Rehmannia glutinosa[J]. Molecular Breeding, 2005, 16: 219-233. DOI:10.1007/s11032-005-8301-x |
| [3] |
Wu L, Wang J, Huang W, et al. Plant-microbe rhizosphere interactions mediated by Rehmannia glutinosa root exudates under consecutive monoculture[J]. Scientific Reports, 2016, 5: 15871. |
| [4] |
黄艳琴. 地黄常见病害的发生与防治[J]. 河南农业, 2006(8): 22-22. DOI:10.3969/j.issn.1006-950X.2006.08.020 |
| [5] |
Bååth E, Anderson T. Comparison of soil fungal/bacterial ratios in a pH gradient using physiological and PLFA-based techniques[J]. Soil Biology & Biochemistry, 2003, 35(7): 955-963. |
| [6] |
Lauber C, Hamady M, Knight R, et al. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Applied & Environmental Microbiology, 2009, 75(15): 5111. |
| [7] |
Aciego C, Brookes P. Substrate inputs and pH as factors controlling microbial biomass, activity and community structure in an arable soil[J]. Soil Biology & Biochemistry, 2009, 41(7): 1396-1405. |
| [8] |
Bengtson P, Sterngren A, Rousk J. Archaeal abundance across a pH gradient in an arable soil and its relationship to bacterial and fungal growth rates[J]. Applied & Environmental Microbiology, 2012, 78(16): 5906-5911. |
| [9] |
Lipson D, Schmidt S. Seasonal changes in an alpine soil bacterial community in the colorado rocky mountains[J]. Applied & Environmental Microbiology, 2004, 70(5): 2867. |
| [10] |
Nemergut D, Costello E, Meyer A, et al. Structure and function of alpine and arctic soil microbial communities[J]. Research in Microbiology, 2005, 156(7): 775-784. DOI:10.1016/j.resmic.2005.03.004 |
| [11] |
国春菲.土壤盐分和pH对滨海盐土土壤微生物多样性的影响[D].杭州: 浙江农林大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10341-1014101404.htm
|
| [12] |
李振方, 杨燕秋, 谢冬凤, 等. 连作条件下地黄药用品质及土壤微生态特性分析[J]. 中国生态农业学报, 2012, 20(2): 217-224. |
| [13] |
杜家方.地黄(Rehmannia glutinosa Libosch.)根区土壤中酚酸类物质的化感作用研究[D].郑州: 河南农业大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10466-2009255124.htm
|
| [14] |
Qu X, Wang J. Effect of amendments with different phenolic acids on soil microbial biomass, activity, and community diversity[J]. Applied Soil Ecology, 2008, 39(2): 172-179. DOI:10.1016/j.apsoil.2007.12.007 |
| [15] |
吴林坤, 黄伟民, 王娟英, 等. 不同连作年限野生地黄根际土壤微生物群落多样性分析[J]. 作物学报, 2015, 41(2): 308-317. DOI:10.3969/j.issn.1000-2561.2015.02.015 |
| [16] |
Kefeli V, Kalevitch V, Borsari B. Phenolic cycle in plants andenvi-ronment[J]. J Cell & Mol Biol, 2003, 2(1): 13-18. |
| [17] |
Chan Y. Utilization of simple phenolics for dinitrogen fixation by soil diazotrophic bacteria[J]. Plant and Soil, 1986, 90(1/2/3): 141-150. |
| [18] |
Wang R, Wang Y, Yang Q, et al. Unraveling the characteristics of the microbial community and potential pathogens in the rhizosphere soil of Rehmannia glutinosa with root rot disease[J]. Applied Soil Ecology, 2018. |
| [19] |
桓明辉, 李杨, 刘晓辉, 等. 1株产纤维素酶木霉菌种的鉴定[J]. 微生物学杂志, 2012, 32(5): 65-68. |
| [20] |
Zhao Z, Gao X, Yang D, et al. Field detection of canker-causing bacteria on kiwifruit trees:Pseudomonas syringae, pv. actinidiae, is the major causal agent[J]. Crop Protection, 2015, 75: 55-62. DOI:10.1016/j.cropro.2015.05.008 |
| [21] |
廖长宏, 陈军文, 吕婉婉, 等. 根茎类药用植物根腐病研究进展[J]. 中药材, 2017, 40(2): 493-498. |
| [22] |
王立新, 刘正坪. 黄芪根腐病病原菌鉴定[J]. 华北农学报, 1994, 9(2): 107-109. DOI:10.3321/j.issn:1000-7091.1994.02.021 |
| [23] |
罗文富, 喻盛甫, 贺承福, 等. 三七根腐病病原及复合侵染的研究[J]. 植物病理学报, 1997, 27(1): 85-91. DOI:10.3321/j.issn:0412-0914.1997.01.023 |
| [24] |
沈清清, 刘芳, 胡彦. 药用植物根腐病病原菌研究进展[J]. 北方园艺, 2014, 11: 187-190. |
| [25] |
Song H, Gao XL, Wang XM, et al. Effects of exogenous phthalic and cinnamic acids on enzyme activities and microbial community structures in rhizosphere soil of Adzuki Bean[J]. Agricultural Science & Technology, 2017(10): 1935-1940. |
| [26] |
刘苹, 高新昊, 孙明, 等. 3种酚酸类物质对花生发芽和土壤微生物的互作效应研究[J]. 江西农业学报, 2012, 24(8). |
| [27] |
母容, 潘开文, 王进闯, 等. 阿魏酸、对羟基苯甲酸及其混合液对土壤氮及相关微生物的影响[J]. 生态学报, 2011, 31(3): 793-800. |
| [28] |
Inderjit, Streibig JC, Olofsdotter M. Joint action of phenolic acid mixtures and its significance in allelopathy research[J]. Physiologia Plantarum, 2010, 114(3): 422-428. |