启动子是一段位于结构基因5'端上游的DNA序列,提供RNA聚合酶识别和结合位点,是调控基因表达强弱的重要元件,通过参与基因的转录环节来调控基因表达的水平、部位及方式[1-2]。研究表明,通过自身启动子在植物中对外源基因进行功能表达,为植物生物技术中有益转基因的应用提供了可能,如提高植物胁迫耐受性等[3]。
目前,最经典的启动子是花椰菜花叶病毒(CaMV)35S启动子[4]、玉米泛素(Ubiquitin)启动子[5]和水稻肌动蛋白(ACT1)启动子[6]等。但随着应用不断深入,上述几个启动子的缺陷也不断暴露出来,如因高效表达需要产生的大量能耗会对植物生长产生影响,引起植物生长缓慢[7]。同时因其表达具有持续性,不随时间和空间的变化而变化,在植物体内表达不具有特异性[8],因而人们开始寻求更加高效、优质的启动子。
有研究表明,使用丝状真菌中的强启动子可以高效启动目的基因的转录。在丝状真菌中利用自身启动子起始转录外源基因的转录效率通常很高,但是一些外源蛋白的产量远远低于内源蛋白的产量[9]。有文献报道,启动子活性、翻译效率、蛋白糖基化、目标基因的拷贝数以及菌株自身蛋白酶的降解能力等均会影响蛋白的产量,其中以启动子转录水平的高低影响最为关键,使用强启动子可以实现目的基因的高效表达[10-11]。目前已报道的丝状真菌启动子主要是曲霉葡糖淀粉酶基因(glaA)启动子,构巢曲霉的3-磷酸甘油醛脱氢酶基因(gpdA)启动子,米曲霉的a-淀酶基因(amyB)启动子,瑞氏木霉纤维二糖水解酶基因(cbh1)启动子[12]。
橡胶树白粉菌(Oidium heveae)引起的橡胶树白粉病是橡胶生产中重要病害之一[13]。在前期研究中,我们首次报道了橡胶树白粉菌基因组[14],构建了适于快速检测橡胶树白粉菌菌株HO-73启动子的探针载体[15],并通过将启动子与CaMV35S启动子及ACT1启动子的活性比较,初步鉴定了WY7[16]、WY51[17]、WY193[18]等能够用于调控双子叶植物和单子叶植物中的外源目的基因表达的橡胶树白粉菌内源启动子。本研究中通过对其基因组进行分析,预测筛选了一些疑似内源启动子的核心区域,并通过克隆得到了其中1个疑似新的内源启动子WY172(BankIt2158599,另文发表)。本研究以WY172上游2K序列为研究对象,通过利用生物信息学软件对其进行检索并预测转录因子结合位点,通过构建不同长度疑似具有启动子活性片段的表达载体,观察报告基因的表达情况,探讨WY172及4个不同长度缺失片段的表达活性,旨在寻求更好的可服务于基因工程、应用于生产实际的优秀启动子。
1 材料与方法 1.1 材料橡胶树白粉菌菌株HO-73筛选、保存于本实验室,培养于橡胶苗中感品种热研7-33-97[19]上,培养室内温度为25℃恒温,光周期为14 h/10 h(光/暗),湿度范围88%左右。模式生物三生烟(Nicotiana tabacum cv. Xanthi nc)作为研究对象,培养于上述培养室中。
1.2 方法 1.2.1 WY172启动子生物信息学分析Promoter Scan预测橡胶树白粉菌全基因组DNA,得到若干橡胶树白粉菌疑似内源启动子的核心区域,将其中一个命名为WY172(BankIt2158599),并利用在线数据库EPD确认所验证的启动子是否为未报道的新启动子。利用在线数据库PROMO对WY172上游2K序列进行转录因子预测分析,利用在线生物信息学软件JASPAR检索相应的转录因子结合位点,根据转录因子结合位点在序列上的分布位置对WY172上游2K序列进行渐变缺失突变,用引物设计软件Primer Premier 5设计5'端不同缺失的上游引物和3'端下游引物。同时通过plantCARE软件对WY172启动子上游2K序列的作用元件进行分析。
1.2.2 WY172启动子及不同长度片段的克隆提取橡胶树白粉菌基因组DNA(OMEGA,D3390),以此为模板,通过上游特异引物172F、172Q1F、172Q2F、172Q3F、172QF和共同的下游引物172NR进行PCR扩增,获得5种不同长度的启动子片段。
将PCR产物经1.0%的琼脂糖凝胶电泳检测并切胶回收。将回收产物与T-easy载体连接,进行TA克隆,并转化Trans5α感受态细胞,涂布于Amp抗性的LB固体培养基(100 μg/mL),37℃过夜培养16 h。挑取单菌落于Amp抗性的LB液体培养基中,37℃摇床震荡培养12 h后进行菌液PCR验证,验证正确的阳性克隆菌株送华大生物公司测序。测序正确的菌株用80%的甘油保菌。
1.2.3 WY172启动子及不同长度片段瞬时表达载体的构建选择Hind Ⅲ/BamH Ⅰ分别酶切并回收pBI121载体和1.2.2中的含不同长度片段的克隆载体,进行连接,并转化Trans5α感受态细胞,涂布于Kan抗性的LB固体培养基(100 μg/mL),37℃培养16 h。挑取单菌落于Kan抗性的LB液体培养基中,37℃摇床震荡培过夜后进行菌液PCR验证,正确的阳性克隆菌株送华大生物公司测序,测序正确的菌株用80%的甘油保菌。
1.2.4 三亲杂交法转化农杆菌菌株挑选含有目的基因的大肠杆菌菌株,在含有50 μg/mL卡那霉素的LB液体培养基中37℃震荡培养(带有CaMV35S启动子的pBI121载体作为阳性对照),至OD600 nm为0.5时,与LBA4404、HB101感受态等体积混匀,涂布于不含任何抗生素的LB固体培养基上,28℃过夜培养。用接种针将长出的菌落转移到含有100 μg/mL利福霉素和50 μg/mL卡那霉素的固体LB培养基上,28℃培养3-4 d,长出单菌落。将长出的单菌落再次转移到含有100 μg/mL利福霉素和50 μg/mL卡那霉素的LB固体培养基上,挑选单斑在含有50 μg/mL卡那霉素和100 μg/mL利福霉素的LB液体培养基中37℃震荡培养,进行菌液PCR检测,正确的阳性克隆菌株送华大生物公司测序,测序正确的菌株用80%的甘油保菌。
1.2.5 GUS染色利用农杆菌介导的转化法(ATMT)侵染三生烟,将侵染后的烟草叶盘28℃共培养2 d后取样,每个片段启动子取6片叶盘浸泡于GUS染色液[20]中,37℃过夜培养,后将样品转入70%乙醇中脱色至叶片组织无色,观察。
1.2.6 GUS酶活性测定取各样品0.1 g液氮研磨,提取植物总蛋白(CWBIO,Plant Protein Extraction Reagent),-80℃保存。GUS蛋白浓度的测定采用BCA法(Solarbio,BCA Protein Assay),使用多功能酶标仪Infinie 200 PRO测定样品在562 nm处的吸光值,最后根据标准曲线计算样品蛋白浓度。采用Jefferson等[21]报道的方法测定GUS蛋白活性,结果以生成的4-甲基伞形酮(4-methylumbelliferon,4-MU)的量与总蛋白的量和时间的比值(pmol 4-MUG/mg protein/min)来表示。实验设置3次重复。最后使用SPSS软件统计结果。
2 结果 2.1 WY172启动子生物信息学分析在线数据库EPD确认未发现与WY172同源的启动子。对转录因子的预测分析结果显示WY172启动子上游2K序列上共有转录因子结合位点17个(表 1),运用IBS软件绘制基因图谱(图 1),直观地展示出各个转录因子结合位点在基因上的位置,为后续缺失突变位置的确定提供参考。根据转录因子结合位点在序列上的分布位置,以不切断转录因子结合位点为原则,设计了4个缺失突变片段,分别为WY172Q(2 250 bp)、WY172Q1(1 551 bp)、WY172Q2(1 281 bp)和WY172Q3(871 bp)(图 2)。结合前期研究得到的WY172启动子(251 bp),通过Primer Premier 5软件设计了6个引物(表 2)。PlantCARE软件分析结果(表 3)显示,其上游2K序列含有丰富的作用元件,包括光响应元件、脱落酸响应元件、生长素响应元件、茉莉酸甲酯响应元件、创伤诱导元件、厌氧感应元件、参与栅栏叶肉细胞分化的元件及玉米蛋白代谢调节的顺式作用元件等。
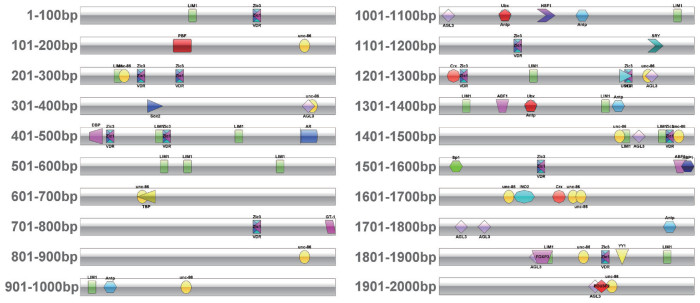
|
| 图中不同形状及颜色的图例代表不同的转录因子 图 1 WY172启动子上游2K序列转录因子分布图 |
通过PCR及产物胶回收,成功获得5个带有酶切位点的不同长度片段,并构建了Teasy-WY172、Teasy-WY172Q、Teasy-WY172Q1、Teasy-WY172Q2、Teasy-WY172Q3共5个载体,菌液PCR结果显示出与目的片段大小基本一致的条带(WY172Q为2 300 bp左右,WY172Q1为1 500 bp左右,WY172Q2为1 300 bp左右,WY172Q3为800 bp左右,WY172为250 bp左右)。并经过华大生物公司测序及NCBI比对结果显示序列相似性为100%,说明成功克隆了WY172启动子及不同长度片段。
2.3 WY172启动子及不同长度片段瞬时表达载体的构建阳性克隆菌株的菌液PCR结果显示获得与目的条带大小一致的片段,华大公司测序结果经过比对显示DNA相似性为100%,获得了重组的植物表达载体pBI121-WY172、pBI121-WY172Q、pBI121-WY172Q1、pBI121-WY172Q2、pBI121-WY172Q3(以pBI121载体作为阳性对照),同时通过Vector NT1绘制了植物表达载体示意图(图 2-A),并利用IBS软件绘制了WY172启动子不同长度片段特征示意图(图 2-C)。将5个重组植物表达载体通过三亲杂交法转化农杆菌,菌液PCR检测结果显示出与目的基因大小一致的特异片段(图 2-B)(WY172Q为2 300 bp左右,WY172Q1为1 500 bp左右,WY172Q2为1 300 bp左右,WY172Q3为800 bp左右,WY172为250 bp左右),经过华大生物公司测序及NCBI比对结果显示序列相似性为100%,说明获得了含有各缺失片段启动子的农杆菌菌株。

|
| A:启动子片段插入pBI121载体的结构示意;B:载体构建PCR检测(其中泳道M为2000 Marker,1为WY172启动子片段,2为WY172Q3启动子片段,3为WY172Q2启动子片段,4为WY172Q1启动子片段,5为WY172Q启动子片段);C:启动子片段特征示意 图 2 不同长度启动子片段及载体构建 |
GUS染色结果(图 3)显示,所有菌株瞬时表达的叶盘都成功染出了蓝色,其中阳性对照菌株(pBI121载体)侵染的叶盘染色最浅,而WY172不同片段菌株侵染的叶盘染色深度均强于阳性对照。pBI121-WY172Q3叶盘染色最深,颜色由深至浅排列是:pBI121-WY172Q3 > pBI121-WY172Q2 > pBI121-WY172Q1 > pBI121-WY172 > pBI121-WY172Q,总体呈现随长度增长GUS染色颜色逐渐变浅的趋势,但WY172Q3片段出现蓝色显著加深现象。结果表明,WY172启动子的5个不同长度片段均能启动GUS基因的表达,其中WY172Q3的表达活性最强。

|
| A:CaMV35S瞬时表达的烟草叶盘;B:WY172瞬时表达的烟草叶盘;C:WY172Q1瞬时表达的烟草叶盘;D:WY172Q2瞬时表达的烟草叶盘;E:WY172Q3瞬时表达的烟草叶盘;F:WY172Q瞬时表达的烟草叶盘 图 3 不同长度启动子片段烟草瞬时表达的GUS染色 |
为测定不同长度片段的酶活性,绘制了BSA标准曲线和4-MU标准曲线,R2值分别为0.999 5和0.999 8,达到了测定要求(图 4)。SPSS软件统计酶活性分析结果(图 5)显示,野生型几乎检测不到酶活性,而CaMV35S启动子和5个WY172不同长度片段启动子均具有驱动GUS基因表达的酶活性,GUS酶活性趋势为:WY172Q3 > WY172Q2 > WY172Q1 > WY172 > WY172Q > CaMV35S,总体呈现随长度的增长活性逐渐递减趋势,但在WY172Q3处酶活性出现显著回升。酶活性检测结果与GUS染色结果一致,再次证明WY172启动子的5个不同长度片段均具有启动子活性,WY172Q3表达活性最强。
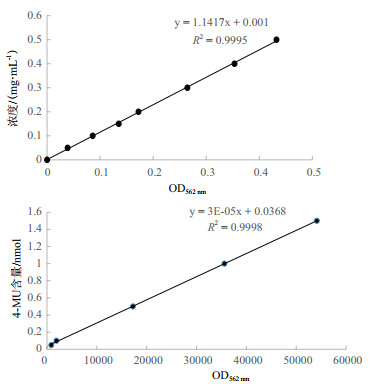
|
| 图 4 BSA标准曲线和4-MU标准曲线 |
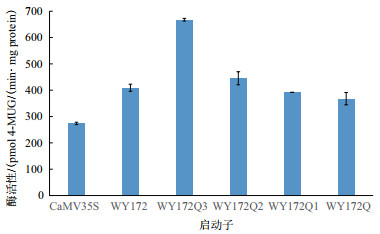
|
| 图 5 不同长度启动子片段烟草瞬时表达的GUS酶活性 |
通过对不同长度启动子的表达活性进行分析可以得知启动子发挥作用的能力[22-23],为充分解读其对基因的调控表达过程及后续应用奠定基础。橡胶树白粉菌是一种专性寄生菌,分子研究严重落后,启动子方面的研究更是少之又少[24]。目前,已见报道的研究多集中于启动子的筛选和鉴定。本实验室前期通过不同卡那霉素浓度下启动子的耐受性大小来筛选强启动子,并以橡胶树白粉菌基因组为研究对象,鉴定出多个在单子叶和双子叶植物中均能表达的强启动子。在此研究的基础上,本研究聚焦于WY172启动子不同长度片段驱动外源基因表达的能力,以WY172启动子上游2K序列为研究对象,进行渐变缺失突变,分析不同片段驱动GUS基因的表达活性。
本研究经过初步分析发现WY172启动子上游2K序列含有丰富的顺式作用元件,其中有参与创伤反应的WUN-motif作用元件,厌氧感应的ARE顺式作用元件,参与叶肉细胞栅栏组织分化的HD-Zip1元件,参与玉米蛋白代谢调节的O2-site顺式作用元件,以及参与昼夜控制的circadian顺式作用元件等功能作用元件,还有茉莉酸甲酯响应、赤霉素响应、生长素响应等激素作用元件,此外还有低温响应、光响应元件等非生物因素的作用元件。这表明WY172启动子很可能在植物生长的各个阶段都能发挥作用,多样性的元件也为下一步高效表达外源基因的启动子的开发提供了可能,为WY172启动子的进一步研究和开发奠定了基础。
GUS染色结果及酶活性检测表明,在调控GUS基因表达方面,WY172启动子的不同长度片段都具有比CaMV35S启动子强的启动子活性。CaMV35S启动子是目前国际上应用最广、活性最强的启动子之一,但随着研究的深入,该类启动子在应用上的不足已经显现地越来越明显[25]。WY172启动子的不同长度片段均具有比CaMV35S启动子更强的活性,这为基因工程工具的开发提供另外一个可能性。在后续实验中将会对WY172启动子的具体类型及应用范围等进行分析,以便为基因工程开发一个更有效的启动子工具。
顺式作用元件的种类和数量的不同,以及转录因子结合位点的差异,都有可能影响基因的表达效果。活性分析结果显示,WY172不同片段的活性强弱关系为WY172Q3 > WY172Q2 > WY172Q1 > WY172 > WY172Q > CaMV35S。WY172Q3段启动子表达活性升高可能是由于在251 bp-821 bp区段含有转录激活元件,使得该区段具有显著增强效应;WY172Q2段启动子区段也有增强效应但表达活性低于251 bp-821 bp段的原因,一个可能是821 bp-1 281 bp区段含有的激活元件种类和数量都少于WY172Q3段,也可能是821 bp-1 281 bp区段同时含有抑制表达元件,与251 bp-821 bp区段中的一部分激活元件的功能相抵了;WY172Q1段启动子及WY172Q段启动子表达活性降低,可能是由于1 281 bp-2 250 bp区段含有抑制表达元件,导致了抑制效应。未来,我们将会对具体的抑制、激活元件进行定位及探究,从而研究该启动子不同情况下的表达量变化。
我们的启动子来源于丝状真菌,这类真菌表达外源蛋白的量比较低[26],为实现外源基因的高效表达,通常需要强大的启动子来驱动基因的转录,但目前针对丝状真菌启动子的研究与应用比较少,主要是木霉属(Trichoderma)和黑曲霉属(Aspergillus niger)的一些启动子[27]。除此之外,丝状真菌启动子大部分都只能应用于自身菌体中外源基因的表达,而来源于橡胶树白粉菌的WY172启动子不仅具有丝状真菌启动子的优点,还可以应用于植物,这为其推广和应用提供了更大的可能。为后续对于其下游基因和调控方式的确定提供方向、奠定基础,同时从一定程度上也促进了橡胶树白粉菌的分子系统发育和形态学分析研究工作。
4 结论本研究克隆了WY172启动子及其4个不同长度的缺失片段,并构建了植物表达载体,通过GUS染色和酶活性检测,对启动子表达活性进行了定性和定量分析。证明以上WY172启动子5个不同长度片段均具有启动子活性,均能驱动GUS基因的表达。GUS染色结果显示WY172启动子不同长度片段的蓝色强度均优于阳性对照CaMV35S启动子,其中WY172Q3驱动GUS基因表达的酶活性最高。且酶活性检测也与GUS染色结果相符。不同片段的缺失对表达活性的影响不同,pBI121-WY172Q3启动子表达活性最强。
| [1] |
孙先花, 苏小运. 丝状真菌启动子的基因工程改造进展[J]. 广西科学, 2017, 24(1): 73-76. |
| [2] |
Juven-Gershon T, Hsu JY, Theisen JW, et al. The RNA polymerase Ⅱ core promoter—the gateway to transcription[J]. Current Opinion in Cell Biology, 2008, 20(3): 253-259. DOI:10.1016/j.ceb.2008.03.003 |
| [3] |
Martínez F, Arif A, Nebauer SG, et al. A fungal transcription factor gene is expressed in plants from its own promoter and improves drought tolerance[J]. Planta, 2015, 242(1): 1-14. |
| [4] |
Mitsuhara I, Ugaki M, Hirochika H, et al. Efficient promoter cassettes for enhanced expression of foreign genes in dicotyledonous and monocotyledonous plants[J]. Plant & Cell Physiology, 1996, 37(1): 49-59. |
| [5] |
Muhitch MJ, Shatters RG. Regulation of the maize ubiquitin(Ubi-1)promoter in developing maize(Zea mays L.)seeds examined using transient gene expression in kernels grown in vitro[J]. Plant Cell Reports, 1998, 17(6-7): 476-481. DOI:10.1007/s002990050428 |
| [6] |
Schledzewski K, Mendel RR. Quantitative transient gene-expression—comparison of the promoters for maize polyubiquitin 1, rice actin 1, maize-derived EMU and CaMV 35S in cells of barley, maize and tobacco[J]. Transgenic Research, 1994, 3(4): 249-255. DOI:10.1007/BF02336778 |
| [7] |
Lessard PA, Kulaveerasingam H, York GM, et al. Manipulating gene expression for the metabolic engineering of plants[J]. Metabolic Engineering, 2002, 4(1): 67-79. DOI:10.1006/mben.2001.0210 |
| [8] |
汤方, 涂慧珍. 真核启动子研究进展[J]. 林业科技开发, 2015, 29(2): 7-12. |
| [9] |
Marilyn GW. Stable production of recombinant proteins in filamentous fungi - problems and improvements[J]. Mycologist, 2003, 17(3): 140-144. DOI:10.1017/S0269915X03003033 |
| [10] |
Minetoki T, Tsuboi H, Koda A, et al. Development of high expression system with the improved promoter using the cis-acting element in Aspergillus species[J]. J Biol Macromol, 2003, 3: 89-96. |
| [11] |
雷达, 许杨, 李燕萍, 等. 曲霉属蛋白表达中高效启动子的应用研究[J]. 食品工业科技, 2013, 34(13): 342-345. |
| [12] |
孟祥锋.瑞氏木霉纤维二糖水解酶(CBHⅠ)丝状真菌表达体系的构建[D].泰安: 山东大学, 2010. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y1790919
|
| [13] |
Wastie RL, Chee KH, Lim TM. Screening clones of Hevea brasiliensis for disease resistance-a review[J]. Planter, Kuala Lumpur, 1973, 49(565): 164-169. |
| [14] |
Liang P, Liu S, Xu F, et al. Corrigendum:Powdery mildews are characterized by contracted carbohydrate metabolism and diverse effectors to adapt to obligate biotrophic lifestyle[J]. Front Microbiol, 2019, 10. DOI:10.3389/fmicb |
| [15] |
徐良向, 刘耀, 廖小淼, 等. 启动子探针载体的构建及橡胶树白粉菌启动子筛选鉴定[J]. 生物技术通报, 2019, 35(1): 51-57. |
| [16] |
缪卫国, 王义, 徐良向, 等.橡胶树白粉菌内源启动子WY7及其用途: 中国, CN107974455A[P]. 2018-05-01.
|
| [17] |
缪卫国, 王义, 刘文波, 郑服丛.橡胶树白粉菌内源启动子WY51及其用途: 中国, CN108374012A[P]. 2018-08-07.
|
| [18] |
缪卫国, 王义, 刘文波, 郑服丛.橡胶树白粉菌内源启动子WY193及其用途: 中国, CN107974454A[P], 2018-05-01.
|
| [19] |
张源源, 张晓飞, 高新生, 李维国. 不同品系橡胶树的花序性状差异研究[J]. 热带农业科学, 2015, 35(1): 1-6, 10. DOI:10.3969/j.issn.1009-2196.2015.01.001 |
| [20] |
Zheng L, Liu G, Meng X, et al. A WRKY gene from Tamarix hispida, ThWRKY4, mediates abiotic stress responses by modulating reactive oxygen species and expression of stress-responsive genes[J]. Plant Molecular Biology, 2013, 82(4-5): 303-320. DOI:10.1007/s11103-013-0063-y |
| [21] |
Jefferson RA, Kavanagh TA, Bevan MW. GUS fusions:beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. The EMBO Journal, 1987, 6(13): 3901-3907. DOI:10.1002/j.1460-2075.1987.tb02730.x |
| [22] |
Nikolić DB, Samardžić JT, Bratić AM, et al. Buckwheat(Fagopyrum esculentum Moench)FeMT3 gene in heavy metal stress:protective role of the protein and inducibility of the promoter region under Cu2+ and Cd2+ treatments[J]. J Agric Food Chem, 2010, 58(6): 3488-3494. DOI:10.1021/jf904483a |
| [23] |
杨桂燕, 郭宇聪, 张凤娇, 等. 不同长度ThVHAc1基因启动子片段分离及活性分析[J]. 林业科学, 2016, 52(1): 55-61. |
| [24] |
Li X, Bi ZH, Di R, et al. Identification of powdery mildew responsive genes in Hevea brasiliensis through mRNA differential display[J]. International Journal of Molecular Sciences, 2016, 17(2): pii:E181. DOI:10.3390/ijms17020181 |
| [25] |
Tao YB, He LL, Niu LJ, et al. Isolation and characterization of an ubiquitin extension protein gene(JcUEP)promoter from Jatropha curcas[J]. Planta, 2015, 241(4): 823-836. DOI:10.1007/s00425-014-2222-z |
| [26] |
Gouka RJ, Punt PJ, Ca VDH. Efficient production of secreted proteins by Aspergillus:progress, limitations and prospects[J]. Appl Microbiol Biotechnol, 1997, 47(1): 1-11. |
| [27] |
林涛, 黄建忠. 丝状真菌启动子研究进展[J]. 安徽农业科学, 2013, 41(7): 2862-2863. DOI:10.3969/j.issn.0517-6611.2013.07.016 |







