2. 吉林省农业科学院大豆研究所,长春 130033
2. Soybean Research Institute, Jilin Academy of Agricultural Sciences, Changchun 130033
杂种优势(Heterosis)指具有不同遗传性状的两个纯系父母本杂交产生子一代,即杂交种,其后代在抗逆性、抗病性、适应性、生长以及品质和产量等方面均优于父母本的生物现象[1]。由于全球人口不断增加,可耕地面积有限,通过作物杂种优势利用,可大幅提升农作物的产量和品质,提高土地利用效率和产出[2-3]。杂种优势利用一般都基于雄性不育系统,在作物中应用最多的是细胞质雄性不育(Cytoplasmic male sterility,CMS)系统,其由不育系、保持系和恢复系构成,不育系和恢复系杂交F1代,即为杂交种。细胞质雄性不育是因为线粒体基因和核基因互作,导致不育系不能产生有活力的花粉或花粉绒毡层异构化发生败育,而恢复系中细胞核恢复基因(Fertility restorer gene,Rf)编码的线粒体靶向蛋白可以影响不育基因转录和翻译,从而使得育性恢复[4]。
在恢复系选育过程中,Rf基因的有无主要通过引进资源与母本逐个测交来检测,费时费力。精细定位并克隆Rf基因,利用分子标记技术辅助选育(Marker assisted selection,MAS)或转基因、基因编辑等手段人工创制恢复系,可以提升恢复系的选育进程,缩短杂交种选育周期。因此,本文针对主要农作物Rf基因的遗传模式、分子标记定位、克隆的研究进展及利用CMS/Rf系统在作物杂交种创制中的应用进行了论述。
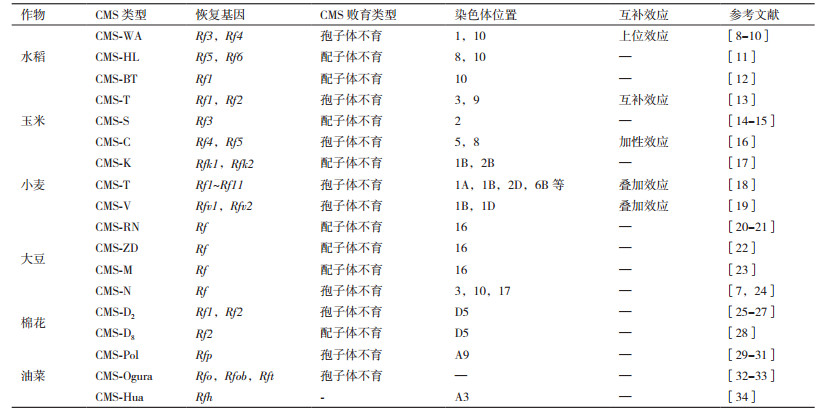
1 主要作物Rf基因的遗传模式成功选育杂交“三系”中的恢复系是创制杂交种的重要一环,而研究恢复基因的遗传模式是选育强恢复系的理论基础。CMS的育性恢复基因的遗传模式有两种,即以孢子体不育胞质为基础的遗传模式和以配子体不育胞质为基础的遗传模式。以孢子体不育胞质为母本,若恢复其育性的基因由1对基因控制,则其后代的分离比为3:1,依次类推。以配子体不育胞质为母本,若恢复其育性的基因由1对基因控制,则其后代的分离比为1:1,依次类推。由于其受体母本和决定基因的差异,导致对应的Rf基因的遗传方式也有所差异[5-7]。对此,针对国内外主要农作物不育细胞质类型及对应的Rf基因进行归纳,如表 1所示。
CMS/Rf系统可以经济且有效地生产杂交种,其育性可以被Rf基因恢复。研究者通过构建临时分离群体或永久性分离群体对相关Rf基因进行定位。随着分子技术、基因组学和测序技术的深入,现已获得了大量与水稻、玉米等主要作物Rf基因连锁的标记,其中有12个Rf基因被克隆鉴定。这些Rf基因大多属于PPR基因家族,其编码的PPR蛋白通过影响不育基因的转录本和翻译产物致使育性恢复。因此,精细定位和克隆Rf基因可以为创制有效的强恢复系创造基础条件。下面具体阐述主要作物Rf基因的定位和克隆。
2.1 水稻(Oryza sativa)主要类型Rf基因的定位与克隆水稻目前已经有超过60种不育胞质被报道,研究和应用最多的是野败型(CMS-WA)、红莲型(CMS-HL)和包台型(CMS-BT)[35]。对应的恢复系也种类繁多,但其携带的Rf基因不尽相同。大量研究证明,水稻的主效Rf基因集中定位于1、8和10号染色体上,部分基因已被克隆。这为水稻恢复系MAS和定向创制提供理论基础。
2.1.1 CMS-WA型CMS-WA型水稻的Rf基因研究是最多且最深入的。现今一般认为CMS-WA育性恢复以2对主效基因控制。Bharaj等[36]最先鉴定出了两个恢复基因Rf-WA-1(主效)和Rf-WA-2(微效),其分别定位于7号和10号染色体上。随后,景润春等[9]在恢复系IR24中也检测到2对主效基因,即Rf3和Rf4,通过ISSR和SSLP标记定位到1号和10号染色体上。此外,Balaji等[37],Cai等[10]也利用不同的材料,分别通过InDel和SSSL标记将Rf3,Rf4基因定位在1号和10号染色体上,其中Rf3的效应大于Rf4且存在一定的加性效应。但有学者在7号染色体上仅定位获得1对野败型育性Rf基因,且于RM182紧密连锁[38]。Kazama等[39]基于图位克隆法鉴定了CMS-WA型水稻的Rf4基因,其含有多个PPR基序,通过减少orf352基因的转录本,从而恢复花粉生育力。Tang等[40]也通过图位克隆法获得3个Rf4候选基因,最终通过农杆菌转化验证了PPR9-782-M基因为Rf4基因,其编码782个氨基酸,具有育性恢复的能力。
2.1.2 CMS-HL型CMS-HL型不育细胞质从红芒野生稻中选育而来,是配子体不育类型。目前认为CMS-HL育性恢复受1对主效基因控制。已定位发现的Rf基因有Rf5和Rf6。Liu等[11]利用RFLP、RAP和SSR标记将密阳23中的Rf5定位于10号染色体的RM5456和RM171标记之间,两标记的遗传距离为5.57 cM。Huang等[41]将Rf6基因定位于8号染色体的RM407和SNP32,其物理距离为16.8 kb。目前Rf5和Rf6基因已被克隆和鉴定,Rf5与CMS-BT的Rf1a基因很相似,但Rf5编码的蛋白在剪切atp6-orfH79转录本时具有不同的方式;Rf6可以编码894个氨基酸,并含有20个PPR基序[41-42]。
2.1.3 CMS-BT型CMS-BT型水稻与HL型类似,属于配子体不育类型。目前已定位克隆了1对Rf基因,即Rf1,其位于10号染色体上。1975年由Shinjyo最先检测到Rf1基因。之后不同学者的相关研究,得出了一致的结论。例如,Komori等[43]利用稳定的RFLP标记将Rf1基因精细定位到10号染色体的S12564Tsp509I和C1361MwoI之间,其遗传距离仅有0.3 cM。Wang等[44]通过图位克隆法获得了Rf1基因,研究表明Rf1基因中含有多个重复的PPR基序,其基因座中有2个完整的开放阅读框,即Rf-1a,Rf-1b。其编码的线粒体靶向蛋白作用于atp6-orf79基因上,使mRNA降解,从而减少毒性蛋白,最终恢复不育系育性。
2.2 玉米(Zea mays)主要类型Rf基因的定位与克隆玉米CMS距今已经有超过40种不育胞质,大致有CMS-T、S、C型3个组群[45],其CMS/Rf系统也是应用最成功的作物之一。结合全基因组关联分析得出,玉米的主效Rf基因有5个,即Rf1~Rf5,其主要分布在2、3、5、8和9号染色体上,这为玉米Rf基因的克隆指明了方向。
2.2.1 CMS-T型CMS-T型玉米是孢子体不育类型。目前研究证明的T型Rf基因有Rf1和Rf2,且存在互补效应。Wise等[13]最先利用RFLP分子标记将Rf1基因定位于3号染色体的umc97和umc92之间;Rf2基因定位于9号染色体的umc153和sus1之间。Cui等[46]通过转座子标签法克隆到CMS-T型玉米的第一个Rf基因Rf2,序列表明Rf2编码的蛋白不含PPR,而是一种存在两个基因座的乙醛脱氢酶,推测其通过影响线粒体的功能致使育性恢复。
2.2.2 CMS-S型CMS-S型玉米是配子体不育类型,其育性易受环境因素的影响,仅靠1对Rf3基因控制育性恢复。Kamps等[47]最先利用RFLP标记检测定位到位于2号染色体上的Rf3基因,与其紧密连锁的标记为whp和bnl17.14,两标记相距10.7 cM。Zhang等[15]利用SSR、AFLP、SCAR、CAPS等标记进行筛选,结果表明,Rf3基因位于2号染色体长臂上的E7P6和Scare12M7之间,遗传距离分别为0.9 cM和1.8 cM[15]。李鹏等[48]根据SSR标记获得了与Rf3基因紧密连锁的标记A165和CG2,此区间仅有两个完整的基因,推测其中一个可能为Rf3基因。李文明[49]采用SSR标记结合SNP标记筛选,将Rf3基因定位于2号染色体的SNP-234011至SNP-227652之间,其间包含641 kb,并存在6个线粒体靶向基因。李鹏等[48]进一步通过定位结果推测GRMZM2G450166基因可能是Rf3基因,其序列编码一个由814个氨基酸组成的PPR家族蛋白,预测此蛋白可以降解不育基因orf355/orf77转录的mRNA,从而恢复花粉的育性,并进一步构建载体通过转基因技术验证其功能。但是,目前Rf3基因仍未明确被克隆。
2.2.3 CMS-C型目前在CMS-C型玉米中已发现了位于8号和5号染色体上的Rf4和Rf5,且二者存在加性效应。Rf4恢复能力明显强于Rf5。刘伟华等[50]通过SSR标记和InDel标记,将Rf4基因定位在umc1483和8号染色体短臂末端之间。邵可可等[16]同样利用SSR、InDel标记进行筛选,将Rf4基因精细定位在8号染色体的X-21-1与X-33之间,其间仅有60 kb。牟碧涛等[51]证明Z16中存在1对恢复基因,并获得与Rf5基因紧密连锁的标记为B-1。Liu等[52]在A619中发现了与Rf5不同的基因Rf*-A619。孙玲凌[53],邵可可[16]分别利用转座子标签法和图位克隆法克隆了Rf4基因,Rf4基因不含PPR基序也没有发现线粒体靶向信号肽,是RNA聚合酶Ⅱ的转录因子,但其如何解除不育基因产生的毒性蛋白,还需进一步探究。
2.3 小麦(Triticum aestivuml)主要类型Rf基因的定位与克隆小麦作为第三大粮食作物,属自花授粉的六倍体作物,其基因组比较庞大且复杂,因此小麦的CMS系统研究相对困难。目前,研究最多的主要是CMS-T、K和V型3种,现已检测和定位的Rf基因已经超过16个。经Rf基因的逐步解析,方便了强恢复系的选育,有效的解决了恢复系稀少的问题。
2.3.1 CMS-K型CMS-K型小麦的不育胞质源于粘果山羊草,是最有潜力的配子体不育类型,但其对应的强恢复系较少,这是限制CMS-K型小麦应用的主要因素。因此,定位并克隆CMS-K型Rf基因有助于其杂交系统在生产上的应用。现今发现和定位的CMS-K型Rf基因是位于1BS和2BL上的Rfk1和Rfk2。詹克慧[54]研究表明,Rfk1与Rfk2有叠加效应,Rfk1基因定位在1BS染色体的Xgwm11和Xgwm347之间,Rfk2基因定位在2BL染色体的Xgwm526附近。孙文鑫[17]对这两个主效Rf基因进行定位,而且证明了Rfk1恢复力强于Rfk2,但Rfk1与Rfk2的克隆还未见报道。
2.3.2 CMS-T型CMS-T型小麦的不育胞质源于提莫菲维小麦,是不育胞质最稳定且应用最广的小麦类型。目前已报道的T型恢复系中的Rf基因共有11个,即Rf1-Rf11。近年来,关荣霞等[55]利用ISSR和SSR标记筛选,将Rf6基因标定在UBC-808和UBC-848之间。李志宽等[18]利用196对SSR和ISSR标记将Rf1定位在6BS的Xgwm193和Xgwm1079之间;Rf4定位在1AS的Xgwm7062和Xgwm136之间。Sinha等[56]发现了一个新的恢复基因Rf8,其位于2DS上的Xwmc503与Xgwm296之间。段阳[57]选取SSR和EST-STS标记,将Rf3定位在1BS的Xfba329和BE425889之间,遗传距离为2.4 cM和1.7 cM。些定位研究为相关Rf基因的克隆奠定基础。
2.3.3 CMS-V型及其他类型除了上述两种常用的不育类型外,研究较多的类型有CMS-V型、CMS-AL型和CMS-BNS型等。石运庆等[19]在CMS-V型恢复系济南13的1B染色体上检测到Rfv1基因,获得了4个连锁的SSR标记,遗传距离均小于9 cM。桂安胜[58]以CMS-AL型材料为亲本,利用BAS法结合SSR标记将Rf基因定位在1B染色体的Xgwm413和Xbarc8之间。孙慧慧等[59]利用SSR标记在CMS-BNS型小麦恢复系中国春中发现位于1A染色体上的1个主效Rf基因位点,但未定位到具体位置。
2.4 大豆(Glycine max)主要类型Rf基因的定位与克隆大豆属油粮兼用作物,杂种优势利用相比水稻、玉米起步较晚,Rf基因的定位研究也甚少。目前报道的大豆CMS类型主要有CMS-RN、ZD、M和N型。近些年来大豆杂种优势利用逐渐成为热点,其Rf基因的研究也逐渐深入。现已检测到的Rf基因出现在3,5,10,16,17染色体上,均未被克隆。研究者采取的策略也趋向一致,都是通过BSA法结合SSR标记进行Rf基因的定位,这为探索大豆育性恢复机理、进一步精细定位和克隆,最终应用于实践生产提供参考。
2.4.1 CMS-RN型CMS-RN型是典型的配子体不育类型,其育性恢复仅靠1对显性基因控制。赵丽梅等[20]首次利用SSR标记,将Rf基因定位于16号染色体的Satt547附近。Wang等[21]进一步将Rf基因缩小至Sctt_011和Satt547之间。之后,任良真[6]和王鹏年[60]均以RN型材料为亲本将Rf基因均定位在16号染色体上,定位区间在500 kb左右,其间有8个PPR家族基因。
2.4.2 CMS-M型CMS-M型也是配子体不育类型。汤复跃等[5]利用BSA结合SSR标记技术将Rf基因定位到5号染色体上的Satt276和Satt545之间,2个标记相距1.15 Mb。但在2016年,Wang等[23]利用同样的亲本对Rf基因进行了精细定位,但其位于16号染色体GmSSR1602和GmSSR1610之间的162.4 kb的区段内,并非5号染色体,遗传距离分别为0.11 cM和0.25 cM。在此区域内有19个ORF,其含7个PPR家族基因。其结果与RN型不育恢复基因的定位区间相近。可能造成这种结果的原因是分离群体过少或者遗传背景出现了误差等。
2.4.3 CMS-N型及其他类型CMS-N型尚未应用于生产,主要用于基础研究,其Rf基因与前两种类型都不同。陶银[61]利用923对SSR标记筛选,将Rf基因定位在Sat_084和Sat_208之间,两标记遗传距离为2.9 cM,物理距离为11.5 Mb。董建生等[24]研究发现中豆5号中含有2对存在叠加效应的Rf基因,通过SSR标记筛选获得一个连锁的标记Satt135,其位于17号染色体上。李曙光等[62]在10号染色体上发现一个新的Rf基因,并定位在Satt311和Satt477之间。
除此之外,近年来其他类型的Rf基因也被定位。例如,焦东燕[7]将可以恢复CMS-ZD型不育系的Rf基因定位在BARCSOYSSR-16-1040和satt547之间。之后Dong等[22]通过BSA结合SSR标记建立高密度连锁遗传图谱缩小了ZD型Rf基因的定位区间,连锁的标记为BARCSOYSSR-16-1064和BARCSOYSSR-16-1082,遗传距离分别为0.59 cM和0.83 cM。连世超等[63]以山西材料为亲本,在1号染色体上发现Rf基因。但由于群体数量较少,遗传背景复杂,其定位区间均较大。
2.5 油菜(Brassica napus)主要类型Rf基因的定位与克隆油菜是重要的油料作物,其杂种优势也比较明显。现今以CMS-Pol和CMS-Ogura系统应用最广,前一种属同源CMS,后一种属异源CMS。目前在油菜中已获得了与Rf基因连锁的标记,其中Rfo和Rfp已被克隆。
2.5.1 CMS-Pol型CMS-Pol型油菜育性可被1对主效Rf基因恢复,即Rfp。Liu等[30]创建回交群体,经SSR和SCAR标记筛选,将Rfp基因精细定位在A9染色体的Os36和Brs06之间,遗传距离分别为0.1 cM和0.02 cM,物理距离仅为29.2 kb。此区间存在7个完整的ORF,其中ORF2可以编码PPR蛋白,可能是Rfp基因。之后郭秀娟等[29],罗莉斯等[64]利用BSA法结合SSR标记分别获得Rfp基因紧密连锁的SSR标记,即Ol13-E08和Os31,与Liu等的定位区间相近。Liu等[65]通过图位克隆法克隆获得一个编码PPR蛋白的基因,即Rfp基因,全长1 953 bp,含有15个PPR重复单元,通过加工atp6-orf224基因的转录本,致使不育系育性恢复。
2.5.2 CMS-Ogur型及其他类型CMS-Ogura型油菜的不育细胞质来源于萝卜,筛选其恢复系研究者进行了大量的工作,但未筛选到理想的恢复系。最后,学者将CMS-Ogura型萝卜中的强恢复基因导入油菜中,可以较强的恢复Ogura-CMS型油菜的育性[66]。目前定位鉴定的CMS-Ogura型油菜的育性恢复基因主要有3个,即Rfo、Rfob和Rft。例如,Brown等[31]利用RFLP标记将Rfo基因定位在R12和L40之间。最后克隆获得该Rf基因g26,其大小为687 bp,含有16个PPR重复单元,可以降低不育基因ORF138产生的毒性蛋白,致使育性恢复。Uyttewaal等[67]利用图位克隆法获得Rfo基因,其含有3个PPR基因座,其中PPR-B基因座编码的蛋白可以调控不育基因的转录本。
除此之外,其他类型的恢复基因定位也取得了很大的进展。官春云等[33]以野油胞质不育系为背景,利用1 500多对SSR引物Rf基因定位于CB10316和BnGMS171之间。郝建轶等[68]基于Rf基因的特点克隆获得了一段长309 bp的序列,其编码的蛋白含有2个PPR基序。Wei等[34]利用SSR和SNP标记将恢复CMS-Hua型不育系的Rfh基因定位在A3染色体的A03TPRSNP3和mrSSR52之间,两标记间仅有94 kb。易聪聪[32]建立了CMS-Mor型回交分离群体,利用3种标记获得与Rfm基因共分离的标记YSSR-127,遗传距离为1.1 cM,此Rfm基因是一个配子体遗传的显性单基因。
2.6 棉花(Gossypium spp.)主要类型Rf基因的定位与克隆棉花也是杂种优势利用研究热点。早在1975年棉花就已经实现“三系”配套。但由于棉花的育性不稳定、恢复系恢复能力弱等问题,导致杂交棉受到了限制,因此亟需筛选到恢复力强的Rf基因,应用于强恢复系的选育。近年来,来源于哈克尼西棉的CMS-D2和来源于三裂棉的CMS-D8的研究居多。刘利彩等[25]以CMS-D2型棉花为亲本,通过BSA结合SSCP标记获得与Rf1基因连锁标记BNL3535和343501-1,其遗传距离分别为2.9 cM和3.2 cM,物理距离164 kb,含有9个PPR家族基因。Wu等[26]在CMS-D2型恢复系ZBR中获得4个与Rf1基因共分离的InDel标记。之后,尤春源等[69]筛选定位来源于不同国家恢复系,获得了与Rf基因连锁的SSR,STS和RAPD标记,为进一步克隆奠定分子基础。此外,Wang等[28]建立CMS-D8型回交群体,利用RAPD标记结合CAPS标记将Rf2基因定位于D5染色体的UBC352-900和UBC683-500之间。杨路明[70],李丹[71]通过图位克隆法分别以不同的供试材料,成功克隆了Rf1基因,并对其PPR家族进行分析。结果表明,定位区间有4个ORF可以编码PPR蛋白且存在线粒体靶向信号,其中ORF3为Rf1基因,CDS长1779 bp,含有10个PPR重复基序。这对解决恢复系的恢复力弱,恢复源少等问题具有至关重要的指导意义。
3 CMS/Rf系统在主要作物杂交育种上的应用杂交水稻由我国首创,是拥有自主知识产权的农作物之一。从简单的“三系法”育种到超级稻问世,再到第三代杂交水稻的诞生,对解决世界粮食问题有着非凡的意义。水稻杂交制种最早利用的是袁隆平院士发现的WA型CMS/Rf系统,由其育成的品种汕优63,主导杂交水稻市场长达24年之久。特优63、协优46和冈优22等品种在20世纪90年代也曾被大量推广。这其中具有强恢复力和高配合力的优良恢复系明恢63的育成,对杂交水稻育种有重要意义。随着两系法水稻品种如两优培九的大面积推广,三系法品种的市场占有率逐渐萎缩。
我国最早于20世纪80年代开展杂交大豆研究,1993年育成世界上第一个真正的大豆细胞质雄性不育系,即RN型;1995年,找到恢复系实现三系配套,同样拥有自主知识产权[60]。目前,RN型CMS/Rf系统是创制大豆杂交种最多的类型,已有18个品种审定,已在东北大豆主产区大面积推广。其中杂交种吉育612两年区域试验平均较对照增产16%以上,且蛋白、脂肪合计达到了国家优质双高大豆标准,实现了产量与品质双提升的飞跃[72]。吉育609、吉育635和吉育639也同样实现优质与高产结合,其脂肪含量均达22%以上。其他细胞质类型的杂交品种也相继被审定,如利用M型CMS/Rf系统创制的杂优豆系列,ZD型CMS/Rf系统创制的阜杂交豆系列,但这些品种繁殖系数较低,尚未像吉育系列品种在生产上大规模应用。
杂交油菜主要种植在我国西北和西南地区,1972年,傅廷栋院士首次发现甘蓝型油菜中的CMS-Pol型不育系,被认为是世界上第一个实际应用的油菜细胞质。从1985年世界上第一个油菜杂交种秦油二号育成起,开创了杂交油菜产业化应用时代[73]。目前,以Pol型CMS/Rf系统选育的品种,如华杂系列在生产上推广面积最大。如华杂2号于1992年通过湖北省品种审定委员会审定,是我国第一个低芥酸油菜杂交种;最新审定的华油杂62R作为我国首批具有应用价值的抗根肿病油菜杂交种也通过专家鉴定,在生产上开始推广应用。除此之外,中油杂系列、秦油系列品种、陇油系列品种也是应用较广的油菜杂交种。
小麦细胞质雄性不育最早在1951年由日本学者发现,开启了杂交小麦研究元年。我国学者利用CMS/Rf系统也育成了一些杂交小麦品种,如利用K型CMS/Rf系统选育成功的901,利用T型CMS/Rf系统育成的T师优1号等。但在杂交小麦品种选育中也发现,T型杂交小麦很难选出强优势组合,且存在易倒伏的问题,而K型和V型选育的杂交种中,常常伴随单倍体植株,这些都制约了三系杂交小麦的发展。随着光、温敏核不育系的发现,其克服了细胞质雄性不育的缺点,逐渐在生产上被大规模应用。
我国作为主要的棉花产区,杂交棉花近些年发展也比较迅猛,大量杂交品种育成。利用CMS/Rf系统育成的一些代表性品种如豫棉杂1号、邯杂301等,也在生产上推广应用,尤其在我国最大的杂交棉花种植区长江流域。但杂交棉花的推广也存在一些技术问题,如杂交制种主要还是以人工去雄授粉为主,耗费大量人力、财力,这极大地限制了棉花杂交种的生产。
除上述作物外,杂交玉米作为种子杂交化最高的作物,因其属异花授粉属性,父母本间杂交非常容易,利用具有优良性状的自交系间进行杂交育种,获得的杂交种性状整齐、抗性更强及稳定性更好。因此基本不采用CMS/Rf系统进行品种选育,尤其是玉米的CMS/Rf系统还存在育性不稳定、易受环境影响、对应的恢复系资源稀少及恢复能力弱等问题。
4 总结与展望细胞质雄性不育是利用杂种优势改变其产量的主要方法之一,其中选育稳定不育系和强恢复系是利用杂优关键步骤。目前对于不育系相关分子基础研究已有很大突破,但恢复系中恢复基因的研究相对滞后。相比常规方法选育强恢复系,利用与恢复基因紧密连锁标记对早期世代进行筛选,不仅可以缩短选育周期、减少工作量,同时可以鉴定恢复系和保持系。对于育性恢复基因的定位,研究者基本均是利用常用的SSR、RAPD、ISSR、InDels及SNPs等分子标记结合高通量测序技术,将不同材料上的Rf基因锁定到染色体的特定区间,进一步筛选基因和功能验证。随着现代生物技术、基因组学和测序技术的进步,恢复基因的定位和克隆已经取得了显著进展,部分恢复基因的作用机理也已明晰。目前已经有超过12个恢复基因被克隆,其中除水稻Rf2基因、Rf17基因和玉米Rf4基因外恢复基因均属PPR家族基因,其编码的PPR蛋白是一个简并串联的蛋白,且没有核酸内切酶活性,常常形成复合物剪接、编辑转录本或者改变翻译产物的积累量致使育性恢复。但对于大多数CMS系统中不育基因和恢复基因相互作用,以及线粒体信号传导尚未被鉴定,与Rf基因连锁的标记距离也较远。结合高通量测序技术不仅可以加速在作物CMS系统中开发新的标记和精细定位Rf基因,而且可以挖掘与Rf基因的生物信息通路,对进一步研究作物杂种优势分子调控机制提供信息和新的见解,进而创制新的恢复系来源,可丰富恢复系的遗传基础,促进分子遗传学和杂交选育的发展。利用基因编辑技术可以将优良的保持系转化为环境敏感型不育系,实现“两系”种,进而促进恢复系的选育。
| [1] |
卢庆善, 孙毅, 华泽田. 农作物杂种优势[M]. 北京: 中国农业科技出版社, 2003.
|
| [2] |
石子, 宋伟, 赵久然. 雄性不育在作物杂种优势中的应用途径分析[J]. 中国生物工程杂志, 2018, 38(1): 126-134. |
| [3] |
Luo X, Ma CZ, Yi B, et al. Genetic distance revealed by genomic single nucleotide polymorphisms and their relationships with harvest index heterotic traits in rapeseed(Brassica napus L.)[J]. Euphytica, 2016, 209(1): 1-7. DOI:10.1007/s10681-016-1646-x |
| [4] |
Lee YP, Cho Y, Kim S. A high-resolution linkage map of the Rfd1, a restorer-of-fertility locus for cytoplasmic male sterility in radish(Raphanus sativus L.)produced by a combination of bulked segregant analysis and RNA-Seq[J]. Theoretical and Applied Genetics, 2014, 127(10): 2243-2252. DOI:10.1007/s00122-014-2376-x |
| [5] |
汤复跃, 周立人, 程潇, 等. 大豆M型细胞质雄性不育恢复基因SSR标记初步定位[J]. 大豆科学, 2008(3): 383-386. |
| [6] |
任良真.大豆细胞质雄性不育恢复基因的SSR标记[D].长春: 吉林大学, 2012. http://www.cnki.com.cn/Article/CJFDTotal-DDKX200706008.htm
|
| [7] |
焦东燕.大豆杂种优势及细胞质雄性不育恢复基因的定位[D].石家庄: 河北师范大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10094-1011148096.htm
|
| [8] |
郑瑞丰, 夏胜平, 陈立云. 水稻野败型恢复系恢复基因的遗传及等位性分析[J]. 湖南农业科学, 2010(23): 1-5. DOI:10.3969/j.issn.1006-060X.2010.23.001 |
| [9] |
景润春, 何予卿, 黄青阳. 水稻野败型细胞质雄性不育恢复基因的ISSR和SSLP标记分析[J]. 中国农业科学, 2000, 33(2): 10-15. DOI:10.3321/j.issn:0578-1752.2000.02.002 |
| [10] |
Cai J, Liao QP, Dai ZJ, et al. Allelic differentiations and effects of the Rf3 and Rf4 genes on fertility restoration in rice with wild abortive cytoplasmic male sterility[J]. Biologia Plantarum, 2013, 57(2): 274-280. DOI:10.1007/s10535-012-0294-9 |
| [11] |
Liu XQ, Xu X, Tan YP. Inheritance and molecular mapping of two fertility-restoring loci for Honglian gametophytic cytoplasmic male sterility in rice[J]. Mol Genet Genomics, 2004, 271(5): 586-594. DOI:10.1007/s00438-004-1005-9 |
| [12] |
李广贤, 姚方印, 庄杰云, 等. 水稻细胞质雄性不育的育性遗传及恢复基因的定位研究进展[J]. 杂交水稻, 2006(3): 1-6. DOI:10.3969/j.issn.1005-3956.2006.03.001 |
| [13] |
Wise RP, Schnable PS. Mapping complementary genes in maize:positioning the rf1 and rf2 nuclear-fertility restorer loci of Texas(T)cytoplasm relative to RFLP and visible markers[J]. Theoretical and Applied Genetics, 1994, 88(6): 785-795. |
| [14] |
Xu XB, Liu ZX, Zhang DF. Isolation and analysis of rice Rf1-orthologus PPR genes co-segregating with Rf3 in maize[J]. Plant Mol Biol Rep, 2009, 27(4): 511-517. DOI:10.1007/s11105-009-0105-4 |
| [15] |
Zhang ZF, Wang Y, Zheng YL. AFLP and PCR-based markers linked to Rf3, a fertility restorer gene for S cytoplasmic male sterility in maize[J]. Mol Gen Genomics, 2006, 276(2): 162-169. DOI:10.1007/s00438-006-0131-y |
| [16] |
邵可可.玉米C型胞质雄性不育育性恢复主基因Rf4的精细定位与图位克隆[D].郑州: 河南农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10466-1012275174.htm
|
| [17] |
孙文鑫.小麦K型细胞质雄性不育育性恢复基因的标记定位和效应分析[D].郑州: 河南农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10466-1012274988.htm
|
| [18] |
李志宽, 祝万万, 马守才, 等. 小麦T型细胞质雄性不育恢复基因Rf1和Rf4的SSR标记分析[J]. 农业生物技术学报, 2014, 22(9): 1114-1122. DOI:10.3969/j.issn.1674-7968.2014.09.008 |
| [19] |
石运庆, 牟秋焕, 李鹏, 等. V型小麦细胞质雄性不育系育性恢复基因的SSR分子标记分析[J]. 山东农业科学, 2005(3): 3-5. DOI:10.3969/j.issn.1001-4942.2005.03.001 |
| [20] |
赵丽梅, 王玉民, 孙寰, 等. 大豆细胞质雄性不育恢复基因SSR标记[J]. 大豆科学, 2007(6): 835-839. DOI:10.3969/j.issn.1000-9841.2007.06.006 |
| [21] |
Wang YM, Zhao LM, Wang X, et al. Molecular mapping of a fertility restorer gene for cytoplasmic male sterility in soybean[J]. Plant Breeding, 2010, 129(1): 9-12. DOI:10.1111/j.1439-0523.2009.01626.x |
| [22] |
Dong DK, Li Z, Yuan FJ, et al. Inheritance and fine mapping of a restorer-of-fertility gene for the cytoplasmic male sterility in soybean[J]. Plant Science, 2012, 188-189: 36-40. DOI:10.1016/j.plantsci.2012.02.007 |
| [23] |
Wang DG, Zhang L, Li JK, et al. The restorer gene for soybean M-type cytoplasmic male sterility, Rf-m, is located in a PPR gene-rich region on chromosome 16[J]. Plant Breeding, 2016, 135(3): 342-348. DOI:10.1111/pbr.12357 |
| [24] |
董建生, 杨守萍, 喻德跃, 等. 大豆质核互作雄性不育系NJCMS2A的育性恢复性遗传和育性恢复基因的SSR标记[J]. 大豆科学, 2008(2): 181-185. |
| [25] |
刘利彩, 郭立平, 戚廷香, 等. 棉花细胞质雄性不育恢复基因Rf1候选区域SSCP标记开发与候选基因表达分析[J]. 棉花学报, 2018, 30(1): 12-20. |
| [26] |
Wu J, Zhang M, Zhang X, et al. Development of InDel markers for the restorer gene Rf1 and assessment of their utility for marker-assisted selection in cotton[J]. Euphytica, 2017, 213(11): 2-8. |
| [27] |
曹秀霞, 吴建勇, 邢朝柱, 等. 棉花细胞质雄性不育育性恢复基因的定位及分子标记辅助育种研究进展[J]. 中国农学通报, 2012, 28(6): 8-13. DOI:10.3969/j.issn.1000-6850.2012.06.002 |
| [28] |
Wang F, Stewart JM, Zhang J. Molecular markers linked to the Rf2 fertility restorer gene in cotton[J]. Genome, 2007, 50(9): 818-824. DOI:10.1139/G07-061 |
| [29] |
郭秀娟, 孙万仓, 杨建春. 甘蓝型油菜细胞质雄性不育系L04-05A恢复基因的SSR标记[J]. 山西农业科学, 2015, 43(7): 788-791. DOI:10.3969/j.issn.1002-2481.2015.07.05 |
| [30] |
Liu Z, Liu PW, Long FR, et al. Fine mapping and candidate gene analysis of the nuclear restorer gene Rfp for pol CMS in rapeseed(Brassica napus L.)[J]. Theor Appl Genet, 2012, 125(4): 773-779. DOI:10.1007/s00122-012-1870-2 |
| [31] |
Brown GG, Formanova N, Jin H, et al. The radish Rfo restorer gene of Ogura cytoplasmic male sterility encodes a protein with multiple pentatricopeptide repeats[J]. The Plant Journal, 2003, 35(2): 262-272. DOI:10.1046/j.1365-313X.2003.01799.x |
| [32] |
易聪聪.芥菜型油菜MOR CMS恢复基因的图谱定位[D].武汉: 华中农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10504-1013336905.htm
|
| [33] |
官春云, 尹明智. 利用SSR标记定位油菜细胞质雄性不育系1193A的恢复基因[J]. 植物遗传资源学报, 2015, 16(2): 364-367. |
| [34] |
Wei C, Wang H, Heng S, et al. Construction of restorer lines and molecular mapping for restorer gene of hau cytoplasmic male sterility in Brassica napus[J]. Theoretical and Applied Genetics, 2019, 6(4): 1-15. |
| [35] |
Tang HW, Xie YG, Liu YG, et al. Advances in understanding the molecular mechanisms of cytoplasmic male sterility and restoration in rice[J]. Plant Reproduction, 2017, 30(4): 179-184. DOI:10.1007/s00497-017-0308-z |
| [36] |
Bharaj TS, Virmani SS, Khush GS. Chromosomal location of fertility restoring genes for wild abortive cytoplasmic male sterility using primary trisomics in rice[J]. Euphytica, 1995, 83(3): 169-173. DOI:10.1007/BF01678126 |
| [37] |
Balaji SP, Srikanth B, Hemanth KV, et al. Fine mapping of Rf3 and Rf4 fertility restorer loci of WA-CMS of rice(Oryza sativa L.)and validation of the developed marker system for identification of restorer lines[J]. Euphytica, 2012, 187(3): 421-435. DOI:10.1007/s10681-012-0737-6 |
| [38] |
Zhu JQ, Zhang HY, Liu Z, et al. Mapping the nuclear fertility restorer gene in rice with simple sequence length polymorphism(SSLP)[J]. High Technology Letters, 2004, 10(4): 94-96. |
| [39] |
Kazama T, Toriyama K. A fertility restorer gene, Rf4, widely used for hybrid rice breeding encodes a pentatricopeptide repeat protein[J]. Rice, 2014, 7(1): 1-5. |
| [40] |
Tang HW, Luo DP, Zhou DG, et al. The rice restorer Rf4 for wild-abortive cytoplasmic male sterility encodes a mitochondrial-localized PPR protein that functions in reduction of WA352 transcripts[J]. Molecular Plant, 2014, 7(9): 1497-1500. DOI:10.1093/mp/ssu047 |
| [41] |
Huang WC, Yu CC, Hu J, et al. Pentatricopeptide-rqjeat family protein Rf6 functions with hexokinase 6 to rescue rice cytoplasmic male sterility[J]. Proc Natl Acad Sci USA, 2015, 112(48): 14984-14989. DOI:10.1073/pnas.1511748112 |
| [42] |
Hu J, Wang K, Huang W, et al. The rice pentatricopeptide repeat protein RF5 restores fertility in HongLian cytoplasmic male-sterile lines via a complex with the glycine-rich protein GRP162[J]. Plant Cell, 2012, 24(1): 109-122. DOI:10.1105/tpc.111.093211 |
| [43] |
Komori T, Ohta S, Murai N. Map-based cloning of a fertilityrestorer gene, Rf-1, in rice(Oryz a sativa L.)[J]. Plant J, 2004, 37: 315-325. DOI:10.1046/j.1365-313X.2003.01961.x |
| [44] |
Wang ZH, Zou YJ, Li XY, et al. Cytoplasmic male sterility of ricewith boro cytoplasm is caused by a cytotoxic peptide and is restored by two related PPR motif genes via distinct modes of mRNA silencing[J]. Plant Cell, 2006, 18(3): 676-687. DOI:10.1105/tpc.105.038240 |
| [45] |
苏爱国, 宋伟, 王帅帅, 等. 玉米细胞质雄性不育及其育性恢复基因的研究进展[J]. 中国生物工程杂志, 2018, 38(1): 108-114. |
| [46] |
Cui XQ, Wise RP, Schnable PS. The rf2 nuclear restore gene of Male-sterile T-cytoplasm maize[J]. Science, 1996, 272(5266): 1334-1336. DOI:10.1126/science.272.5266.1334 |
| [47] |
Kamps TL, Chase CD. RFLP mapping of the maize gametophytic restorer of fertility locus(Rf3)and aberrant pollen transmission of the nonrestoring Rf3 allele[J]. Theor Appl Genet, 1997, 95: 525-531. DOI:10.1007/s001220050593 |
| [48] |
李鹏, 肖森林, 王淑霞, 等. 玉米S型细胞质雄性不育恢复基因Rf3的精细定位及其候选基因预测[J]. 山东农业科学, 2014, 46(8): 1-5. DOI:10.3969/j.issn.1001-4942.2014.08.001 |
| [49] |
李文明.玉米CMS-S育性恢复基因定位分析及EMS突变体筛选[D].武汉: 华中农业大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10504-1018192689.htm
|
| [50] |
刘伟华, 罗红兵, 邱博. 玉米CMS-C型雄性不育系C543恢复基因的初定位[J]. 湖南农业大学学报:自然科学版, 2016, 42(1): 16-19. |
| [51] |
牟碧涛, 赵卓凡, 岳灵, 等. 两份玉米CMS-C恢复系的育性恢复力测定及恢复基因的分子标记定位[J]. 作物学报, 2019, 45(2): 225-234. |
| [52] |
Liu YM, Zhao ZF, Lu YL. A preliminary identification of Rf*-A619, a novel restorer gene for CMS-C in maize(Zea mays L.)[J]. Peer J, 2016, 4(4): 2719. |
| [53] |
孙玲凌.玉米C型胞质雄性不育恢复相关基因的克隆[D].郑州: 河南农业大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10466-2008212394.htm
|
| [54] |
詹克慧.小麦K型细胞质雄性不育系育性恢复机理的研究[D].郑州: 河南农业大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10466-2006064335.htm
|
| [55] |
关荣霞, 郭小丽, 刘冬成, 等. 小麦T型细胞质雄性不育恢复基因Rf6的ISSR标记分析[J]. 中国农业科学, 2002, 35(11): 1297-1301. DOI:10.3321/j.issn:0578-1752.2002.11.001 |
| [56] |
Sinha P, Tomar S, Singh VK, et al. Genetic analysis and molecular mapping of a new fertility restorer gene Rf8 for Triticum timopheevi cytoplasm in wheat(Triticum aestivum L.)using SSR markers[J]. Genetica, 2013, 141(10-12): 431-441.
|
| [57] |
段阳. T型细胞质雄性不育小麦T763A败育的特点与育性恢复基因Rf3的分子作图[D].杨凌: 西北农林科技大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10712-1017100621.htm
|
| [58] |
桂安胜.小麦AL型雄性不育系育性恢复基因的遗传分析和定位[D].杨凌: 西北农林科技大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10712-1017003261.htm
|
| [59] |
孙慧慧, 杨靖, 卫笑, 等. 小麦BNS雄性不育中国春恢复基因的连锁群检测和QTL初步定位[J]. 麦类作物学报, 2016, 36(7): 856-865. |
| [60] |
王鹏年. RN型大豆细胞质雄性不育恢复基因的精细定位[D].长春: 吉林农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10193-1016732342.htm
|
| [61] |
陶银.大豆质核互作雄性不育系NJCMS1A育性恢复基因的SSR标记定位研究[D].南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013284845.htm
|
| [62] |
李曙光, 赵团结, 盖钧镒. 大豆质核互作雄性不育系NJCMS3A双亲雄性育性基因的SSR标记[J]. 作物学报, 2010, 36(7): 1061-1066. |
| [63] |
连世超, 雷梦林, 张瑞军, 等. 大豆细胞质雄性不育恢复基因的标记定位[J]. 山西农业科学, 2016, 44(5): 579-582. DOI:10.3969/j.issn.1002-2481.2016.05.003 |
| [64] |
罗莉斯, 李大雄, 张超, 等. 甘蓝型油菜细胞质雄性不育恢复基因的SSR标记及初步定位[J]. 种子, 2018, 37(1): 77-79. DOI:10.3969/j.issn.1005-2690.2018.01.060 |
| [65] |
Liu Z, Yang ZH, Wang X, et al. A mitochondria-targeted PPR protein restorespol cytoplasmic male sterility by reducing orf224 transcriptlevels in oilseed rape[J]. Mol Plant, 2016, 9(7): 1082-1084. DOI:10.1016/j.molp.2016.04.004 |
| [66] |
廖志强, 况晨光, 许丽芳, 等. 中国甘蓝型油菜细胞质雄性不育的主要类型及在育种实践中的应用[J]. 中国农学通报, 2010, 26(3): 105-110. |
| [67] |
Uyttewaal M, Arnal N, Quadrado M, et al. Characterization of Raphanus sativus pentatricopeptide repeat proteins encoded by the fertility restorer locus for Ogura cytoplasmic male sterility[J]. Plant Cell, 2008, 20: 3331-3345. DOI:10.1105/tpc.107.057208 |
| [68] |
郝建轶, 李云昌, 胡琼, 等. 油菜野芥细胞质雄性不育恢复基因候选片段的克隆[J]. 中国油料作物学报, 2011, 33(5): 433-437. |
| [69] |
尤春源, 聂新辉, 雷江荣, 等. 不同来源国家的三套棉花胞质雄性不育恢复基因的分子标记定位[J]. 新疆农业科学, 2013, 50(6): 1003-1007. |
| [70] |
杨路明.棉花细胞质雄性不育恢复基因的图位克隆及PPR基因家族的分析[D].南京: 南京农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10307-2010173778.htm
|
| [71] |
李丹.棉花细胞质雄性不育恢复基因的图位克隆[D].南京: 南京农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016037484.htm
|
| [72] |
彭宝, 张春宝, 张伟, 等. "双高"大豆杂交种吉育612创制及高产制种技术研究[J]. 大豆科学, 2019, 38(3): 501-503. |
| [73] |
张泽华.甘蓝型油菜不同细胞质类型特异分子标记的研发及应用[D].杨凌: 西北农林科技大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10712-2010050540.htm
|