脲酶(Urease,EC 3.5.1.5)能够催化尿素分解生成两分子氨和一分子二氧化碳,自1926年Sumner从刀豆中分离出其晶体以来[1],人们在大自然中众多生物如植物、细菌、真菌、藻类及无脊椎动物均发现脲酶的存在,甚至游离于土壤作为土壤脲酶出现[2]。基于此,脲酶已被广泛开发并应用于医学检验、食品加工、农肥科学和环保监测等领域,尿素废水处理便是其中之一[3]。
尿素作为主要的化肥种类之一,也是一种重要的化工原料。2018年,全球产量达1.691×108 t,预计2019年将增长1.1%[4]。但尿素的生产避免不了尿素废水,其中尿素的含量达750 mg/L[5],若直接排放不仅造成了尿素的流失,还会污染环境,因此需要对其进行废水处理。目前处理尿素废水的方法有3种:化学热力学水解法、微生物水解法及脲酶水解法。化学水解法反应需要在高温高压下进行,设备庞大且成本高,资源浪费大,特别是对低浓度尿素废水的处理非常不合算[6]; 微生物水解法虽然作用温和,但是微生物在尿素废水中难以生长,须经长期驯化及额外补料才能发挥作用[7]; 而脲酶水解法操作简便、反应条件温和、费用低,处理过后的废水经二次解吸脱氨能使残余的尿素和氨达痕量,从而直接排放或用于锅炉给水及循环水[6]。
游离酶不稳定,容易变性失活,且反应后难以分离回收以进行重复利用,因此通常将酶引入到合适的载体上进行固定化,使其在保持高效催化特性的同时,还具有可重复利用、操作稳定等优点[8]。目前酶的固定化方法主要有包埋法、吸附法、交联法以及共价偶联法,包埋法由于操作简单、结合程度强、酶活损失小、费用低等优点,适合于大规模工业化处理[9]。
尿素废水由于尿素及氨的存在,pH往往高于9.0,因此需要额外添加磷酸或者通入CO2来降低pH以达到常规脲酶的工作条件,同时开发耐碱的酶以适应尿素废水环境或者寻求良好的固定化材料以提高酶的稳定性[3]也是解决办法之一。有意义的是,相关研究已发现海洋来源的脲酶相对于陆地来源酶更具耐碱性[10-12],但是目前的实验材料大都集中于植物来源的中性或弱碱性脲酶[8],因此有必要探究海洋源性脲酶在处理尿素废水上具有的优势。
本研究采用课题组从中国南海(18.42°N,109.97°E)海绵Siphonochalina sp.中分离得到的一株产碱性脲酶的海洋真菌Penicillium sp.,该菌所产脲酶最适温度和pH达55℃、8.5。在此基础上,为进一步提高其耐热及耐碱性,采用最简单实用的包埋法进行固定化,对比了几种不同材料的包埋效果,选择最优的固定化脲酶装柱运行,考察其处理尿素废水的能力。
1 材料与方法 1.1 材料脲酶冻干粉(1 542 U/mg),本实验室经细胞破碎、硫酸铵盐析、Hitrap DEAE FF离子交换层析及Superdex 200 10/300 GL凝胶过滤层析、真空冷冻干燥所得; 聚乙烯醇、明胶,Aladdin公司; 海藻酸钠,上海源叶生物科技有限公司; 氯化钙、硼酸,上海凌峰化学试剂有限公司; 戊二醛,罗恩公司; 尿素废水(0.012 5 mol/L尿素,0.007 mol/L氨,自来水配置灭菌后使用)实验室自制[3]。
酶标仪,BioTek公司; pH计,梅特勒-托利多公司; φ 2 cm×20 cm填料柱,业立生物科技(上海)股份有限公司; 蠕动泵,上海青浦沪西仪器厂; 培养箱,上海新苗医疗器械制造有限公司; 水浴锅,上海精宏实验设备有限公司。
1.2 方法 1.2.1 固定化方法 1.2.1.1 海藻酸钠包埋法[13]取一定量的海藻酸钠溶于适量去离子水中,于40℃水浴加热搅拌使其充分溶解,待冷却至室温后将一定量的脲酶溶于其中,搅拌均匀并用注射器(针头内径1.54 mm)以恒定高度逐滴滴加至含一定浓度的CaCl2水溶液中,随后将包埋了脲酶的海藻酸钠- CaCl2凝胶颗粒置于4℃冰箱硬化过夜。硬化结束后用Tris-HCl(50 mmol/L,pH 8.5)洗涤3次,沥干水分后置于4℃保存备用。
1.2.1.2 聚乙烯醇包埋法[9]将一定量的聚乙烯醇置于适量去离子水中充分溶胀,随后于90℃水浴加热搅拌30 min至充分溶解,冷却至室温后取一定量的脲酶溶于其中,搅拌均匀后用注射器针头内径1.54 mm)以恒定高度逐滴滴加至饱和硼酸溶液(用Na2CO3调pH至8.5)中,成型后置于4℃施以慢速搅拌过夜固化。固化结束后用Tris-HCl(50 mmol/L,pH 8.5)洗去表面残留物质,沥去水分后置于4℃保存备用。
1.2.1.3 明胶包埋法[14]用一定量的明胶溶于适量Tris-HCl(50 mmol/L,pH 8.5)中并于60℃水浴加热不断搅拌1 h成澄清透明溶液,自然冷却至室温后称取一定量的脲酶溶于其中,随后用玻璃棒搅匀并倒入一次性平板中置于4℃固化30 min,待冷凝后切成4 mm×4 mm×4 mm小块,并泡入一定浓度的戊二醛溶液中室温交联一定时间。之后用Tris-HCl(50 mmol/L,pH 8.5)洗涤数次,除去水分后置于4℃保存备用。
1.2.2 酶活力测定方法游离酶酶活力通过靛酚蓝反应采用Berthelot比色法进行测定,具体方法见参考文献[15]。而固定化酶酶活力测定则是将包埋颗粒置于含500 mmol/L尿素的Tris-HCl(50 mmol/L,pH 8.5)中于55℃振荡孵育20 min,随后取出400 μL反应液按游离酶酶活力测定的后续方法进行测定。
酶活力定义:在常压、55℃、pH 8.5条件下,每分钟分解1 μmol底物所需的酶量为一个酶活力单位。
1.2.3 分析方法 1.2.3.1 酶回收率测定固定化酶回收率(%)=(固定化酶的总活力/用于固定化的脲酶冻干粉总活力)× 100%,通过测定单位质量固定化酶的酶活力(见1.2.2),求出固定化酶的总活力。
1.2.3.2 凝胶颗粒机械稳定性测定参照文献[9],固定化颗粒的机械强度采用正面按压法测量,随机选取10个固定化颗粒,以2×5的排列方式盖以载玻片,并用适量的砝码逐级加压于载玻片上,直至颗粒破裂,该压力值表征固定化颗粒的机械强度。
1.2.3.3 稳定状态动力学酶的最适温度及pH通过比较其在35-85℃范围内或在pH 7-10.5梯度中反应后的酶活得出[15]; 酶的温度及pH耐受性通过测定其在35-85℃(pH 8.5)中保存半小时或pH 7-10.5(4℃)中保持6 h后的残余酶活获得[15]; 酶的储存稳定性通过测定酶在4℃、Tris-HCl(50 mmol/L,pH 8.5)中随时间变化(每3 d一个点)的残余酶活得出。
1.2.3.4 尿素降解率测定尿素浓度根据二乙酰一肟法进行测定[15]:尿素降解率(%)=(反应前后溶液中尿素浓度差/原溶液中尿素初始浓度)× 100%。
1.2.4 尿素废水处理装置的构建将制备好的固定化脲酶颗粒填装进φ 2 cm×20 cm的柱子中,连接蠕动泵调节流速,让尿素溶液自上而下流过填料柱,整个装置置于培养箱中,通过调节培养箱的温度来改变填料柱的工作温度,收集柱子下端流出的液体,并每间隔5 d测定尿素降解率及固定化脲酶残余酶活。
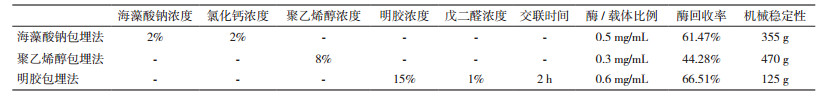
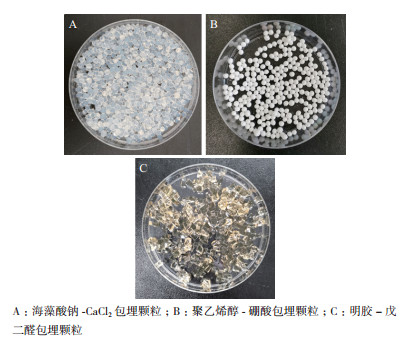
2 结果 2.1 固定化参数确定及效果比较三种包埋方法所制备的凝胶微球,如图 1所示。海藻酸钠与聚乙烯醇包埋颗粒皆呈规则圆球状,而明胶包埋法由于其制备方法的差异性,与前二者有明显区别。海藻酸钠包埋小球为无色透明状,聚乙烯醇包埋小球呈白色,且相互之间有黏性,而明胶块由于戊二醛的原因而呈黄色。本实验以每种包埋方法所能达到最大酶回收率时作为最优条件,从而确定各参数值。
|
| 图 1 脲酶包埋颗粒效果图 |
实验中发现,海藻酸钠浓度过高时难以溶解,而浓度过低时形成的凝胶微球拖尾导致形状不规则,且易破碎变形,因此选择的海藻酸钠浓度(W/V)为1%、2%、3%、4%、5%和6%。钙离子能与海藻酸钠迅速发生离子交换从而生成凝胶,因此CaCl2浓度亦对包埋效果造成影响,预实验表明,CaCl2浓度过低会导致凝胶强度变弱,酶回收率也比较低,而CaCl2浓度过高时酶回收率迅速下降,可能是钙离子与脲酶发生作用所致,因此选择CaCl2浓度为1%、2%、3%、4%、5%和6%。随着所添加酶量的增大,固定化酶活力持续上升,但过高时酶回收率开始下降,说明此时载体已达到饱和,故选取的加酶量为0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL、0.6 mg/mL、0.7 mg/mL和0.8 mg/mL。同样,聚乙烯醇浓度过低时凝胶球不易成型,过高时溶液太黏稠稠且凝胶球易粘连,因此选取聚乙烯醇浓度为1%、2%、4%、6%、8%和10%。明胶包埋时,明胶浓度过低,所形成的凝胶机械强度明显不够,操作易破裂,过高时太黏稠易发生焦糊现象,而导致固定化酶活力明显下降,因此选取明胶的浓度为5%、10%、15%、20%、25%和30%。固定化酶活力随戊二醛浓度的增大而增大,说明酶在载体上的固载量增加了,但是过高时固定化酶活力呈下降态势,因此选取戊二醛的梯度为0.25%、0.5%、1%、1.5%、2%和2.5%。交联时间越长,固定化率越高,但过长时,固定化酶活下降,推测是偶联的酶太多,使载体孔径变小,底物不易于酶结合,从而降低了酶促反应,故选取的交联时间为0.5 h、1 h、1.5 h、2 h、2.5 h和3 h。
经正交实验(表 1),海藻酸钠包埋法最终选取海藻酸钠、CaCl2、酶/载体比例分别为2%、2%和0.5 mg/mL,其酶回收率及机械稳定性达到了61.47%、355 g; 聚乙烯醇包埋法最优组合为8%聚乙烯醇及0.3 mg/mL酶/载体比例,酶回收率及机械稳定性达到了44.28%、470 g; 明胶包埋法采用明胶浓度、戊二醛浓度、交联时间、酶/载体比例为15%、1%、2 h、0.6 mg/mL时效果最佳,酶回收率及机械稳定性达66.51%、125 g。
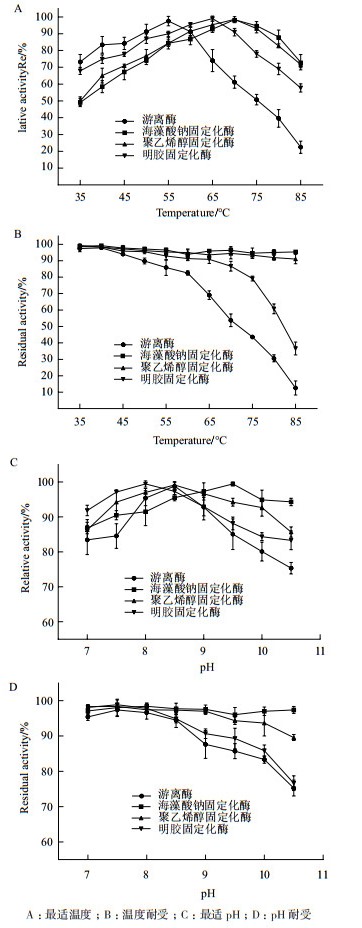
对3种固定化脲酶与游离脲酶就最适温度、温度耐受以及最适pH、pH耐受进行分析。如图 2所示,海藻酸钠、聚乙烯醇、明胶固定化酶最适温度分别为70、70及65℃,而游离酶在55℃时酶活力最大,且其在70℃时活性只有50%左右(图 2-A),游离酶经海藻酸钠、聚乙烯醇、明胶固定化后最适温度分别提升了15、15及10℃。此外,海藻酸钠与聚乙烯醇固定化酶在35-85℃保存30 min后酶活力仍能保持在90%以上,基本无酶活损失,明胶固定化酶在高于65℃时残余酶活力下降明显,而游离酶在50℃以上时活性迅速丧失,在85℃反应30 min后海藻酸钠、聚乙烯醇以及明胶固定化酶残余酶活分别为95.45%、91.05%及36.66%,而游离酶只有12.58%(图 2-B),表明固定化酶尤其是海藻酸钠和聚乙烯醇包埋颗粒比游离脲酶耐热性有较大提升,能在相对高的温度下进行催化反应。在不同的pH值缓冲溶液中分别对固定化酶和游离酶进行测定,结果显示海藻酸钠、聚乙烯醇、明胶固定化酶以及游离酶的最适pH分别为9.5、8.5、8.0和8.5,海藻酸钠在pH 10.5时固定化酶活力能保持在90%以上,聚乙烯醇、明胶固定化酶大概在80%,而游离酶只有70%左右(图 2-C); 海藻酸钠固定化脲酶在pH 7-10.5范围内保持6 h,残余酶活均在90%以上,聚乙烯醇固定化酶在pH 9.5以上时出现下降,而明胶固定化酶与游离酶耐碱性质类似,在pH高于8.5时快速失活(图 2-D),表明海藻酸钠固定化酶比其他三者更具耐碱性,适合在碱性条件下工作。
|
| 图 2 温度和pH对游离脲酶和固定化脲酶的影响 |
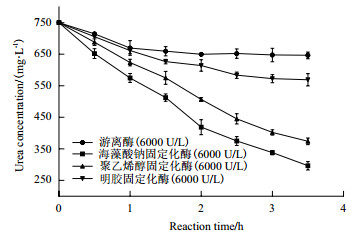
从上文中可以看出,固定化脲酶比游离酶更耐热,且海藻酸钠固定化酶还具有一定的碱偏好性。因此更利于尿素废水处理,但为了考察四者的工作效率,本实验将固定化脲酶和游离脲酶分别置于尿素废水中,在6 000 U/L脲酶浓度、70℃的条件下,测量其随时间的尿素降解情况,结果如图 3所示,至2 h时游离脲酶基本失活,此后溶液中尿素浓度保持不变; 明胶固定化酶性能相较于游离酶并没有得到较大提升,其在3 h时失活,最终尿素降解率为24%;聚乙烯醇耐热性耐碱性提升明显,因此其处理下的尿素废水中尿素浓度在不断下降; 而海藻酸钠是四者中性质最稳定的,其处理样本在2.5 h时尿素降解率能达到50%,且尿素浓度随着时间延长而不断下降。因此4种方法的工作效率由高到低依次为海藻酸钠、聚乙烯醇、明胶固定化酶以及游离脲酶,选取海藻酸钠固定化脲酶进行下一步试验。
|
| 图 3 游离脲酶与固定化脲酶的降解效率 |
采用固定化酶技术进行尿素废水处理存在的问题在于,固定化酶有一定的使用期限,需要定期进行更换。为了降低固定化酶生产成本以及应对突发情况需要对固定化酶进行预制备,并进行冷藏保存。因此本实验将游离酶和海藻酸钠固定化酶置于4℃冰箱保存,每3 d测定一次酶活,以测定两者的储存稳定性,如图 4所示,游离脲酶半衰期为20 d左右,而海藻酸钠固定化酶半衰期为3个月以上,表明其稳定性显著高于游离脲酶,可以进行大规模预制备。

|
| 图 4 游离脲酶与海藻酸钠固定化脲酶储存稳定性 |
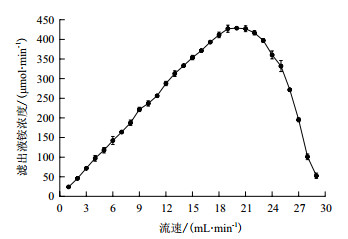
利用1.2.4中搭建的尿素废水处理装置进行尿素废水处理,为减少处理后的液体加热解吸脱氨所需要的热能,本实验选择70℃作为工作温度。通过恒流泵调节尿素废水的进样速度,同时收集滤液测定铵浓度,从图 5可以看出,随着流速的不断增大,尿素转化速度也在加大,但流速超过一定大小后,尿素转化速度出现下滑,这可能是因为流速过大,使得尿素废水在柱子中停留的时间过短,因而限制了脲酶对尿素的分解。图中显示当流速为19、20和21 mL/min时,三者尿素转化速度相当,但流速为19 mL/min时尿素降解率是三者中最大的,为90.25%,因此选取19 mL/min作为工作流速。
|
| 图 5 工作流速选择 |
为鉴定该装置的处理效率,本实验对其进行了跟踪。如图 6所示,固定化酶在前35 d酶活在90%以上,基本与初始值一致,且尿素的降解率也维持在高水平。随着时间的推移,固定化酶酶活及尿素降解率皆出现下滑,其中固定化酶半衰期为65 d,且此时的尿素降解率仍能达到50%左右。根据现行GB13458-2001《合成氨工业水污染物排放标准》中尿素含量规定(≤ 200 mg/L),其使用期限可达55 d,说明该装置具有一定的工作有效性。

|
| 图 6 尿素废水处理装置连续运转参数变化 |
固定化酶回收率越大,其所固定的酶活力就越多,则处理效果越快[16]; 而且当固定化酶处于流体中时,其机械稳定性越好,装柱运行时更不容易受剪切力而发生形变导致塌柱[17]。此外,固定化酶的温度及pH性质是影响其工作效率的主要因素,最适温度越高,能够为后续加热解吸脱氨节能,最适pH越高则能较好地适应碱性废水条件[6],因此选取最大酶回收率、机械稳定性以及温度和pH性质这4个实用性指标作为衡量标准。就酶回收率而言,海藻酸钠(61.47%)与明胶(66.51%)效果基本一致,聚乙烯醇则明显较低(44.28%),结合制备情况和文献调研分析其可能原因在于聚乙烯醇水溶液为乳浊液,夹带了很多气泡,影响了脲酶冻干粉的分散,另外聚乙烯醇-硼酸反应体系能形成致密的网状结构,从而阻碍酶和底物间的扩散[16]; 机械稳定性上看,固定化材料本身的物理性质是主要的影响因素。此外,由于球体所受压力比立方体更均匀,更不易发生形变[17],因此明胶由于其制备方法的差异,造成其机械稳定性(125 g)显著弱于海藻酸钠(355 g)和聚乙烯醇(470 g); 温度和pH性质方面,不同载体对酶的包裹强度不同使得酶的热运动程度也不同,造成热稳定性呈现不同效果[18],而且载体的带电性能差异也会使其和所固定的酶之间电荷-电荷作用不同,从而影响固定化酶的稳定性[8]。因此,海藻酸钠、聚乙烯醇及明胶呈现出不同的酶学性质:最适温度分别为70、70及65℃,最适pH分别为9.5、8.5和8.0。此外,明胶会吸水膨胀,且随着时间延长会发生胶解现象,造成其稳定性明显较弱[19]; 最重要的是,3种固定化酶在对尿素废水进行实际处理时,其降解效率由高到低依次为海藻酸钠、聚乙烯醇和明胶。综上所述,海藻酸钠固定化酶展现出较高的酶回收率和不错的机械稳定性,且其在最适温度及温度耐受、最适pH及pH耐受方面性能显著优于聚乙烯醇、明胶固定化酶及游离脲酶,因此最终选取了海藻酸钠作为最优的固定化方案,但是关于海藻酸钠固定化脲酶最优解的证实下一步还可以结合扫描电镜以及红外光谱法进行分析,并在今后的研究中逐步深入。
虽然脲酶的固定化可以用共价偶联法[20-21]、吸附交联法[22-23]等,但它们大都操作复杂,成本高,不适合工业化生产,而且共价偶联法会对脲酶造成不可逆的损伤,吸附交联法固定化酶在流体中容易流失[9]。海藻酸钠作为一种天然提取物,被证实是良好的包埋法固定化材料。Das等[24]利用3%的海藻酸钠固定木豆脲酶,使0.12 mg蛋白/mL浓度的酶回收率达到了50%。西瓜脲酶利用3.5%的海藻酸钠进行固定,最终的固定化率高达72%[25]。利用海藻酸钠固定化的脲酶最适温度、pH分别提升了15、1℃,而且固定化酶在25-85℃保持0.5 h或在pH 7-10.5范围内保持6 h后酶活仍能维持在90%以上,相对于游离酶有显著的提升,能够适应尿素废水碱性环境,而且较高的反应温度能够有效节约后续解吸脱氨过程供给的热能。在其他相关研究中,Srivastava等[14]通过明胶固定化木豆脲酶以制成尿素探测器发现,其最适温度从47℃提高至65℃,最适pH从7.3变成6.5。通过氨基酸偶合反应,Kutcherlapati等[26]将脲酶制成水凝胶,使其温度、pH耐受能力得到提高。可以看出,固定化技术能够提升游离酶的稳定性,甚至改变酶的理化性质,使其在保持酶活的情况下还能适应更高环境条件的要求。然而,值得注意的是当前的固定化技术结果大都集中在提升了酶的最适温度及温度耐受性[8, 27-28],但是酶的最适pH或pH耐受性往往得不到较大的改善,甚至由于固定化基质材料的不同,反而使最适pH向相反的方向移动[29-30],因此用于尿素废水处理还是离不开添加磷酸或通入CO2以调节废水条件。但本实验基于耐碱脲酶,在固定化后使得其pH稳定性进一步提高,因此能够直接进行尿素废水处理,实用性更强。
用φ 2 cm×20 cm的柱子填料运转,在70℃时处理的尿素废水流量能达到19 mL/min,且初始尿素降解率为90.25%,降低流速能进一步提高尿素降解率,据此可以根据生产流量要求设计柱子结构以及床层尺寸,如将多根固定化柱并联或者改用更大孔径的柱子能够快速高通量地处理尿素废水。该装置连续运转35 d,残余酶活以及尿素降解率均能保持稳定在90%以上,半衰期能够维持两个月以上,使用期限可达55 d,效率可靠,只需定期更换填料柱即可。因此,利用该海藻酸钠-CaCl2固定化脲酶装置处理工业尿素废水是切实可行的,且经后续改进,如通过组合固定化技术或者运用新型固定化方法、开发新的固定化材料,能够使固定化酶性质进一步提高,从而实现尿素废水的绿色高效处理。此外,本固定化酶处理技术主要消耗材料如脲酶发酵培养基以及用于固定化的海藻酸钠和氯化钙等廉价易得,且固定化酶大规模生产时成本还可以进一步减少,从而降低尿素废水处理费用,为中小型生产企业的尿素废水处理工艺提供选择。
4 结论经固定化处理后,海洋碱性脲酶最适温度、最适pH、耐热性及耐碱性皆得到提升。与聚乙烯醇和明胶相比,海藻酸钠固定化方案综合效果最佳。利用海藻酸钠固定的海洋脲酶进行尿素废水处理简单易行、价格低廉,φ 2 cm×20 cm柱处理速度为19 mL/min,有效期达55 d,是除化学处理法外的一条有效途径。
| [1] |
Kafarski P, Talma M. Recent advances in design of new urease inhibitors:A review[J]. J Adv Res, 2018, 13: 101-112. DOI:10.1016/j.jare.2018.01.007 |
| [2] |
Krajewska B, Ureases I. Functional, catalytic and kinetic properties:A review[J]. J Mol Catalysis B Enzym, 2009, 59(1-3): 9-21. DOI:10.1016/j.molcatb.2009.01.003 |
| [3] |
Qin Y, Cabral JMS. Review properties and applications of urease[J]. Biocatalysis and Biotransformation, 2002, 20(1): 1-14. DOI:10.1080/10242420210154 |
| [4] |
Heffer P, Prud' homme M. Short-term fertilizer outlook 2018-2019[C]. Beijing: International Fertilizer Association Strategic Forum, 2018.
|
| [5] |
Latkar M, Chakrabarti T. Performance of upflow anaerobic sludge blanket reactor carrying out biological hydrolysis of urea[J]. Water Environment Research, 1994, 66(1): 12-15. |
| [6] |
乔德阳. 利用固定化脲酶处理尿素废水的研究[J]. 徐州师范大学学报:自然科学版, 2001, 19(2): 47-49. |
| [7] |
Zeinali M, Lenjannezhadian H. Degradation of urea by entrapped cross-linked urease aggregates:a combinatorial approach to urease stabilization for environmental and industrial applications[J]. Int J Environ Sci Technol, 2018, 15(1): 49-56. DOI:10.1007/s13762-017-1337-8 |
| [8] |
Krajewska B. Ureases. Ⅱ. Properties and their customizing by enzyme immobilizations:A review[J]. J Mol Catalysis B Enzyme, 2009, 59(1-3): 22-40. DOI:10.1016/j.molcatb.2009.01.004 |
| [9] |
张莉娟.脲酶的组合固定化研究[D].武汉: 武汉理工大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10497-1012403223.htm
|
| [10] |
Jahns T. Purification and properties of urease from Sporobolomyces roseus[J]. Antonie Van Leeuwenhoek, 1995, 68(3): 209-214. DOI:10.1007/BF00871817 |
| [11] |
Palinska KA, Jahns T, Rippka R, et al. Prochlorococcus marinus strain PCC 9511, a picoplanktonic cyanobacterium, synthesizes the smallest urease[J]. Microbiology, 2000, 146(12): 3099-3107. DOI:10.1099/00221287-146-12-3099 |
| [12] |
Phillips A, Pretorius GH, Du Toit PJ. A survey of yeast ureases and characterisation of partially purified Rhodosporidium paludigenum urease[J]. FEMS Microbiology Letters, 1991, 79(1): 21-25. DOI:10.1111/j.1574-6968.1991.tb04497.x |
| [13] |
Tanriseven A, Dogan S. Immobilization of invertase within calcium alginate gel capsules[J]. Process Biochemistry, 2001, 36(11): 1081-1083. DOI:10.1016/S0032-9592(01)00146-7 |
| [14] |
Srivastava PK, Kayastha AM, Srinivasan. Characterization of gelatin-immobilized pigeonpea urease and preparation of a new urea biosensor[J]. Biotechnol Appl Biochem, 2001, 34(1): 55-62. DOI:10.1042/BA20010016 |
| [15] |
Liu Q, Chen Y, Yuan M, et al. A Bacillus paralicheniformis iron-containing urease reduces urea concentrations in rice wine[J]. Appl Environ Microbiol, 2017, 83(17): e01258-17. |
| [16] |
段晓琛, 盛军, 徐甲坤, 等. 海洋脂肪酶ADM47601固定化方法的研究[J]. 海洋与湖沼, 2013, 44(5): 1311-1317. |
| [17] |
Moreira SM, Moreira-Santos M, Lucia G, et al. Immobilization of the marine microalga Phaeodactylum tricornutum in alginate for in situ experiments:Bead stability and suitability[J]. Enzyme and Microbial Technology, 2006, 38(1-2): 135-141. DOI:10.1016/j.enzmictec.2005.05.005 |
| [18] |
莫旖, 姬琳, 柳畅先. 固定化脲酶的制备及应用[J]. 分析科学学报, 2013, 29(1): 85-88. |
| [19] |
骆东辉, 刘安妮, 李明芳, 等. 131I标记海藻酸钠包裹明胶微球的制备及性能评价[J]. 高等学校化学学报, 2011, 32(6): 1412-1417. |
| [20] |
Tiwari A, Aryal S, Pilla S, et al. An amperometric urea biosensor based on covalently immobilized urease on an electrode made of hyperbranched polyester functionalized gold nanoparticles[J]. Talanta, 2009, 78(4-5): 1401-1407. DOI:10.1016/j.talanta.2009.02.038 |
| [21] |
Yang L, Liu X, Zhou N, et al. Characteristics of refold acid urease immobilized covalently by graphene oxide-chitosan composite beads[J]. J Biosci Bioeng, 2019, 127(1): 16-22. DOI:10.1016/j.jbiosc.2018.06.012 |
| [22] |
Kayastha AM, Srivastava PK. Pigeonpea(Cajanus cajan L.)urease immobilized on glutaraldehyde-activated chitosan beads and its analytical applications[J]. Applied Biochemistry and Biotechnology, 2001, 96(1-3): 41-53. DOI:10.1385/ABAB:96:1-3:041 |
| [23] |
Kirdeciler SK, Soy E, Ozturk S, et al. A novel urea conductometric biosensor based on zeolite immobilized urease[J]. Talanta, 2011, 85(3): 1435-1441. DOI:10.1016/j.talanta.2011.06.034 |
| [24] |
Das N, Kayastha AM, Malhotra OP. Immobilization of urease from pigeonpea(Cajanus cajan L.)in polyacrylamide gels and calcium alginate beads[J]. Biotechnol Appl Biochem, 1998, 1: 25-29. |
| [25] |
Prakash O, Upadhyay LSB. Physico-chemical characterization of watermelon urease upon immobilization in alginate beads[J]. J Plant Biochem Biotechnol, 2005, 14(2): 209-213. |
| [26] |
Kutcherlapati SN, Yeole N, Jana T. Urease immobilized polymer hydrogel:Long-term stability and enhancement of enzymatic activity[J]. J Colloid Interface Sci, 2016, 463: 164-172. DOI:10.1016/j.jcis.2015.10.051 |
| [27] |
Alatawi FS, Monier M, Elsayed NH. Amino functionalization of carboxymethyl cellulose for efficient immobilization of urease[J]. Int J Biol Macromol, 2018, 114: 1018-1025. DOI:10.1016/j.ijbiomac.2018.03.142 |
| [28] |
Zhang L, Du Y, Song JY, et al. Biocompatible magnetic nanoparticles grafted by poly(carboxybetaine acrylamide)for enzyme immobilization[J]. International Journal of Biological Macromolecules, 2018, 118: 1004-1012. DOI:10.1016/j.ijbiomac.2018.06.181 |
| [29] |
Monier M, EI-Sokkary AMA. Modification and characterization of cellulosic cotton fibers for efficient immobilization of urease[J]. Int J Biol Macromol, 2012, 51(1-2): 18-24. DOI:10.1016/j.ijbiomac.2012.04.019 |
| [30] |
Dogac YI, Deveci I, Teke M, et al. TiO2 beads and TiO2-chitosan beads for urease immobilization[J]. Materials Science and Engineering:C, 2014, 42: 429-435. DOI:10.1016/j.msec.2014.05.058 |