重金属污染是目前危害最大、面积最广的环境问题之一[1]。而污染水体的重金属主要包括生物毒性显著的铬、镉、汞和铅等[2],其中铬广泛用于电镀,制革和纺织染色木材处理等工业过程[3]。铬在水中主要有六价铬和三价铬两种存在形式,六价铬的毒性很强,是三价铬的100倍[4],且六价铬更易被人体吸收、蓄积而诱发多种疾病[5]。因此,研究如何高效地去除或还原水体中的六价铬具有极为重要的意义。近年的研究表明,由于固定化微生物技术拥有二次污染小、环保经济、应用前景良好等优点[6],被广泛应用于重金属污染,常用的固定化方法有交联法、吸附法和包埋法等[7]。
包埋法是利用高聚物形成凝胶时将微生物包埋在载体中,或者是将微生物细胞分散到凝胶聚合物孔隙所构成的网络空间中,从而将微生物细胞固定的方法[8]。包埋法具有减轻或耐受底物抑制的作用,有效地保持细胞的降解活性等优点[9]。本研究利用硼酸与无水氯化钙混合液作为交联液,聚乙烯醇(Polyvinyl alcohol,PVA)和海藻酸钠(Sodium alginate,SA)的混合液作为凝胶基质,通过两种包埋方式,聚乙烯醇-海藻酸钠(PVA-SA)和聚乙烯醇-海藻酸钠-马铃薯葡萄糖琼脂培养基(PVA-SA-PDA),制备两种BSL01固定化孢子小球,对比两种小球对六价铬的还原效率、机械性能的差异,探究了包埋小球对六价铬的还原效率及循环利用次数。本研究制备的固定化孢子小球,首次将活细菌和PDA培养基一起包埋在小球里,保证了小球里菌丝的活性,有利于增加还原的次数和还原效率,希望能为水体中六价铬的处理提供新的研究思路。
1 材料与方法 1.1 材料本研究所用的钩状木霉(BSL01)是利用六价铬作为筛选条件,从东北林业大学林场的土壤中筛选出的对六价铬耐受力较强的菌株,保藏于东北林业大学生命科学学院微生物实验室。
1.2 方法 1.2.1 包埋小球的制备交联剂的制备:称取不同配比的硼酸和无水氯化钙,按照马志刚等[10]的方法制备成交联剂,待用。
包埋小球的制备:选择不同浓度配比的PVA和SA(表 1),置于无菌水中,水浴加热至75-85℃使其溶解,室温放置12 h,再放置在75-85℃水浴锅中加热1 h,水浴加热3次,最后一轮水浴时,待混合物的温度降低至40℃左右,将混合物推到交联剂中,观察各组小球形态并测定各组小球机械性能。
PDA的制备:称取去皮马铃薯200 g,切成小块,投入蒸馏水中煮沸至能用玻璃棒戳破,过滤后加入葡萄糖20 g(固体PDA需加入琼脂15 g),混匀,补水至1 000 mL,115℃高压蒸汽灭菌20 min[11]。
PVA-SA-PDA小球的制备:固体PDA冷却至室温后,用刀片将其切割成2 mm×2 mm×2 mm的立方体,用1.2.1中PVA-SA小球的制备方法将上述PDA小立方体包裹入包埋小球中,制备成PVA-SA-PDA包埋小球。
1.2.3 BSL01孢子的固定用1.2.1中的方法制备含有BSL01孢子的包埋小球。最后一轮水浴中,待混合物冷却至约40℃时,加入BSL01分生孢子悬液(孢子悬液与混合物体积比为1:10),混合均匀。将含有分生孢子的混合物推到交联剂中,制备成含有BSL01孢子的PVA-SA和PVA-SA-PDA包埋小球,置于4℃下保存。将上述PVA-SA包埋小球接种到无菌的PDA平板中,放入培养箱中(30℃)培养3-5 d,观察其生长状况。
1.2.4 两种BSL01包埋小球对六价铬还原率的测定将两种包埋小球放入培养基中,置于恒温振荡培养箱(pH 9.0,30℃,150 r/min)培养2-3 d,用去离子水洗涤3次,称取20 g小球放入100 mL含有六价铬的培养液中,六价铬浓度为50 mg/L,置于恒温振荡培养箱(30℃,150 r/min)培养,间隔24 h测定六价铬的还原率。
1.2.4.1 消解菌丝用消煮法消解菌丝,得到含铬的待测溶液[12]。
1.2.4.2 六价铬浓度的测定利用二甲基苯碳酰二肼法测定上清液中六价铬的含量,原子吸收分光光度计测定上清液中的总铬含量,根据测得的总铬含量和六价铬含量的差值计算出上清液中三价铬的含量。
1.2.5 两种BSL01包埋小球重复使用次数及还原效率的测定在无菌条件下,分别称取PVA-SA和PVA-SA-PDA包埋小球20 g,放入含有六价铬的100 mL培养液中,六价铬浓度为50 mg/L,每12 h取样一次,当六价铬被彻底还原时,用无菌水冲洗包埋小球,并将其投入到新鲜的含有六价铬(50 mg/L)的100 mL培养液中,如此循环处理,直至菌丝体泄露。
2 结果 2.1 PVA-SA小球的制备为了得到理想包埋条件,本研究通过正交试验对包埋小球的硬度、成球性、通透度、弹性等机械性能进行测定(表 2)。
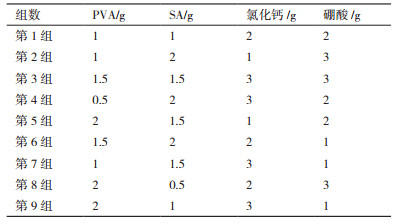
本研究选择硬度最大且透明的第9组实验小球(由于两种小球外观差异并不明显,以下所有附图均为PVA-SA-PDA小球(图 1)。
|
| 图 1 形状规则的包埋小球(A)形状不规则的包埋小球(B) |
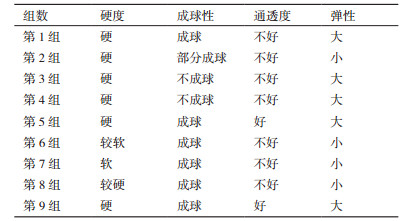
含有BSL01孢子的PVA-SA包埋小球的PDA平板在恒温培养箱中(30℃)培养3-5 d后,菌落形态如图 2-A,菌丝结构如图 3,可以看出,固定在PVA-SA小球中的BSL01孢子经过培养后可以正常发育。
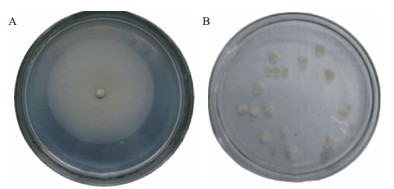
|
| 图 2 PVA-SA孢子球发育菌落(A)PVA-SA中BSL01菌体泄露(B) |

|
| 图 3 光学显微镜下的BSL01菌丝(40X) |
将含有BSL01孢子的PVA-SA和PVA-SA-PDA包埋小球投入只含有培养基的六价铬浓度为50 mg/L的培养液中,由于营养过剩,第7天包埋小球裂解,菌体泄露,如图 2-B; 投入到不含有培养基的六价铬培养液中,由于营养物质缺乏,两种包埋小球中,孢子生长均很缓慢,六价铬还原效率也很低,分别为12.3%和23.7%(图 4-A)。为了找出两种包埋小球还原六价铬的最优条件,本研究尝试在培养液中添加不同浓度的培养基。发现在培养基浓度为50%、六价铬浓度为50 mg/L的培养液中,两种包埋小球内BSL01孢子能够正常生长且菌丝体没有出现泄露,同时六价铬还原效率均可达到90%以上(图 4-B),在120 h时,PVA-SA包埋小球还原率为93.4%,PVA-SA-PDA包埋小球还原率为97.2%,可以看出,两种还原小球单次利用时还原效果相差不大。

|
| 图 4 PVA-SA-孢子和PVA-SA-PDA-孢子对六价铬的还原率 |
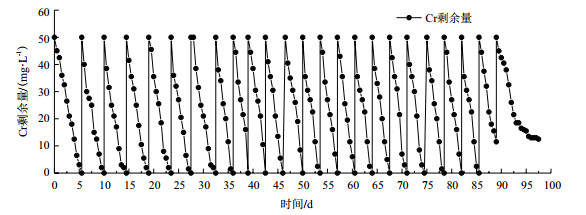
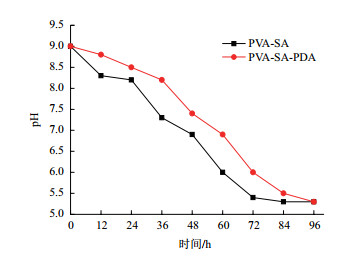
将两种含有BSL01孢子的包埋小球分别投放到六价铬浓度为50 mg/L、培养基浓度为50%的培养液中循环使用,发现PVA-SA包埋小球经历18次循环(图 5)之后,球体裂解,即PVA-SA包埋小球可重复利用18次,而PVA-SA-PDA包埋小球可以达到23个循环(图 6)。第一个循环时,PVA-SA包埋小球需要5 d将六价铬完全还原,PVA-SA-PDA包埋小球需要5.5 d; 第一个循环之后,还原速率加快,PVA-SA包埋小球从第8个循环之后,PVA-SA-PDA包埋小球从第9个循环之后,每个循环将六价铬完全还原只需要3 d。每个循环开始时,培养液的pH值为9.0,循环结束后,培养液的pH值为5.3(图 7)。

|
| 图 5 PVA-SA包埋小球重复使用次数的测定 |
|
| 图 6 PVA-SA-PDA包埋小球重复使用次数的测定 |
|
| 图 7 包埋小球还原六价铬过程中pH的变化 |
利用微生物将六价铬还原为三价铬是一种极具前景的方法[13],具有成本低、环境友好、可持续利用等优点。目前已分离出的能还原六价铬的真菌有Fusarium sp.、Aspergillus flavus和Aspergillus niger等[14]。PVA-SA和PVA-SA-PDA两种BSL01包埋小球内的孢子均可以萌发生长形成菌丝,为去除六价铬实验奠定基础。两种小球在培养基浓度为50%的培养液中将六价铬还原为三价铬的效率最高,且不发生菌丝泄露,为后期包埋小球重复使用效率的测定奠定了实验基础。
在固定化小球重复使用效率的测定实验中,每个循环结束之后,测得培养液的pH从9.0下降到了5.3,该结果与Sanghi等[15]的研究相似,推断原因可能是在培养真菌过程中有机酸代谢物的积累所致。此外,相对于PVA-SA固定化小球,PVA-SA-PDA固定化孢子球的还原效率和循环次数明显增加,我们推测,PVA-SA-PDA小球内培养基的存在,使孢子活性保持时间较长,因而该核壳结构小球还原六价铬的效率较高且循环次数增多。但是,还原机制目前不完全清楚。
4 结论本研究表明,通过PVA-SA,PVA-SA-PDA两种包埋方式制备的两种BSL01活菌固定化小球,还原六价铬的效果显著且能够持续还原,且在PVA-SA-PDA孢子小球中,由于培养基的存在,还原的效率更高且循环次数更多。
| [1] |
刘素纯, 萧浪涛, 王惠群, 等. 植物对重金属的吸收机制与植物修复技术[J]. 湖南农业大学学报:自然科学版, 2004, 30(5): 493-498. |
| [2] |
张聪, 宋超, 胡庚东, 等. 中国渔业水体重金属的污染现状及消除技术研究进展[J]. 中国农学通报, 2018, 34(2): 141-145. |
| [3] |
李培中, 吕晓健, 王海见, 等. 某电镀厂六价铬污染土壤还原稳定化试剂筛选与过程监测[J]. 环境科学, 2017, 38(1): 368-373. |
| [4] |
林国庆, 李文娟. 海蒿子和三价铁溶液绿色制备纳米铁及其去除六价铬的实验研究[J]. 中国海洋大学学报:自然科学版, 2018, 48(S2): 127-133. |
| [5] |
梁慧贞, 李学莲, 雷占昌. 电感耦合等离子体质谱法测定地下水中的六价铬[J]. 分析仪器, 2017(6): 59-61. DOI:10.3969/j.issn.1001-232x.2017.06.009 |
| [6] |
文晓凤, 杜春艳, 袁瀚宇, 等. 改性磁性纳米颗粒固定内生菌Bacillus nealsonii吸附废水中Cd2+的特性研究[J]. 环境科学学报, 2016(12): 4376-4383. |
| [7] |
陈壁珠. 固定化微生物技术处理重金属废水的研究[J]. 山东工业技术, 2015(4): 72-72. |
| [8] |
郑宇, 王晓琼, 赵阳国, 等. 包埋法固定化对硫氧化微生物菌群结构和功能的影响[J]. 微生物学报, 2016, 56(9): 1504-1512. |
| [9] |
吴芳芳, 林皓, 邱凌峰, 等. 聚乙烯醇包埋Trichosporon sp. X1处理苯酚废水[J]. 科学技术与工程, 2018(14): 214-219. |
| [10] |
马志刚, 王亚军, 王德培. 费氏丙酸菌的固定化方法及其发酵丙酸的工艺条件研究[J]. 天津科技大学学报, 2015(1): 25-28. |
| [11] |
张映.钩状木霉生物还原制备纳米银的研究[D].哈尔滨: 东北林业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10225-1015665389.htm
|
| [12] |
Fang H, Xia L. Cellulase production by recombinant Trichoderma reesei, and its application in enzymatic hydrolysis of agricultural residues[J]. Fuel, 2015, 143: 211-216. DOI:10.1016/j.fuel.2014.11.056 |
| [13] |
康鹏洲, 白红娟, 罗征, 等. 球形红细菌对六价铬的生物还原与三价铬积累[J]. 国际药学研究杂志, 2018, 45(5): 60-66. |
| [14] |
Debabrata P, Lala B, Matthew S, Pattanathu K. Recent bioreduction of hexavalent chromium in wastewater treatment:A review[J]. Journal of Industrial and Engineering Chemistry, 2017, 55: 1-20. DOI:10.1016/j.jiec.2017.06.040 |
| [15] |
Sanghi R, Srivastava A. Long-term chromate reduction by immobil-ized fungus in continuous column[J]. Chemical Engineering Journal, 2010, 162(1): 122-126. DOI:10.1016/j.cej.2010.05.011 |