矿山开采、化工、制药、烟气脱硫等生产过程都会产生大量含硫酸盐废水,其不仅导致设备结垢,还会在厌氧条件下生成硫化氢等生物毒性组分,传统处理方法(如化学沉淀法等)存在设备腐蚀结垢、药剂消耗大及废渣产量大等问题[1-2]。硫酸盐还原菌(Sulphate reducing bacteria,SRB)在电子供体充足情况下可实现对硫酸盐的生化转化,其具有反应条件温和、固废产量小及回收硫资源等优点[3-4]而受到广泛关注。传统SRB常以醇类、有机酸类和糖类等为电子供体[5],但该类可溶性有机电子供体投加量大、运行成本高、出水残留有机物浓度高,而需要后续深度处理[6],因此寻求新型SRB电子供体具有重要的现实意义。
自Widdel等[7]发现合成气(H2/CO2/CO)可供微生物利用,Dupreez等[8]证明合成气可用作生物硫酸盐还原的电子供体,加之合成气具有来源广泛、价格低廉、单位质量供电子量大、出水残留COD浓度较低等显著优势,在硫酸盐废水处理领域受到持续关注。本文主要综述SRB利用气体作为电子供体时的反应机理和影响因素(环境因子、气体传质、涉硫组分和供体竞争)、气体特性及代谢转化对硫酸盐还原的影响,以期对后续深入研究奠定基础。
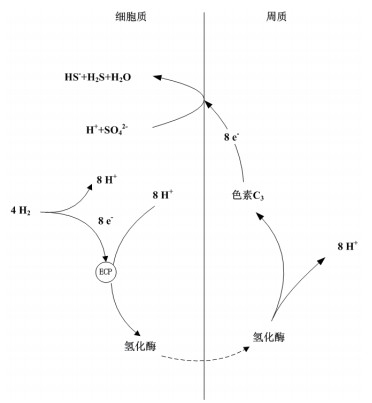
1 以气体为电子供体的反应机理SRB以气体作为电子供体,其通过对分子氢的直接利用,氢扩散穿过细胞质膜,在氢化酶及色素C3作用下,膜转移用于细胞质的电子受体还原,利用过程如图 1所示。在该还原过程中,SRB消耗电子供体的量受电子受体的分子量及形态影响,如电子受体SO32-较SO42-消耗的供体H2少[见等式(1)和(2)],且SO42-的代谢中间产物SO32-、S2O32-在H2氛围下会歧化生成硫酸盐和硫化物[见等式(3)和(4)]。
|
| 图 1 SRB利用气体为电子供体的酶定位、氢循环示意图 |
以H2/CO2作为电子供体/碳源,在SRB生化还原中的反应:
 (1[
(1[ (2[
(2[在H2存在下,SO32-、S2O32-歧化反应:
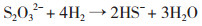 (3[
(3[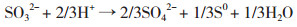 (4[
(4[由于CO具有毒性,大多数SRB只能在较低的CO浓度条件下生长且它们生长代谢存在差异。部分SRB(如Desulfotomaculum carboxydivorans)能直接利用CO作为电子供体进行硫酸盐还原产生硫化物[12];存在着部分厌氧菌(如Carboxydothermu hydrogenoformans)可将CO代谢转化为H2和CO2[13-14],CO2易溶于水生成HCO3-,SRB可利用该类厌氧菌产生的H2和CO2进行硫酸盐还原;大部分SRB(如D. kuznetsovii和D. thermobenzoicum subsp.thermosyntrophicum)利用CO时会受到CO抑制影响[15]。
以CO作为电子供体,在SRB生化还原中的反应:
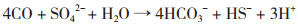 (5[
(5[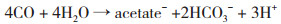 (6[
(6[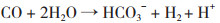 (7[
(7[能够进行无机化学营养生长的细菌属于自养型。通常,能利用H2作为电子供体进行产能代谢的自养型SRB具有两种不同类型的氢化酶,一种是在细胞质里的氢化酶用于吸收H2,另一种是膜结合氢化酶用于产能作用。另外,能利用CO作为电子供体的SRB还需具有CO脱氢酶[16]。在自养型SRB代谢过程中,除氢化酶起重要作用外,细胞色素C3可起到传递电子的作用,对SRB还原活性的提高有帮助(表 1)。
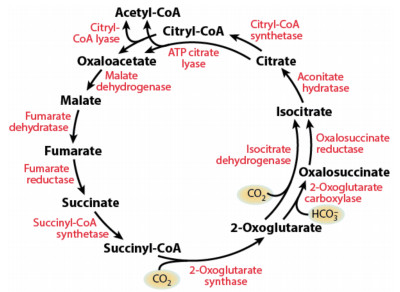
自养型SRB通过利用H2/CO2、CO等电子供体进行代谢产生ATP、一些小分子的物质或分解代谢过程中的中间产物用于生物固碳合成细胞物质,其采用的固碳机制是还原型三羧酸循环(rTCA)和还原型乙酰辅酶A循环。rTCA循环由Evans等[18]在1966年提出,在rTCA循环中两分子的CO2可以合成一分子的乙酰辅酶A,如图 2所示,rTCA循环中大多数酶(苹果酸脱氢酶、延胡索酸水合酶、琥珀酰辅酶A合成酶、异柠檬酸脱氢酶以及乌头酸水合酶)催化反应都是可逆的,其中延胡索酸还原酶、2-酮戊二酸合成酶以及柠檬酸裂解酶是rTCA循环特有的酶。Aoshima等[19]报道rTCA循环中包括两个羧化反应:2-酮戊二酸合成酶催化的琥珀酸辅酶A转化成2-酮戊二酸;由异柠檬酸脱氢酶或酮戊二酸和草酰琥珀酸还原酶催化的羧基化反应(2-酮戊二酸羧基化为异柠檬酸)。ATP依赖型柠檬酸裂解为乙酰辅酶A的反应被认为是rTCA循环中的关键反应,这个关键反应由ATP柠檬酸裂解酶单独催化或者由柠檬酰辅酶A合成酶和柠檬酰辅酶A裂解酶共同催化。还原型乙酰辅酶A途径最早由Drake等[20]和Ljungdahl[21]团队在产乙酸菌中发现,其反应途径为两分子CO2直接以非环化的方式合成乙酰辅酶A,最终产物为乙酸,其中起作用的关键酶为CO脱氢酶。
2 以气体为电子供体的影响因素 2.1 环境因子环境因子的变化会影响SRB的生命活动,只有当环境条件适宜时,SRB的生命活动才能正常进行,否则其生命活动就会受到抑制、引起变异或死亡。SRB可在氯化钠含量小于0.818%的环境中进行生长,大于2.45%时其生长受到完全抑制。pH不仅会影响SRB对硫酸盐的转化,还会导致微生物聚集体的变化,Van Houten等[23]以H2/CO2为电子供体及碳源进行硫酸盐还原发现,当pH 7.0-7.5时,硫酸盐转化速率为16 g SO42- /(L·d),SRB聚集体为不规则球状;pH从7.5上升至8.0,硫酸盐转化速率较pH 7.5时降低,且聚集体表面变得更不规则;当pH降低至6.5时,硫酸盐转化速率及聚集体无明显变化;pH继续降至5.5时,总硫酸盐转化速率急剧下降至2 g SO42- / L·d-1,聚集体由原来的球状变为丝状和螺旋状。SRB作为严格的厌氧菌,其具有一定的抗氧能力[24],但其细胞内各种生物化学反应都需在特定的ORP范围内完成,Chang等[25]和Neufeld等[26]发现SRB只有在ORP < -100的条件下才能正常生长,随着ORP的升高,SRB还原活性下降;徐慧纬等[27]研究表明在SRB反应过程中ORP < -350 mV时,与pH、SO42-浓度相比,ORP不再是影响硫酸盐还原速率的主要因素。温度是厌氧沉积物中硫酸盐还原作用的主要环境参数,Van Houten等[23, 28]在中温(30℃)条件下获得最大硫酸盐转化率30 g SO42- /(L·d);Nevatalo等[29]发现在35℃时HSRB的还原活性最强92 mmol/(gVSS·d),随着温度的降低,HSRB还原活性降低。
2.2 气体传质气体传质主要是在压力梯度驱动下的气体流动传质。气体传质限制会影响SRB的厌氧生化转化,可通过加强生物反应器中的气体传质,来提高SRB还原效率。Van Houten等[28]通过改变反应器内H2浓度,验证了硫酸盐的稳态转化是由于H2的传质限制。Sipma等[17]发现脱硫肠状菌属D. carboxydivorans对CO的转化受气体传质影响。
由于H2、CO在水中的溶解度较小,为增加该类气体(电子供体)在水中的溶解浓度和传质效果,有学者通过膜供应气态底物、增大气体压力等方法来强化气液传质。Fedorovich等[30]利用微孔(0.45 μm)疏水性膜向反应器提供H2,得出气体传质和反应器液体不适当的混合不利于低浓度硫酸盐还原。Tang等[31]发现复合中空纤维的气体输送率较单壁聚酯高,但其存在成本高、沉淀物易堵塞孔隙的缺点;Ontiveros-Valencia等[32-35]研究了硫酸盐还原菌(Sulphate reducing bacteria,SRB)、反硝化菌(Denitrifying bacteria,DB)和高氯酸盐还原菌(Perchlorate-reducing bacteria,PRB)的共存关系,发现气体压力的增加有助于硫酸盐还原。针对气体加压存在能耗大、运行成本高、气压存在上限等问题,徐慧纬等[27]采用两室型生物-电化学系统通过附加直流电的方式来供H2,得出当I = 1.50 mA时,硫酸盐平均还原速率最高。符诗雨和骆海萍等[36]利用双极室微生物电解系统(Microbial electrolysis system,MES)供氢,外加电压为0.8 V时,硫酸盐的去除率较高,平均硫酸盐还原速率可达73.2 mg/L·d。
2.3 涉硫组分硫酸盐废水中SO42-基本无毒性,而过低SO42-浓度不利于SRB的生长代谢,Fedorovich等[30]将生物反应器中SO42-浓度由1.75降至0.75 g/(L·d)时,SRB还原力降低(由0.9降至0.22 g/(L·d));Zhou等[37]不断减少进水SO42-浓度发现,SRB的代谢转化能力逐渐减弱。SRB代谢产生的SO32-、硫化物(H2S、HS-和S2-)等产物对厌氧菌(包括SRB)具有抑制作用,其中SO32-对SRB的影响较小,由于SO32-作为代谢中间产物,很快就能被SRB转化而去除,而硫化物作为代谢最终产物,其对SRB具有较强的毒性抑制。
在中性pH 7时,硫酸盐还原产物是等量的H2S和HS-[等式(5)(9)]。在pH 5时,约99%的产物是H2S[等式(8)(10)],如下列等式[38]:
 (8)
(8)
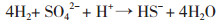 (9)
(9)
 (10)
(10)
H2S是pH < 7时抑制作用最强的硫化物[38-39],但H2S对微生物的抑制机理尚未明确。其中一种假说认为H2S可自由穿过细胞膜,一旦进入细胞质,就假定硫化物与细胞色素中的铁、其他细胞内含铁化合物结合,从而抑制细菌生长甚至死亡[40]。另一种假说则认为在偏酸性条件下,硫酸盐还原产生的大量H2S穿过细胞膜后,在细胞质中解离并释放出质子,使质子动力不稳定,从而抑制ATP的生成,并且SRB所获得的大部分能量被用于pH稳态而不是细菌生长,最终导致细胞死亡[41]。Bijmans等[39]研究了pH为5的高硫酸盐SRB反应器中硫化物的去除对反应器性能和微生物群落的影响,发现硫化物的去除提高了硫酸盐的转化,若未去除硫化物,不仅硫酸盐转化率急剧降低,而且反应器内生物多样性也会大幅度减少。然而,在硫化物存在的情况下SRB的活性较产甲烷菌(Methanogenic bacteria,MPB)高,是由于絮状厌氧污泥比颗粒污泥对硫化物的抑制更敏感[42];Sipma等[43]发现体系中硫化物的增加,MPB活性逐渐消失,而SRB仍具有电子供体的利用能力,其中MPB活性消失的原因是硫化物的毒性抑制。
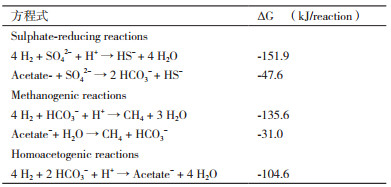
2.4 供体竞争在低ORP的环境中,SRB和其他微生物之间存在电子供体竞争关系,包括MPB和产乙酸菌(Acetogenic bacteria,AB),这些竞争关系中一些重要方程式列于表 2中。当硫酸盐过量的情况下,SRB比MPB有较优的生长速率、底物亲和力、细胞产率。Meulepas等[44]发现SRB对氢的亲和力高于MPB,即使在低氢分压下SRB的活性也强于MPB;任荣等[45]发现反应系统中ORP的降低,可提高MPB对SRB的H2竞争。
在以H2/CO2为电子供体时,污泥停留时间(Sludge retention time,SRT)对厌氧污泥中SRB、MPB和AB之间H2竞争有影响。Weijma等[47]认为增加SRT会影响SRB与MPB的H2竞争,且较长的SRT会使AB和SRB的共生形式比MPB更具有优势;Sipma等[43]研究发现增加SRT仅推迟MPB与SRB的竞争,而不影响最终的竞争结果,且较长的SRT对MPB、SRB和AB无显著影响。
在以CO为能源时,水力停留时间(Hydraulic retention time,HRT)将决定SRB在反应中竞争H2的优势。Sipma等[48]发现较长的HRT不利于SRB电子供体的竞争。在控制HRT为3 h时,SRB较MPB占优势,硫酸盐还原速率为17 mmol·L-1d-1,超过87%的H2生产用于硫酸盐还原;4 h时,其能够消耗反应器内95%的H2,硫酸盐还原速率较3 h时高;当HRT上升至49 h时,MPB成为H2消耗的主导[49],而SRB得不到足够的电子供体,导致硫酸盐还原速率下降。然而较短的HRT会使反应器内SRB生物量降低,这显然会导致电子供体利用率、硫酸盐转化速率降低,表明足够的生物量是实现更高的硫酸盐转化速率的先决条件[28, 49]。Van Houten等[28]向反应器中添加浮石颗粒等载体材料促使SRB生物量增加,但MPB在载体中的附着能力也强。
3 气体特性及代谢转化行为 3.1 CO毒性抑制CO具有毒性会抑制SRB的生长。Van Houten等[23, 28]以H2/CO2/CO的气体混合物作为电子供体和碳源来评估CO对SRB的影响发现,在H2/CO2培养下,生物聚集体的外表面具有“毛状”结构,当加入CO后外表面上的毛状结构消失且变得光滑,微生物的附着能力、生长速率、硫酸盐还原能力降低。Pandelia和Greco等[50-51]研究发现在CO培养下的厌氧菌存在氢化酶抑制作用。Parshina等[16, 52]发现当CO浓度达20%以上时,SRB氧化H2电子供体所需的时间增加,表明CO对SRB氢化酶存在抑制作用。然而Sipma等[43]发现SRB生化反应器内CO浓度的增加,乙酸盐不断生成,但氢化酶在乙酸生成中起着核心作用,表明CO对氢化酶的抑制不太可能是SRB受CO抑制的唯一原因。
3.2 CO代谢转化由于CO对SRB具有毒性抑制,因此能利用CO为唯一电子供体的微生物较少。Van Houten等[28]、Sokolova等[14]研究表明SRB在较高CO浓度下不能在聚集体的外部区域存活,且能利用CO生长的微生物数量较少。然而Parshina等[16]发现硫酸盐还原菌D.kuznetsovii和D.thermobenzoicum subsp.thermosyntrophicum均能在较高CO浓度下生长。D.kuznetsovii能耐受20% CO浓度,当超过20% CO进入系统时,其硫酸盐转化率、H2S产量显著下降,体系中乙酸盐随着CO浓度的增加而增加;D. thermosyntrophicum能耐受高达70% CO浓度,当CO浓度超过70%时,其硫酸盐转化率、H2S产量降低,体系中乙酸盐先增加后降低(表 3)是由于CO浓度的增加,硫酸盐还原受到抑制而产生大量乙酸盐,受到CO毒性抑制的D.thermobenzoicum不能转化和利用CO,导致其利用体系中的乙酸盐进行还原反应。

|
部分微生物可直接利用CO进行生长。Parshina等[15]报道Carboxydothermu hydrogenoformans将CO代谢转化为H2进行生长,其不具有硫酸盐还原能力;SRB可与这种微生物共培养来降低CO的毒性抑制(表 3)。Parshina和Sipma等[16, 52-53]发现脱硫肠状菌属D.carboxydivorans不仅能进行硫酸盐还原,还能实现对CO的代谢转化。当存在硫酸盐的情况下,D.carboxydivorans将CO代谢转化为H2,该H2又被用于硫酸盐还原且最大硫酸盐还原速率为0.3 mmol/h;当不存在硫酸盐时,该菌属仍能实现对CO的代谢转化[12, 53]。
3.3 代谢转化产物CO由厌氧污泥内产氢群体(如D.carboxydivorans)代谢转化为H2和CO2,H2的存在会降低CO转化率。据Sipma等[53]发现CO/H2比率决定着SRB对CO的代谢转化,H2的增加会降低CO被代谢转化的速率。CO被代谢转化成的H2在厌氧污泥中也存在着竞争关系。Sipma等[43]发现在CO存在情况下,厌氧污泥中MPB对H2的竞争强于SRB,而AB的竞争能力弱于SRB。当硫酸盐还原或产甲烷作用占H2消耗主导时,能被AB利用的氢电子流通常很小,以致于AB不能与MPB或SRB竞争,产生这种竞争结果的原因可能是产乙酸作用需要相对较长的时间[42, 53],当HRT远低于AB的倍增时间时,反应器内AB活性低、H2竞争能力弱。在CO培养的厌氧污泥中,需尽量减少MPB对电子供体的消耗来提高硫酸盐还原。Sipma等[17]发现在较高温度(60和65℃)下,SRB活性比MPB强,但温度较高会影响污泥中产氢群体对CO的代谢转化;Vallero等[49]发现在高盐度情况下,MPB比SRB的H2竞争能力强;Parshina等[52]发现当pH低于5.8时,SRB的H2竞争能力较MPB强,但转化CO的产氢菌属将不能生长。
4 小结含硫酸盐废水的生化处理较传统物化处理具有多重优势,而气体作为SRB代谢过程的电子供体相较传统有机碳源也具有显著优势。综上所述,气体作为SRB电子供体在代谢机理、影响因素、毒性气体(CO)的还原转化等方面已有相应的研究,其具有重要的理论意义和指导价值。但气体作为电子供体在含硫酸盐废水的生化处理工程应用中仍有诸多难题亟待解决。气体传质对于SRB还原能力的提升至关重要,而H2、CO为难溶性气体,其溶于水体供SRB利用的效率较低,因此难溶性气体在生化系统中的传质阻力及效率提升还需深入研究,新型增溶扩散膜材料及电解产氢电极材料可能是有潜力的技术方向。CO可作为SRB良好的电子供体,其具有较强毒性导致大多数SRB受抑制而未能发挥还原能力,且CO对生化代谢过程的毒性抑制机理尚不明确,其抑制机理及解除策略还有待深入研究。在代谢反应过程中,SRB存在生物增殖、竞争能力减弱等问题,为有力促进SRB在含硫酸盐废水处理中的工程应用,可考虑SRB的高效增殖、代谢活性保持、目标代谢产物的定向调控等研究。
| [1] |
狄军贞, 江富, 戴男男, 等. 硫酸盐还原菌污泥固定化特性[J]. 环境工程学报, 2015, 9(5): 2227-2231. |
| [2] |
董慧, 张瑞雪, 吴攀, 等. 利用硫酸盐还原菌去除矿山废水中污染物试验研究[J]. 水处理技术, 2012, 38(5): 31-35. DOI:10.3969/j.issn.1000-3770.2012.05.008 |
| [3] |
吴熙, 胡学伟, 宁平, 等. 基于硫循环的烟气生化脱硫及硫磺回收的过程机理[J]. 中国环境科学, 2019, 39(3): 954-959. DOI:10.3969/j.issn.1000-6923.2019.03.007 |
| [4] |
谢苹, 张书良, 杨科科. 微氧环境下无色硫细菌和硫酸盐还原菌脱硫[J]. 环境工程学报, 2013, 7(1): 306-310. |
| [5] |
Hao TW, Xiang PY, Mackey HR, et al. A review of biological sulfate conversions in wastewater treatment[J]. Water Research, 2014, 65: 1-21. DOI:10.1016/j.watres.2014.06.043 |
| [6] |
Schmidtova J, Baldwin SA. Correlation of bacterial communities supported by different organic materials with sulfate reduction in metal-rich landfill leachate[J]. Water Research, 2011, 45(3): 1115-1128. |
| [7] |
Widdel F, Bak F. Gram-negative mesophilic sulfate-reducing bacteria[M]. New York: The Prokaryotes Springer, 1992, chapter 183: 3352-3378.
|
| [8] |
Dupreez LA, Odendaal JP, Maree JP. Biological removal of sulphate from industrial effluents using producer gas as energy source[J]. Environmental Technology, 1992, 13(9): 875-882. DOI:10.1080/09593339209385222 |
| [9] |
Van Houten RT, Yun SY, Lettinga G. Thermophilic sulphate and sulphite reduction in lab-scale gas-lift reactors using H2 and CO2 as energy and carbon source[J]. Biotechnol Bioeng, 1997, 55(5): 807-814. DOI:10.1002/(SICI)1097-0290(19970905)55:5<807::AID-BIT11>3.0.CO;2-8 |
| [10] |
Sousa JAB, Bijmans MFM, Stams AJM, et al. Thiosulfate conversion to sulfide by a haloalkaliphilic microbial community in a bioreactor fed with H2 gas[J]. Environ Sci Technol, 2017, 2: 914-923. |
| [11] |
Sánchez-andrea I, Sanz JL, Bijmans MFM, et al. Sulfate reduction at low pH to remediate acid mine drainage[J]. Journal of Hazardous Materials, 2014, 269: 98-109. |
| [12] |
Sipma J, Osuna MB, et al. H2 enrichment from synthesis gas by Desulfotomaculum carboxydivorans for potential applications in synthesis gas purification and biodesulfurization[J]. Appl Microbiol Biotechnol, 2007, 76(2): 339-347. |
| [13] |
Fardeau ML, Bonilla SM, L'haridon S, et al. Isolation from oil reservoirs of novel thermophilic anaerobes phylogenetically related to Thermoanaerobacter subterraneus:reassignment of T. subterraneus, Thermoanaerobacter yonseiensis, Thermoanaerobacter tengcongensis and Carboxydibrachium pacificum to Caldanaerob-acter subterraneus gen. nov. sp. nov. comb. nov. as four novel subspecies[J]. International Journal of Systematic and Evolutio-nary Microbiology, 2004, 54(2): 467-474. DOI:10.1099/ijs.0.02711-0 |
| [14] |
Sokolova TG, González JM, Kostrikina NA, et al. Thermosinus carboxydivorans gen. nov. sp. nov. a new anaerobic, thermophilic, carbon-monoxide-oxidizing, hydrogenogenic bacterium from a hot pool of Yellowstone National Park[J]. Int J Syst Evol Microbiol, 2004, 54(6): 2353-2359. DOI:10.1099/ijs.0.63186-0 |
| [15] |
Parshina SN, Kijlstra S, Henstra AM, et al. Carbon monoxide conversion by thermophilic sulfate-reducing bacteria in pure culture and in co-culture with Carboxydothermus hydrogenoformans[J]. Appl Microbiol Biotechnol, 2005, 68(3): 390-396. DOI:10.1007/s00253-004-1878-x |
| [16] |
Parshina SN, Sipma J, Henstra AM, et al. Carbon monoxide as an electron donor for the biological reduction of sulphate[J]. International Journal of Microbiology, 2010. DOI:10.1155/2010/319527 |
| [17] |
Sipma J, Meulepas RJ, et al. Effect of carbon monoxide, hydrogen and sulfate on thermophilic (55℃) hydrogenogenic carbon monoxide conversion in two anaerobic bioreactor sludges[J]. Appl Microbiol Biotechnol, 2004, 64(3): 421. |
| [18] |
Evans MC, Buchanan BB, Arnon DI. A new ferredoxin-dependent carbon reduction cycle in a photosynthetic bacterium[J]. Proc Natil Acad Sci, 1966, 55(4): 928-934. DOI:10.1073/pnas.55.4.928 |
| [19] |
Aoshima M. Novel enzyme reactions related to the tricarboxylic acid cycle:phylogenetic/functional implications and biotechnological applications[J]. Appl Microbiol Biotechnol, 2007, 75(2): 249-255. DOI:10.1007/s00253-007-0893-0 |
| [20] |
Drake HL, Gössner AS, Daniel SL. Old acetogens, new light[J]. Ann N Y Acad Sci, 2010, 1125(1): 100-128. |
| [21] |
Ljungdahl LG. A life with acetogens, thermophiles, and cellulolytic anaerobes[J]. Annual Review of Microbiology, 2009, 63(1): 1-25. DOI:10.1146/annurev.micro.091208.073617 |
| [22] |
陈颖.厌氧甲烷氧化微生物代谢分子机制及其潜在参与矿物形成机理的研究[D].上海: 上海交通大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10248-1015807921.htm
|
| [23] |
Van Houten RT, Elferink SJ, Hamels EV, et al. Sulphate reduction by aggregates of sulphate-reducing bacteria and homo-acetogenic bacteria in a lab-scale gas-lift reactor[J]. Bioresource Technology, 1995, 54(1): 73-79. DOI:10.1016/0960-8524(95)00117-4 |
| [24] |
Lefèvre CT, Howse PA, Schmidt ML, et al. Growth of magnetotactic sulfate-reducing bacteria in oxygen concentration gradient medium[J]. Environ Microbiol Rep, 2016, 8(6): 1003. DOI:10.1111/1758-2229.12479 |
| [25] |
Chang YJ, Chang YT, Hung CH, et al. Microbial community analysis of anaerobic bio-corrosion in different ORP profiles[J]. Int Biodeter Biodegr, 2014, 95: 93-101. DOI:10.1016/j.ibiod.2014.04.008 |
| [26] |
Neufeld RD, Ropelewski L, Acheson M. Sewage as a mixed organic substrate for desulfurization bacteria[J]. Proceedings of the Water Environment Federation, 2012(17): 265-274. |
| [27] |
徐慧纬, 张旭, 杨姗姗, 等. 电场条件下的硫酸盐还原效应及pH/ORP响应[J]. 清华大学学报:自然科学版, 2009, 49(9): 1520-1523. |
| [28] |
Van Houten RT, Van der Spoel H, Van aelst AC, et al. Biological sulfate reduction using synthesis gas as energy and carbon source[J]. Biotechnol Bioeng, 1996, 50(2): 136-144. |
| [29] |
Nevatalo LM, Bijmans MFM, Lens PNL, et al. The effect of sub-optimal temperature on specific sulfidogenic activity of mesophilic SRB in an H2-fed membrane bioreactor[J]. Process Biochem, 2010, 45: 363-368. DOI:10.1016/j.procbio.2009.10.007 |
| [30] |
Fedorovich V, Greben M, Kalyuzhnyi S, et al. Use of hydrophobic membranes to supply hydrogen to sulphate reducing bioreactors[J]. Biodegradation, 2000, 11(5): 295-303. DOI:10.1023/A:1011100120121 |
| [31] |
Tang Y, Zhou C, Ginkel SWV, et al. Hydrogen permeability of the hollow fibers used in H2-based membrane biofilm reactors[J]. J Memb Sci, 2012, 407-408(none): 176-183. |
| [32] |
Ontiveros-valencia A, et al. Interactions between nitrate-reducing and sulfate-reducing bacteria coexisting in a hydrogen-fed biofilm[J]. Environ Sci Technol, 2012, 46(20): 11289-11298. DOI:10.1021/es302370t |
| [33] |
Ontiveros-valencia A, Ilhan ZE, Kang DW, et al. Phylogenetic analysis of nitrate-and sulfate-reducing bacteria in a hydrogen-fed biofilm[J]. FEMS Microbiol Ecol, 2013, 85(1): 158-167. |
| [34] |
Ontiveros-valencia A, Tang Y, Kpajmalnik-brown R, et al. Managing the interactions between sulfate-and perchlorate-reducing bacteria when using hydrogen-fed biofilms to treat a groundwater with a high perchlorate concentration[J]. Water Research, 2014, 55: 215-224. DOI:10.1016/j.watres.2014.02.020 |
| [35] |
Ontiveros-valencia A, Tang Y, Kpajmalnik-brown R, et al. Perchlorate reduction from a highly contaminated groundwater in the presence of sulfate-reducing bacteria in a hydrogen-fed biofilm[J]. Biotechnol Bioeng, 2013, 110(12): 3139-3147. DOI:10.1002/bit.24987 |
| [36] |
符诗雨, 刘广立, 骆海萍, 等. 微生物电解系统生物阴极的硫酸盐还原特性研究[J]. 环境科学, 2014, 35(2): 626-632. |
| [37] |
Zhou J, Xing J. Effect of electron donors on the performance of haloalkaliphilic sulfate-reducing bioreactors for flue gas treatment and microbial degradation patterns related to sulfate reduction of different electron donors[J]. Biochem Eng J, 2015, 96: 14-22. DOI:10.1016/j.bej.2014.12.015 |
| [38] |
Bijmans MF, Dopson M, Ennin F, et al. Effect of sulfide removal on sulfate reduction at pH 5 in a hydrogen fed gas-lift bioreactor[J]. J Microbiol Biotechnol, 2008, 18(11): 1809-1818. |
| [39] |
Bijmans MF, Dopson M, Peeters TW, et al. Sulfate reduction at pH 5 in a high-rate membrane bioreactor:reactor performance and microbial community analyses[J]. J Microbiol Biotechnol, 2009, 19(7): 698-708. |
| [40] |
Caffrey SM, Voordouw G. Effect of sulfide on growth physiology and gene expression of Desulfovibrio vulgaris Hildenborough[J]. Antonie Van Leeuwenhoek, 2010, 97(1): 11-20. DOI:10.1007/s10482-009-9383-y |
| [41] |
Brileya KA, Camilleri LB, et al. Biofilm growth mode promotes maximum carrying capacity and community stability during product inhibition syntrophy[J]. Front Microbiol, 2014, 5: 693. |
| [42] |
Esposito G, Weijma J, Pirozzi F, et al. Effect of the sludge retention time on H2, utilization in a sulphate reducing gas-lift reactor[J]. Process Biochemistry, 2003, 39(4): 491-498. |
| [43] |
Sipma J, Lettinga G, Stama AJM, et al. Hydrogenogenic CO conversion in a moderately thermophilic (55℃) sulfate-fed gas lift reactor:competition for CO-derived H2[J]. Biotechnology Progress, 2010, 22(5): 1327-1334. |
| [44] |
Meulepas RJW, Stams AJM, Lens PNL. Biotechnological aspects of sulfate reduction with methane as electron donor[J]. Reviews in Environmental Science and Bio-Technology, 2010, 9(1): 59-78. DOI:10.1007/s11157-010-9193-8 |
| [45] |
任荣, 杨颖, 汪张懿, 等. 硫酸盐对厌氧处理的影响及控制对策[J]. 科技创新与应用, 2015(28): 172-173. |
| [46] |
Muyzer G, Stams AJM. The ecology and biotechnology of sulphate-reducing bacteria[J]. Nat Rev Microbiol, 2008, 6: 441-454. DOI:10.1038/nrmicro1892 |
| [47] |
Weijma J, Gubbels F, Hulshoff pol LW, et al. Competition for H2 between sulfate reducers, methanogens and homoacetogens in a gas-lift reactor[J]. Water Sci Technol, 2002, 45(10): 75-80. DOI:10.2166/wst.2002.0294 |
| [48] |
Sipma J, Osuna MB, Lettinga G, et al. Effect of hydraulic retention time on sulfate reduction in a carbon monoxide fed thermophilic gas lift reactor[J]. Water Research, 2007, 41(9): 1995-2003. DOI:10.1016/j.watres.2007.01.030 |
| [49] |
Vallero MVG, Lettinga G, Lens PNL. High rate sulfate reduction in a submerged anaerobic membrane bioreactor (SAMBR) at high salinity[J]. J Memb Sci, 2005, 253(1): 217-232. |
| [50] |
Pandelia ME, Ogata H, Currell LJ, et al. Inhibition of the[NiFe]hydrogenase from Desulfovibrio vulgaris Miyazaki F by carbon monoxide:an FTIR and EPR spectroscopic study[J]. Biochim Biophys Acta, 2010, 1797(2): 304-313. DOI:10.1016/j.bbabio.2009.11.002 |
| [51] |
Greco C, Bruschi M, Heimdal J, et al. Structural insights into the active-ready form of [FeFe]-hydrogenase and mechanistic details of its inhibition by carbon monoxide[J]. Inorganic Chemistry, 2007, 46(18): 7256-7258. DOI:10.1021/ic701051h |
| [52] |
Parshina SN, Sipma J, Nakashimada Y, et al. Desulfotomaculum carboxydiVorans sp. nov., a novel sulfate reducing bacterium capable of growth at 100% CO[J]. Int J Syst Evol Microbiol, 2005, 55: 2159-2165. DOI:10.1099/ijs.0.63780-0 |
| [53] |
Sipma J, Lens PN, Stams AJ, et al. Carbon monoxide conversion by anaerobic bioreactor sludges[J]. FEMS Microbiol Ecol, 2003, 44(2): 271-277. |