聚羟基脂肪酸酯(Polyhydroxyalkanoates,PHA)是一种由微生物合成的天然生物聚酯,在不利的生长条件下作为碳源和能量存储、氧化还原调节剂和冷冻保护剂维持细胞生存[1]。同时,由于其生物可降解性、生物相容性、热塑性等优良特性,PHA已经广泛地应用于诸多领域。虽然PHA的使用能够有效地避免石化塑料对环境造成的危害,但这种环境友好的生物塑料成本过于高昂,限制了其未来发展的更多可能。目前,PHA的商业生产价格高达每千克2.2-5.0欧元,而聚丙烯塑料的价格仅为每千克1.0欧元[2]。微生物工业制品的生产成本主要取决于原料的价格、连续发酵过程的灭菌成本以及产品的产量与产率,为了使工业生物技术与化学工业具有相同的竞争力,开发低成本的生物加工技术具有重要意义。本文针对目前PHA生产面对的诸多问题,结合课题组的一些研究成果和国内外最新的研究进展,综合阐述低成本合成PHA的可行方法,并对今后PHA的研究前景加以展望。
1 PHA的分类及特性PHA是具有多种化学结构的脂肪族生物聚酯的统称,其分子结构通式如图 1所示。

|
| 图 1 PHA的分子结构 |
式中,m为主链单体链长,多为1-3;n表示聚合度,决定了分子量的大小;R为侧链,可以是多种烷基基团。根据PHA单体的碳原子数,通常将其分为两类:单体含3-5个碳原子的为短链PHA(SCL-PHA),广泛分布于古细菌以及革兰氏阳性和阴性细菌中[3-4],一般具有较高的结晶度和耐热性;单体含6个及以上碳原子的为中长链PHA(MCL-PHA),大多存在于假单胞菌Pseudomonas中[5],结晶度较低,具有良好的弹性。然而天然PHA的性能很难满足人类的需要,所以通常会采用物理共聚的方式引入其他生产生活中需要的材料性能。例如,聚-3-羟基丁酸(PHB)是PHA均聚物的常见形式,其力学性能与传统热塑性塑料聚丙烯相似,但抗冲击性较差,很容易折断,且加热温度高于熔点10℃左右时就会降解,限制了它的应用范围。于是人们向PHB单体中加入少量MCL-PHA单体,大幅提高其韧性和弹性而不会过多地降低其熔点,得到聚羟基丁酸羟基己酸酯(PHBHHx)等一系列性能优异的PHA共聚物。表 1展示了不同种类PHA与塑料的物理性能对比。
PHA不仅与人体组织细胞相容性良好,而且降解的产物都是机体本身具有的物质,目前已经应用于靶向药物释放的载体、外科手术器材和植入性组织材料等[6]。药物运输方面,天然PHA是惰性的,不具备靶向能力,需要人为地物理共聚或化学修饰改变其特性[7]。这样,药物就可以包埋在载体中或吸附在其表面,并在表面耦联了特异性靶向分子的纳米颗粒,以此来控制靶向药物与细胞表面受体的识别和结合,避免了传统材料可能的致癌风险[8]。不仅如此,外科手术使用的医用缝合线也可以由PHA材料制作。理想的手术缝合线需要具有弹性、表面光滑、可抵抗细菌生长并与组织细胞相容,3-羟基丁酸-3羟基己酸共聚物[P(3HB-co-3HHx)]等材料完全符合人们的预期[9]。而PHA材料制作的三维支架则为广大的先天心脏瓣膜病患者带来了福音,同时植入性的组织工程材料也在神经导管、消化道、心血管及软骨疾病等方面发挥了开创性作用[10]。PHA三维支架可以支持细胞在损伤部位生长,帮助其形成特定的组织,等到受损组织修复后再自行降解,几乎不会产生免疫排斥反应[11-12]。
2.2 工业、农业领域的应用PHA在工业领域拥有巨大的应用潜力,先后有四代PHA产品陆续投入生产(PHB、PHBV、PHBHHx和P3HB4HB),产品主要包括包装塑料、器具材料、服装材料、喷涂材料和纤维等[13]。为了进一步提高PHA的机械性能和热性能,通常与纳米材料或其他生物塑料如聚乳酸(Polylactide,polylactic acid,PLA)共聚。与生物基塑料相比,传统包装塑料在地表土壤的降解周期约为1-2个世纪,而PHA生产出的农田地膜可以在富含微生物的土壤环境中被迅速降解,具有较高的生态和经济优势。不仅如此,PHA在水产养殖业也发挥着重要作用:Thai等[13]通过投放高PHB浓度的饲料喂养罗氏沼虾Macrobrachium rosenbergii发现,PHB可以改善甲壳类水生动物的肠道菌群,抑制细菌性病原体从而提高幼虫的存活率[14]。
3 PHA的低成本合成PHA的商品化发展一直受制于其高昂的生产成本,从PHB、PHBV、PHBHHx到P3HB4HB,研究者在提升PHA材料学性能的同时一直在为降低成本而努力。如果解决底物成本与灭菌成本过高、产率和性能较低的问题,PHA完全有希望取代塑料。笔者认为,降低PHA成本有两种途经:一是从PHA生产的各个环节分别找到低成本的方法;二是大幅提高PHA的产量,也就间接降低了PHA的单位生产成本。
3.1 低成本合成途径的构建代谢途径的构建很大程度上依赖于不同菌种对不同碳源的利用能力。简单来说,生产PHA的微生物更倾向于利用与PHA单体结构相似或相关的碳源,这也就决定了除PHB以外,糖类为唯一碳源时很难天然合成其他类型的PHA。如果想要生产性能更加优异的PHA共聚物,就不得不在生产过程中添加昂贵的第二种碳源。因此,通过重新构建微生物的PHA合成途径,使糖类作为唯一碳源成为可能。
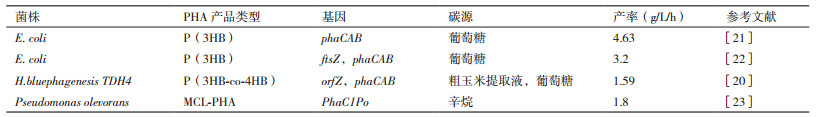
PHBV是一种已经广泛应用的第二代生物塑料产品,但成本仍然受制于不得不补充相关碳源(丙酸、戊酸等)来生产3HV单体的前体丙酰辅酶A。为解决这一问题,Srirangan等[15]在大肠杆菌中构建了不相关碳源(如葡萄糖、甘油等)直接合成P(3HB-co-3HV)的途径,创新地利用睡美人变位酶操纵子(Sleeping beauty mutase,SBM)激活编码诱导琥珀酰辅酶A转化为丙酰辅酶A前体的酶;而Wang等[16]开发了利用无关碳源生产PHBV的苏氨酸合成途径,过表达thrABC操纵子与苏氨酸脱氢酶基因,甚至设计了柠檬酸途径与苏氨酸合成途径的结合,均只使用葡萄糖为唯一碳源,最高使PHBV共聚物中的3HV单体部分含量提高到25.4 mol%。目前,几乎所有的高性能PHA共聚物都实现了唯一碳源的廉价生产。
3.2 对菌种的改造通过基因工程技术,对细菌进行基因编辑,不仅可以大幅提高PHA的产量,还可能拥有其他多方面的优势,如提高微生物的抗逆性、增大菌体承载的PHA体积等。Tao等[17]通过CRISPRi技术抑制了编码嗜盐菌Halomonas species TD01分裂时ftsZ基因的表达,导致细胞形态的延长。与对照组相比,细胞长度增加了20-70倍,大大增加了胞内PHA的积累空间。为了进一步节约细菌在运动上的消耗,Wang等[18]敲除了76个恶臭假单胞菌Pseudomonas putida KT2442的关于鞭毛和菌毛合成及组装的基因,得到的重组细菌显示出诸多生理上的优势,如提高了细菌对氧化应激的耐受性、增强了PHA的积累能力等[19]。此外,为了解决部分细菌能够表达异源基因的启动子较少的问题,Shen等[20]研究出一种基于Pporin构建启动子库的方法,在启动子核心区进行饱和突变,显著增加了启动子文库的多样性,适用于多种不同异源基因的转录。于是在嗜盐菌H. bluephagenesis TDH4中构建了含编码4HB-CoA转移酶的orfZ基因,由文库中选择的启动子驱动,经50 h生长后,PHA占细胞干重80%以上,产率为1.59 g/L/h。
所以选择优质高产底盘菌进行基因编辑是一个提高产量的可行办法,可以弥补其在其他方面的不足。例如,大肠杆菌既不能合成也不能降解PHA,但由于其基因序列背景清晰、培养与操作简单、体内又无可以使PHA降解的酶,成为实施基因改造的热门底盘菌。研究者通常将其他高产菌种的关键操纵子如phaCAB等转入大肠杆菌中,再调节其生理状态和代谢流,综合提高PHA产量。表 2展示了部分高产工程菌的类型和产量。
为微生物发酵提供了营养的底物约占生产总成本的50%[24],这就意味着精致的糖类和脂肪酸需要被廉价的底物所替换。碳源的选择标准应该是更加经济、可行和高效的,一些工业、农业生产的废弃物是比较理想的选择。
3.3.1 粗甘油生物柴油的副产物——粗甘油越来越受到研究者们的青睐。仅以2015年为例,全球生物柴油的年产量就达2.91×107 t。作为其主要衍生物,80%纯度的粗甘油的价格仅为每吨44美元[25]。据此,Pan等[26]将粗甘油预处理后使用两步法合成高附加值的1,3-丙二醇和PHA。第一步,厌氧发酵合成1,3-丙二醇;第二步,利用碳化棒状杆菌Corynebacterium Hydrocarbooxydans ATCC 21767和大型芽孢杆菌Bacillus Megaterium DSM 90的混合菌群将厌氧发酵的副产物羧酸和剩余的甘油转化为PHB。不过,粗甘油的预处理略微增加了成本。Możejko-Ciesielska等[27]从活性污泥中筛选出一株气单胞菌Aeromonas spp.,在48 h内细胞于纯甘油或粗甘油上的增加的细胞干重相同,所以无需提纯甘油,大大节约了成本。而Volova等[28]在2018年的报道中已经将甘油为底物的P(3HB)产量提高至85.8 g/L,但仍略低于糖类。
3.3.2 活性污泥活性污泥是用于污水处理的微生物群落及其依附的有机质和无机质的总称,因其中含有大量的营养物质被认为是合成PHA的理想底物。例如,棕榈油是世界上生产量和消费量最大的可食用植物油,每年棕榈油厂废水中大量的低质量棕榈油污泥(Sludge palm oil,SPO)有待再利用[29]。SPO的主要成分为长链脂肪酸,非常适合用来制备mcl-PHA[30]。Kang等[31]筛选出恶臭假单胞菌Pseudomonas putida S12以SPO为唯一碳源分批补料发酵,提取出3.7 g/L的PHA,产率约为41%。Ward等[32]更是证明了假单胞菌Pseudomonas利用SPO与利用脂肪酸生产PHA的产率是相似的,避免了使用精致碳源,大大降低了底物成本。
3.3.3 木质纤维素工业木材残渣、农业废料等廉价的木质纤维素材料长期得不到有效利用,是合成PHA的潜在碳源。但对于大多数天然纤维素材料来说,结构的致密性和异质性阻碍了酶解的发生,使得预处理尤为重要。其中木质素是一种广泛存在于植物体中的含氧代苯丙醇的高聚物,需要被解聚和脱氧为单体,才可以被微生物代谢和利用。Kumar等[33]驯化了一株罗氏真养菌R. eutropha,能够耐受水解产物中的苯甲酸盐、苯酚和糠醛等抑制剂,通过协同代谢合成PHA,产量为11.1 g/L。而价格更低、水解条件更温和的纤维素和半纤维素更适合作为碳源。以小麦秸秆为例,仅欧洲地区就年产近1×108 t,采用蒸汽爆破或稀硫酸处理得到的水解产物主要为葡萄糖、木糖和阿拉伯糖[34]。Cesário等[35]在2 L搅拌槽反应器中分批补料发酵61 h后达到P(3HB)浓度的最大值105 g/L,是迄今为止在农业废弃物方面所达到的最高水平。
3.4 发酵工艺流程的改进如何使微生物保持在发酵的最佳条件是PHA工业化生产的困难之一:若PHA积累过早发生,则会降低产率;若PHA积累过慢,则可能将碳源浪费在细菌生长上。为进一步提高其成本竞争力,研究者改进了发酵方式和流程,开发了同时积累多种产品的新途径。
3.4.1 联合生产在不影响细胞代谢平衡的条件下,能够在合成PHA的同时积累多种其他产品具有极高的经济价值。氨基酸、蛋白质、醇、胞外聚合物等产品都可以与PHA联合生产[36]。以其中一种具有高附加值的小分子L-色氨酸为例:L-色氨酸是一种人体必需氨基酸,可以治疗糙皮病、营养缺陷和用来诱导睡眠等。研究发现,PHB的生物合成可以改变细胞的代谢流和氧化还原状态,提高L-色氨酸的产量。Gu等[37-38]通过在工程大肠杆菌GPT1020中表达含phaCAB操纵子基因的合成途径来增强L-色氨酸的产生,得到14.4 g/L的色氨酸和9.7%的PHB(W/W)。联合生产的优势在于可以最大限度地利用底物和细胞的代谢能力,却也受到微生物遗传特性和代谢能力的限制。如果可以进一步优化共生产的参数、提高上述高经济价值产品的收率,这种一举多得的联合生产方式将有望取代单一产品的传统发酵模式,成为PHA低成本生产的有力途径[39]。
3.4.2 分批补料和连续发酵分批补料发酵可以解除产物对发酵的抑制,减少消耗在菌体生长上的成本。据有关研究显示,生产PHA的最佳碳氮比为32-45,所以Norhafini等[40]通过开始添加所有营养使菌体快速生长、随后补加碳源限制氮源保持最佳碳氮比直到发酵结束,达到了大于50 g/L的聚合物积累量。与之相比,连续发酵会在添加底物的同时以相同速度流出产物,可以使细胞始终维持在最佳生产状态。但是连续发酵高昂的成本并不符合我们的初衷:对底物利用率较低带来的浪费、连续灭菌和自动化设备的成本都是目前难以解决的问题。
3.4.3 蓝水生物技术为解决上述发酵过程中高昂的成本问题,Yin和陈国强等[41]开发出一种基于嗜盐菌和海水的蓝水生物技术,或是低成本连续发酵的成功尝试。嗜盐菌是一类生活在高盐浓度环境下的微生物,其中嗜盐单胞菌Halomonas TD01、Halomonas campaniensis LS21和嗜盐古菌地中海富盐菌Haloferax mediterranei等均已成功地应用于PHA生产中。他们利用一些嗜盐菌可以在高盐高碱的条件下生长而其他微生物会受到抑制的特性,实现了开放式不灭菌的连续发酵:一方面避免了灭菌过程中带来的诸多额外成本;另一方面使用海水作为高盐浓度的培养基节约了宝贵的淡水资源。如果以嗜盐菌为底盘菌进行基因改造,进一步降低底物成本,有望弥补其为数不多的劣势,为PHA工业化生产带来重大变革。
值得注意的是,蓝藻Cyanobacteria以及海洋光合紫细菌Rhodovulum sulfidophilum等自养微生物均可以在海水中合成PHA,同样具备蓝水生物技术的诸多优势[42-43]。蓝藻等光营养细菌可以从阳光中吸收能量,以CO2和乙酸盐为底物的成本非常低廉。虽然蓝藻的生产力非常低下,但这项研究无疑具有着重大意义,异养微生物产生PHB的成本约为2-5欧元/kg而蓝藻在含有高碳、氮和磷的废水中培养并通入工业烟气中的二氧化碳,可以使成本降低到2欧元/kg[44]。
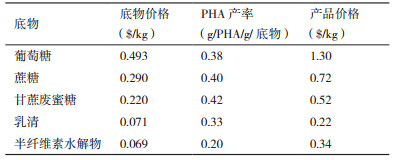
3.5 PHA产业化现状及低成本化的预期效果不可否认的是,到目前为止,采用微生物发酵技术生产的生物塑料对于化工生产来说仍然不具备价格的优势。利用天然罗氏真养杆菌Ralstonia eutrophus生产PHA的价格高达16美元/kg,比聚苯乙烯塑料高出18倍[45]。通过工程大肠杆菌生产PHA可以将成本控制在4美元/kg左右,但仍需进一步降低。成本控制进入瓶颈的原因很大程度上与高昂的底物成本有关,糖类为底物生产PHA的转化率最高仅为48%,再加上其他成本,PHA的售价将达到底物成本的10倍以上。根据已经投产的公司数据来看,德国BASF公司和美国Cargill Dow公司倾向于使用淀粉为底物生产PHA。由于淀粉的价格(0.22美元/kg)低于葡萄糖的价格(0.49美元/kg),对于每年1×105 t PHB的生产规模,成本将从4.91美元/kg降至3.72美元/kg[46]。随着PHA共聚物的投产,PHB受到很大冲击,Metabolix公司曾实现了60 t的PHB大规模发酵,使成本控制在2.2美元/kg,但最终仍不得不退出生物塑料领域。虽然PHA共聚物成本是聚乙烯的2-5倍,但性能远优于PHB甚至聚烯烃塑料,可以应用于生物医学等高附加值领域。近年来,通过现代微生物工业技术将合成生物学和基因编辑技术整合起来,对PHA的合成途径重新构建,加之蓝水生物技术的兴起,PHA对于石化塑料不再保持价格上的劣势不再是梦想。表 3展示了各种底物在最优利用下的产品价格,不过由于当时的货币价值与现在不同,不能简单加以比较。另外,虽然一些工农业废弃物价格较低,但较低的单位产率可能会造成PHA提取和下游加工的困难。
4 结语从PHA的发展史来看,PHB等天然PHA的生产历史已达数十年之久,具有较为成熟的产业链。但由于其高昂的成本和特殊性能的限制,PHB的前景并不被看好。PHBV作为对PHB的改进,在添加了3HV单体后弹性有很大提高。而如今已经广泛使用的PHBHHx是新型的短链和中长链PHA共聚物,与PHBV相比,具有更低的结晶度和更高的延展性,性能可以与聚乙烯塑料媲美,也能够以脂肪酸为唯一碳源生产,只是价格对聚乙烯不具备竞争力。
随着基因工程技术和合成生物学的不断发展,通过人为改变菌株的代谢途径和形态结构,利用廉价的底物或工农业废弃物,开发更为有效的生产工艺流程,使PHA的低成本合成成为可能。根据欧洲生物塑料协会(European Bioplastics)预测,全球生物塑料年产量将从2017年的2.05×106 t增长至2022年的2.44×106 t。据此,随着PHA生产成本的逐步降低,PHA取代部分传统石化塑料的趋势已不可逆转。笔者认为,今后PHA产品的开发可能会倾向于短链与几种不同中长链单体(HV、HHx、HD和HO等)的结合,形成三聚物甚至四聚物,随着调整引入中长链单体的种类、数量和比例等,结晶度、熔融温度和机械性能会随之改变,就可以根据人类需求来“制造”相应的PHA。但值得注意的是,在根据需要构建代谢途径时,还应从整个代谢网络角度分析PHA合成是否会影响其他重要的代谢途径,盲目地基因编辑或改造代谢途径手段并不可取。
| [1] |
Elmowafy E, Abdal-Hay A, Skouras A, et al. Polyhydroxyalkanoate (PHA):applications in drug delivery and tissue engineering[J]. Expert Review of Medical Devices, 2019, 16(6): 467-482. DOI:10.1080/17434440.2019.1615439 |
| [2] |
Ong SY, Zainab-L I, Pyary S, et al. A novel biological recovery approach for PHA employing selective digestion of bacterial biomass in animals[J]. Applied Microbiology and Biotechnologyl, 2018, 102(5): 2117-2127. DOI:10.1007/s00253-018-8788-9 |
| [3] |
Poli A, Di Donato P, Abbamondi GR, et al. Synthesis, production, and biotechnological applications of exopolysaccharides and polyhydroxyalkanoates by archaea[J]. Archaea, 2011, 693253. |
| [4] |
Keshavarz T, Roy I. Polyhydroxyalkanoates:bioplastics with a green agenda[J]. Current Opinion in Microbiology, 2010, 13: 321-326. DOI:10.1016/j.mib.2010.02.006 |
| [5] |
Albuquerque MG, Martino V, Pollet E, et al. Reis, Mixed culture polyhydroxyalkanoate (PHA) production from volatile fatty acid (VFA)-rich streams:Effect of substrate composition and feeding regime on PHA productivity, composition and properties[J]. Journal of Biotechnology, 2011, 151: 66-76. DOI:10.1016/j.jbiotec.2010.10.070 |
| [6] |
Singh AK, Srivastava K, Chandel AK, et al. Biomedical applications of microbially engineered polyhydroxyalkanoates:an insight into recent advances, bottlenecks, and solutions[J]. Applied Microbiology and Biotechnology, 2019, 103: 2007-2032. DOI:10.1007/s00253-018-09604-y |
| [7] |
Yeo JCC, Muiruri JK, Thitsartarn W, et al. Recent advances in the development of biodegradable PHB-based toughening materials:approaches, advantages and applications[J]. Mater Sci Eng C Mater Biol Appl, 2017, 92: 1092-1116. |
| [8] |
Ali I, Jamil N. Polyhydroxyalkanoates:current applications in the medical field[J]. Frontiers in Biology, 2016, 11: 19-27. DOI:10.1007/s11515-016-1389-z |
| [9] |
He Y, Hu Z, Ren M, et al. Evaluation of PHBHHx and PHBV/PLA fibers used as medical sutures[J]. Journal of Materials Science:Materials in Medicine, 2014, 25: 561-571. DOI:10.1007/s10856-013-5073-4 |
| [10] |
Butt FI, Muhammad N, Hamid A. Recent progress in the utilization of biosynthesized polyhydroxyalkanoates for biomedical applications-Review[J]. International Journal of Biological Macromolecules, 2018, 120: 1294-1305. DOI:10.1016/j.ijbiomac.2018.09.002 |
| [11] |
Kynadi AS, Suchithra TV. Formulation and optimization of a novel media comprising rubber seed oil for PHA production[J]. Industrial Crops and Products, 2017, 105: 156-163. DOI:10.1016/j.indcrop.2017.04.062 |
| [12] |
Park SJ, Kang KH, Lee H, et al. Propionyl-CoA dependent biosynthesis of 2-hydroxybutyrate containing polyhydroxyalkanoates in metabolically engineered Escherichia coli[J]. Journal of Biotechnology, 2013, 165: 93-98. DOI:10.1016/j.jbiotec.2013.03.005 |
| [13] |
Thai TQ, Wille M, Garcia-Gonzalez L, et al. Poly-β-hydroxybutyrate content and dose of the bacterial carrier for Artemia enrichment determine the performance of giant freshwater prawn larvae[J]. Applied Microbiology and Biotechnology, 2014, 98(11): 5205-5215. DOI:10.1007/s00253-014-5536-7 |
| [14] |
Che XM, Situ W, Yu LS, et al. Application perspectives of polyhydroxyalkanoates[J]. Chinese Journal of Biotechnology, 2018, 34(10): 1531-1542. |
| [15] |
Srirangan K, Liu X, Tran TT, et al. Engineering of Escherichia coli for direct and modulated biosynthesis of poly (3-hydroxybutyrate-co-3-hydroxyvalerate) copolymer using unrelated carbon sources[J]. Scientific Reports, 2016, 6: 36470. DOI:10.1038/srep36470 |
| [16] |
Wang Q, Liu X, Qi Q. Biosynthesis of poly (3-hydroxybutyrate-co-3-hydroxyvalerate) from glucose with elevated 3-hydroxyvalerate fraction via combined citramalate and threonine pathway in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2014, 98(9): 3923-3931. DOI:10.1007/s00253-013-5494-5 |
| [17] |
Tao W, Lv L, Chen GQ. Engineering Halomonas species TD01 for enhanced polyhydroxyalkanoates synthesis via CRISPRi[J]. Microbial Cell Factories, 2017, 16(1): 48. DOI:10.1186/s12934-017-0655-3 |
| [18] |
Wang J, Ma W, Wang Y, et al. Deletion of 76 genes relevant to flagella and pili formation to facilitate polyhydroxyalkanoate production in Pseudomonas putida[J]. Applied Microbiology and Biotechnology, 2018, 102(24): 10523-10539. DOI:10.1007/s00253-018-9439-x |
| [19] |
Lieder S, Nikel PI, de Lorenzo V, et al. Genome reduction boosts heterologous gene expression in Pseudomonas putida[J]. Microb Cell Factories, 2015, 14: 23. DOI:10.1186/s12934-015-0207-7 |
| [20] |
Shen R, Yin J, Ye JW, et al. Promoter engineering for enhanced P (3HB-co-4HB) production by Halomonas bluephagenesis[J]. ACS Synthetic Biology, 2018, 7(8): 1897-1906. DOI:10.1021/acssynbio.8b00102 |
| [21] |
Choi JI, Lee SY, Han K. Cloning of the Alcaligenes latus polyhydroxyalkanoate biosynthesis genes and use of these genes for enhanced production of Poly (3-hydroxybutyrate) in Escherichia coli[J]. Applied Environmental and Microbiology, 1998, 64(12): 4897-4903. |
| [22] |
Wang F, Lee SY. Production of poly (3-hydroxybutyrate) by fed-batch culture of filamentation-suppressed recombinant Escherichia coli[J]. Applied Environmental and Microbiology, 1997, 63(12): 4765-4769. |
| [23] |
Kraak MN, Smits TH, Kessler B, et al. Polymerase C1 levels and poly (R-3-hydroxyalkanoate) synthesis in wild-type and recombinant Pseudomonas strains[J]. Journal of Bacteriology, 1997, 179(16): 4985-4991. DOI:10.1128/jb.179.16.4985-4991.1997 |
| [24] |
Możejko-Ciesielska J, Kiewisz R. Bacterial polyhydroxyalkanoates:Still fabulous?[J]. Microbiological Research, 2016, 192: 271-282. DOI:10.1016/j.micres.2016.07.010 |
| [25] |
Quispe CAG, Coronado CJR, Carvalho JAJ. Glycerol:production, con-sumption, prices, characterization and new trends in combustion[J]. Renewable and Sustainable Energy Reviews, 2013, 27: 475-493. DOI:10.1016/j.rser.2013.06.017 |
| [26] |
Pan C, Tan GA, Ge L, et al. Two-stage microbial conversion of crude glycerol to 1, 3-propanediol and polyhydroxyalkanoates after pretreatment[J]. Journal of Environmental Management, 2019, 232: 615-624. DOI:10.1016/j.jenvman.2018.11.118 |
| [27] |
Możejko-Ciesielska J, Pokoj T. Exploring nutrient limitation for polyhydroxyalkanoates synthesis by newly isolated strains of Aeromonas sp. using biodiesel-derived glycerol as a substrate[J]. The Journal of Life and Environmental Sciences, 2018, 6: e5838. |
| [28] |
Volova T, Demidenko A, Kiselev E, et al. Polyhydroxyalkanoate synthesis based on glycerol and implementation of the process under conditions of pilot production[J]. Appl Microbiol Biotechnol, 2019, 103(1): 225-237. DOI:10.1007/s00253-018-9460-0 |
| [29] |
Chin MJ, Poh PE, Tey BT, et al. Biogas from palm oil mill effluent (POME):Opportunities and challenges from Malaysia's perspective[J]. Renewable and Sustainable Energy Reviews, 2013, 26: 717-726. DOI:10.1016/j.rser.2013.06.008 |
| [30] |
Kellerhals MB, Kessler B, Tchouboukov A, et al. Renewable long-chain fatty acids for production of biodegradable medium-chain-length polyhydroxyalkanoates (mcl-PHAs) at laboratory and pilot plant scales[J]. Macromolecules, 2000, 33: 4690-4698. DOI:10.1021/ma000655k |
| [31] |
Kang DK, Lee CR, Lee SH, et al. Production of Polyhydroxyalkano-ates from sludge palm oil using Pseudomonas putida S12[J]. Journal of Microbiology and Biotechnology, 2017, 27(5): 990-994. DOI:10.4014/jmb.1612.12031 |
| [32] |
Ward PG, O'Connor KE. Bacterial synthesis of polyhydroxyal-kanoates containing aromatic and aliphatic monomers by Pseudomonas putida CA-3[J]. International Journal of Biological Macromoleculesl, 2005, 35: 127-133. DOI:10.1016/j.ijbiomac.2005.01.001 |
| [33] |
Kumar P, Maharjan A, Jun HB, et al. Bioconversion of lignin and its derivatives into polyhydroxyalkanoates:Challenges and opportunities[J]. Biotechnology and Applied Biochemistry, 2018, 66(2): 153-162. |
| [34] |
Bledzki AK, Mamun AA, Volk J. Physical, chemical and surface properties of wheat husk, rye husk and soft wood and their prolypropylene composites[J]. Composites Part A:Applied Science and Manufacturing, 2010, 41: 480-488. DOI:10.1016/j.compositesa.2009.12.004 |
| [35] |
Cesário MT, Raposo RS, de Almeida MC, et al. Enhanced bioproduction of poly-3-hydroxybutyrate from wheat straw lignocellulosi chydrolysates[J]. New Biotechnology, 2014, 31(1): 104-113. DOI:10.1016/j.nbt.2013.10.004 |
| [36] |
Li T, Elhadi D, Chen GQ. Co-production of microbial polyhydroxyalkanoates with other chemicals[J]. Metabolic Engineering, 2017, 43(Pt A): 29-36. |
| [37] |
G u, P, Ya ng, F, Ka ng, J, et al. One-step of tryptophan attenuator inactivation and promoter swapping to improve the production of L-tryptophan in Escherichia coli[J]. Microbial Cell Factories, 2012, 11: 30-38. DOI:10.1186/1475-2859-11-30 |
| [38] |
G u, P, Ka ng, J, Ya ng, F, et al. The improved L-tryptophan production in recombinant Escherichia coli by expressing the polyhydroxybutyrate synthesis pathway[J]. Applied Microbiology and Biotechnology, 2013, 97: 4121-4127. DOI:10.1007/s00253-012-4665-0 |
| [39] |
Tohme S, Hacıosmanoğlu GG, Eroğlu MS, et al. Halomonas smyrnensis as a cell factory for co-production of PHB and levan[J]. International Journal of Biological Macromolecules, 2018, 118(Pt A): 1238-1246. |
| [40] |
Norhafini H, Huong KH, Amirul AA. High PHA density fed-batch cultivation strategies for 4HB-rich P (3HB-co-4HB) copolymer production by transformant Cupriavidus malaysiensis USMAA1020[J]. International Journal of Biological Macromolecules, 2019, 125: 1024-1032. DOI:10.1016/j.ijbiomac.2018.12.121 |
| [41] |
Yin J, Che XM, Chen GQ. Progress on polyhydroxyalkanoates (PHA)[J]. Chinese Journal of Biotechnology, 2016, 32(6): 726-737. |
| [42] |
Foong CP, Higuchi-Takeuchi M, Numata K. Optimal iron concentr-ations for growth-associated polyhydroxyalkanoate biosynthesis in the marine photosynthetic purple bacterium Rhodovulum sulfidophilum under photoheterotrophic condition[J]. PLoS One, 2019, 14(4): e0212654. DOI:10.1371/journal.pone.0212654 |
| [43] |
Fradinho JC, Oehmen A, Reis MAM. Improving polyhydroxyalkan-oates production in phototrophic mixed cultures by optimizing accumulator reactor operating conditions[J]. International Journal of Biological Macromolecules, 2019, 126: 1085-1092. DOI:10.1016/j.ijbiomac.2018.12.270 |
| [44] |
Kamravamanesh D, Lackner M, Herwig C. Bioprocess engineering aspects of sustainable polyhydroxyalkanoate production in Cyanobacteria[J]. Bioengineering, 2018, 5(4): 111. DOI:10.3390/bioengineering5040111 |
| [45] |
陈国强, 魏岱旭. 微生物聚羟基脂肪酸脂[M]. 北京: 化学工业出版社, 2014.
|
| [46] |
Rodriguez-Perez S, Serrano A, Pantión AA, et al. Challenges of scaling-up PHA production from waste streams. A review[J]. Journal of Environmental Management, 2018, 205: 215-230. |