2. 福建农林大学 福建省农业生态过程与安全监控重点实验室,福州 350002
2. Fujian Provincial Key Laboratory of Agroecological Processing and Safety Monitoring, Fujian Agriculture and Forestry University, Fuzhou 350002
嗜水气单胞菌为气单胞菌属的一种革兰氏阴性短杆菌,常导致淡水鱼类患运动性气单胞菌败血症,该疾病每年都给水产养殖业造成数百万美元的经济损失[1-3],而疫苗是防控水产养殖业感染性疾病最有效的策略之一[4]。目前的渔用疫苗主要包括灭活疫苗、减毒疫苗、核酸疫苗和亚单位疫苗等,其中亚单位疫苗是一种只保留病原体中有效的免疫原成分(外膜蛋白、糖蛋白、分泌蛋白、外毒素、胞外蛋白酶等)而不含有其他无关或者有害成分的新型疫苗,因具有组分清楚、安全性好、技术成熟、便于产业化等优点被广泛推广。外膜蛋白(OMP)是存在于细菌外膜中所有蛋白的总称,在维持外膜结构、保证物质运输等方面有着重要作用[5]。已有多项研究表明,细菌的主要外膜蛋白具有很强的免疫原性,是重要的保护性抗原,且利用致病菌的OMP做免疫原还可使鱼产生对不同血清型菌株感染的交叉保护力[6],因此通过制备外膜蛋白亚单位疫苗预防嗜水气单胞菌的感染是当今疫苗研究的主要方向之一。但是目前对嗜水气单胞菌外膜蛋白免疫原性研究多集中于实验室筛选阶段,需要对不同外膜蛋白免疫效果进行全面分析,筛选出高效且适用于规模化生产的疫苗。本文基于以上现状选取嗜水气单胞菌外膜蛋白OprM为研究对象,探究OprM蛋白作为亚单位疫苗在模式生物斑马鱼体内的免疫应答反应与嗜水气单胞菌强毒株攻毒后的相对免疫保护率,为鱼类养殖业疫苗研究提供理论依据与实践参考。
1 材料和方法 1.1 材料 1.1.1 实验菌株、质粒与斑马鱼本实验所需的原核表达载体pET-32a(+)、嗜水气单胞菌ATCC 7966和嗜水气单胞菌强毒株LP-2为本实验室保存;健康斑马鱼200条(0.3±0.1 g)购于福州花鸟市场,实验前饲养一周,每天喂食1次,换水1次,24 h供氧。
1.1.2 试剂和引物LB培养基:20 g胰蛋白酶胨,20 g NaCl、10 g酵母粉溶于2 000 mL ddH2O;限制性内切酶和T4 DNA连接酶购买自Thermo公司;大肠杆菌BL21感受态细胞购买于全式金生物技术有限公司;胶回收试剂盒和质粒提取试剂盒购自Omega公司;氨苄青霉素(AMP)购自生工生物工程有限公司;引物由福州博尚生物公司合成(表 1)。
以嗜水气单胞菌ATCC 7966总基因组为模板,用oprM基因引物进行PCR扩增。所得产物通过琼脂糖凝胶电泳检测,检测所得特异性片段用胶回收试剂盒进行回收,保存于-20℃备用。
1.2.2 表达质粒构建用质粒提取试剂盒pET-32a质粒,对克隆的目的片段和提取的pET-32a质粒分别用Hind Ⅲ和EcoR Ⅰ进行双酶切。酶切后进行连接得到重组质粒,转化至E.coli BL21感受态细胞中,涂布在LB(含100 μg/mL AMP)平板上,37℃培养过夜。
1.2.3 重组菌株的表达和纯化挑取单克隆至5 mL LB培养基(含100 μg/mL AMP),37℃,200 r/min培养过夜。然后转移至200 mL新鲜LB培养液(含100 μg/mL AMP)中,37℃,200 r/min培养至OD600=0.3-0.6,加入1 mmol/L IPTG于16℃诱导菌株10-12 h。然后在4℃、10 000 r/min下离心,弃上清,并用磷酸盐缓冲液(PBS)洗涤2次,将菌体重悬于5 mmol/L咪唑溶液中,进行超声破碎处理。离心收集沉淀,所得沉淀溶解于8 mol/L Urea缓冲液中,通过Ni-NTA树脂柱进行纯化(过程中使用6 mol/L,4 mol/L,2 mol/L Urea缓冲液梯度复性)。SDS-PAGE检测所纯化条带,并将获得的蛋白存放于-20℃。
1.2.4 腹腔注射斑马鱼将实验组OprM蛋白与对照组BSA分别与弗氏佐剂以1:1的比例均匀混合,充分乳化。接着对斑马鱼进行腹腔注射,每尾免疫3 μg。免疫14 d后,对各组进行再次加强免疫,注射量与第一次相同,持续到28 d。
1.2.5 蛋白免疫后斑马鱼免疫反应检测利用Trizon法分别提取实验组、对照组斑马鱼内脏RNA:将斑马鱼内脏取出后,加入液氮并置于研钵中研碎,然后向各样本中加入1 mL的Trizon,静置5 min;接着加入0.2 mL氯仿,剧烈振荡,静置2-3 min,2-8℃、12 000 r/min下离心15 min;然后吸取上层水相并加入0.5 mL异丙醇,静置10 min,2-8℃、12 000 r/min下离心10 min,去上清;最后加入1 mL75%乙醇,振荡混匀,2-8℃、7 500 r/min下离心5 min,去上清,干燥沉淀,测浓度后于-20℃保存。并利用qPCR技术对其进行免疫相关基因表达情况鉴定,相关基因引物如表 2。
取保存于-80℃的嗜水气单胞菌LP-2于37℃,200 r/min下活化16-18 h,再转接至5 mL试管中,37℃,200 r/min摇至OD=1.0,1×PBS稀释菌液至1×105 CFU/mL,(25倍斑马鱼半数致死量)。将鱼用1.2.4的方法处理后,每尾注射20 μL进行攻毒实验,每组鱼为30尾,3次重复。最后每天记录攻毒结果,连续记录两周,绘制相对存活率曲线。
2 结果 2.1 嗜水气单胞菌oprM基因的扩增以嗜水气单胞菌ATCC 7966的基因组DNA为模版,根据oprM基因特异性引物进行PCR扩增,获得大小1 416 bp片段,与预期oprM基因大小相符合(图 1-A)。用质粒提取试剂盒提取pET-32a载体质粒,其大小约为5 900 bp,核酸电泳结果与预期相一致(图 1-B)。

|
| 图 1 oprM基因PCR扩增结果(A)与pET-32a质粒检测结果(B) |
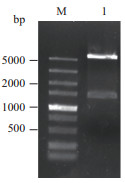
将克隆的目的片段和载体pET-32a用EcoR Ⅰ和Hind Ⅲ进行双酶切后,回收目的片段,将目的片段与载体连接,得到重组质粒,转化进入感受态细胞E.coli BL21获得重组高表达菌株。所得菌株提取质粒后用EcoR Ⅰ和Hind Ⅲ进行双酶切验证,结果(图 2)发现两条分别位于1 500 bp和5 000 bp左右的清晰条带,电泳结果验证说明该重组菌成功,含有目的基因oprM。
|
| M:5 000 bp maker;1:重组菌双酶切电泳检测结果 图 2 高表达重组质粒双酶切结果 |
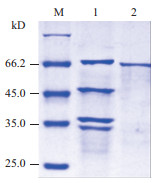
所得高表达重组菌经IPTG诱导表达和Ni-NTA树脂柱纯化后,样品跑SDS-PAGE分析。如图 3所示,条带1为IPTG诱导后重组菌全菌表达情况,可以发现存在明显高表达条带。条带2中为经Ni-NTA树脂柱纯化后获得的纯化蛋白,条带单一,与目的蛋白位置一致,表明蛋白纯化成功。
|
| M:蛋白maker;1:重组菌表达结果;2:OprM蛋白纯化结果 图 3 重组菌表达与纯化SDS-PAGE结果 |
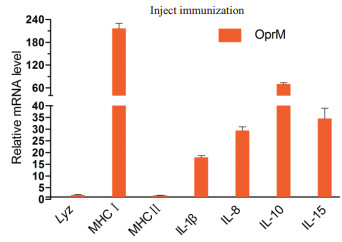
免疫斑马鱼28 d后,利用Trizon法提取内脏RNA,用qPCR技术检测7种免疫相关基因(Lyz,MHCI,MHCII,IL-1β,IL-8,IL-10和IL-15)的mRNA表达情况[7]。注射OprM蛋白组与BSA对照组相比,大多数免疫相关基因都上调(变化倍数 > 2),其中MHCI和IL-10的表达量升高的情况最为显著,MHCI的表达量提高216.6倍,IL-10表达量提高了70.1倍。IL-1β,IL-8和IL-15表达量也有显著的增大(图 4)。
|
| 图 4 斑马鱼的免疫相关基因表达结果 |
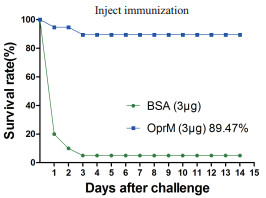
分别用3 μg OprM蛋白与BSA免疫斑马鱼,28 d后再用嗜水气单胞菌强毒株LP-2攻毒后继续观察2周,如图 5所示,注射BSA的斑马鱼在攻毒后3天内陆续死亡,而注射OprM蛋白后相对免疫保护率达到89.47%(相对免疫保护率=[(对照组死亡率-免疫组死亡率)/对照组死亡率]×100%)[8]。该结果表明,OprM蛋白具有高效的免疫保护作用[9]。
|
| 图 5 攻毒后注射免疫下接种的斑马鱼的累积存活率 |
嗜水气单胞菌是我国水产养殖鱼类爆发性传染病的主要病原[10],它还可以感染人和动物[11],能引发人类的中耳炎、败血症及创伤面感染、腹膜炎以及急性肠胃炎等疾病[12-13]。以往防治这类危害的直接方法就是投放抗生素,但是传统的抗生素防治手段因易造成耐药性和药物残留等问题已在我国水产养殖过程中限制使用[14]。在如此严峻环境面前,一种新型治疗方法的开发已迫在眉睫。疫苗作为一种无毒害,且高效便捷的治疗方式,是对抗嗜水气单胞菌的可持续替代品,深受人们的青睐。针对水生生物的疫苗主要有传统疫苗、基因工程疫苗和亚单位疫苗等。其中亚单位疫苗因具有安全性高、治疗效果好且成本低等优点而成为当今的研究热点。细菌外膜蛋白具有较好的免疫原性,是一种潜在的疫苗候选蛋白,其中嗜水气单胞菌外膜蛋白疫苗研究已有多篇文献报道,例如Maiti等[15]评估了两种重要的嗜水气单胞菌外膜蛋白Aha1和OmpW的免疫原性,通过将这些蛋白在大肠杆菌中过表达,纯化并接种于鲤鱼,结果显示抗体水平显著提升,分别获得52%和71%的相对免疫保护率;Hossam等[16]研究表明,用OmpA1、Tdr和TbpA三种重组外膜蛋白免疫鲶鱼,发现鲶鱼可以很好地抵抗嗜水气单胞菌感染,是一类较好的潜在疫苗。尽管如此,针对嗜水气单胞菌的疫苗还未得到商业化应用,还是有较多的外膜蛋白作为疫苗的免疫保护功能未被报道,因此寻求更全面、适用于商业化的疫苗成为现在抑制该菌危害的关键。本文以嗜水气单胞菌的外膜蛋白OprM为研究对象,选取pET-32a作为连接载体,与oprM基因进行重组表达,获得纯化蛋白OprM,并将其腹腔注射斑马鱼检测其免疫保护效果。结果发现,与空白对照组相比,该蛋白能够显著提升斑马鱼体内免疫相关基因的应答,且免疫保护率达到89.47%。这可能是因为OprM蛋白作为一种嗜水气单胞菌主要的外膜蛋白,在对宿主的感染和免疫中扮演着重要的角色,是重要的保护性抗原[17-18]。研究发现,OprM等外膜蛋白还可以激发机体产生保护性免疫应答,刺激机体产生针对黏附素的特异性抗体,抑制细菌在体内的定植,进而减少机体发生病变的机会[19]。以上结果表明OprM蛋白是一种可以较好地抵御嗜水气单胞菌病害的疫苗候选蛋白。
4 结论本研究成功克隆表达了嗜水气单胞菌外膜蛋白OprM,通过IPTG诱导表达后经SDS-PAGE分析发现能够较好的纯化出单一且浓度较高的OprM蛋白。将纯化所得蛋白与弗氏不完全佐剂1:1等体积充分乳化制备成亚单位疫苗后,腹腔注射斑马鱼,分别观察其免疫应答反应与相对免疫保护率。研究发现斑马鱼体内免疫相关基因表达显著提升,揭示该疫苗可以引起斑马鱼免疫应答。此外攻毒实验观察两周后发现,实验组斑马鱼相对免疫保护率达89.47%,具有较强的免疫保护作用,是一种较佳的嗜水气单胞菌亚单位疫苗。
| [1] |
Hossain MJ, Sun D, McGarey DJ, et al. An Asian origin of virulent Aeromonas hydrophila responsible for disease epidemics in United States-farmed catfish[J]. MBio, 2014, 5(3): e00848-14. |
| [2] |
Noonin C, Jiravanichpaisal P, Söderhäll I, et al. Melanization and pathogenicity in the insect, Tenebrio molitor, and the crustacean, Pacifastacus leniusculus, by Aeromonas hydrophila AH-3[J]. PLoS One, 2010, 5(12): e15728. DOI:10.1371/journal.pone.0015728 |
| [3] |
Kregiel D, Niedzielska K. Effect of plasma processing and organosilane modifications of polyethylene on Aeromonas hydrophila biofilm formation[J]. Biomed Res Int, 2014, 232514. DOI:10.1155/2014/232514 |
| [4] |
王玉堂. 疫苗及其在水生动物疾病预防中的应用(三)[J]. 中国水产, 2018(9): 88-90. |
| [5] |
Liu j, Huang S, Zhang Q. Outer membrane proteins:key players for bacterial adaptation in host niches[J]. Mi-crob Infect, 2002, 4(3): 325-331. DOI:10.1016/S1286-4579(02)01545-9 |
| [6] |
周宇, 周秋白. 嗜水气单胞菌防控技术研究进展[J]. 生物灾害科学, 2012, 35(2): 126-133. |
| [7] |
Zhang ZH, Wu HZ, Xiao JF, et al. Immune responses of zebrafish (Danio rerio) induced by bath-vaccination with a live attenuated Vibrio anguillarum vaccine candidate[J]. Fish Shellfish Immunol, 2012, 33(1): 36-41. DOI:10.1016/j.fsi.2012.03.031 |
| [8] |
Wang YQ, Wang XY, Farman A, et al. Comparative extracellular proteomics of Aeromonas hydrophila reveals iron-regulated secreted proteins as potential vaccine candidates[J]. Frontiers in Immunology, 2019, 10: 3389-4003. |
| [9] |
Wang YQ, Chen HR, Guo Z, et al. Quantitative proteomic analysis of iron-regulated outer membraneproteins in Aeromonas hydrophila as potential vaccine candidates[J]. Fish Shellfish Immunol, 2017, 68: 1-9. DOI:10.1016/j.fsi.2017.07.002 |
| [10] |
Vivas J, Carracedo B, Riano J, et al. Behavior of all Aeromonas hydrophila aroA live vaccine in water microcosms[J]. Appl Environ Microbiol, 2004, 70: 2702-2708. DOI:10.1128/AEM.70.5.2702-2708.2004 |
| [11] |
李文艳, 张伟伟, 马秀娟, 等. 嗜水气单胞菌相关毒力基因的研究进展[J]. 安徽农业科学, 2001, 39(9): 5060-5064. |
| [12] |
江金伦. 一起由嗜水气单胞菌引起腹泻的调查[J]. 上海预防医学, 2010, 22(1): 31-32. DOI:10.3969/j.issn.1004-9231.2010.01.015 |
| [13] |
黄艳, 韦小瑜, 吴成梅, 等. 一起嗜水气单胞菌引起的食物中毒调查[J]. 中国食品卫生杂志, 2012, 24(4): 391-393. |
| [14] |
刘望, 杨佳杰, 杨静, 等. 嗜水气单胞菌外膜蛋白原核表达及其免疫保护性研究[J]. 陕西科技大学学报, 2017, 35(6): 125-130. DOI:10.3969/j.issn.1000-5811.2017.06.025 |
| [15] |
Maiti B, Shetty M, Shekar M, et al. Evaluation of two outer membrane proteins, Aha1 and OmpW of Aeromonas hydrophila as vaccine candidate for common carp[J]. Vet Immunol Immunopathol, 2012, 149(3-4): 298-301. DOI:10.1016/j.vetimm.2012.07.013 |
| [16] |
Hossam A, Iman I, Seong WN, et al. Evaluation of three recombinant outer membrane proteins, OmpA1, Tdr, and TbpA, as potential vaccine antigens against virulent Aeromonas hydrophila infection in channel catfish (Ictalurus punctatus)[J]. Fish Shellfish Immunol, 2017, 66: 480-486. DOI:10.1016/j.fsi.2017.05.043 |
| [17] |
Quinn DM, Max AH, Bretag AH, et al. Carbonhydrate-reaction, pore-forming outer membrane protein of Aeromonas hydrophila[J]. Infect Immun, 1994, 62(9): 4054-4058. DOI:10.1007/BF01967598 |
| [18] |
Habibur M, Kenji K. Outer membrane proteins of Aeromonas hydrophila induce protective immunity in goldfish[J]. Fish & Shellfish Immunology, 2000, 10: 379-382. |
| [19] |
董传甫, 林天龙, 等. 嗜水气单胞菌主要外膜蛋白对欧洲鳗鲡的免疫保护试验[J]. 水生生物学报, 2005(3): 285-290. DOI:10.3321/j.issn:1000-3207.2005.03.009 |






