2. 江苏海洋大学江苏省海洋生物技术重点实验室,连云港 222005
2. Jiangsu Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang 222005
气单胞菌属(Aeromonas spp.)是一类嗜温性、运动性的革兰氏阴性菌[1-2]。气单胞菌是导致鱼类出血性败血症的主要病原,鱼类患病的主要症状为身体充血,腹部充气。鱼类出血性败血症主要流行于淡水鱼中,海洋鱼类中偶有发生,具有流行广、发病快、传染性强及死亡率高的特点,给水产养殖业带来了巨大的经济损失[3-6]。同时,气单胞菌也是一种人类条件致病菌,通过水环境、交叉污染的食物、伤口等使人感染,典型症状为腹泻、软组织感染等[7-10]。近年来的研究表明,除了传统的嗜水气单胞菌,维氏气单胞菌、豚鼠气单胞菌、斑点气单胞菌、温和气单胞菌也会导致鱼类[11-12]和人类感染[13-14]。水产病害的快速检测和预警对病害的防治、水产品安全保障具有重要作用,国标方法检测病原菌耗时长,无法满足实际检测需要。病原菌快速检测方法主要包括聚合酶链式反应(PCR)和免疫检测方法等,但目前并没有准确性好的气单胞菌属快速检测手段。气单胞菌种类较多,且存在多种血清型,是实现气单胞菌快速检测的主要难题之一。因此研究气单胞菌共同表面抗原,制备气单胞菌交叉型抗体,建立气单胞菌属的免疫快速诊断方法用于鱼类出血病的初步筛选将具有较好的应用价值。
外膜蛋白(Outer membrane protein,Omp)是革兰氏阴性菌细胞外膜的主要结构,在细菌的物质运输、形态维持和有关物质合成方面起着重要作用[15]。研究表明,气单胞菌外膜蛋白具有良好的免疫原性,可激发机体的体液免疫,且具有较好的保守性,是一种潜在的共同保护性抗原[16-18]。在众多的外膜蛋白中,OmpF和OmpC是两种细菌中最常见的孔蛋白,占细胞总蛋白的2%。OmpF由16条反向平行的β-链组成,形成嵌入膜中的桶状结构,并在N末端细胞外显示8个表面抗原[19]。OmpF是气单胞菌重要的黏附因子,属内相似性较高,是气单胞菌属保守性表面抗原,具有较高的研究价值。Secundino等[20]的研究表明,伤寒沙门氏菌的OmpF可以诱导产生持续的、终生的和特异性的抑菌抗体反应。
目前国内外已有研究均为嗜水气单胞菌OmpF鱼类亚单位疫苗的开发,未见气单胞菌OmpF重组蛋白用于制备气单胞菌交叉型抗体的相关报道。本研究通过生物信息学工具分析气单胞菌OmpF的基本结构和属内外同源性,并采用大肠杆菌重组表达嗜水气单胞菌OmpF重组蛋白,评价其免疫BALB / c小鼠后血清与气单胞菌及其他细菌的交叉反应,旨为进一步制备气单胞菌属检测抗体提供支撑。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和实验动物本研究所用的菌株见表 1。原核表达载体pET-28a(+)为本实验室保存。6-8周龄的BALB / c小鼠购于扬州大学兽医学院。
质粒抽提试剂盒、限制性内切酶BamHⅠ和Hind Ⅲ、DNA Marker、双色预染蛋白Marker、卡那霉素、IPTG、SDS-PAGE凝胶电泳所需试剂均购自生工生物工程(上海)股份有限公司;弗氏完全和不完全佐剂、牛血清蛋白BSA购自Sigma公司;羊抗鼠二抗购自Jackson ImmunoResearch公司;其他化学试剂均购自上海国药化学试剂有限公司;96孔酶标板购自无锡国盛生物工程有限公司;酶标仪为Thermo Fisher,Multiskan FC;气单胞菌OmpF蛋白单抗1B1为本实验室制备。
1.2 方法 1.2.1 嗜水气单胞菌OmpF蛋白结构及生物信息学分析采用NCBI的Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)及生物信息学DNA star软件(version:7.1.0(44))对嗜水气单胞菌外膜蛋白OmpF的保守区域结构、属内同源性以及蛋白序列的抗原性、暴露性进行分析。蛋白质结构同源建模采用Swiss model(https://swissmodel.expasy.org/interactive)进行,将NCBI检索到的嗜水气单胞菌OmpF蛋白序列粘贴到输入框,检索后根据全局模型质量评估(GMQE)选择评分最高的模板进行建模,并与NCBI检索的保守区域结构进行对比。嗜水气单胞菌OmpF与气单胞菌孔蛋白的系统发育树构建采用NCBI结合Mega 6(version:6.0.6)进行,首先通过Blast检索到与嗜水气单胞菌OmpF(Locus CCO02501)同源性较高的气单胞菌外膜蛋白,选取并下载14个不同种气单胞菌的外膜蛋白的蛋白质序列,用Mega 6打开后采用ClustalW进行比对,随后采用邻接法(Neighbor joining,NJ)进行建树,自举法(bootstrapping)的值设为1000。
1.2.2 重组质粒的构建由上海生工生物有限公司合成含有GenBank上发表的嗜水气单胞菌(Aeromonas hydrophila)OmpF基因序列(LOCUS:HF545837)转入带有BamHⅠ和Hind Ⅲ酶切位点的重组质粒pET-28a(+),命名为pET-28a(+)-OmpF。重组质粒pET-28a(+)-OmpF用BamHⅠ和Hind Ⅲ进行双酶切验证。验证正确后将重组质粒转化入宿主菌BL21(DE3)感受态中,作为工程菌株。
1.2.3 重组蛋白OmpF的表达与优化挑取阳性克隆于5 mL含50 μg/mL卡那霉素的LB培养基中,37℃过夜培养,次日按1%接种量接种于50 mL含卡那霉素的LB培养基中,37℃培养至OD600值为0.6-0.8时,加入IPTG至终浓度为0.2 mmol/L,28℃,180 r/min摇床振荡培养过夜。同时设置未经IPTG诱导的阳性克隆作为对照。离心取菌体,菌体用2.5 mL无菌水重悬,冰浴超声破碎,离心后收集上清和沉淀,SDS-PAGE检测重组蛋白的表达情况。
重组表达过程中蛋白的快速和不正确折叠容易形成包涵体,较低的诱导温度、IPTG浓度和诱导时间对重组蛋白的正确折叠有利,从而可以减少包涵体的形成[21]。因此,本研究对诱导温度、IPTG和诱导时间进行了单因素试验的优化。IPTG浓度优化:固定诱导温度为25℃,诱导时间12 h,IPTG浓度为0.1 mmol/L、0.2 mmol/L、0.4 mmol/L、0.8 mmol/L和1.0 mmol/L;诱导温度优化:固定IPTG浓度为0.2 mmol/L,诱导时间为12 h,诱导温度4、16、25、28、31、34和37℃;诱导时间优化:固定诱导温度为28℃,IPTG浓度为0.2 mmol/L,诱导时间2 h、4 h、8 h、12 h、16 h、20 h和24 h,确定最佳诱导条件。
1.2.4 OmpF包涵体的初步纯化与Western blot鉴定采用最佳诱导条件,即诱导温度28℃,IPTG浓度0.2 mmol/L,诱导时间12 h,诱导表达OmpF蛋白。菌体经离心后冰浴超声破碎,离心收集沉淀,加入到3 mL预冷的洗涤液(20 mmol/L Tris-Hcl,pH 8.0、0.5 mol/L Nacl、2 mol/L尿素、2% Triton-100、1 mmol/L EDTA),搅拌20 min,4℃,12 000 r/min,离心10 min,弃上清,取沉淀。重复一次,洗涤4 h,去除膜碎片和膜蛋白,所得沉淀用50 mmol/L Tris-HCl洗一次,去除残留的EDTA,再次离心弃去上清,所得的沉淀即为初步纯化后的包涵体。
采用Western blot对制备的OmpF包涵体蛋白进行鉴定。将纯化后的OmpF包涵体蛋白经10% SDS-PAGE分离胶分离后,半干法转至PVDF膜,用含5%脱脂奶粉的PBST于4℃封闭过夜;加入本实验室制得的识别气单胞菌属OmpF保守性多肽的单克隆抗体1B1(用含0.05% Tween 20和1% BSA的PBS按1:2 000稀释),于室温振荡反应1 h;用PBST洗涤3次,每次5 min,加入HRP标记的羊抗鼠IgG(用含0.05% Tween 20和1% BSA的PBS按1:2 000稀释),于室温振荡反应1 h;用PBST洗涤5次,每次5 min,加入沉淀型底物缓冲液,出现明显条带时,水洗终止反应。
1.2.5 重组OmpF蛋白免疫动物将初步纯化后的OmpF包涵体蛋白与等体积弗氏佐剂乳化后免疫BALB / c小鼠,首次免疫用弗氏完全佐剂,加强免疫用弗氏不完全佐剂。小鼠首免、二免免疫剂量为80 μg/只,之后的免疫剂量减半。每3周免疫一次,免疫方式为背部皮下多点注射。第3、4次免疫后一周尾部采血并分离血清,-20℃保存备用。
1.2.6 间接ELISA法和Western blot法测定血清效价及交叉反应气单胞菌属细菌用营养肉汤在28℃条件下培养过夜,煮沸灭活,-20℃保存备用。用碳酸盐缓冲液(pH 9. 6)将灭活的菌体稀释为108 CFU/mL,加入96孔板,于37℃包被2 h;加入含0.2%明胶的碳酸盐缓冲液37℃封闭2 h后;加入经抗体稀释液(PBS,0.1%明胶,0. 05% Tween-20)稀释的免疫小鼠血清(从1 000倍开始,进行3倍梯度稀释),于37℃孵育30 min;PBST(0. 05% Tween-20)洗板3次,加入HRP标记的羊抗鼠IgG(抗体稀释液稀释3 000倍),37℃孵育30 min;PBST洗板4次,TMB显色15 min;2 mol/L H2SO4终止反应后测定OD450吸光值。同时设置空白阴性对照,当最高稀释度的阳性血清OD450值与空白阴性对照OD450值之比(P/N)≥2.1,该稀释度即为血清效价。
2 结果 2.1 嗜水气单胞菌OmpF蛋白结构、序列保守性及抗原性分析经过Swiss model同源建模和Blast发现嗜水气单胞菌OmpF属于革兰氏阴性孔蛋白家族和Proin_4家族,分子量为36.35 kD,与大肠杆菌OmpF(cdd00342)结构相似,即为3个相同亚基组成的孔蛋白,每个亚基各含一个位于跨膜区域的α螺旋(图 1-A)。嗜水气单胞菌OmpF蛋白粒径在6-10 nm,蛋白孔状结构为分子量低于500的小分子营养物质如糖类、盐类的扩散和运输中起到重要作用。根据外膜孔蛋白插入磷脂双分子层的特点,OmpF蛋白部分暴露在细菌细胞膜外。因此,细菌表面存在部分OmpF抗原表位能被OmpF蛋白的抗体识别。通过建立嗜水气单胞菌OmpF系统发育进化树表明(图 1-B),嗜水气单胞菌OmpF与维氏气单胞菌、肇东气单胞菌、豚鼠气单胞菌、台湾气单胞菌、湖气单胞菌、杀鲑气单胞菌、Aeromonas rivipollensis、鳗鱼气单胞菌等孔蛋白的氨基酸变异度小于25%,说明气单胞菌OmpF蛋白属内相似度较高,具有较好的气单胞菌特异性。图 1-B中节点处的值为自展值,代表系统发育树的可信度。
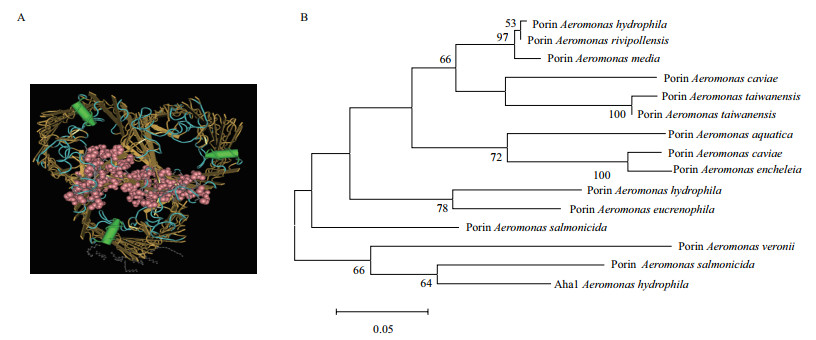
|
| 标尺表示蛋白氨基酸序列的变异度为5% 图 1 嗜水气单胞菌外膜蛋白OmpF的结构(A)与蛋白进化树(B) |
采用NCBI数据库的Blast功能在线对嗜水气单胞菌OmpF与气单胞菌属内菌株的序列同源性进行了具体分析。如图 2所示,黄色部分标出了同源性在85%以上的蛋白氨基酸序列,由图中可以看出在N端开始的1-40AA、70-90AA、130-160AA、170-200AA、260-280AA、300-320AA、340-360AA及C端370-380AA均有部分连续的保守序列。嗜水气单胞菌OmpF与大肠杆菌、沙门氏菌的比对表明序列相似性在30%以下。这些信息说明采用OmpF蛋白或保守性多肽作为免疫原制备气单胞菌交叉型抗体具有较好的可行性。
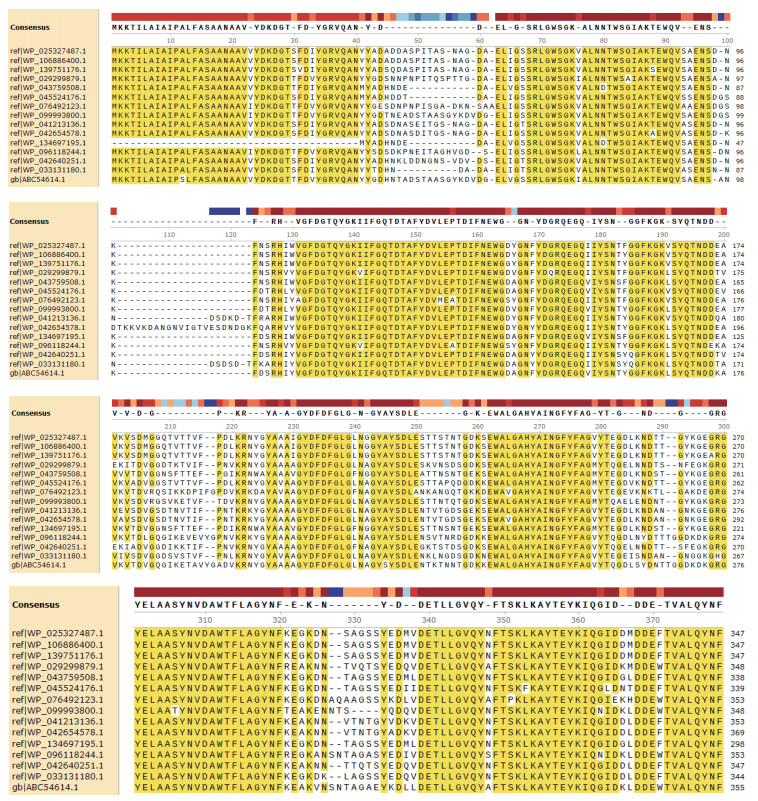
|
| 图 2 嗜水气单胞菌OmpF与气单胞菌属菌株的序列同源性分析 |
试验前期研究中从嗜水气单胞菌基因组DNA扩增OmpF开放阅读框(ORF)基因片段,上游引物为:CGCGGATCCGTGGTTTATGACAAAGACGG,下游引物为:CCCAAGCTTTTAGAAGTTGTATTGC。构建的重组质粒经测序后发现与嗜水气单胞菌BA1外膜蛋白Aha1(ahal)基因符合度为99%,与OmpF符合度低于90%,说明PCR扩增并插入的基因为Aha1。经BLAST后发现,OMP Aha1同与OmpF相似性为83%,在蛋白起始和末端序列高度一致,这给PCR扩增OmpF基因带来了一定困难。因此,由上海生工生物全合成OmpF ORF基因,插入重组质粒pET-28a(+)后经双酶切得到一条5 000 bp左右和1 000 bp左右的片段(图 3-A),与预期的质粒(5 300 bp)和目的片段(994 bp)的大小一致,同时测序结果说明插入基因为OmpF ORF基因,重组表达载体构建成功。
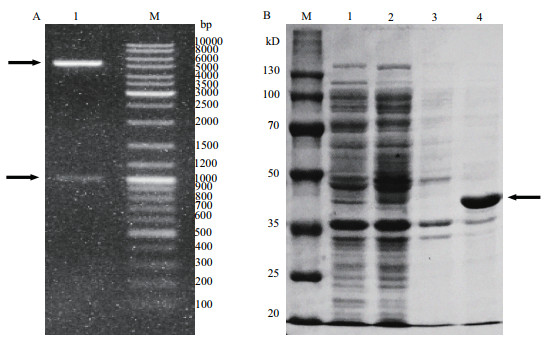
|
| M:DNA分子量标准(DL 10000);1:双酶切的产物;箭头示目的片段;A. M:蛋白分子量标准;1:诱导后的上清;2:未诱导的上清;3:未诱导的沉淀;4:诱导的沉淀 图 3 pET-28a(+)-OmpF重组表达载体双酶切鉴定(A)pET-28a(+)-OmpF重组表达产物SDS-PAGE验证(B) |
将诱导的菌体超声裂解,分离上清和沉淀后进行10% SDS-PAGE凝胶电泳分析。结果(图 3-B)表明,37℃,IPTG浓度为0.2 mmol/L,诱导过夜,超声破碎的沉淀样品在40 kD左右出现明显条带,诱导后上清中未见目标条带。未诱导的表达上清和沉淀中均未出现目的条带,说明重组蛋白OmpF在诱导后以包涵体的形式进行了表达。
为提高OmpF的可溶性表达,对IPTG浓度、培养温度、诱导时间进行了优化。结果表明在25℃,诱导时间为12 h,IPTG浓度为0.2 mmol/L时,超声破碎的上清中目标条带的量相对其他条件更多,随着IPTG浓度继续上升上清和沉淀中的目标条带均没有明显增加(图 4-A),上清中OmpF表达量仍占比很低。IPTG浓度为0.2 mmol/L,诱导时间为12 h时,随着诱导温度的提高,表达量也随之增加,到28℃时上清和沉淀中的目标条带表达量不再明显增加(图 4-B),OmpF表达仍以包涵体为主;当诱导温度为28℃,IPTG浓度为0.2 mmol/L时,随着表达时间的延长,表达量有所增加,当表达时间达到12 h后表达量不再增加,而且不同诱导时间下上清的OmpF表达量均非常低,仍主要以包涵体形式进行表达。以上结果表明,通过优化IPTG浓度、培养温度,重组蛋白OmpF可溶性表达有一定的增加,但后续纯化试验表明低丰度的可溶性OmpF进行纯化的难度较大,因此本研究确定采用OmpF包涵体进行后续研究,其最佳诱导条件是:培养温度28℃,IPTG浓度0.2 mmol/L,诱导时间12 h。
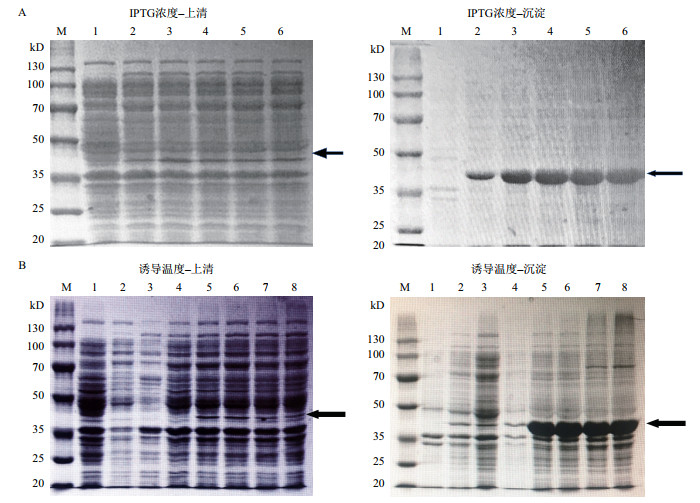
|
| M:蛋白分子量Marker,1:未诱导样品。A,2-6:0.1 mmol/L、0.2 mmol/L、0.4 mmol/L、0.8 mmol/L、1.0 mmol/L;B,2-8:4、16、25、28、31、34和37℃ 图 4 不同梯度IPTG浓度(A)、诱导温度(B)下,菌体破碎离心后上清和沉淀样品的电泳图 |
运用最佳诱导条件大量诱导表达并收集超声破碎后的沉淀,即为包涵体蛋白。该包涵体蛋白经过尿素梯度法复性到2 mmol/L尿素浓度后随即发生沉淀,难以复性。随后采用Ni柱进行纯化时发现包涵体蛋白无法挂柱,由于沉淀物中OmpF蛋白的纯度相对较高,因此采用洗涤纯化的方法对包涵体蛋白进行纯化。结果(图 5-A)显示,通过3次纯化洗涤缓冲液的洗涤可以去除一些细胞碎片和杂蛋白,最终得到纯度较高的OmpF包涵体蛋白。采用实验室前期制备的识别OmpF保守性多肽的单克隆抗体1B1对制备的OmpF包涵体蛋白进行Western blot检测,结果(图 5-B)显示在40 kD处出现特异性的目的条带,说明制备的包涵体蛋白为气单胞菌OmpF蛋白。

|
| (A)M:蛋白Marker,1-3:3种洗涤液分别洗涤后的上清,4:纯化后的OmpF包涵体;(B)M:蛋白Marker;1:纯化后的OmpF包涵体;箭头:目的蛋白 图 5 包涵体蛋白的纯化过程表征(A)与Western blot鉴定(B) |
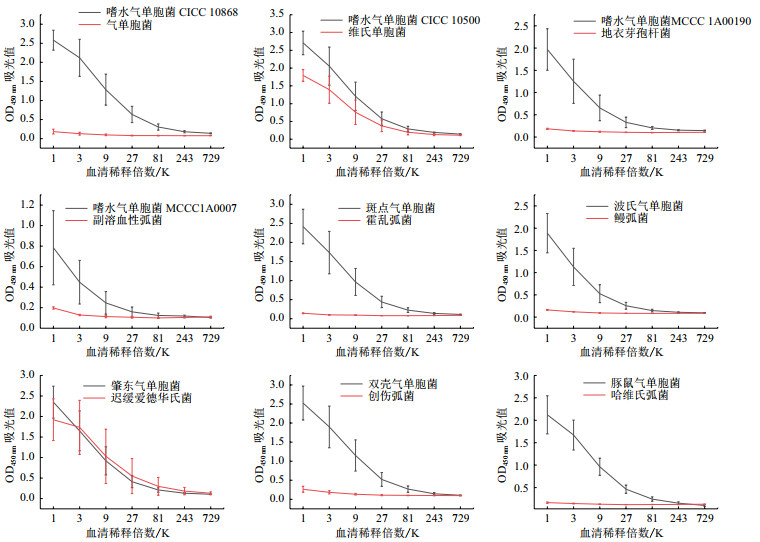
采用间接ELISA方法检测重组蛋白OmpF免疫的小鼠血清。图 6表示的是10只小鼠血清对煮沸灭活的气单胞菌的平均吸光值随血清稀释倍数的变化曲线。由图可以看出,免疫的小鼠血清对嗜水气单胞菌CICC 10500、嗜水气单胞菌CICC 10868、嗜水气单胞菌MCCC 1A00190、维氏气单胞菌MCCC 1K03237、波氏气单胞菌CGMCC 1.9063、豚鼠气单胞菌MCCC 1A12231、斑点气单胞菌CGMCC 1.1960、双壳气单胞菌MCCC 1A02126、肇东气单胞菌MCCC 1A12437有较强的交叉反应,平均效价在1:81 000,对嗜水气单胞菌MCCC 1A0007的效价稍弱,对气单胞菌CICC 23565基本无交叉反应。血清对气单胞菌属外的创伤弧菌、副溶血性弧菌、霍乱弧菌、鳗弧菌、哈维氏弧菌、地衣芽孢杆菌没有交叉反应,但血清与迟缓爱德华氏菌出现较强的交叉反应。
|
| 图 6 OmpF包涵体免疫小鼠血清对气单胞菌属内外菌株的交叉反应 |
ELISA结果表明重组OmpF包涵体免疫的小鼠血清对测试的11株气单胞菌中的10株具有交叉反应,包括4株不同的嗜水气单胞菌及6株常见的气单胞菌,说明OmpF蛋白的免疫血清对气单胞菌属菌株具有较好的交叉反应,仅对1株气单胞菌无法识别,这与生物信息学分析得出的气单胞菌属内OmpF蛋白相似性较高保持一致。属外的交叉反应测试表明与免疫血清对气单胞菌属的特异性较好。
3 讨论气单胞菌是淡水鱼类重要的条件致病菌,每年因其感染所引起的出血性败血症给我国水产养殖业造成了巨大的经济损失[5-6]。近年来的研究表明,除了嗜水气单胞菌,维氏气单胞菌等其他气单胞菌也是引起鱼类败血症的主要病原。此外,气单胞菌也是一种人类条件致病菌,可以引起人类腹泻和软组织感染等疾病。因此,目前水产养殖、食品领域及临床检验领域,亟需针对气单胞菌属的准确、快速检测方法,用于鱼类败血症预警、保障食品安全及病原检测。然而,气单胞菌属内致病菌种较多,目前缺乏准确的快速检测方法。免疫快速检测方法是常用的致病菌快速检测方法之一,其准确性主要取决于抗体的交叉反应和亲和力。因此,气单胞菌共同抗原的研究对制备气单胞菌属交叉型抗体、进行流行气单胞菌的快速免疫检测具有重要意义。
目前国内外气单胞菌诊断抗体的制备主要依赖菌体抗原进行免疫,而菌体抗原由于表面抗原种类繁多、丰度不一,因此筛选的抗体多为菌株或血清型特异性抗体,难以对主要气单胞菌进行识别和检测。黄艺丹等[22]采用豚鼠气单胞菌抗原制备了豚鼠气单胞菌单克隆抗体并建立了豚鼠气单胞菌特异性胶体金试纸检测方法。马丽等[23]采用点状气单胞菌菌体免疫制备了点状气单胞菌特异性抗体并建立了双抗体夹心ELISA方法,该方法与点状气单胞菌强阳性反应,与近似菌无交叉反应。很多研究表明,外膜蛋白具有良好的免疫原性,部分外膜蛋白具有较高的属内同源性,是制备生物识别材料以及亚单位疫苗的良好抗原。刘明智等[24]表达纯化了嗜水气单胞菌OmpW包涵体,用此蛋白免疫草鱼,所得草鱼血清经ELISA分析显示呈现阳性反应,说明该重组蛋白能诱导鱼类产生抗体。蒋蔚等[25]表达纯化了嗜水气单胞菌OmpA,经此蛋白免疫后的兔血清可与8株不同血清型的嗜水气单胞菌及杀鲑气单胞菌总蛋白发生特异性免疫印迹反应,说明该外膜蛋白具有很好的免疫原性,并可能是嗜水气单胞菌的共同保护抗原。
本研究首先分析了嗜水气单胞菌OmpF蛋白的基本结构,发现其为同源三聚体组成的孔蛋白,部分结构在细胞膜外具有暴露性,可以用于免疫动物制备气识别气单胞菌体的抗体。通过Blast比较嗜水气单胞菌OmpF与气单胞菌属内外菌株的同源性发现,气单胞菌OmpF属内同源性较高,在多个区域的氨基酸序列同源性大于85%,与属外常见细菌如大肠杆菌、沙门氏菌等的同源性低于30%,说明气单胞菌OmpF蛋白具有较好的气单胞菌特异性,适合用于制备气单胞菌属交叉型抗体。本研究构建了pET-28a(+)-OmpF重组质粒,经过表达温度、IPTG浓度等表达条件优化后,重组蛋白OmpF主要以包涵体的形式表达。采用洗涤纯化的OmpF包涵体蛋白免疫小白鼠,ELISA结果显示免疫后小鼠血清与11株气单胞菌中的10株气单胞菌(10/11)有特异性交叉反应,包括4株嗜水气单胞菌以及维氏气单胞菌、波氏气单胞菌、斑点气单胞菌、豚鼠气单胞菌、双壳气单胞菌、肇东气单胞菌,对4株弧菌和地衣芽孢杆菌没有交叉反应,但与迟缓爱德华氏菌有强阳性反应。经过比对,气单胞菌OmpF与迟缓爱德华氏菌的同源性仅在27%-30%之间,存在交叉的原因可能是包涵体的纯度不高,具体有待进一步验证。以上结果说明OmpF重组蛋白可以用于免疫小鼠制备气单胞菌广泛交叉的抗体,为建立气单胞菌免疫快速检测方法提供了技术保障。
同时,本研究发现免疫血清对煮沸灭活的气单胞菌有很强的结合能力,而对气单胞菌活菌无识别作用,说明抗体识别的包涵体蛋白结构与天然蛋白构象存在较大差异。因此,如果采用OmpF包涵体作为疫苗,对鱼进行病害防护的效果可能不佳,该发现与目前国内其他鱼类OmpF亚单位疫苗的保护效果评价结果保持一致。秦杨蕾[26]采用PET30a(+)重组表达了鳖源嗜水气单胞菌4个主要外膜蛋白Omp38、OmpTS、OmpF和Aha1,4种蛋白均以包涵体的形式表达。中华鳖经过免疫、攻毒后发现Omp38、OmpTS的保护率在70%,而OmpF和Aha1为20%-30%。廖紫超[27]发现鳗鲡感染嗜水气单胞菌后的恢复期血清可以与表达丰度最高的37 kD蛋白以及5株菌株共有的28 kD蛋白发生免疫印迹反应,后经质谱鉴定分别为OmpF和OmpK。经重组表达后免疫鳗鲡及攻毒嗜水气单胞菌(5×106 CFU/尾)发现OmpF的保护率为35.3%,OmpK的免疫保护率为70%。
4 结论本研究首先通过系统发育进化树及Blast等说明嗜水气单胞菌OmpF与气单胞菌属外膜蛋白的相似性较高,是潜在的气单胞菌属检测靶点。随后构建了重组表达载体pET-28a(+)-OmpF,诱导表达条件的优化表明重组OmpF蛋白主要以包涵体形式表达。采用纯化的包涵体免疫BALB / c小鼠,结果表明小鼠血清与11株气单胞菌中的10株气单胞菌(10/11)均有交叉反应,包括4株嗜水气单胞菌和多种常见的气单胞菌,与副溶血性弧菌、哈维氏弧菌、地衣芽孢杆菌等无交叉反应。结果表明气单胞菌OmpF蛋白可以用于制备气单胞菌属交叉型单克隆抗体。
| [1] |
沈锦玉. 嗜水气单胞菌的研究进展[J]. 浙江海洋学院学报:自然科学版, 2008, 27(1): 78-86. DOI:10.3969/j.issn.1003-1111.2003.06.016 |
| [2] |
郭闯, 王永坤. 嗜水气单胞菌研究进展[J]. 水产科学, 2003, 22(6): 48-51. DOI:10.3969/j.issn.1003-1111.2003.06.016 |
| [3] |
于学辉, 王远微, 汤承, 岳华. 嗜水气单胞菌的研究进展[J]. 西南民族大学学报:自然科学版, 2007, 33(3): 507-514. |
| [4] |
杨守明, 王民生. 嗜水气单胞菌及其对人的致病性[J]. 中华疾病控制杂志, 2006, 10(5): 511-514. |
| [5] |
张翠娟, 于宙亮, 赵宝华, 何宏轩. 嗜水气单胞菌研究进展[J]. 中国兽药杂志, 2008, 42(7): 46-50. DOI:10.3969/j.issn.1002-1280.2008.07.012 |
| [6] |
董传甫, 林天龙. 嗜水气单胞菌研究进展(综述)[J]. 福建农业学报, 2003, 18(4): 243-248. DOI:10.3969/j.issn.1008-0384.2003.04.011 |
| [7] |
蒋云升, 王永坤. 烹调对河蟹致病性气单胞菌控制的研究[J]. 扬州大学学报:自然科学版, 1999, 2(3): 27-30. |
| [8] |
陈茂春.河蟹气单胞菌控制与醉制食品安全研究[D].扬州: 扬州大学, 2010.
|
| [9] |
殷俊, 朱剑. 无锡市南长区首次由气单胞菌引起食物中毒的调查研究[J]. 当代医学, 2013(36): 155-156. DOI:10.3969/j.issn.1009-4393.2013.36.108 |
| [10] |
董庆利, 王海梅, Malakar PK. 气单胞菌在不同食物接触表面的存活与交叉污染[J]. 农业机械学报, 2015, 46(3): 228-234. |
| [11] |
Abd-El-Malek AM. Incidence and virulence characteristics of Aeromonas spp.in fish[J]. Veterinary World, 2017, 10(1): 34-37. DOI:10.14202/vetworld.2017.34-37 |
| [12] |
Ran C, Qin C, Xie M, et al. Aeromonas veronii and aerolysin are important for the pathogenesis of motile aeromonad septicemia in cyprinid fish[J]. Environ Microbiol, 2018, 20(9): 3442-3456. DOI:10.1111/1462-2920.14390 |
| [13] |
Batra P, Mathur P, Misra MC. Aeromonas spp.:An emerging nosocomial pathogen[J]. Journal of Laboratory Physicians, 2016, 8(1): 1-4. DOI:10.4103/0974-2727.176234 |
| [14] |
Chen PL, Lamy B, Ko WC. Aeromonas dhakensis, An increasingly recognized human pathogen[J]. Front Microbiol, 2016, 7: 793. |
| [15] |
鱼艳荣, 刘希成. 革兰氏阴性菌外膜蛋白研究进展[J]. 动物医学进展, 2000, 2: 35-39. |
| [16] |
黄晓, 叶巧真, 何建国, 等. 嗜水气单胞菌外膜蛋白基因ompTS的克隆与序列分析[J]. 水产学报, 2001, 25(6): 552-558. |
| [17] |
董传甫, 林天龙, 俞伏松, 龚晖. 嗜水气单胞菌细胞外膜蛋白及S层蛋白分析[J]. 中国水产科学, 2003, 10(3): 201-205. DOI:10.3321/j.issn:1005-8737.2003.03.005 |
| [18] |
董传甫, 林天龙, 龚晖, 等. 嗜水气单胞菌主要外膜蛋白对欧洲鳗鲡的免疫保护试验[J]. 水生生物学报, 2005, 29(3): 285-290. DOI:10.3321/j.issn:1000-3207.2005.03.009 |
| [19] |
Williams KM, Iii ECB, Raybourne RB. Identification of murine B-cell and T-cell epitopes of Escherichia coli outer membrane protein f with synthetic polypeptides[J]. Infection & Immunity, 2000, 68(5): 2535. |
| [20] |
Secundino I, López-Macías C, Cervantes-Barragán L, et al. Salmonella porins induce a sustained, lifelong specific bactericidal antibody memory response[J]. Immunology, 2010, 117(1): 59-70. |
| [21] |
陈伟, 刘文恩, 李艳华, 等. 艰难梭菌毒素B受体结合区CDB3融合蛋白诱导表达条件优化及其纯化[J]. 检验医学与临床, 2014, 6: 725-728. DOI:10.3969/j.issn.1672-9455.2014.06.003 |
| [22] |
黄艺丹, 汪开毓, 郑建, 黄锦炉. 鱼类致病性豚鼠气单胞菌单克隆抗体-胶体金检测方法的建立[J]. 水生生物学报, 2010, 34(3): 509-516. |
| [23] |
马丽, 康洁. 草鱼点状产气单胞菌单克隆抗体的制备与双抗原夹心ELISA法的建立[J]. 贵州农业科学, 2012, 40(5): 138-141. DOI:10.3969/j.issn.1001-3601.2012.05.037 |
| [24] |
刘明智, 叶星, 田园园, 等. 嗜水气单胞菌外膜蛋白W基因的表达及其免疫原性分析[J]. 微生物学通报, 2011, 38(3): 437-445. |
| [25] |
蒋蔚, 刘永杰, 陆承平. 嗜水气单胞菌J-1株OmpA融合蛋白的高效表达及免疫原性分析[J]. 中国水产科学, 2008, 15(2): 301-306. DOI:10.3321/j.issn:1005-8737.2008.02.014 |
| [26] |
秦杨蕾.鳖源嗜水气单胞菌的分离鉴定及主要外膜蛋白的免疫原性研究[D].宁波: 浙江万里学院, 2015.
|
| [27] |
廖紫超.嗜水气单胞菌ompF和ompK的原核表达及对欧洲鳗鲡的免疫保护作用[D].福州: 福建农林大学, 2015.
|




