黏细菌属于革兰氏阴性真细菌,是一类形态特殊复杂、具有明显的社会学特征的细菌[1]。由于黏细菌的分离纯化较困难,黏细菌的研究比其他细菌少很多。但随着分离纯化方法的不断探索与改进,菌株来源不断增加。近年来随着各国学者对黏细菌研究工作的深入,黏细菌的新型种属不断涌现,当前德国生物技术中心(GBF)共确定黏细菌菌株7 500多株,同时黏细菌保存的种属与数量最多,山东大学及河北大学等高校更是推动了国内黏细菌分离纯化的顺利进行。黏细菌具有复杂的生活史和多细胞行为,可以滑行运动,能够产生结构各异、种类多样、活性高效的次级代谢产物,尤其是Epothilones(埃博霉素)[2-3]在抗肿瘤方面成效显著,使黏细菌成为开发潜力巨大的一类生物类群[4-6],更是发现和生产天然生物活性物质的“微工厂”[7],在农业、生态、医药等方面具有重要的研究和应用价值[8-14]。
呼伦贝尔市地处内蒙古自治区东北部,地处东经115°31'-126°04'、北纬47°05'-53°20'。其地形总体特征为西高东低,地势由西到东逐渐过渡,该地区地处温带北部,属温带大陆性气候,昼夜温差和降水量差异大,降水期多集中在7-8月。呼伦贝尔市国土面积2.5×107 hm2,各类资源丰富,类型多种多样,农耕地土壤类型主要以黑土、暗棕壤、黑钙土和草甸土为主,质地肥沃,肥力高,由于近年来人们对牧区、草原的过度开垦,导致土壤肥力逐渐下降,荒漠化现象也日趋严重,使其成为生态环境脆弱区[14]。
呼伦贝尔地形得天独厚,自然资源以及土壤类型多样,这些都预示着该地区黏细菌资源的丰富性。本研究首次对内蒙古呼伦贝尔地区的可培养黏细菌资源的多样性进行研究,并对黏细菌的分布与环境因子之间的相关性及其抗菌活性进行初步分析,为今后该地区黏细菌资源的开发利用与活性物质研究的进一步探究奠定了基础。
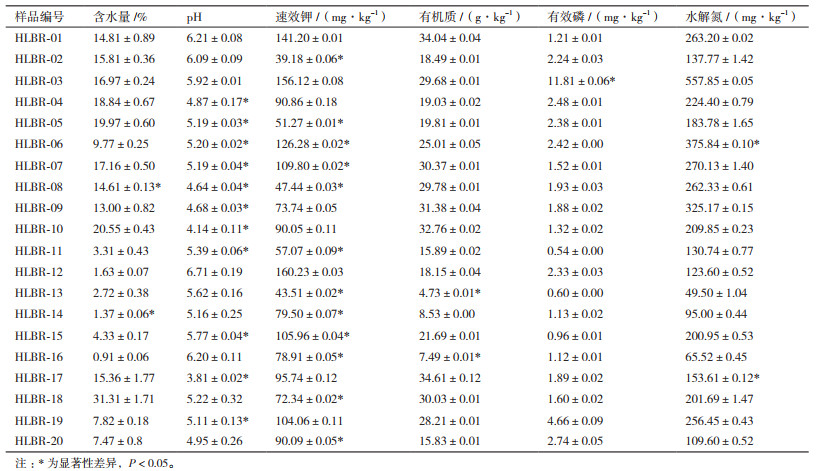
1 材料与方法 1.1 材料 1.1.1 供试土样2016年8月从呼伦贝尔地区共采集土壤样品20份。采集的土样要具备均一性和代表性。根据采样区域的大小确定取样点数,一般面积大于3.3 hm2要取超过15个样点,小于0.7 hm2取5-10个样点,面积在二者之间则取10-15个点。以对角线或蛇形的方式布置采样点,去除土壤表层杂质后,挖一个5 cm左右深度的“凹”字土坑,再混匀所有挖出的土样,将其中的1/4收在封口袋内。依照《中国土壤分类与代码》(GB/T 17296-2009)内土壤的分类标准,确定呼伦贝尔地区的土壤类型(表 1)。测定含水量后于室温自然阴干,过60目筛室温保存(表 2)。
WCX固体培养基(pH6.0、6.5、7.2)、VY/2固体培养基(pH7.2)、ST21CX固体培养基、CAS液体培养基、土豆葡萄糖琼脂(PDA)固体培养基、牛肉膏蛋白胨固体及液体培养基、酵母蛋白葡萄糖(YPD)液体培养基、LB液体培养基参考Rechenbach等[15]的研究。
1.2 方法 1.2.1 土壤样品环境参数的测定测土壤含水量采用烘干法[16],测pH值采用电位法[17],测有机质采用重铬酸钾容量法(稀释热法)[18],测速效钾采用NaNO3浸提-四苯硼钠比浊法[19],测有效磷采用NaHCO3浸提-钼锑抗比色法[20],测水解氮采用碱解扩散法[21]。
1.2.2 黏细菌的分离土样预处理:取约50 g土样于灭菌培养皿内,加入终浓度100 mg/mL的放线菌酮溶液浸泡过夜。
在超净工作台内,用无菌枪头挑取黄豆粒大小的浸泡过夜土样接种到涂有大肠杆菌划线的WCX培养基内和铺有滤纸的ST21CX培养基内,另挑取粒大饱满的灭菌兔粪3颗放入铺有浸泡土样的ST21CX培养基内,30℃恒温培养箱内培养,分别于2 d,10 d和7 d后开始观察是否有子实体形成及滤纸降解情况,及时转接到VY/2固体培养基和ST21CX固体培养基上。
1.2.3 黏细菌的纯化及保存采用子实体反复转接的方法对黏细菌进行纯化,直至无其他杂菌为止。挑取纯化好的菌株于CAS液体培养基内30℃,180 r/min振荡培养24 h,若培养基澄清则表明该菌株已纯,用25%灭菌甘油于-80℃冰箱内保存。
1.2.4 黏细菌的鉴定通过Nikon SMZ275体视显微镜和Sony数码相机对纯化的菌株进行形态结构观察拍照,并参照《Bergey’s Manual of Systematic Bacteriology》和《原核生物学》的分类标准进行初步鉴定。再采用NaOH-CTAB法提取黏细菌的基因组DNA,并以通用引物27 F(5'-AGAGTTTGATCC-TGGCTCAG-3')和1495 R(5'-CTACGGCTACCTTG-TTACGA-3')进行16S rRNA基因序列扩增。扩增程序:94℃预变性3 min,94℃变性30 s,55℃退火45 s,72℃延伸90 s,共30个循环;72℃延伸10 min。电泳检测后将PCR产物送至北京博迈德基因技术有限公司测序,利用BLAST程序与GenBank数据库内的已知序列进行同源性比对。
1.2.5 黏细菌抗菌活性的检测将大肠杆菌DH-5α(Escherichia coli DH-5α)、金黄色葡萄球菌(Staphylococcus aureus)和枯草芽孢杆菌(Bcicius subtilis)的菌液接入已灭菌的牛肉膏蛋白胨液体培养基内,在37℃,180 r/min的条件下振荡培养16 h,第2天将3种菌的液体培养基进行离心,取菌体沉淀分别涂布在牛肉膏蛋白胨固体培养基上,晾干。用灭菌的蓝枪头扎取已纯化的黏细菌,将黏细菌菌饼倒扣在涂有指示细菌的培养基上,并在培养基边缘放上相同大小的VY/2培养基菌饼作空白对照,37℃恒温培养48 h后观察抑菌情况。将酿酒酵母菌(Saccharomyces cerevisiae)接入已灭菌的YPD液体培养基内培养18 h后,均匀涂布在PDA培养基上,晾干。将其菌饼倒扣在涂有指示细菌的培养基上,并在培养基边缘放上VY/2培养基菌饼作空白对照,37℃恒温培养40 h后观察抑菌情况。将核盘菌(Sclerotinia sclerotiorum)、立枯丝核菌(Rhizoctonia solanikuhn)和尖孢镰刀菌(Fusarium oxysporum)的菌饼放入PDA培养基中心,马铃薯晚疫病菌(Phytophthora infestans)的菌饼放入黑麦培养基中心,再将黏细菌菌饼分别倒扣在距指示真菌约2 cm处,VY/2培养基菌饼作空白对照,18℃恒温培养7 d后观察抑菌情况。
2 结果 2.1 土样环境参数测定对内蒙古呼伦贝尔地区采集的20份土壤样品进行了含水量、pH、速效钾、有机质、有效磷和水解氮含量的测定(表 3)。
将呼伦贝尔地区的20个土壤样品的环境参数指标与养分含量分别与全国第二次土壤普查的各级土壤养分指标进行对比,可以得出该地区土壤整体呈酸性,其中55%为强酸性土壤,30%为微酸性土壤,10%为极度酸性土壤,仅5%为中性土壤;80%的土样处于轻旱至重旱状态,10%的土样含水量处于适宜状态,10%处于偏湿状态;45%的土样有机质含量处于低和很低水平,25%处于中等水平,30%处于高水平;90%的土样有效磷含量处于极低的水平,只有5%的土样处于中等水平;55%的土样速效钾含量处于低和很低水平,35%处于中等水平,10%处于高水平;水解氮的含量整体呈高水平,65%的土样处于极高水平,15%处于高水平,10%处于中等水平,10%处于低和很低水平。
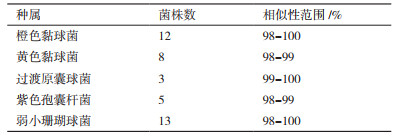
2.2 黏细菌的分离及鉴定利用3种分离方法对20份土壤样品进行黏细菌分离,共得到106株细菌,通过形态学鉴定及16S rRNA基因序列比对,得到黏细菌共41株(表 4),包括黏球菌属(Myxococcus)20株、珊瑚球菌属(Corallococcus)13株、孢囊杆菌属(Cystobacter)5株、原囊菌属(Archangium)3株共4个属;弱小珊瑚球菌(Corallococcus exiguous)13株、橙色黏球菌(Myxococcus fulvus)12株、黄色黏球菌(Myxococcus xanthus)8株、过渡原囊球菌(Archangium gephyra)3株和紫色孢囊杆菌(Cystobacter violaceus)5株共5个种(图 1)。其中,通过大肠杆菌划线诱导法得到的分离菌株数及纯化菌株数均为最高,经鉴定共获得的4个属5个种的黏细菌,且各种属黏细菌菌株数也较其他方法多;滤纸诱导法分离到的菌株数略低于大肠杆菌诱导法,但该法并没有纯化出黏细菌,故其纯菌率为0;兔粪诱导法虽然分离出的菌株数最少,但纯化得到黏细菌11株,纯菌率为57.89%,经鉴定该法共获得2个属3个种的黏细菌(表 5)。
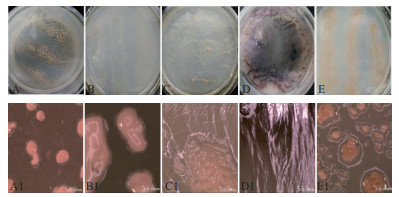
|
| A为Myxococcus fulvus;B为Myxococcus xanthus;C为Archangium gephyra;D为Cystobacter violaceus;E为Corallococcus exiguous;A1-E1分别为A-E对应菌株子实体图片 图 1 部分黏细菌菌落形态图及相应的子实体图(30×) |
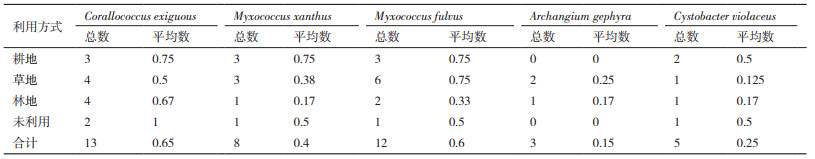
通过表 1可知呼伦贝尔地区共有4种土样利用方式,即草地(8份)、林地(6份)、耕地(4份)和未利用(2份)。不同土样利用方式黏细菌的分布有所差异(图 2),耕地平均每个样品中得到的分离菌株数和纯化菌株数均高于其他利用方式的土样,分别为7.25和2.75,未利用土地次之,草地第三,林地平均每个样品中得到的分离菌株数和纯化菌株数最低。

|
| 图 2 不同利用方式样品分离纯化的菌株数 |
统计不同土壤利用方式中黏细菌种属的分布情况(表 6),4种土样利用方式中均纯化出Corallococcus exiguous、Myxococcus xanthus、Myxococcus fulvus和Cystobacter violaceus,只有草地和林地土样中纯化出了Archangium gephyra。其中,耕地平均每个样品中的Corallococcus exiguous、Myxococcus xanthus、Myxococcus fulvus较多,Cystobacter violaceus数量较少,没有Archangium gephyra;未利用土地平均每个样品中的Corallococcus exiguous数量较多,Myxococcus xanthus、Myxococcus fulvus、Cystobacter violaceus数量较少,没有Archangium gephyra;草地平均每个样品中的Myxococcus fulvus数量最多,Corallococcus exiguous次之,后续依次为Myxococcus xanthus、Archangium gephyra,而Cystobacter violaceus数量最少;林地平均每个样品中的Corallococcus exiguous数量最多,Myxococcus fulvus次之,Myxococcus xanthus、Archangium gephyra和Cystobacter violaceus数量最少。
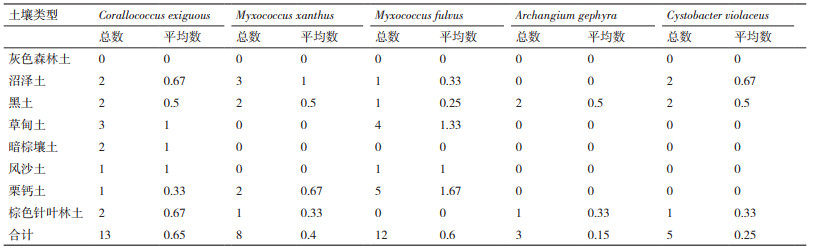
由表 1可知呼伦贝尔地区土样共有8个土壤类型,即灰色森林土(1份)、沼泽土(3份)、黑土(4份)、草甸土(3份)、暗棕壤土(2份)、风沙土(1份)、栗钙土(3份)、棕色针叶林土(3份)。不同土壤类型中黏细菌的分布有所差异(图 3),黑土平均每个样品分离菌株数最高,为6.5,后续依次为草甸土、栗钙土、沼泽土、暗棕壤、风沙土、棕色针叶林;沼泽土和栗钙土平均每个样品的纯化菌数最高,均为2.67,之后依次为后续草甸土、黑土、暗棕壤土、风沙土、棕色针叶林土,灰色森林土平均每个样品中分离菌株数和纯化菌株数最低。
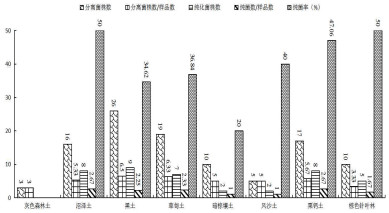
|
| 图 3 不同土壤类型样品分离纯化的菌株数 |
统计不同土壤类型黏细菌种属的分布情况(表 7),只有黑土中5个种属的黏细菌都有分布,灰色森林土样中未纯化出黏细菌,暗棕壤土仅纯化出Corallococcus exiguous。沼泽土平均每个土样中纯化出的Myxococcus xanthus数量最多,Corallococcus exiguous和Cystobacter violaceus较少,Myxococcus fulvus数量最少,没有Archangium gephyra;黑土平均每个土样中纯化出的Myxococcus xanthus、Corallococcus exiguous、Archangium gephyra和Cystobacter violaceus数量相同且最多,Myxococcus fulvus最少;栗钙土平均每个土样中纯化出的Myxococcus fulvus数量最多,Myxococcus xanthus次之,Corallococcus exiguous最少,未纯化出Archangium gephyra和Cystobacter violaceus;棕色针叶林土中平均每个土样中纯化出Corallococcus exiguous最多,后续依次为Myxococcus xanthus、Archangium gephyra和Cystobacter violaceus,未纯化出Myxococcus fulvus;草甸土和风沙土平均每个土样中纯化得到的Myxococcus fulvus数量最多,Corallococcus exiguous较少,且均未纯化出Myxococcus xanthus、Archangium gephyra和Cystobacter violaceus。
利用SPSS 19.0软件对呼伦贝尔地区黏细菌的分布与其环境参数之间的关系进行分析(表 8)。可以看出该地区分离得到的黏细菌总数和菌株总数均与含水量、pH、有机质、有效磷和水解氮含量呈正相关,均与速效钾含量呈负相关,但土样的各环境参数与分离得到的黏细菌总数和菌株总数并未有显著的相关性。
对41株黏细菌进行抗菌活性检测,通过测量抑菌圈的大小来确定其抗菌活性的强弱,图 4为一株Cystobacter violaceus的抗菌活性检测结果,可以看出其对Escherichia coli DH-5α的微弱的抑菌圈及对Phytophthora infestans产生的明显抑菌圈,对其他指示菌株无抑菌活性。

|
| A:Escherichia coli DH-5α; B:Staphylococcus aureus; C:Bcicius subtilis; D:Saccharomyces cerevisiae; E:Phytophthora infestans; F:Rhizoctonia solanikuhn; G:Sclerotinia sclerotiorum; H:Fusarium oxysporum. 图 4 一株Cystobacter violaceus抗菌活性的检测 |
通过对菌株抗菌活性的检测发现,所有黏细菌对Phytophthora infestans均表现出不同程度的拮抗作用且对Escherichia coli DH-5α均有微弱的溶解能力,有3株黏细菌(1株Corallococcus exiguous,2株Myxococcus fulvus)表现出对Staphylococcus aureus的抑制作用,所有黏细菌对Bcicius subtilis、Saccharomyces cerevisiae、Sclerotinia sclerotiorum、Rhizoctonia solanikuhn和Fusarium oxysporum均未表现出抑制活性。
3 讨论从环境参数中可以看出呼伦贝尔地区土样基本呈酸性,且多呈干旱状态;有90%的土样有效磷含量处于极低水平,水解氮含量整体处于中等以上水平,有机质和速效钾含量整体处于中等偏低水平,说明该地区土壤养分含量不均衡。与内蒙古中部和西部地区土壤环境参数[22-23]相比较,这些地区的土壤含水量、有机质和速效钾的含量均处于较低水平,但是中部和西部地区土壤多为中性偏碱性,而呼伦贝尔地区多为酸性土壤;中部和西部地区土壤整体有效磷含量较高,水解氮含量较低,而呼伦贝尔地区则完全相反。王璐等[24]发现,虽然呼伦贝尔市92.53%的耕地有效磷处于不同程度富集状态,但其中鄂温克族自治旗、新巴尔虎左旗、陈巴尔虎旗、牙克石市和阿荣旗5个旗市的耕地有效磷含量却介于中等偏低水平,本研究中的耕地土样均采自这5个区域,其中25%的耕地土样有效磷含量处于中等水平,75%处于极低水平,与王璐等的研究结果相符,这可能是采样地点土壤的温度、降水等环境条件以及期间是否施用磷肥等因素造成的。
Dawid等[25]表明黏细菌在pH值为6-8的土壤环境中最丰富,但本地区土样pH有一半以上呈强酸性,加之黏细菌纯化周期较长,反复转接过程中容易导致菌株的丢失,故最终分离得到的黏细菌种属较少,共得到41株噬细菌类群的黏细菌,包括黏球菌属(Myxococcus)20株、珊瑚球菌属(Corallococcus)13株、孢囊杆菌属(Cystobacter)5株和原囊球菌属(Archangium)3株,优势菌属为Myxococcus。值得注意的是,内蒙古中部、西部地区和呼伦贝尔地区的优势菌均为Myxococcus,这也验证了Myxococcus对环境适应性较强,在贫瘠和肥沃的土壤中均有分布[26]这一研究结果。与中部地区土样中分离得到的黏细菌[22]相比,该地区没有Pyxidicoccus和Melittangium这2个属的黏细菌分布,与西部地区分离得到的黏细菌[27-29]相比,本地区缺少没有Pyxidicoccus和Anqiococcus这2个属的黏细菌分布。周秀文等[30]研究表明,黏细菌的丰度和有机碳含量、碳氮比、pH、温度等的相关性较低,与年平均温度和碳氮比相关性较高。本研究中,呼伦贝尔地区的黏细菌总数和菌株总数均与含水量、pH、有机质、有效磷和水解氮呈正相关,与速效钾呈负相关,但却并未表现出显著的相关性,与周秀文等的研究结果基本一致,分析原因,可能是样品采集地点有限或黏细菌未能全部纯化出来,也可能是盐度、重金属等其他因素也对黏细菌的分布有影响[31-32]。
方晓梅等[33]关于黏细菌生态多样性的研究中表明褐土和黑土营养丰富,黏细菌数量多,而沙土、风化岩中黏细菌极少。分析本研究结果数据可知,在土壤类型和利用方式不同的情况下,呼伦贝尔地区的黑土纯化出黏细菌种类及数目最多,相较其他土壤类型表现出较丰富的多样性,而暗棕壤土中的黏细菌最少;草地纯化出黏细菌种类及数目最多,未利用土地最少。与内蒙古中部和西部地区相比,中部地区潮土和灰褐土中分离黏细菌较多,栗褐土和粗骨土分布较少,中部地区样品在土样利用方式上的黏细菌分布规律和本研究结果相同;而西部地区风沙土和草甸土中分离黏细菌较多,棕漠土和灰漠土较少,林地中菌株数目多且种类最丰富[22, 27-29]。由于不同地区的同一土壤类型环境参数差异较大,以及这些土壤被不同植被覆盖,可能造成了黏细菌种群和数量上分布的差异。
Phytophthora infestans是由致病疫霉菌引起,会造成马铃薯致病,已使全球马铃薯产业损失巨大[34]。如今杀菌剂的耐药性日渐减弱,为防止致病能力造成的变异使作物丧失抗病性,科学家们发现了对植物病害防止较有潜力的一种方式,即以有益菌抑制有害菌,这更是目前抗马铃薯晚疫病生物农药研制的重要途径。Fusarium oxysporum会使豆类及茄科植物根系腐烂死亡,降低土壤的固氮能力等,其产生的一种名为镰刀菌毒素[35-36]的物质会使人发生皮肤溃烂等疾病[37];Rhizoctonia solanikuhn可使稻麦、蔬菜瓜果等根茎处致病;Sclerotinia sclerotiorum会使向日葵根茎叶盘腐烂,致病后使葵花籽的籽仁含油率及蛋白质含量下降,对向日葵产业的发展造成严重的影响[38-39]。除此之外本研究也对黏细菌抗大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌等细菌进行了抗菌活性的分析。本地区分离得到的所有黏细菌菌株均对Phytophthora infestans表现出抗性,且不同种属的黏细菌阳性检出率均为100%,中部和西部地区对Phytophthora infestans有抗性的黏细菌分别占83%和78%[22, 27-29],Myxococcus的阳性检出率最高。由此可见,呼伦贝尔地区黏细菌资源的开发对马铃薯晚疫病的防治及新药研究可能更具潜力。本研究中不同土样中分离得到的同一属种黏细菌抗指示细菌和真菌的种类及抗性强弱均有差异,研究结果与武志华等[40]的研究结果相同,这表明黏细菌中的抗菌活性物质可能具有菌株特异性。李越中等[41]和张利平等[42]研究发现黏细菌中具有抗癌、抗肿瘤的活性物质,Li[43]、Dahm等[44]发现黏细菌对林木病原真菌有抑制作用,这都为本地区黏细菌的药用作用及生物防治的进一步研究提供了更多方向。
4 结论呼伦贝尔地区的土样总体呈酸性且多为干旱状态,土壤养分含量不均衡。共分布有4个属5个种的可培养黏细菌,优势菌属为Myxococcus。该地区的黑土样品中黏细菌种类和数量最多,而风沙土、暗棕壤土样品中黏细菌丰富度较差;草地样品中黏细菌的种类和数量最多,而未利用土地样品中黏细菌丰富较差。黏细菌分布与土壤环境参数没有明显地相关性。所有黏细菌菌株均表现出对Phytophthora infestans有抗性,对其活性物质的确定及拮抗机理等问题需进一步探究。本研究对内蒙古呼伦贝尔地区黏细菌分布及其抗菌活性进行了分析,为未来该地区黏细菌资源的开发及利用奠定基础。
| [1] |
徐文.黏细菌的分离纯化、鉴定及生物活性物质的筛选研究[D].保定: 河北大学, 2013.
|
| [2] |
程益华, 陈秀华. 埃博霉素类抗肿瘤药物的研究进展[J]. 世界临床药物, 2011, 32(10): 619-623. |
| [3] |
陆震.埃博霉素生产菌株选育及埃博霉素抑瘤活性研究[D].济南: 山东轻工业学院, 2011.
|
| [4] |
Kaiser D. Coupling cell movement to multicellular development in myxobacteria[J]. Nature Reviews Microbiology, 2003, 1(1): 45-54. DOI:10.1038/nrmicro733 |
| [5] |
Kaplan HB. Multicellular development and gliding motility in Myxococcus xanthus[J]. Current Opinion in Microbiology, 2003, 6(6): 572-577. DOI:10.1016/j.mib.2003.10.006 |
| [6] |
Garza AG, Pollack JS, Harris BZ, et al. Sdek is required for early fruiting body development in Myxococcus xanthus[J]. Journal of Bacteriology, 1998, 180(17): 4628. |
| [7] |
Wenzel SC, Müller, Ro lf. Myxobacteria-'microbial factories'for the production of bioactive secondary metabolites[J]. Molecular BioSystems, 2009, 5(6): 567. DOI:10.1039/b901287g |
| [8] |
Garcia RO, Krug D, Müller R. Chapter 3 Discovering natural products from myxobacteria with emphasis on rare producer strains in combination with improved analytical methods[J]. Methods Enzymol, 2009, 458(458): 59-91. DOI:10.1016/S0076-6879(09)04803-4 |
| [9] |
Gerth K, Schummer D, Höfle G, et al. Ratjadon:a new antifungal compound from Sorangium cellulosum(myxobacteria) production, physio-chemical and biological properties[J]. Cheminform, 1996, 49(1): 71-5. DOI:10.1002/chin.199647256 |
| [10] |
Cortina NS, Krug D, Plaza A, et al. Myxoprincomide:a natural product from Myxococcus xanthus discovered by comprehensive analysis of the secondary metabolome[J]. Angewandte Chemie International Edition, 2012, 51(3): 811-816. DOI:10.1002/anie.201106305 |
| [11] |
Schiefer A, Schmitz A, Schaberle TF, et al. Corallopyronin a specifically targets and depletes essential obligate wolbachia endobacteria from filarial nematodes in vivo[J]. Journal of Infectious Diseases, 2012, 206(2): 249-257. DOI:10.1093/infdis/jis341 |
| [12] |
Dawid W. Biology and global distribution of myxobacteria in soils[J]. FEMS Microbiology Reviews, 2000, 24(4): 403-427. DOI:10.1111/j.1574-6976.2000.tb00548.x |
| [13] |
Herrmann J, Elnakady YA, Wiedmann RM, et al. Pretubulysin:from hypothetical biosynthetic intermediate to potential lead in tumor therapy[J]. PLoS One, 2012, 7(5). |
| [14] |
张蕾, 郑利远, 于贺, 等. 呼伦贝尔市农牧交错区典型土壤剖面理化性状特征分析[J]. 中国农学通报, 2018, 34(20): 92-95. |
| [15] |
Shimkets LJ, Dworkin M, Reichenbach H.The Myxobacteria[M].Springer New York, 2006.
|
| [16] |
中华人民共和国农业行业标准.NY/T1121.3-2006土壤机械组成的测定[S].北京: 中国标准出版社, 2006.
|
| [17] |
中华人民共和国农业行业标准.NY/T1121.2-2006土壤pH的测定[S].北京: 中国标准出版社, 2006.
|
| [18] |
中华人民共和国农业行业标准.NY/T1121.6-2006土壤有机质的测定[S].北京: 中国标准出版社, 2006.
|
| [19] |
中华人民共和国农业行业标准.NY/T889-2004土壤速效钾和缓效钾含量的测定[S].北京: 中国标准出版社, 2006.
|
| [20] |
中华人民共和国农业行业标准.NY/T1121.7-2014土壤有效磷的测定[S].北京: 中国标准出版社, 2006.
|
| [21] |
鲍士旦. 土壤农化分析[M]. .
|
| [22] |
武志华.内蒙古中部地区黏细菌分离及其抑制马铃薯晚疫病菌的活性和成分研究[D].呼和浩特: 内蒙古农业大学, 2018.
|
| [23] |
丁一秀, 谢荣辉, 高安琪, 等. 内蒙古西部地区土壤微生物数量及其土壤理化特性[J]. 干旱区研究, 2017, 34(6): 1294-1303. |
| [24] |
王璐, 姜英君, 王红霞, 等. 呼伦贝尔市耕地土壤磷素富集空间变异研究[J]. 中国农技推广, 2018, 34(10): 62-65. DOI:10.3969/j.issn.1002-381X.2018.10.029 |
| [25] |
Dawid W. Biology and global distribution of myxobacteria in soils[J]. FEMS Microbiology Reviews, 2000, 24(4): 403-427. DOI:10.1111/j.1574-6976.2000.tb00548.x |
| [26] |
赵智颖, 张鲜姣, 谭志远, 等. 药用植物根系土壤可培养黏细菌的分离鉴定[J]. 微生物学报, 2013, 53(7): 657-668. |
| [27] |
丁一秀.鄂尔多斯高原地区黏细菌的分离鉴定及其拮抗致病疫霉活性的初步分析[D].呼和浩特: 内蒙古农业大学, 2017.
|
| [28] |
任兴波.巴彦淖尔地区土壤中黏细菌的分离鉴定及其抗致病疫霉活性的初步研究[D].呼和浩特: 内蒙古农业大学, 2016.
|
| [29] |
赵璞钰.阿拉善地区黏细菌的分离鉴定及其抗致病疫霉活性的初步研究[D].呼和浩特: 内蒙古农业大学, 2018.
|
| [30] |
周秀文.土壤中黏细菌群落的调查及领地性行为的分子机制的研究[D].济南: 山东大学, 2013.
|
| [31] |
张鲜姣, 黎志坤, 谭志远, 等. 新疆阿克苏地区盐碱地黏细菌分离鉴定[J]. 微生物学报, 2012, 52(2): 160-168. |
| [32] |
Farnleitner AH, Wilhartitz I, Ryzinska G, et al. Bacterial dynamics in spring water of alpine karst aquifers indicates the presence of stable autochthonous microbial endokarst communities[J]. Environmental Microbiology, 2005, 7(8): 1248-1259. DOI:10.1111/j.1462-2920.2005.00810.x |
| [33] |
方晓梅, 张利平. 黏细菌生态多样性的初步研究[J]. 生物多样性, 2001, 9(3): 207-213. DOI:10.3321/j.issn:1005-0094.2001.03.002 |
| [34] |
Haverkort AJ, Boonekamp PM, Hutten R, et al. Durable late blight resistance in potato through dynamic varieties obtained by cisgenesis:scientific and societal advances in the DuRPh project[J]. Potato Research, 2016, 59(1): 35-66. DOI:10.1007/s11540-015-9312-6 |
| [35] |
张璐, 丁延芹, 杜秉海, 等. 黄瓜枯萎病病原拮抗细菌Ds-1菌株鉴定及其生防效果研究[J]. 园艺学报, 2010, 37(4): 575-580. |
| [36] |
王芳, 王晓倩, 王莹, 等. 6种杀菌剂对黄瓜尖孢镰刀菌的毒力测定试验[J]. 中国农学通报, 2019(9): 143-148. |
| [37] |
王朵, 谢学文, 柴阿丽, 等.华北地区十字花科芸薹属蔬菜上立枯丝核菌的病原生物学研究[J/OL].植物病理学报, 2019.doi.org/10.13926/j.cnki.apps.
|
| [38] |
曹翠玲, 刘素琪, 康瑞姣, 等. 康氏木霉对向日葵菌核病菌拮抗作用研究[J]. 山西农业大学学报:自然科学版, 2005, 46(2): 150-152. |
| [39] |
贾瑞芳.向日葵小核盘菌的生物学特性、致病力分化以及遗传多样性的研究[D].呼和浩特: 内蒙古农业大学, 2018.
|
| [40] |
武志华, 丁一秀, 任兴波, 等. 黏细菌的活性检测及与环境因子的相关性[J]. 应用与环境生物学报, 2017, 23(2): 244-250. |
| [41] |
李越中, 李健, 周璐, 等. 我国黏细菌(Myxobacteria)资源的分离与鉴定[J]. 微生物学报, 2000(6): 652-656. DOI:10.3321/j.issn:0001-6209.2000.06.015 |
| [42] |
方晓梅, 张利平. 黏细菌生态多样性的初步研究[J]. 生物多样性, 2001(3): 207-213. DOI:10.3321/j.issn:1005-0094.2001.03.002 |
| [43] |
Li Z, Ye X, Chen P, et al. Antifungal potential of, Corallococcus, sp.strain EGB against plant pathogenic fungi[J]. Biological Control, 2017, 110: 10-17. DOI:10.1016/j.biocontrol.2017.04.001 |
| [44] |
Dahm H, Brzezin'ska AJ, WrótniakDrzewiecka W, et al. Myxobacteria as a potential biocontrol agent effective against pathogenic fungi of economically important forest trees[J]. Dendrobiology, 2015, 74: 13-24. DOI:10.12657/denbio.074.002 |