2. 伊犁师范大学生物与地理科学学院,伊宁 835000
2. College of Biology and Geography and Science, Yili Normal University, Yining 835000
当今,从药用植物中筛选生物活性成分或先导化合物成为研制新药的有效途径之一,但人类对药用植物需求量日益增大,致使许多药用植物开采过度,濒临灭绝。植物内生菌的出现为药用植物新资源的研究开拓了一条新思路[1]。近年研究显示,内生菌不仅具有促进植物体的生长,抗菌、抗病虫害等功能,还能参与植物次生代谢成分的转化合成,甚至独立合成与宿主植物相同或相似的次生代谢产物[2]。因此,利用植物资源分离和筛选产活性物质的内生菌,用于生产新型活性物质,以期研制高效、环保的新药,即可解决某些药用植物生长缓慢,资源紧缺等引起的药源匮乏,耐药致病菌的发生等问题,还可保护植物生态,开发植物内生菌资源。
伊犁野核桃属胡桃科(Juglan daceae)山核桃属(Carya)落叶乔木,属典型的药、食两用植物。生长于天山支脉北坡植物生长缓慢,资源紧[3],属国家二级保护的野生植物。核桃属植物中主要含有黄酮类、蒽醌类、酚类等多种化学成分[4],具有抗肿瘤、抑菌及抗氧化等活性作用[5]。近年关于伊犁野核桃内真菌生物学方面[6-7]研究备受关注,而对伊犁野核桃内生真菌研究未见报道。本实验以伊犁野核桃研究对象,分离其内生真菌并对高活性菌株鉴定,以期为伊犁野核桃新的药用资源的利用供依据。
1 材料与方法 1.1 材料 1.1.1 材料野核桃采自巩留县野核桃沟,经生物系张维教授鉴定为伊犁野核桃。
1.1.2 供试菌株核盘菌(Sclerotinia sclerotiorum)、番茄灰霉菌(Bontrvtis cinerea)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)及枯草芽孢杆菌(Bacillus subtilis)均购于广东环凯微生物科技有限公司
1.1.3 培养基马铃薯葡萄固体培养基(PDA);察氏培养基;核桃汁培养基:琼脂粉20 g,野核桃叶浸提液200 mL,加水定容至1 000 mL。
1.1.4 主要试剂无水乙醇、Tris碱、Tris-HCI、CTAB、氯仿、异戊醇、琼脂糖等分析纯试剂均购于天津福晨化学试剂厂,DPPH购于长城生物化学工程有限公司。
1.1.5 仪器琼脂糖凝胶电泳仪:美国伯乐公司,HT30;立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备;超净工作台:北京东联哈尔滨仪器制造有限公司,真空旋转蒸发仪:上海亚荣生化仪器厂,Y-2000型;高速冷冻离心机HC-3018R:安徽中科中佳科学仪器有限公司;凝胶成像系统和PCR仪C-1000TM均购于美国Bio-Rad。
1.2 方法 1.2.1 伊犁野核桃内生真菌的分离及保存把野核桃根、茎、叶、果皮、果仁切成约1 cm×0.5 cm的组织块,依次用75%酒精浸泡30 s,无菌水冲洗3次,8%次氯酸钠浸泡5 min,无菌水冲洗3次,分别接种到PDA培养基、察氏培养基和核桃浸提液培养基(各加入1‰青霉素和链霉素,抑制细菌的生长)中,最后一遍无菌水涂布于空白培养基,检验植物表面是否消毒彻底。28℃培养3-7 d,待材料边缘长出菌丝后,菌丝尖端接种法接至新PDA培养基,2-3次纯化后,每菌转接3支斜面培养基(其中一支用甘油封存,长期保存),于冰箱保存备用。
1.2.2 抑菌活性筛选 1.2.2.1 初筛琼脂块法[8](1)病原细菌的检测将金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌分别接种于LB液体培养基,37℃,150 r/min培养12 h,用无菌水稀释至最终浓度为106 CFU/mL。取100 μL菌悬液均匀涂布于LB固体培养基,用打孔器取直径0.5 cm内生真菌菌饼,均匀接种于培养皿,37℃培养12 h后,测定供试菌株的抑菌圈大小,每种重复3次。(2)供试菌株的检测采用两点对峙实验[9]测定内生真菌对供试菌株的抑制作用,将已活化的内生真菌和病原真菌接种于同一个90 mm PDA平板中,2个接种点中心对称,相距40 mm,每组处理重复3次。于28℃下恒温培养。对照组不接种内生真菌,测定处理组供试菌株菌落生长半径和对照组病原菌生长半径。采用公式(1)计算供试真菌生长抑制率。
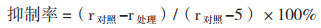 (1)
(1)
其中,r对照为对照组供试菌株菌落生长半径,单位mm;r处理为处理组供试菌株菌落生长半径单位为mm。
1.2.2.2 复筛-滤纸片扩散法[10](1)待测菌株发酵液制备将初筛的13株内生真菌,分别接种于盛有200 mL PDL培养基的锥形瓶中,置于28℃,150 r/min培养2周左右,用8层纱布过滤,将真菌发酵液浓缩至原体积的1/3,加入等体积乙酸乙酯超声萃取3次,每次20 min,合并乙酸乙酯萃取液,40℃减压蒸干,用少量甲醇重新溶解,继续减压旋蒸约1.5 mL,过0.22 μm的滤膜后,定容至2 mL,菌株发酵液,4℃冰箱备用。(2)发酵液抑菌活性测试用移液枪取8 μL发酵液于灭菌滤纸片,微风吹干,置于放有病原菌的平板,每个板3个重复,同时以甲醇作空白对照,分别置于28℃和37℃培养,十字交叉法测定抑菌圈直径。
1.2.3 发酵物抗氧化能力的检测对13种抑菌活性较好的野核桃内生真菌进行抗氧化测试,取一定浓度真菌发酵液及其乙酸乙酯萃取液进行DPPH自由基清除实验,筛选高抗氧化活性菌株[11]
1.2.4 野核桃内生真菌的5.8S rDNA基因序列分析选取抑菌活性较强内生真菌,采用CTAB法提取活性菌株DNA模板[12]。选通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTC-CGCTTATTGATATGC-3')进行PCR扩增,将扩增产物送至上海生物工程技术服务公司测序。将菌株的ITS序列信息输入GenBank进行BLAST分析,MEGA软件聚类分析,利用邻接法构建系统发育数,再结合形态根据《真菌鉴定手册》[13]对菌株进行初步鉴定。
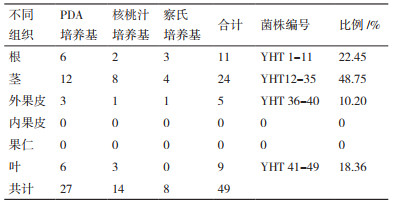
2 结果 2.1 野核桃内生真菌的分离从野核桃中共分离纯化到49株内生真菌(表 1),其中PDA培养基得内生真菌27株,核桃汁培养基比较少,14株,察氏培养基仅8株。由表 1知,分离出的野核桃内生真菌数量在各组织中分布有差别:茎 > 根 > 叶 > 果皮 > 果仁,茎分离的最多(24株),占总数的48.75%,根次之22.45%,果仁和内果皮两次都没有分离到内生菌。
首先用琼脂块法进行初筛。前人研究表明,抑菌活性分为弱:抑菌圈直径d≤1 cm;较强:1 cm < d < 1.4 cm;强:d > 1.4 cm三个等级(真菌:抑制率≥ 75%为强,抑菌率为50%-75%较强拮抗能力,抑制率 < 50%为弱)[14]。
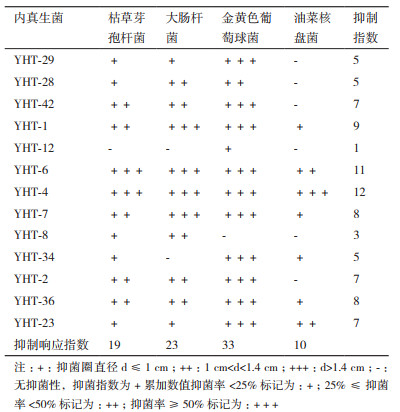
由表 2知49株野核桃内生真菌中50%以上的菌株对3种指示细菌抑菌性较强,表明野核桃内生真菌对革兰氏阳性菌和革兰氏阴性菌具有广谱抑菌性。其中有41株内生真菌对金黄色葡萄球菌抑菌作用显著,达83.67%;而对供试真菌的抑菌活性相对较弱,其中有2株对油菜菌核菌表现抑菌作用较强,占总数的4.08%,而对番茄灰霉抑菌作用弱。
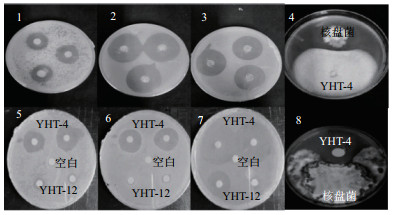
对初筛的13株内生真菌的乙酸乙酯萃取液进行抑菌实验(表 3,图 1),结果显示:(1)大部分内生真菌的乙酸乙酯萃取液与其琼脂块抑菌效果一致,但个别内生真菌的琼脂块与其萃取液抑菌效果差异大,如YHT-12的琼脂块抑菌直径均大于1.4 cm,其萃取液的抑菌直径均小于1.4 cm,可能产生挥发性物质,或者是萃取液处理过程使其失活可进一步研究。(2)不同内生真菌对4种供试菌株抑制效果差别较大,其中YHT-6和YHT-4最为突出,抑菌指数均大于10,对3种指示细菌的抑菌直径都大于1.4 cm,对油菜核盘菌抑菌率大于50%;(3)不同内生真菌对同一病原菌抑制效果也不同,其中对金黄色葡萄球菌表现抑制作用的菌株数量最大,13株内生菌中有12株对其有抑制作用,抑菌响应指数达33。对油菜核盘菌的抑制效果较差,抑菌响应指数仅为10。
|
| 1:大肠杆菌;2:枯草芽孢杆;3:金黄色葡萄球菌;4:油菜菌核菌初筛结果;5-8:依次为其复筛结果 图 1 野核桃内生真菌YHT-4菌株和乙酸乙酯萃取液抑菌图 |
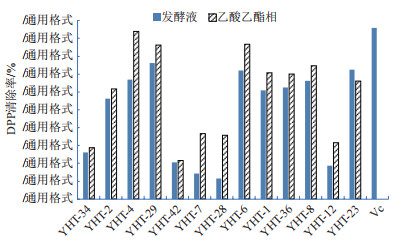
清除DPPH自由基模型是一种应用广泛的快速评估抗氧化活性的方法,由图 2知,13株内生真菌的发酵液及其乙酸乙酯萃取液对DPPH自由基清除能力差异明显,大多数菌株的乙酸乙酯萃取液对DPPH·PPH·能力差异明显,大多数菌株8株内生真菌的乙酸乙酯萃取液清除率超过50%,菌株YHT-4的乙酸乙酯萃取液对DPPH·PPH·萃取液达93.82%,接近Vc(95.95%);而菌株YHT-43的EFFEA对DPPH·的清除率最低,为21.42%。可见,半数以上野核桃内生真菌具有良好的清除DPPH·自由基能力,菌株YHT-4抗氧化活性较强。
|
| 图 2 野核桃菌株发酵液及其乙酸乙酯萃取液对DPPH自由基的清除率 |
菌株YHT-4具有较强的抑菌、抗氧化能力,且遗传性状稳定,对其培养鉴定。由图 3可见,菌株YHT-4在PDA培养基上生长良好,于28℃培养6 d后,其菌落直径接近9 cm,菌落厚而突起,生长较快,菌丝初生白色长而蓬松,后期菌落中部变为粉色,菌落边缘白色,不规则;菌丝分枝,有隔,孢子无色,多孢,略弯,两端稍尖。参照《真菌鉴定手册》发现菌株YHT-4与镰刀菌(Fusarium tricinctum)的形态特征相似。

|
| 图 3 菌株YHT-4显微照片 |
由测序结果知,内生真菌YHT-4的PCR扩增的DNA片段为524 bp,提交至GenBank得登录号为MH754650,构建系统发育树见图 4,内生真菌YHT-4在镰刀菌属中的遗传距离与Fusarium tricinctum在一个分枝上,即两者遗传距离最近,故初步判断菌株YHT-4为属于Fusarium tricinctum(三线镰刀菌)。

|
| 图 4 菌株YHT-4系统发育树状图 |
植物内生真菌在长期进化过程中与宿主植物形成共生互利关系。实验证明,内生真菌可产生具有抑菌、抗氧化、抗肿瘤等与宿主植物相似活性的代谢产物。因此,植物内生真菌为寻找安全新型药提供了潜在的资源[15-16]。本研究从伊犁野核桃各组织中共分离出内生真菌49株,通过抑菌和抗氧化测试筛选出一株具有较强的抑菌和抗氧化性活性菌株YHT-4,其对4种供试菌株具有较强抑制作用,抑菌指数均大于10,抑菌直径大于1.4 cm;同时,对DPPH·的清除率达93.82%,接近Vc(95.95%);最后该菌株被鉴定为三线镰刀属。菌株YHT-4展现出一定的开发价值,表明伊犁野核桃的内生真菌中蕴含丰富的抑菌抗氧化菌株资源。
据统计,镰刀属真菌广泛分布于植物体内和土壤中,具有抗肿瘤、抑菌、抗氧化等生物活性。镰刀菌属为栽培核桃的优势内生真菌属[17],刘泽星等[14]从栽培核桃分离出镰刀菌的发酵产物含有较多的活性物质,具有广泛的抑菌活性。Tiwari等[18]研究显示,从毛姜黄分离出的内生真菌中,镰刀菌具有较好的抗氧化活性。
有研究表明,三线镰刀菌在特定条件下代谢产生T-2毒素,T-2毒素可对人和动物的多个组织器官包括血液、消化系统、免疫系统等产生毒性效应[19]。近年实验报道,T-2毒素可明显抑制某些肿瘤细胞的增殖并诱发细胞凋亡。Wu等[20]报道了当T-2毒素作用于人宫颈癌HeLa细胞时最终诱导细胞凋亡。可见,虽然T-2毒素具有一定毒性,也因此展现了在肿瘤治疗中潜在的应用价值。因此需要进一步确定菌株YHT-4的抗氧化及抑菌活性成分,并对其使用安全性进一步评价。
4 结论本实验采用组织块法从伊犁野核桃中分离到49株内生真菌,通过抑菌活性筛选,得到抑菌活性菌株YHT-4,其发酵液对大肠杆菌,金黄色葡萄球菌,枯草芽孢杆菌的抑菌直径均大于1.4 cm,对油菜核盘菌的抑菌率达70.92%;其清除DPPH自由基能力与Vc相当。形态学与分子学鉴定为三线镰刀菌。
| [1] |
董静洲, 易自力, 蒋建雄. 我国药用植物种质资源研究现状[J]. 西部林业科学, 2005, 34(2): 95-101. DOI:10.3969/j.issn.1672-8246.2005.02.021 |
| [2] |
Nongkhlaw FMW, Joshi SR. Microscopic study on colonization and antimicrobial property of endophytic bacteria associated with ethnomedicinal plants of Meghalaya[J]. Journal of Microscopy and Ultrastructure, 2017, 5(3): 132-139. DOI:10.1016/j.jmau.2016.09.002 |
| [3] |
张维.新疆天山屯峡谷渐危植物野核桃保护生物学研究[D].长春: 东北师范大学, 2016.
|
| [4] |
吴威, 李巍, 张易, 等. 胡桃科植物的化学成分与生物活性研究进展[J]. 中草药, 2013, 44(17): 2480-2488. |
| [5] |
周媛媛, 王栋. 胡桃属植物抗肿瘤作用化学成分研究进展[J]. 药房, 2010, 21(433): 4119-4121. |
| [6] |
韩冷, 徐敏, 张萍. 干旱胁迫下新疆野核桃幼苗叶片渗透调节物质变化研究[J]. 天津农业科学, 2018, 24(8): 1-3. |
| [7] |
张捷, 李勤霞, 张萍, 等. 基于SRAP分子标记新疆野核桃的遗传多样性分析[J]. 植物遗传资源学报, 2016, 17(2): 239-245. |
| [8] |
颜霞, 何晶晶, 赵彬, 等. 假真吾内生菌分离及其拮抗菌的筛选与鉴定[J]. 西北植物学报, 2010, 5: 1029-1034. |
| [9] |
张冬静.药用植物内生真菌的分离及其抑菌活性筛选[D].长春: 吉林大学, 2015.
|
| [10] |
Chen AF, Chen DD, Daiber A, et al. Free radical biology ofthe cardiovascular system[J]. Clinical Science, 2012, 123(1-2): 73-91. |
| [11] |
宋颖娟.药用植物(黄精和黄芪)内生菌的分离鉴定及胞外多糖结构和生物活性的研究[D].济南: 山东大学, 2017.
|
| [12] |
Kohout P, TĕšsitelováT, Roy M, et al. A diverse fungal community associated with Pseudorchis albida(Orchidaceae) roots[J]. Fungal Ecology, 2013, 6(1): 50-64. DOI:10.1016/j.funeco.2012.08.005 |
| [13] |
魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
|
| [14] |
刘泽星, 阿依佳玛丽·依玛尔, 惠建超, 等. 陕西核桃内生真菌代谢产物抑菌活性分析[J]. 西南林业大学学报, 2017, 37(4): 126-131. |
| [15] |
赵欢. 药用植物内生真菌的研究进展[J]. 北方园艺, 2017(13): 170-175. |
| [16] |
范黎. 植物内生真菌次生代谢产物抗菌机制分析[J]. 微生物学通报, 2016, 43(7): 1660. |
| [17] |
问小强.核桃属两种植物内生真菌次生代谢产物的抑菌活性研究Ⅱ[D].杨凌: 西北农林科技大学, 2009.
|
| [18] |
Tiwari S, Singh S, Pandey P, et al. Isolation, structure determination, and antiaging effects of 2, 3-pentanediol from endophytic fungus of Curcuma amada and docking studies[J]. Protoplasma, 2014, 251(5): 1089-1098. DOI:10.1007/s00709-014-0617-0 |
| [19] |
邹广迅, 张红霞, 花日茂. 毒素的毒性效应及致毒机制研究进展[J]. 生态毒理学报, 2011, 6(2): 121-128. |
| [20] |
Wu QH, Wang X, Yang W, et al. Oxidative stress-mediated cytotoxicity and metabolism of T-2 toxin and deoxYnivalenol in animals humans:an update[J]. Archives of Toxicology, 2014, 88(7): 1309-1326. DOI:10.1007/s00204-014-1280-0 |