2. 中国水产科学研究院黄海水产研究所,青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071
近年来,随着氮素污染物的过量排放导致的水体富营养化日益严重,利用生物脱氮技术去除水体中氮素污染物已经成为最经济有效、且无二次污染的热点生物技术之一。生物脱氮理论认为,水体中氮素的去除主要利用微生物将有机氮经过氨化、硝化、反硝化作用还原为NO、N2O和N2,才能彻底去除水体中的氮素污染物[1]。可见反硝化过程是富营养化水体净化整个脱氮过程最后且最关键的一步。研究参与反硝化过程的微生物不仅利于废水的生物脱氮、土壤肥力的保存,而且对于臭氧气层的保护,减少N2O气体的排放均具有重要的意义[2]。因此筛选出具有反硝化功能的微生物至关重要。
反硝化主要途径为硝酸盐在周质硝酸盐还原酶Nap或膜质硝酸盐还原酶Nar的作用下还原为亚硝酸盐,亚硝酸盐在亚硝酸盐还原酶Nir的作用下还原为NO,NO在亚硝酸盐氧化还原酶Nor的作用下还原为N2O,N2O在氧化亚氮还原酶Nos的作用下还原为N2[3]。目前,已有报道对反硝化菌的筛选大多基于底物消除法,以硝酸氮和亚硝酸氮的减少作为反硝化细菌存在的依据[4]。但是,有些异养菌会通过同化作用吸收硝酸氮和亚硝酸氮,转化成细胞物质,这样即使检测到两种底物的减少,而不一定转化成气体。还有报道在此基础上,通过气体产生检测或利用编码反硝化酶的功能基因的PCR检测作为筛选条件[2, 5]。但是PCR检测方法对反应条件要求高,如果条件不合适,会出现假阴性,而气体检测常用的气相色谱法操作繁琐、费用高[6]。2000年,日本研究人员Notomi等[7]报道的环介导等温扩增(Loop mediated isothermal amplification,LAMP)是一种新型的体外扩增DNA技术,即用2对(或3对)特殊引物和具有链置换活性的Bst DNA聚合酶在恒温条件下(60-65℃),完成核酸扩增的一种生化方法[8-9]。LAMP的扩增产物可以采用琼脂糖凝胶电泳、浊度分析法、HNB指示剂法进行检测[9]。由于其产物是大小长短不一的重复序列,因此可以观察到大小不同的阶梯条带;又因为从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物(焦磷酸镁)形成乳白色沉淀,可通过肉眼观察判定扩增与否[10],也可以通过加入SYBR GreenⅠ[11]、GeneFinder[11]等核酸染料进行终点直接观察。反应能在1 h内完成,具有快速、简易、高特异性及不依赖于昂贵检测设备等优点[12]。如Yano等[13]使用LAMP对肠毒素大肠杆菌进行检测;Zhong等[14]使用LAMP对临床样本中的人类乳头状瘤病毒进行检测;Ferrara等[15]使用LAMP法对纯培养的青霉菌进行检测。然而通过LAMP方法同时利用反硝化酶的功能基因nirS、nirK和nosZ快速筛选反硝化菌株的研究报道尚未见到。为此,本研究通过选择nirS基因、nirK基因和nosZ基因作为靶序列[16]设计小于500 bp特异性LAMP引物,结合PCR验证和产气检测,建立了快速、简便的产N2好氧反硝化菌筛选方法,从运行良好的海水养殖循环水系统的生物滤池中分离筛选到了5株性能良好的目标反硝化菌株,旨在为污废水的脱氮治理提供一种高效、便捷的好氧反硝化菌株筛选方法和菌种资源。
1 材料与方法 1.1 材料 1.1.1 样品来源样品于2018年10月取自位于青岛市即墨区的中国科学研究院黄海水产研究所水产遗传育种基地的南美白对虾种虾培育系统的生物滤池。该滤池对氨氮和亚硝酸氮的去除效果良好,使养殖系统的氨氮和亚硝酸氮维持在0.2 mg/L以下。取滤池水样和挂膜材料分别置于100 mL血清瓶中,低温保存,快速带回实验室。
1.1.2 主要试剂和仪器试剂:TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒、LAMP体系试剂购自纽英伦生物技术(北京)有限公司、PCR试剂购自北京博迈德科技发展有限公司;所用国产化学药品均为分析纯,采购于国药集团。仪器:SIGMA 3-18K高速冷冻离心机(Sigma,德国);梯度PCR仪(Eppendorf,德国);MF-chemiBIS 3.2化学发光型凝胶成像系统(DNR,以色列);超微量核酸蛋白分析仪(Biodropsis Bo-1000,北京五洲东方科技发展有限公司);testo 510数字式压差仪(0-100 hPa,德国仪器国际贸易(上海)有限公司)。
1.2 方法 1.2.1 培养基富集培养基:参照孙雪梅[1]并有所改进:MgSO4·7H2O 0.1 g,NaH2PO4 0.2 g,K2HPO40.5 g,CaCO31 g,FeSO40.1 g,NaNO32.47 g,(NH4)2SO42 g,葡萄糖(孔径0.22 μm滤膜过滤灭菌)1.25 g,过滤后的陈海水1 000 mL(固体培养基则加入2%琼脂粉),pH 7.4-7.8,121℃高压蒸汽灭菌20 min。
分离培养基[17]:KNO3 1.2 g、柠檬酸钠5 g,K2HPO4 1 g,KH2PO4 1 g,MgSO4·7H2O 0.2 g,微量元素[18](EDTA 2.06 g,FeSO4·7H2O 1.54 g,MnCl·4H2O 0.2 g,ZnSO4·7H2O 0.1 g,CuSO4·5H2O 0.02 g,Na2MnO4 0.1 g,CoCl·6H2O 2 mg,蒸馏水1 000 mL)2 mL,蒸馏水1 000 mL(固体培养基则加入2%琼脂粉),pH 7.4-7.8,121℃高压蒸汽灭菌20 min。
产气测试培养基[19]:柠檬酸钠5 g,K2HPO4 1 g,KH2PO4 1 g,MgSO4·7H2O 0.2 g,微量元素2 mL,KNO3 1.2 g,KNO2 1.2 g,(NH4)2SO4 0.008 g,蒸馏水1 000 mL(固体培养基则加入2%琼脂粉),pH 7.4-7.8,121℃高压蒸汽灭菌20 min。
反硝化能力测试培养基[19]:柠檬酸钠5 g,K2HPO4 1 g,KH2PO4 1 g,MgSO4·7H2O 0.2 g,微量元素2 mL,KNO31.2 g,蒸馏水1 000 mL,pH 7.4-7.8。121℃高压蒸汽灭菌20 min。亚硝酸氮去除测试培养基则将KNO3分别替换为KNO2,各形态氮含量为50 mg/L,其余条件不变。
1.2.2 菌株富集与分离将带回实验室的水样恒温振荡30 min,在无菌条件下,将40 mL无菌海水加入盛挂膜材料的血清瓶中,恒温振荡1 h,然后取10 mL接入到90 mL无菌0.85%的生理盐水中,恒温振荡15 min。
取10 mL振荡液接种于液体富集培养基中,于28℃、180 r/min好氧条件下振荡培养5 d,重复转接3-4次后,取10 mL富集液进行系列梯度稀释,取适当倍数稀释液100 μL均匀涂布于分离培养基上,放于28℃恒温培养箱,培养48-72 h,根据菌落特征挑选不同形态的单菌落进行平板划线分离,重复划线分离4-5次,直至得到纯的单菌落,13株候选菌株分别编号为KFDX1、KFDX2、KFDX3、KFDX4、KFDX5、KFDX6、KFDX7、KWDX1、KWDX2、KWDX3、FJ3-1、FJ3-2和FJ6-1。
1.2.3 好氧反硝化菌株的LAMP初步筛选基因组DNA提取,取分离到的13株菌株的保存菌种分别加入到2216E液体培养基中,28℃、150 r/min条件下过夜培养。取培养液进行DNA提取,方法按照TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒说明书的方法。将得到的基因组DNA片段,使用微量DNA定量仪进行DNA浓度和纯度的检测,然后将产物进行分装,用于后续实验。
LAMP引物设计,根据GenBank公布的nirS(序列号:BAK92488.1)基因、nirK(序列号:AP012279.1)基因和nosZ(序列号:KT877014.1)基因序列,应用引物设计软件Primer Explorer V4(http://primerexplorer.jp/elamp4.0.0)设计多组基因nirS、nirK和nosZ的LAMP引物,经优化后,选用引物序列见表 1,然后由金唯智生物科技有限公司进行引物合成。
LAMP反应体系,低温条件下,先将样品模板与引物充分混合。然后,配制扩增反应体系如下:10×等温扩增反应缓冲液2.5 μL、MgSO4(100 mmol/L)1.5 μL、dNTP Mix(10 mmol/L)3.5 μL、FIP/BIP Primers(25×)1 μL、F3/B3 Primers(25×)1 μL、Bst 2.0 DNA聚合酶(8 000 U/mL)1 μL、DNA Sample 1 μL、灭菌水补充至25 μL,再将10×GeneFinderTM核酸染料4 μL点在离心管盒盖内侧用封口膜封口,放置60℃恒温水浴锅中反应60 min。检测过程中以特定的反硝化标准菌株作为阳性对照,以ddH2O代替菌株作为阴性对照。
LAMP扩增产物的检测,对扩增后的LAMP扩增产物采用添加GeneFinderTM核酸染料显色液进行直接观察的方式:水浴60 min后,将盒盖上的染料轻轻弹下混匀后,用肉眼直接观察颜色变化,呈荧光绿的为阳性,仍呈橙色的为阴性。
1.2.4 菌株的PCR二次筛选为了防止通过LAMP筛选的含nirS基因或nirK基因和nosZ基因的反硝化菌株存在假阳性,而采用PCR进行进一步验证和筛选。PCR引物为nirS-3F:5'-CCGCACCCGGGBCG -YGG -3';nirS-6R:5'-CGTTGAACTTRCCGGT -3'[18];nirK-1F:5'- GGMATGGTKC -CSTGGCA-3';nirK-5R:5'- GGMATGGTKCCSTGGCA-3'[19];nosZ-F:5'-CGYTGTTCMTCGA- CAGCCAG-3';nosZ-1622R:5'-CGCRASGGCAASAAGGTSCG -3'[18]。反应体系(50 μL)为:Premix LA Tap 25 μL、Primers(25×)0.4 μL、模板2 μL、ddH2O补充至50 μL。PCR程序如下:94℃预变性3 min,94℃变性30 s,55℃退火30 s,:72℃延伸30 s;循环30次,最后72℃延伸5 min,4℃保存。PCR产物进行2%琼脂糖凝胶电泳,然后在凝胶成像系统观察拍照。
1.2.5 菌株的产气检测三次筛选将二次筛选出来的反硝化菌株接种到500 mL反硝化能力测试培养基,然后将锥形瓶放进带有气体表盘和接有实时监测气体数据的显示器的密闭性testo 510数字式压差仪气罐中,28℃,150 r/min振荡培养48 h。每间隔12 h观察一次N2气体产生情况,然后总结最后筛选结果。
1.2.6 菌株的反硝化性能测定在含有1.0 g/L葡萄糖(过滤灭菌)的条件下、保持氮添加量为50 mg/L的水平,分别配制亚硝酸氮和硝酸氮的去除测试液,每组做3个平行。取对数生长期菌液将接种量控制在1. 8 × 106 - 1. 9 × 106 CFU/mL范围内,置于28℃、150 r/min振荡培养.每隔12 h取一次样,测定NO2-N和NO3-N的值,每次同时测定各测试液的OD600值。
无机氮的分析方法参照《海洋监测规范》(GB17378. 4-2007)[1],亚硝酸氮的测定采用盐酸萘乙二胺分光光度法;硝酸氮的测定采用锌-隔还原法。菌体生长量采用吸光度法,用可见分光光度计于600 nm处测量吸光度值(OD600)。
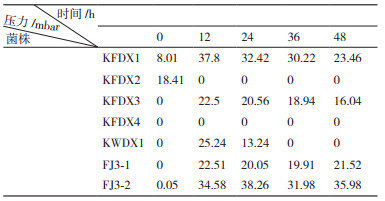
2 结果 2.1 菌株的LAMP初步筛选利用建立的LAMP方法对分离获得的13株反硝化候选菌株进行初步筛选。如图 1-A所示,由nirS基因作为靶基因的LAMP体系反应产物与GeneFinderTM核酸染料反应后,可以发现其中菌株KFDX1、KFDX2、KFDX3、KFDX4、FJ3-1和FJ3-2颜色变为荧光绿,结果为阳性;其余7株反应液颜色为橙色,结果为阴性。如图 1-B所示,由nirK基因作为靶基因的LAMP体系反应60 min后,可以观察有菌株KFDX1、KFDX2、KFDX3、KFDX4、KWDX1、FJ3-1和FJ3-2等7株颜色变为荧光绿,结果为阳性;6株筛选的反硝化菌株反应液颜色为橙色,结果为阴性。如图 1-C所示,由nosZ基因作为靶基因的LAMP体系反应产物的颜色变化,其中,菌株KFDX1、KFDX2、KFDX3、KWDX1和FJ3-2等5株颜色变为荧光绿,结果为阳性;其余8株为橙色,结果为阴性。通过LAMP法对3种反硝化相关基因的检测结果,可看出菌株KFDX1、KFDX2、KFDX3、KWDX1和FJ3-2同时含有nirS或nirK和nosZ基因,可初步认定为反硝化菌。

|
| 1:空白对照;2:菌株KFDX1;3:菌株KFDX2;4:菌株KFDX3;5:菌株KFDX4;6:菌株KWDX1;7:菌株FJ3-1;8:菌株FJ3-2;9:菌株F6-1;10:菌株KWDX2;11:菌株KWDX3;12:菌株KFDX5;13:菌株KFDX6;14:菌株KFDX7 图 1 分别以nirS、nirK、nosZ基因为靶基因的LAMP产物直接观察结果 |
为了进一步验证LAMP法筛选的菌株的准确性,以上述初步筛选出的菌株的DNA为模板,分别用PCR引物进行PCR验证。分别由nirS基因、nirK基因、nosZ基因作为靶基因的PCR体系反应产物琼脂糖凝胶电泳检测结果如图 2所示。
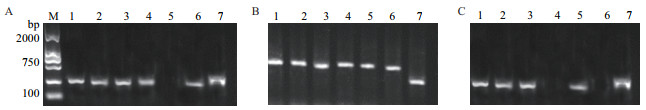
|
| M:2 000 bp marker;1:菌株KFDX1;2:菌株KFDX2;3:菌株KFDX3;4:菌株KFDX4;5:菌株KWDX1;6:菌株FJ3-1;7:菌株FJ3-2 图 2 以初筛菌株nirS、nirK、nosZ基因为靶基因的PCR产物的电泳结果 |
由nirS基因作为靶基因的检测结果(图 2-A)显示:7株菌株中,KFDX1、KFDX2、KFDX3、KFDX4、FJ3-1、FJ3-2等6株菌株有清晰条带,表明该6株菌株含有nirS基因。与LAMP体系的结果一致。由nirK基因作为靶基因的检测结果(图 2-B)显示:7株菌株都有清晰条带,该结果表明7株菌株都含有nirK基因。与由nirK基因作为靶基因LAMP体系的结果一致。由nosZ基因作为靶基因的检测结果(图 2-C)显示:7株菌株中,只有KFDX1、KFDX2、KFDX3、KWDX1和FJ3-2等5株菌株有清晰条带,表明该5株菌株含有nosZ基因。与由nosZ基因作为靶基因LAMP的结果一致。采用PCR验证结果显示,阳性菌与通过LAMP方法筛选的结果一致。由此证明,本研究构建的LAMP筛选体系简单、快速、经济有效且特异性高灵敏度强,可以用于快速筛选目标菌株。
2.3 反硝化菌株的产气检测筛选将初步筛选到的7株菌株接种到500 mL产气测试培养基中,然后将锥形瓶放进带有气体表盘和接有实时监测气压数据的显示器的密闭性testo 510数字式压差仪气罐中,28℃,150 r/min振荡培养48 h。结果如表 2所示,菌株KFDX1、KFDX2、KFDX3、KWDX1、FJ3-1和FJ3-2等6株菌株有气体产生。
综合3步筛选,确认KFDX1、KFDX2、KFDX3、KWDX1和FJ3-2为目标产N2的好氧反硝化菌株。
2.4 菌株的反硝化性能测试结果将7株菌在添加葡萄糖、以亚硝酸钾为氮源的测试液中连续培养72 h,如图 3-A所示,除菌株KFDX1的OD600值一直在0.5左右,其余菌株生长迅速,12 h即达到对数生长期,亚硝酸氮浓度迅速下降,如图 3-B所示,7株菌对亚硝酸氮的去除均降到1 mg/L以下,7株菌株对亚硝酸氮的去除速率均在3.8 mg/(L·h)以上。随着菌体的繁殖,48 h之后菌体生长缓慢,亚硝酸氮去除速率变慢,开始趋于平缓;72 h后,7株菌株均将亚硝酸氮降到0.5 mg/L以下,去除率高达99%。其中,菌株KFDX2去除最快,速率为3.91 mg/(L·h)、,72 h后达到最大去除率为99.04%;菌株KWDX1次之,去除速率为3.90 mg/(L·h)、72 h后最大去除率为99%;菌株FJ3-1去除速率最低,为2.63 mg/(L·h)、36 h后最大去除率也达到了99%。数据表明,筛选出含nosZ基因的菌株KFDX1、KFDX2、KFDX3、KWDX1和FJ3-2对亚硝酸氮的降解效果和降解速率都优于不含nosZ基因的菌株KFDX4、FJ3-1。

|
| 图 3 七株菌在亚硝酸氮环境中的菌量变化和去除效果 |
将7株菌在添加葡萄糖、以硝酸钾为氮源的测试液中连续培养72 h,如图 4-A、图 4-B所示,12 h后,KFDX3、KFDX4、FJ3-1、FJ3-2菌体迅速生长,菌株KFDX1、KFDX2 12 h后才快速生长并迅速去除硝酸氮。菌株KFDX1、KFDX2、KFDX3、KFDX4、FJ3-2对硝酸氮的最大去除速率分别可达到2.1633 mg/(L·h)、3.824 mg/(L·h)、3.773 7 mg/(L·h)、4.031 2 mg/(L·h)、3.595 8 mg/(L·h)。12-48 h内,菌体生长达到平台期,对硝酸氮的利用也趋于平缓。KFDX1、KFDX2、KFDX3、KWDX1、FJ3-2对硝酸氮的去除效果良好,去除率高达90%以上。其中菌株FJ3-2对硝酸氮12 h的降解率最大为98.02%,去除速率为3.595 8 mg/(L·h);另外发现筛选出来的含nosZ基因的菌株KFDX2、KWDX1和FJ3-2对硝酸氮浓度的降解效果和降解速率优于不含nosZ基因的菌株FJ3-1。有趣的是菌株KFDX1、KFDX2、KWDX1和FJ3-1测试液中硝酸盐氮浓度先上升,后下降,其原因有待进一步研究。
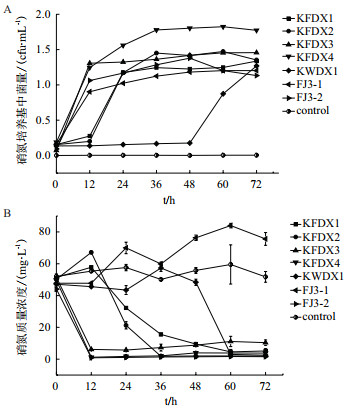
|
| 图 4 七株菌在硝酸氮环境中的菌量变化和去除效果 |
常规的反硝化菌的筛选大多是通过设计运行能提供兼性厌氧条件的生物反应器辅助底物测定,周丹丹等[20]通过污泥驯化、测总氮和氮元素轨迹跟踪法筛选好氧反硝化细菌;梁贤等[21]从驯化成熟的SBR反应器中筛选反硝化菌株。也有报道是通过普通的培养基和温度条件加以PCR检测筛选反硝化菌株;冯雅丽等[22]通过富集分离从深海沉积物中筛选出反硝化菌。熊焰等[23]从养殖水体中通过常规检测和16S rRNA序列分析鉴定反硝化菌株。这些研究方法都需要繁琐的实验过程、特定严格的实验环境、昂贵专业的实验仪器,不利于实现快速、准确筛选。合适的DNA靶标序列是分子鉴定和检测的基础[24],本研究在好氧富集、分离的基础上,基于反硝化系列酶编码基因nirS、nirK和nosZ的序列,建立了筛选好氧反硝化菌株的LAMP初筛技术和产气检测二筛技术。由于直接针对反硝化反应最后一步需要的氧化亚氮还原酶编码基因—nosZ基因的序列,设计了LAMP特异引物,可以直接筛选到产N2的反硝化菌株,避开了产温室气体NO2或N2O的反硝化菌株。同时该体系只需要在60℃下恒温条件下反应1 h,而且反应结果通过添加核酸染料,用肉眼直接观察颜色的变化再加上简单的压差仪可直接测出气体的产生,不需要任何专业的精密的仪器如PCR仪、气相色谱等昂贵的仪器[24]。因此本研究建立的LAMP反应体系可实现快速筛选,操作方便、经济、灵敏[25],可以更高效、更准确地筛选好氧反硝化菌株,用于工业废水、生活污水及水产养殖高氮水的净化,为今后反硝化菌株的研究提供了便捷的途径,丰富了脱氮处理污废水的理论,推动好氧反硝化细菌的分离及其反硝化性能的研究与应用[26-27]。
好氧反硝化细菌的分离及其反硝化性能的研究与应用得到了迅速发展[26-27],了解好氧反硝化细菌的反硝化特性利于反硝化的深入研究,进而可以优化污废水生物脱氮工艺、优化升级水产养殖产业。熊焰等[23]分离筛选的反硝化菌SZ-3在28℃、96 h对亚硝酸氮的降解率为91.78%;张峥[28]等从柳钢焦化废水A/O系统中筛选的好氧反硝化细菌f-3在36 h对硝酸氮去除率为92.85%,亚硝氮去除率为68.45%。而本研究从南美白对虾种虾培育系统的生物滤池通过LAMP方法筛选出5株好氧反硝化菌,在好氧条件下24 h对亚硝酸氮去除率就达到了99%,硝酸氮去除率为90%。最高去除速率可分别达到3.91为mg/(L·h)、4.0312 mg/(L·h);明显高于前述已报道的菌株。实验表明利用LAMP方法以是否含有nosZ基因作为标准筛选出来的含nosZ基因的菌株KFDX1、KFDX2、KFDX3、KWDX1和FJ3-2对亚硝酸氮和硝酸氮的降解效果和降解速率优于不含该基因的菌株KFDX4、FJ3-1;同时,在实验中发现,菌株KFDX4对硝酸氮的去除率很高,但未检测到nosZ基因,也不产气,可能是通过同化作用利用了硝酸氮,而不是反硝化反应;菌株FJ3-1中未检测到nosZ基因,但检测到有气体产生,可能该菌株是产NO2或N2O的反硝化菌株。另外,菌株FJ3-1等在硝态氮环境里不利用硝态氮,反而促进硝态氮浓度的升高,其原因还需要进一步研究。
虽然环介导等温扩增具有诸多优点,但是,由于LAMP具有极高的灵敏性,极易产生假阳性,所以在实验的过程中必须保证无菌环境,减少空气中气溶胶的产生。本试验在无菌条件下一次性完成,将GeneFinderTM核酸染料点在离心管的内盖上,然后离心管用封口膜封好,待反应结束后不打开反应管的盖子,将事先加在盒盖上的染料轻轻弹下,直接观察颜色变化,避免了气溶胶扩散到空气中,为后续LAMP反应试验创造无菌环境,减少因假阳性结果出现而影响LAMP检测结果的准确性[29-30]。
4 结论建立的LAMP体系在60℃下反应60 min,通过GeneFinderTM核酸染料染色直接观察法从南美白对虾种虾培育系统的生物滤池中快速准确地筛选出7株同时含有nirS基因或nirK基因和nosZ基因的好氧反硝化菌株KFDX1、KFDX2、KFDX3、KFDX4、KWDX1、FJ3-1和FJ3-2;再进行PCR验证和产气测试,最终确定5株可产N2的好氧反硝化菌KFDX1、KFDX2、KFDX3、KWDX1和FJ3-2。
筛选出来的含nosZ基因的菌株KFDX1、KFDX2、KFDX3、KWDX1和FJ3-2对亚硝酸氮和硝酸氮的降解效果良好,对NO2-N和NO3-N的去除率分别达到99%和90%以上,最大去除速率分别可高达4.9 mg/(L·h)和4.03 mg/(L·h)。降解速率优于不含该基因的菌株KFDX4、FJ3-1。
| [1] |
孙雪梅, 李秋芬, 张艳, 等. 一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J]. 微生物学报, 2012, 52(6): 687-695. |
| [2] |
梁丽华, 左剑恶. 反硝化功能基因--检测反硝化菌种群结构的分子标记[J]. 微生物学通报, 2009, 36(4): 627-633. |
| [3] |
陈茂霞, 王欢, 周后珍, 等. 异养硝化-好氧反硝化菌HN-02的筛选及其特性[J]. 应用与环境生物学报, 2013, 19(4): 688-693. |
| [4] |
连红民, 邱忠平, 何昆明, 等. 一株好氧反硝化-异养硝化菌的筛选及脱氮特性研究[J]. 生物技术通报, 2015, 31(6): 138-143. |
| [5] |
魏利, 马放, 苏俊峰, 等. 基于nirS基因的反硝化细菌快速定量检测[J]. 哈尔滨工业大学学报, 2008, 40(10): 1563-1565. DOI:10.3321/j.issn:0367-6234.2008.10.011 |
| [6] |
杨平, 杨迎伍, 陈伟, 等. 食品中4种致病微生物的多重PCR快速检测技术研究[J]. 西南大学学报:自然科学版, 2007(05): 90-94. |
| [7] |
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [8] |
Wang Y, Wang Y, Lan R, et al. Multiple endonuclease restriction real-time loop-mediated isothermal amplification[J]. The Journal of Molecular Diagnostics, 2015, 17(4): 392-401. DOI:10.1016/j.jmoldx.2015.03.002 |
| [9] |
付振芳, 汪小福, 徐俊锋, 等. 环介导等温扩增终端产物检测及结果判断的研究进展[J]. 浙江农业科学, 2016, 57(5): 725-729. |
| [10] |
曹以诚, 石磊, 陈洵, 等.基于环介导等温扩增技术的嗜肺军团菌基因快速诊断试剂盒及其检测方法: 中国, CN101654706 A[P].2008-11-12.
|
| [11] |
陈云娇, 陈莉敏, 美亮, 等. 核酸染料Genefinder使用方法的比较[J]. 生物技术, 2011, 21(5): 66-68. DOI:10.3969/j.issn.1004-311X.2011.05.129 |
| [12] |
黄鹤, 李应国, 肖进文, 等. 羊痘病毒环介导等温扩增(LAMP)检测方法的建立[J]. 中国畜牧兽医, 2012, 39(6): 72-75. DOI:10.3969/j.issn.1671-7236.2012.06.017 |
| [13] |
Yano A, Ishimaru R, Hujikata R. Rapid and sensitive detection of heat-labile Ⅰ and heat-stable Ⅰ enterotoxin genes of enterotoxigenic Escherichia coli by Loop-Mediated Isothermal Amplification[J]. Journal of Microbiological Methods, 2007, 68(2): 414-420. DOI:10.1016/j.mimet.2006.09.024 |
| [14] |
Zhong Q, Li K, Chen D, et al. Rapid detection and subtyping of human papillomaviruses in condyloma acumination using loop-mediated isothermal amplification with hydroxynaphthol blue dye[J]. British Journal of Biomedical Science, 2018, 75(3): 1-6. DOI:10.1080/09674845.2017.1411864 |
| [15] |
Ferrara M, Perrone G, Gallo A, et al. Development of loop-mediated isothermal amplification (LAMP) assay for the rapid detection of Penicillium nordicum in dry-cured meat products[J]. International Journal of Food Microbiology, 2015, 202: 42-47. DOI:10.1016/j.ijfoodmicro.2015.02.021 |
| [16] |
Throbäck IN, Enwall K, Jarvis A, et al. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J]. Fems Microbiology Ecology, 2010, 49(3): 401-417. DOI:10.1016/j.femsec.2004.04.011 |
| [17] |
孔庆鑫, 李君文, 王新为, 等. 一种新的好氧反硝化菌筛选方法的建立及新菌株的发现[J]. 应用与环境生物学报, 2005, 11(2): 95-98. |
| [18] |
杨浩锋, 唐佳玙, 胡安辉, 等. 一株反硝化细菌的分离鉴定及其反硝化特性[J]. 环境工程学报, 2014, 8(1): 366-371. |
| [19] |
Braker G, Fesefeldt A, Witzel K P. Development of PCR primer systems for amplification of nitrite reductase genes (nirK and nirS) to detect denitrifying bacteria in environmental samples[J]. Applied & Environmental Microbiology, 1998, 64(10): 3769-3775. |
| [20] |
周丹丹, 马放, 王弘宇, 等. 关于好氧反硝化菌筛选方法的研究[J]. 微生物学报, 2004, 44(6): 837-839. DOI:10.3321/j.issn:0001-6209.2004.06.030 |
| [21] |
梁贤, 任勇翔, 杨垒, 等. 异养硝化-好氧反硝化菌YL的脱氮特性[J]. 环境科学, 2015, 36(5): 1749-1756. |
| [22] |
冯雅丽, 李洪珊, 李浩然. 一株深海反硝化菌的分离鉴定及反硝化特性研究[J]. 环境污染与防治, 2016, 38(12): 27-30. |
| [23] |
熊焰, 刘力源, 罗睿, 等. 1株亚硝酸盐降解菌的筛选、鉴定、降解条件及效果[J]. 中国水产科学, 2010, 17(6): 1264-1271. |
| [24] |
刘星彤, 林柏荣, 廖金铃, 等. 环介导等温扩增法(LAMP)检测最短尾短体线虫[J]. 华中农业大学学报, 2018, 37(06): 23-30. |
| [25] |
Dhama K, Karthik K, Chakraborty S, et al. Loop-mediated isothermal amplification of DNA (LAMP):a new diagnostic tool lights the world of diagnosis of animal and human pathogens:a review[J]. Pak J Biol Sci, 2014, 17(2): 151-166. DOI:10.3923/pjbs.2014.151.166 |
| [26] |
Pai SL, Chong NM, Chen CH. Potential applications of aerobic denitrifying bacteria as bioagents in wastewater treatment[J]. Bioresource Technology, 1999, 68(2): 179-185. DOI:10.1016/S0960-8524(98)00140-0 |
| [27] |
Kong QX, Wang XW, Jin M, et al. Development and application of a novel and effective screening method for aerobic denitrifying bact-eria[J]. FEMS Microbiol Lett, 2006, 260(2): 150-155. DOI:10.1111/j.1574-6968.2006.00306.x |
| [28] |
张峥, 黄家富, 覃华静, 等. 一株好氧反硝化菌的筛选及其脱氮性能研究[J]. 广西科技大学学报, 2018, 29(4): 50-56, 61. |
| [29] |
Nagamine K, Hase T, Notomi T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Mol Cell Probes, 2002, 16(3): 223-229. DOI:10.1006/mcpr.2002.0415 |
| [30] |
Fu S, Qu G, Guo S, et al. Applications of loop-mediated isothermal DNA amplification[J]. Applied Biochemistry and Biotechnology, 2011, 163(7): 845-850. DOI:10.1007/s12010-010-9088-8 |