2. 中山大学医学院,广州 510000
2. School of Medicine, Sun Yat-sen University, Guangzhou 510000
高密度集约化的池塘养殖模式常会引起水质污染,特别是水体氨氮、硝态氮和亚硝态氮等严重超标,对水生动物有直接且严重的毒害作用,造成经济巨大损失[1-5]。针对现阶段养殖池塘的严重问题,生物脱氮是一种有效途径[6]。传统生物脱氮一般认为硝化作用是好氧的自养过程,反硝化作用是严格或兼性厌氧的异养过程[7],使得需要单独设置缺氧单元,增加成本和管理难度。
20世纪80年代,Robertson等[8]报道了好氧反硝化细菌和好氧反硝化酶系存在,可在有氧条件下进行硝化和反硝化过程。后来研究者们从污水处理设施、鱼塘、稻田等环境中分离出好氧反硝化菌[9-10]。Srinandan等[11]从污水处理厂污泥样品中分离出高效反硝化功能的丛毛单胞菌属(Comamonas sp.)和假单胞菌(Pseudomonas sp.);成钰等[12]从刺参养殖环境中分离出具有异养硝化和好氧反硝化的花津滩芽孢杆菌(Bacillus hwajinpoensis);王田野等[13]从长期施用农家肥的土壤中筛选出一株属不动杆菌(Acinetobacter sp.)的耐高氨氮脱氮菌株等[11-13]。这种新型脱氮菌株极大改良了传统生物脱氮的不足,异养硝化-好氧反硝化细菌已成为目前生物脱氮研究热点。但现阶段研究水平所分离的脱氮菌株,仍然具有如脱氮周期长,降氮形式单一等不足之处。
本实验在养殖池塘废水水样及底泥中,筛得一株具有高效降氮能力的异养硝化-好氧反硝化菌株,在实验室的条件下研究其生长规律及其脱氮特性,并对其进行初步种属鉴定,旨在为菌株将来应用到实际废水进行脱氮提供理论指导。
1 材料与方法 1.1 材料 1.1.1 实验样品广东省广州市西朗珠江水产所养殖池池水及底泥。
1.1.2 培养基BTB培养基[14](g/L):KH2PO4 1.5 g,MgSO4·7H2O 0.01 g,Na2HPO4 7.9 g,柠檬酸钠5.66 g,NaNO3 0.8415 g,NH4Cl 0.192 g,NaNO2 0.362 g,微量元素溶液2 mL,BTB溶液1 mL,琼脂25 g,H2O 1 000 mL,pH 7.0-7.5;反硝化培养基(g/L):KNO3 0.53 g,柠檬酸钠3.0 g,KH2PO4 0.25 g,Na2HPO4 0.3 g,MgSO4·7H2O 1 g,琼脂20 g,H2O 1 000 mL,pH 7.0;牛肉膏蛋白胨硝酸盐培养基[15](g/L):牛肉膏5 g,蛋白胨10 g,KNO3 1 g,NaCl 5 g,琼脂20 g,H2O 1 000 mL,pH 7.2-7.4;DM发酵培养基(g/L):KH2PO4 1.5 g,MgSO4·7H2O 0.01 g,Na2HPO4 7.9 g,柠檬酸钠5.66 g,微量元素溶液2 mL,NH4Cl 0.603 6 g(或NaNO3 0.959 0 g或NaNO2 0.375 g),H2O 1 000 mL,pH 7.2。
1.2 方法 1.2.1 菌株的分离纯化称取泥样10 g和水样10 mL分别用无菌水稀释制备成10-1稀释液,取0.1 mL在新鲜BTB、反硝化和牛肉膏蛋白胨硝酸盐培养基中涂布,28℃恒温培养2-3 d,挑取单菌落划线3-4次,镜检验纯并斜面保种于4℃冰箱。
1.2.2 脱氮性能菌株的初筛纯化菌株接种于BTB反硝化鉴定培养基培养1-2 d,根据生长情况和培养基颜色圈大小情况筛选出具有反硝化能力的菌株;再将筛得菌株接种异养硝化鉴定培养基于28℃,180 r/min培养2 d,利用格里斯试剂检测筛得具硝化能力的菌株。
1.2.3 脱氮性能菌株的复筛将1.3.2得到的菌株取3环活化斜面接种于营养肉汤以28℃,180 r/min恒温摇床培养1 d,测其OD600值,以1%接种量再接至以氨氮(NH4-N)、硝态氮(NO3-N)以及亚硝态氮(NO2-N)作为唯一氮源的DM发酵液中以28℃,180 r/min恒温摇床培养,于0 h、24 h和48 h取发酵液液测其OD600值,并以5 000 r/min,5 min离心处理,测氨氮(NH4-N)、硝态氮(NO3-N)以及亚硝态氮(NO2-N)的含量。
1.2.4 硝化性能及反硝化性能测定选择复筛后高性能菌株BB-17作为目标菌株,取斜面3环活化斜面接种于100 mL含氨氮(NH4-N)、硝态氮(NO3-N)以及亚硝态氮(NO2-N)作为唯一氮源的种液中以28℃,180 r/min恒温摇床中培养1 d并测其OD600值;再以1%的接种量接种于含对应种液不同氮源发酵液中以28℃,180 r/min恒温摇床中培养2 d。于0 h、6 h、12 h、18 h、24 h、30 h、36 h、42 h和48 h取样液测其OD600值,以5 000 r/min,5 min离心处理,取其上清液测其总氮(TN)、氨氮(NH4-N)、硝态氮(NO3-N)以及亚硝态氮(NO2-N)的含量。
1.2.5 氮素检测方法及去除率计算氨氮(NH4-H)采用纳氏试剂分光光度法(GB HJ535-2009)测定;硝态氮(NO3-N)采用紫外分光光度法(GB HJ/T346-200)测定;亚硝态氮(NO2-N)采用N-(1-萘基)-乙二胺二盐酸盐分光光度法(GB 7493-87)测定;总氮(TN)采用碱性过硫酸钾消解紫外分光光度法(GB HJ636-2012)测定。去除率的计算公式如下:
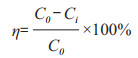
式中:C0表示0 h相应氮源浓度(mg/L),Ci表示发酵培养后某时间相应氮源浓度(mg/L)。每组设置3组平行,采用Excel对实验结果进行统计分析与绘图。
1.2.6 菌株形态学鉴定接种菌株到营养琼脂平板中28℃培养24 h,观察单菌落的生长情况,染色镜检观察菌体形态特征并拍照记录。
1.2.7 菌株16S rDNA分子鉴定以细菌基因组DNA为模板扩增其16S rDNA,扩增采用一对通用引物:上游引物(27F):5'-AGAGTTTGATCCTGGCTCAG-3';下游引物(1492R):5'-GGCTACCTTGTTACGACTT-3'。DNA模板提取采用TaKaRa Lysis Buffer for Microorg-anism to Direct PCR裂解酶,取20 μL于灭菌PCR管中,用灭菌枪头挑取单菌落至于管中搅动后取出,80℃金属浴15 min,低速离心取上清液作为模板。PCR反应体系(50 μL):上海翊圣生物2×HieffTM PCR Master Mix(With Dye)25.0 μL,上游引物和下游引物各2.5 μL,DNA模板5 μL,无酶水15 μL。PCR程序如下:(1)94℃预变性,5 min;(2)94℃变性,1 min;(3)55℃退火,1 min;(4)72℃延伸1.5 min;(5)72℃,8 min;(2)-(4)步循环30次。琼脂糖凝胶电泳(1×TBE电泳缓冲液,1%琼脂糖)分析PCR结果。PCR产物的纯化和测序由上海生物工程有限公司完成,测序结果通过ExBioCloud进行比对分析,并利用MEGA 7.0软件构建系统发育树。
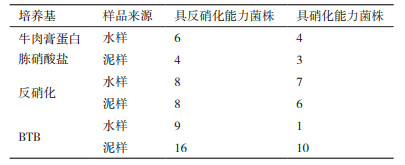
2 结果 2.1 分离纯化与初筛的菌株经3种筛选培养基分离纯化出的菌株的平板初筛,初步获得82株生长状态良好并具有利用培养基中氨氮、硝态氮和亚硝态氮的菌株。利用BTB反硝化鉴定培养基的显色反应,以及格力斯试剂检测颜色深浅情况,初步筛选具有反硝化能力的菌株共有51株,占筛选出细菌总数62.20%,而具有硝化能力的菌株共有31株,占筛选出细菌总数37.80%。其中,既具有反硝化能力又兼有硝化能力的菌株共有16株,占筛选出细菌总数19.51%。不同培养基分离纯化结果如表 1所示,牛肉膏蛋白胨硝酸盐培养基共筛得17株,占总数20.73%;反硝化培养基筛得29株,占总数35.37%;BTB培养基筛得36株,占总数43.90%。其中由BTB培养基筛得泥样的降氮能力数量最多。
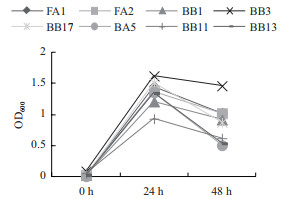
对2.1初筛获得菌株,以氨氮,硝态氮和亚硝态氮为唯一氮源进行脱氮能力测定。如图 1-3所示,其中大多数菌株在氨氮为唯一氮源的培养基中生长良好,大部分在24 h达到生物最大量并在48 h下降。由图 1和图 2可见,多数菌株在氨氮和硝态氮唯一培养基中生长良好,但相对其他两种氮源更多的菌株在单一亚硝态氮中生长较为缓慢。
|
| 图 1 不同菌株在氨氮为唯一氮原的培养基中的生长情况 |
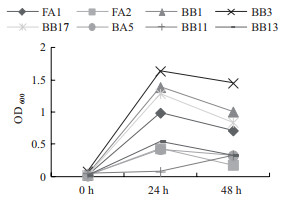
|
| 图 2 不同菌株在硝态氮为唯一氮原的培养基中的生长情况 |
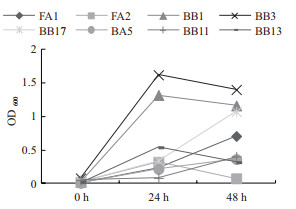
|
| 图 3 不同菌株在亚硝态氮为唯一氮原的培养基中的生长情况 |
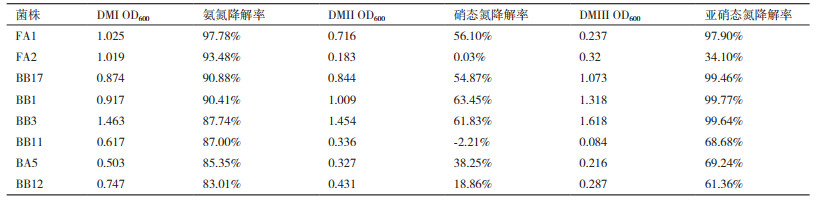
不同菌株的脱氮情况见表 2,筛得多数菌株能够高效利用氨氮和亚硝态氮,其中FA1、FA2、BB1和BB17在48 h能够对氨氮降解达到高于90%,BB1、BB17和BB3在48 h能够对亚硝态氮降解达到高于99%,相比菌株对于氨氮和亚硝态氮的利用,大多数菌株对硝态氮的去除能力不强,更多地表现为对氨氮或亚硝态氮的摄取降解。
在2.2所得到的复筛结果中,选择一株性能明显且高效的异养硝化-好氧反硝化菌株BB-17,进行以NH4Cl、NaNO3和NaNO2为唯一氮源的脱氮性能测定。
2.3.1 BB-17菌株对NH4Cl的脱氮特性以NH4Cl为唯一氮源,BB-17菌株生长状况及其脱氮特性如图 4所示。菌株在经历约6 h迟缓期后生长速度急剧上升进入对数期,在18 h时OD600到达生物最大量。18 h后菌量出现缓慢下降。在菌株迟滞期间,氨氮去除率趋于平缓,随着菌株进入生长对数期,氨氮去除率随后在6 h到18 h急剧上升,并达到最大值93.92%,此时氨氮浓度达到最低,在18 h后去除率开始缓慢下降。总氮去除率与OD600和氨氮去除率趋势基本一致,都体现为先升高,在第18 h到最大值68.96%,再降低,30 h后总氮去除率趋于平缓。由于菌株的硝化作用,将培养液中唯一氮源NH4Cl转化为亚硝酸盐和硝酸盐,菌株能够快速利用氨氮来自身合成生长所需物质,在18 h利用率达到最高,而氨氮浓度也达到最低。在后续生长过程中,亚硝酸盐的积累也可能影响菌株的生长,理化性质改变可能导致细菌自身大量分解,释放菌体内自身氮源,从而使总氮含量短时间内回升,总氮去除率下降。在30 h之后,培养液中总氮去除率相对处于平缓状态。
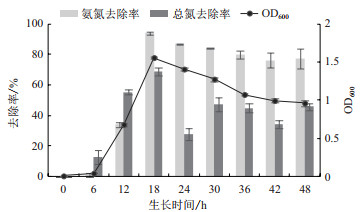
|
| 图 4 BB-17菌株在以NH4Cl为唯一氮源的培养基中的生长曲线及氨氮和总氮降解情况 |
以NaNO3为唯一氮源,BB-17菌株生长状况及其脱氮特性如图 5所示。菌株在经历约6 h迟缓期后,生长速度在6 h到12 h期间开始缓慢上升进入对数期,在12 h到18 h期间生长速度急剧上升并在18 h时OD600达到生物最大量。18 h后菌量缓慢下降,下降至36 h后呈现平缓。硝态氮降解率随着菌株进入对数期而升高,在0 h到18 h与OD600趋势大致相同,24 h后,硝态氮去除率趋于平缓,直到42 h又开始缓慢上升,在48 h达到最大去除率66.11%。总氮去除曲线与菌株生长曲线趋势基本一致,呈现为0 h到12 h升高到达降解最大值49.32%,12 h后缓慢下降,在42 h后出现回升。在以NaNO3唯一氮源培养基进行发酵培养,因菌株的反硝化作用,培养体系中有亚硝态氮生成,菌株需要再适应并后续利用其作为氮源合成营养物质,因而生长状态较为缓慢。
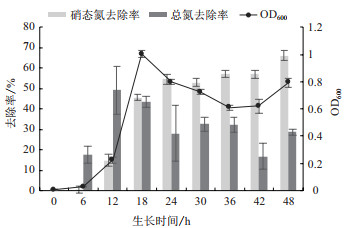
|
| 图 5 BB-17菌株在以NaNO3为唯一氮源的培养基中的生长曲线及硝态氮和总氮降解情况 |
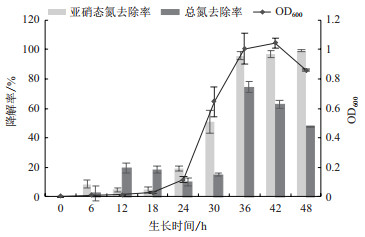
以NaNO2为唯一氮源,BB-17菌株生长状况及其脱氮特性如图 6所示。菌株在经历约18 h的迟缓期后,生长速度由18 h到24 h的缓慢上升,到24 h到36 h急速上升,并在36 h后生长速度减慢趋于稳定,在42 h时OD600达到生物最大量。42 h后菌量开始下降。亚硝态氮去除率曲线与生长曲线趋势大致相同,0 h到18 h趋于平缓,18 h到36 h去除率大快上升,36 h后趋于稳定,在48 h处达到最大值99.11%。总氮去除率与生长曲线趋势大致相同,呈现从0 h到36 h先升高达到最大值74.33%。36 h后总氮降解率开始下降。菌株适应期较长有可能是因为初始亚硝态氮浓度过高,后期由于菌株的反硝化作用,利用培养液中唯一氮源NaNO2,菌株适应环境后,能够快速利用亚硝态氮来自身合成生长所需物质。
|
| 图 6 BB-17菌株在以NaNO2为唯一氮源的培养基中的生长曲线及亚硝态氮和总氮降解情况 |
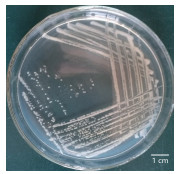
如图 7所示,BB-17在营养琼脂平板上为圆形米白色菌落,边缘整齐不透明,表面光滑湿润,具有黏性。
|
| 图 7 BB-17菌株平板菌落形态特征 |
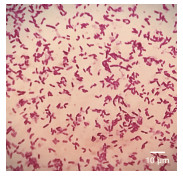
如图 8及图 9所示,BB-17经染色镜检为短杆菌,无芽孢革兰氏阴性,图中箭头所指即其端生鞭毛。
|
| 图 8 BB-17菌株单染色镜检图 |

|
| 图 9 BB-17菌株鞭毛染色镜检图(箭头所指即为鞭毛) |
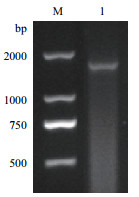
以细菌基因组DNA为模板,27F和1492R为上下游引物扩增其16S rDNA,并以不加入菌体DNA模板的PCR产物作为阴性对照,将PCR扩增产物进行琼脂糖凝胶电泳,结果见图 10,在1 500 bp左右处得到一条单一、明亮的条带。将PCR产物送至上海生工生物工程有限公司测序,所得序列经过EzBioCloud数据库比对分析,与Pseudomonas vancouverensis(AJ011507)具有98.41%同源性,可初步确定BB-17为假单胞菌属,并将其命名为Pseudomonas sp. BB17。
|
| M:分子量标准;1:BB-17菌株基因片段 图 10 BB-17菌株16S rDNA图谱 |
将Ezbiocloud数据库上与BB-17 16S rDNA序列比对具有最高相似度的Pseudomonas vancouverensis、P. moorei、P. umsongensis和P. mohnii等菌株通过MEGA 7.0软件构建系统发育树,结果如图 11所示。BB-17菌株与P. vancouverensis(AJ011507)在进化上具有较高的同源性,但由于其16S rDNA匹配度并不高,BB-17有可能是新菌种,但仍需结合形态学和生理生化特征进行进一步鉴定。

|
| 图 11 基于16S rDNA序列同源性构建BB-17菌株的系统发育树 |
异养硝化-好氧反硝化菌在自然界中广泛存在,现已在多种环境中分离纯化得到。根据本实验方法,在含氮养殖池水中分离筛选得到具有高性能异养硝化-好氧反硝化能力菌株,其中具有高效脱氮能力的细菌大多数在塘泥当中,在水中能够脱氮的细菌的数量较少。使用3种不同氮源组成的培养基以模拟多种不同氮源环境摇瓶测定脱氮性能,得到数量可观的高性能菌株。并以一株性能明显的BB-17菌株作为对象,测定该菌株在3种唯一氮源的培养基中发酵的脱氮性能,BB-17其对于总氮(TN)、氨氮(NH4-N)、硝态氮(NO3-N)以及亚硝态氮(NO2-N)4个指标均有良好的脱氮性能。结合形态学和16S rDNA序列比对的方法,初步鉴定BB-17菌株属于假单胞菌属(Pseudomonas sp.),并对该菌株命名为Pseudomonas sp. BB17。
本方法从养殖池塘筛得菌株具有高效脱氮能力。筛选得到的菌株在24 h左右达到生物最大量和最大脱氮率。其中高性能菌株BB-17具有优秀的高效脱氮性能。在发酵培养中,BB-17菌株在以NH4Cl为唯一氮源的DM培养基中生长速度最快,以NaNO3为唯一氮源其次,在以NaNO2唯一氮源的则生成速度较慢。BB-17在以NH4Cl为唯一氮源的DM培养基中氨氮去除情况在18 h达到最大值93.92%,而在以NaNO3为唯一氮源的DM培养基中硝态氮去除情况在48 h达到最大值66.11%,另外在以NaNO2为唯一氮源的DM培养基中亚硝态氮去除情况在48 h达到最大值99.10%,不同之处在于生长周期不同,氨氮培养基中BB-17在18 h达到单一氮源下的生物最大量,在硝态氮培养基中与氨氮培养基基本一致,但在亚硝态氮培养基中生长缓慢,约于42 h达到生物最大量。所得结果与牟东阳等从活性淤泥中分离筛选出P. sp. DK1情况类似,相比于沈辉等[17]从海洋分离得到的盐单胞菌属Halomonas和产碱杆菌属Alcaligenesx细菌和菜钰颖等[18]从活性污泥中所分离的生长周期约6 d的菌株,BB-17均有达到生物最大量时间短和脱氮率高等优点[16-18]。但在不同氮源中BB-17对于脱氮能力的表现并不相同。结合BB17的生长情况分析比较,原因可能是菌株对不同氮源的适应性不同,对不同氮源的利用能力也有所不同[19-21]。不同氮源培养基中总氮降解率的差距在于菌株对不同氮源适应性以及利用率的问题,也可能是菌株的硝化性能以及反硝化性周期规律性问题,同时也存在于培养体系因取样问题而减少,导致降氮情况有所改变也不排除培养体系减少而导致生长体系中营养物质减少、代谢废物过多的可能。综上所述,高性能菌株BB-17在初步摇瓶发酵探究其脱氮性能中,表现出优秀的特性,主要包括菌株生长速度快、脱氮周期短、降氮类型多样和降解能力强等优点,为后续应用于实际废水的脱氮研究提供重要的理论指导意义。
4 结论本研究从广州市西朗珠江水产所养殖池池水及底泥中分离纯化得到16株异养硝化好氧反硝化菌株,从中筛选得到1株高效脱氮的菌株BB-17。测定其在单一氮源培养基发酵的生长曲线和脱氮性能,显示菌株BB-17在28℃培养48 h,基本在6-24 h内到达生长对数期,其氨氮去除率在18 h可达93.92%,硝态氮去除率在48 h可达66.11%,亚硝态氮去除率在48 h可高达99.10%。经过鉴定BB-17为革兰氏阴性短杆菌,16S rDNA序列分析结果与Pseudomonas vancouverensis(AJ011507)比对具有98.41%同源性,确定BB-17为假单胞菌属并命名为Pseudomonas sp. BB17。
| [1] |
Townsend AR, Howarth RW. Fixing the global nitrogen problem[J]. Scientific American, 2010, 302: 64-71. DOI:10.1038/scientificamerican0210-64 |
| [2] |
Paerl HW, Gardner WS, Macarthy MJ, et al. Algal blooms:noteworth nitrogen[J]. Science, 2014, 346(6206): 175. |
| [3] |
Vitousek PM, Aber JD, Howarth RW, et al. Human alteration of the global nitrogen cycle:sources and consequences[J]. Ecological Applications, 1997, 7(3): 737-750. |
| [4] |
彭志兰, 柳敏海, 郭海波, 等. 一株高效好氧反硝化菌的分离与鉴定[J]. 上海海洋大学学报, 2015, 24(4): 632-639. |
| [5] |
李卫芬. 1株好氧反硝化菌的分离鉴定及反硝化特性研究[J]. 环境科学, 2011, 32(8): 2403-2408. |
| [6] |
孙锦宜. 含氮废水处理技术与应用[M]. 北京: 化学工业出版社, 2003.
|
| [7] |
Frette L, Gejlsbjerg B, Westermann P. Aerobic denitrifiers isolated from an alternating active sludge system[J]. FEMS Microbiology Ecology, 1997, 24: 363-370. DOI:10.1111/j.1574-6941.1997.tb00453.x |
| [8] |
Robertson LA, Kuenen JG. Aerobic denitrification:A controversy revived[J]. Archives of Microbiology, 1984, 139(4): 351-354. DOI:10.1007/BF00408378 |
| [9] |
Kundu P, Pramanik A, Dasgupta A, et al. Simultaneous heterotro-phic nitrification and aerobic denitrification by Chryseobacterium sp.R31 isolated from abattoir wastewater[J]. BioMed Research Internationa, 2014. DOI:10.1155/2014/436056 |
| [10] |
颜薇芝. 1株异养硝化好氧反硝化不动杆菌的分离及脱氮性能[J]. 环境工程学报, 2017, 11(7): 4419-4428. |
| [11] |
Srinandan CS, Shah M, Patal B, et al. Assessment of denitrifying bacterial composition in activated sludge[J]. Bioresource Technology, 2011, 102(20): 9481-9489. DOI:10.1016/j.biortech.2011.07.094 |
| [12] |
成钰, 李秋芬, 费聿涛, 等. 海水异养硝化-好氧反硝化芽孢杆菌SLWX2的筛选及脱氮特性[J]. 环境科学, 2016(37): 2681-2688. |
| [13] |
王田野, 魏荷芬, 胡子全, 等. 一株异养硝化好氧反硝化菌的筛选鉴定及其脱氮特性[J]. 环境科学学报, 2017(3): 946-953. |
| [14] |
战海. 一株好氧反硝化细菌的分离鉴定及反硝化能力初测[J]. 天津农学院学报, 2017, 24(2): 44-48. DOI:10.3969/j.issn.1008-5394.2017.02.012 |
| [15] |
丁梦娇. 植烟土壤中微生物特性及氨化、亚硝化菌分离鉴定与活性研究[J]. 中国生态农业学报, 2017, 25(10): 1444-1455. |
| [16] |
牟东阳, 靳鹏飞, 彭永臻, 等. 1株异养硝化-好氧反硝化细菌DK1的分离鉴定及其脱氮特性[J]. 环境科学, 2017, 38(11): 4763-4773. |
| [17] |
沈辉, 万夕和, 蒋葛. 两株海洋异养好氧硝化-反硝化细菌的筛选、鉴定及能力测试[J]. 应用与环境生物学报, 2017, 23(1): 157-163. |
| [18] |
菜钰颖, 商平, 魏丽娜, 等. 氨氮降解微生物菌株的分离筛选及去除效果初步研究[J]. 净水技术, 2008, 27(3): 44-47. DOI:10.3969/j.issn.1009-0177.2008.03.012 |
| [19] |
刘思雅. 高氨氮条件碳源对地衣芽孢杆菌(Dy)降氮的影响[J]. 江西农业大学学报, 2017, 39(5): 1002-1009. |
| [20] |
黄婧. 畜禽养殖污水中高效氨氮降解菌的筛选、鉴定及生长条件研究[J]. 环境工程学报, 2011, 8(5): 1779-1784. |
| [21] |
王有乐, 雷兴龙, 陈连军, 等. 土壤中好氧反硝化菌的分离及脱氮特性研究[J]. 环境工程学报, 2011, 5(8): 1902-1906. |