2. 北京中医药大学生命科学学院,北京 102488
2. School of Life Science, Beijing University of Chinese Medicine, Beijing 102488
亚硝酸盐是生态系统中氮循环的成分之一,也是微生物硝化作用和反硝化作用的中间产物。高浓度的亚硝酸盐对水生生物、哺乳动物及人类具有多种毒害效应[1-2],降低及控制亚硝酸盐含量是水处理工艺中的重要步骤。与物理法和化学法脱氮方式相比,生物法去除亚硝酸盐氮因具有高效、安全、成本低、无二次污染等优点,成为最常用的技术。反硝化细菌是去除环境中对生物有毒害作用亚硝酸盐的重要菌群,通过好氧或厌氧反硝化过程将硝酸盐或亚硝酸盐转化成一氧化二氮或氮气,从根本上解决水体中亚硝酸盐污染的问题[3-4]。好氧反硝化菌主要分离自活性污泥、废水、废水处理系统、土壤、海底沉积物等环境中[5],涵盖的种属类型多,有假单胞菌属(Pseudomonas)[6]、不动杆菌属(Acinetobacter)[7]、芽孢杆菌属(Bacillus)[8]、肠杆菌属(Enterobacter)[3]、海杆菌属(Marinobacter)[9]和苍白杆菌属(Ochrobactrum)[10]等。
反硝化细菌多在25-37℃范围内有较高的反硝化能力,而低温或高温均会影响菌株的生长和酶的活性。超过40℃,细菌的硝化和反硝化过程受到强烈抑制[3]。生产实际中,很多工业废水的温度都达到45℃以上,利用常规反硝化细菌处理,需将废水进行冷却处理。若直接用高温反硝化细菌处理高温废水,不仅省去高温废水冷却处理环节,减少设备投资,也提高了水处理效率。目前关于耐高温反硝化细菌的报道有限,在50℃高温条件下,反硝化细菌TAD1对初始浓度(113.58 mg/L)相同的硝酸盐氮去除率高出亚硝酸盐氮近4倍,对亚硝酸盐的脱氮率不足25%,最适的反硝化氮源为硝酸盐[11];菌株Bacillus licheniformis JH8可使250 mg/L亚硝酸盐的去除率达到97.63%[12],经温度梯度驯化的菌株Brevibacillus sp. XF-03可使NO2--N浓度由初始的100 mg/L降至4.9 mg/L,降解率达到95.1%[13],但这两株菌是否耐受更高浓度的亚硝酸盐未见报道;分离自集约化水产养殖废水中的菌株Bacillus megaterium S379在25-40℃范围内对320 mg/L亚硝酸盐的去除率均在70%以上,而45℃条件下仅为57.93%[14]。目前,已报道的耐高温反硝化细菌中缺少既耐高温又耐高浓度亚硝酸盐的细菌。因此,筛选耐高温耐高浓度亚硝酸盐且具有高效好氧反硝化能力的细菌对高温废水和烟气脱硝具有重要的理论意义和实践意义。
本研究从某水产养殖厂废水中筛选到菌株Y7,发现该菌株对亚硝酸盐的最大耐受浓度达到1 100 mg/L而且能耐受50℃高温,进一步利用单因子优化实验,确定了菌株Y7在高温下降解亚硝酸盐的最适条件。
1 材料与方法 1.1 材料 1.1.1 菌株本实验中的耐高温反硝化细菌菌株Y7,分离自某水产养殖厂的废水。
1.1.2 培养基富集培养基(g/L):(NH4)2SO4 1、丁二酸钠3.4、KNO3 0.5、MgSO4·7H2O 0.1、K2HPO4 1.5、MnSO4·4H2O 0.01、FeSO4·7H2O 0.01、NaCl 0.5、NaNO2 0.5。
筛选固体培养基(g/L):丁二酸钠3.4、KNO3 1、MgSO4·7H2O 0.1、K2HPO4 1.5、MnSO4·4H2O 0.01、FeSO4·7H2O 0.01、NaCl 0.5、1%BTB(溴百里酚蓝)1 mL,琼脂20。
LB培养基(g/L):蛋白胨10、酵母提取物5、NaCl 10。
发酵培养基(g/L):KH2PO4 0.5、K2HPO4 0.5、MgSO4·7H2O 0.2、CaCl2 0.1、NaCl 1、葡萄糖5、NaNO2 0.1。
1.2 方法 1.2.1 菌株的筛选、分离与鉴定将采自不同养殖厂的废水水样2 mL加入含有富集培养基的三角瓶中于30℃条件下170 r/min振荡培养48 h,连续富集培养两次后,取菌悬液用无菌生理盐水进行不同梯度稀释后在筛选平板上涂布,30℃条件下恒温培养2-3 d,挑取有蓝色晕圈的单菌落进行平板划线纯化,纯化后的菌株经LB培养基活化后转接到发酵培养基中进行发酵培养,离心取上清,利用N-(1-萘基)-乙二胺分光光度法测定残留的NO2--N含量[15],选择上清液中NO2--N浓度最低的菌株为目标菌株进行后续研究。
目标菌株Y7在LB固体平板上划线,30℃培养24 h,观察菌落形态。取单菌落接种在LB液体培养基中,30℃培养12 h,取菌液在光学显微镜下观察菌体显微形态。参照《常见细菌系统鉴定手册》[16]进行菌株Y7的生理生化鉴定。
挑取菌株Y7单菌落接种在LB液体培养基中30℃条件下170 r/min振荡培养12 h后,离心收集菌体,利用细菌DNA提取试剂盒(天根生化,北京)提取菌株Y7的基因组DNA,利用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行16S rRNA基因的PCR扩增,PCR反应条件为:95℃预变性5 min,30个循环(95℃ 1 min、53℃ 1 min、72℃ 1.5 min),延伸72℃ 10 min。用胶回收试剂盒(天根生化,北京)纯化大约1.5 kb的目的片段,将纯化后的PCR产物送至华大基因进行测序,将所得序列经NCBI网站的BLAST(http://www.ncbi.nlm.nih.gov/blast)进行在线比对分析,利用MEGA 5.0软件中的Neighbor-Joining方法构建系统发育树,确定菌株Y7的种属。
1.2.2 菌株Y7的反硝化性能研究挑取菌株Y7单菌落接于LB液体培养基中,30℃条件下170 r/min振荡培养24 h后,按2%的接种量转接于发酵培养基中进行发酵培养,分别在12 h、24 h取样,离心取上清液测定亚硝酸盐(NO2--N)含量,根据下式计算亚硝酸盐降解率。亚硝酸盐降解率(%)=(亚硝酸盐起始浓度-亚硝酸盐终浓度)/亚硝酸盐起始浓度×100%。
以对菌株生长和脱氮影响比较显著的碳源、亚硝酸盐浓度、初始pH、装液量、接种量、种龄、温度等为单因素变量,对菌株Y7的脱氮条件进行优化,除种龄优化外,其他因素中所转接的种子液均为活化24 h的菌液。碳源种类是将发酵培养基中的葡萄糖替换为如下碳源(蔗糖、可溶性淀粉、甘油、酒石酸钾钠、丁二酸钠);菌株Y7对NaNO2耐受程度设置为200、400、600、800和1 000 mg/L;用1 mol/L HCl和NaOH将培养基的初始pH分别调整为5.0、6.0、7.0、8.0和9.0;在250 mL三角瓶中的装液量分别设置为30、50、70、100和150 mL;将OD600=1.5的菌液按照1、3、5、7和10%(V/V)的量转接到优化的发酵培养基中;种龄分别设置为8、12、24和32 h;发酵温度分别设置为25、30、37、42和50℃。研究碳源种类的亚硝酸盐浓度为200 mg/L,研究pH、装液量的亚硝酸盐浓度为600 mg/L,研究接种量的亚硝酸盐浓度为800 mg/L,研究种龄的亚硝酸盐浓度为1 000 mg/L,研究温度的亚硝酸盐浓度为1 100 mg/L。
2 结果 2.1 菌株的筛选及鉴定经富集培养、平板初筛和摇瓶发酵培养测定菌株对亚硝酸盐降解率的复筛,最终确定一株降解NaNO2效果最好的菌株,编号为Y7。菌株Y7在LB固体培养基上划线,置于30℃培养1 d,菌落形态的结果如图 1-A所示,菌落近圆形,中间凸起、乳白色、边缘不规则,表面光滑有黏性。菌株Y7显微形态的结果如图 1-B所示,细胞呈细长杆状。菌株Y7的生理生化鉴定实验结果表明:接触酶、脲酶、蛋白酶、淀粉酶及纤维素酶为阳性;而脂酶、MR实验、VP实验均为阴性。
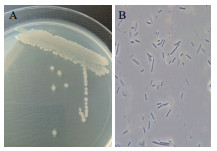
|
| 图 1 菌株Y7的菌落形态(A)和显微形态(B) |
以菌株Y7的基因组DNA为模板,以16S rRNA基因的通用引物进行PCR扩增,PCR产物经测序后获得1 450 bp的碱基序列,将该序列在NCBI网站进行BLAST同源序列比对,菌株Y7与Bacillus相似性高达99%,利用MEGA 5.0构建的系统进化树如图 2所示,菌株Y7与Bacillus subtilis菌株聚类在一起,故将菌株Y7命名为Bacillus subtilis Y7。
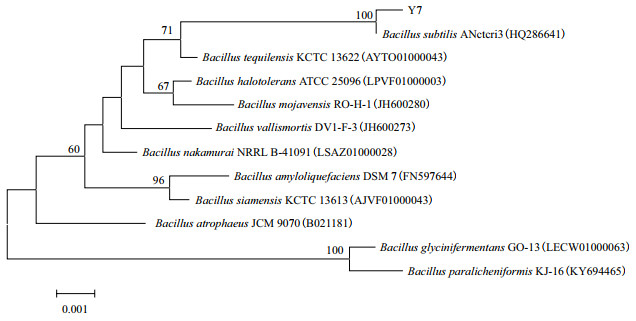
|
| 图 2 菌株Y7基于16S rRNA基因序列的系统发育进化树 |
挑取菌株Y7单菌落接种到LB液体培养基中,30℃条件下170 r/min振荡培养,间隔一定时间取菌液在600 nm下测定OD值,间接反映菌体的生长状况。菌株Y7的生长曲线如图 3所示,从接种开始到第12小时,菌株Y7的生长处于延滞期,生长缓慢,600 nm下的OD值为0.456,延滞期较长,可能与接种的是单菌落有关;第12-24小时期间为菌株Y7的指数生长期,24 h后菌体浓度达到最高,OD600达到1.757;第24-28小时为菌株Y7的生长稳定期,OD600略有增加;第28小时以后细菌进入衰亡期。因此,指标的测定时间选择发酵培养第12和第24小时两个时间点。
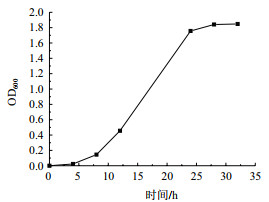
|
| 图 3 菌株Y7的生长曲线 |
在碳源种类的实验中,亚硝酸钠的初始浓度为200 mg/L。实验结果如图 4所示,不加碳源时,菌株Y7对亚硝酸盐的降解率不足10%。菌株Y7发酵培养12 h时,碳源为丁二酸钠的降解亚硝酸钠效率最高,达到59.3%;其次为酒石酸钾钠(55.1%),甘油仅为35.9%;然而,发酵培养24 h时,甘油为碳源时,菌株Y7对亚硝酸钠的降解率高达84.9%,显著高于其他碳源。菌株Y7在葡萄糖、蔗糖和可溶性淀粉等糖类碳源中发酵培养后对亚硝酸钠降解率最高不超过50%。因此,最适碳源为甘油。
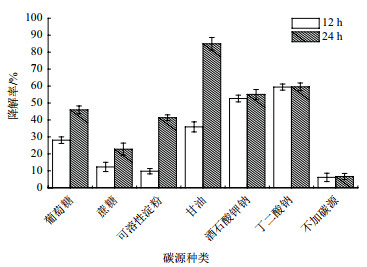
|
| 图 4 碳源种类对菌株Y7降解亚硝酸盐的影响 |
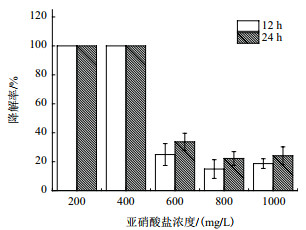
不同菌株对亚硝酸盐的耐受性差别很大。菌株Y7对亚硝酸盐浓度的耐受性如图 5所示,以甘油为碳源,起始亚硝酸钠浓度为200和400 mg/L时,菌株Y7发酵培养仅12 h时,其对亚硝酸钠的降解率就达到100%;随着亚硝酸钠浓度的逐渐增加,菌株Y7对亚硝酸盐的降解能力显著下降,600-1 000 mg/L时,降解率仅为22.2%-33.7%,因此,在下一步的优化过程中,起始亚硝酸盐浓度定为600 mg/L。
|
| 图 5 菌株Y7对亚硝酸盐的耐受性 |
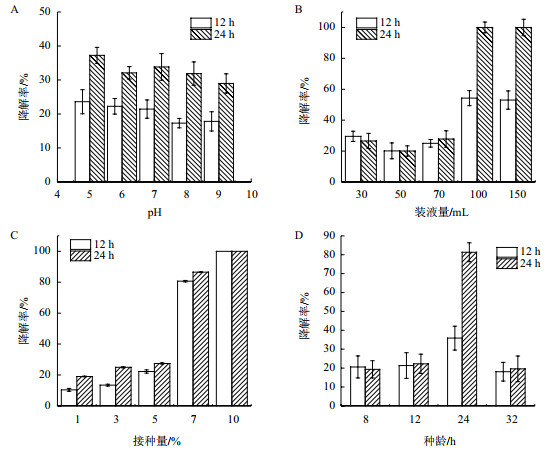
在亚硝酸钠为600 mg/L时,起始pH对菌株Y7降解亚硝酸盐的结果如图 6-A所示,菌株Y7发酵培养12 h时,在pH 5-9范围内的降解效率在17.3%-23.6%;发酵培养24 h时,在pH 5-9范围内的降解效率在29.0%-37.2%;最高值与最低值相差不超过10%。可见,菌株Y7在较宽pH范围内均能有效降解亚硝酸盐。为了方便实验,选取pH 7.0为菌株Y7的最适起始pH。装液量间接反映溶氧量对菌株降解亚硝酸盐的影响,图 6-B的结果表明:在250 mL三角瓶中装液量为30-70 mL时,发酵培养12 h和24 h的降解率在20.0%-29.6%之间,而装液量100和150 mL时,降解率明显上升,发酵培养24 h时,降解率接近100%。因此,确定在250 mL三角瓶中的装液量为100 mL。研究接种量对菌株Y7降解亚硝酸盐的影响时,亚硝酸钠浓度设置为800 mg/L,种子液OD600为1.5,结果如图 6-C所示,1%-5%接种量时,降解率在20%左右;接种量7%时,降解率提高了近4倍;接种量为10%时,降解率接近100%。因此,接种量确定为10%。研究种龄对菌株Y7降解亚硝酸盐影响时,亚硝酸钠浓度设置为1 000 mg/L,将活化8、12、24和32 h的种子液转接到发酵培养基中,结果如图 6-D所示,种龄8、12和32 h的种子液按照10%接种量转接到含100 mL以甘油为碳源发酵培养基的250 mL三角瓶中发酵培养12 h和24 h时,对亚硝酸钠的降解率差距不大,均在20%左右;而种龄24 h的种子液转接到以甘油为碳源发酵培养基中发酵培养12 h时,降解率仅为35.9%;而发酵培养24 h后的降解率高达81.3%。因此,最适种龄为24 h。
|
| 图 6 起始pH、装液量、接种量、种龄对菌株Y7降解亚硝酸盐的影响 |
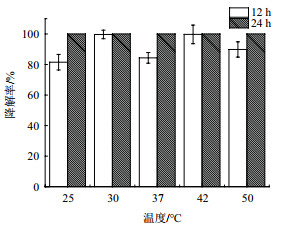
在温度对菌株Y7降解亚硝酸盐的影响中,所采用的亚硝酸钠浓度为1 100 mg/L,实验结果如图 7所示,菌株Y7在25、30、37、42和50℃条件下发酵培养12 h后,降解率分别为81.5%、99.7%、84.3%、99.7%和85.3%,降解率均较高;发酵培养24 h后,菌株Y7在不同温度下对亚硝酸盐的降解率均接近100%。表明菌株Y7对温度有较宽的适应范围,且高温不影响菌株对亚硝酸钠的降解能力。
|
| 图 7 温度对菌株Y7降解亚硝酸盐的影响 |
反硝化细菌去除亚硝酸盐受到多种因素的影响。在好氧条件下,碳源不仅作为菌体生长的营养源,也是反硝化过程的能量来源和电子受体,对细菌的生长和反硝化效率具有重要作用[6]。在无碳源的情况下,菌株的反硝化能力极低[12, 17]。反硝化细菌的碳源种类包括糖类、柠檬酸盐、乙酸盐、丁二酸盐、甘油、醇类等。糖类是最易被异养微生物利用的营养物质与能源物质,其中葡萄糖作为单糖更易被反硝化细菌吸收利用,如菌株Enterobacter cloacae HNR[3]和Providencia rettgeri YL[17]反硝化过程中的最适碳源为葡萄糖。然而,菌株Psychrobacter sp. S1-1以葡萄糖为碳源时,不利于其生长和反硝化[18]。柠檬酸盐和丁二酸钠作为三羧酸循环的中间代谢产物,能直接被细菌所利用,广泛被用作细菌好氧反硝化的碳源[9, 11-12, 18-20]。此外,细菌好氧反硝化的最适碳源还有乙酸钠[21]和乙醇[22]等。在本研究中,菌株Y7以葡萄糖、蔗糖和可溶性淀粉为碳源时,其反硝化效率明显低于甘油,甘油作为一种化工产品,相比其他碳源,成本更低。甘油作为最适碳源也有相类似的报道,菌株Pseudomonas alcaligenes HP1以柠檬酸钠和甘油为最适碳源[23]。因此,不同反硝化细菌所利用的碳源种类是不同的,具有明显的种属特异性[9]。
亚硝酸盐中氮的去除主要通过微生物的同化作用、酶降解和酸降解实现,其中酶降解亚硝酸盐的途径是最主要方式[4]。培养基中的pH不仅影响微生物对营养物质的吸收,而且影响酶的活力。此外,微生物的脱氮系统对pH的变化很敏感。不同微生物对pH适应范围不同,文献已报道的耐高温、低温或嗜温反硝化菌,其最适pH多在7-9[5, 8-9, 11, 20-21],菌株Bacillus megaterium S379在pH < 6,反硝化能力几乎丧失[14]。中性偏碱环境利于好氧菌的反硝化,而偏酸环境利于厌氧菌的反硝化过程[10]。菌株Y7在pH 5-9范围内,对亚硝酸盐氮的去除率差异不大(图 6-A),与所报道的Ochrobactrum anthropic LJ81菌株相一致[10]。因菌株Y7的pH适应范围更广,故对偏酸性或偏碱性的废水均有较好的处理效果。
温度是影响微生物脱氮的关键因素之一。目前,已报道的好氧反硝化菌的最适温度一般为25-37℃,低于10℃或高于40℃时,反硝化作用受到强烈抑制[4-5]。对于低温和高温好氧反硝化细菌的报道均较少,何腾霞等[20, 24]从长期淹水的冬水田中分离了多株耐冷反硝化细菌,在15℃条件下对亚硝酸盐的去除率仍然较高。赵惊鸿等[12]从燃煤电厂生物滴滤系统中分离到一株地衣芽孢杆菌JH8,该菌能在50℃的高温条件下24 h内将初始浓度为1 000 mg/L KNO3和250 mg/L NaNO2去除。耐高温好氧反硝化细菌(Chelatococcus sp. TAD1)在50℃高温条件下24 h内将培养液中的亚硝酸盐氮由初始的113.58 mg/L降低到85.31 mg/L,脱氮率仅为24.89%[11]。分离自水产养殖池废水中的菌株Bacillus megaterium S379在25-40℃范围内对初始浓度为250 mg/L NaNO2的脱氮率在86.26%-97.96%[14]。与上述的高温好氧反硝化细菌相比,菌株Y7在25-50℃范围内,24 h内均能将初始浓度1 100 mg/L的NaNO2全部降解,菌株Y7在耐受高温和耐受高浓度亚硝酸盐方面比上述菌株具有明显的优势。但温度为20℃,反硝化能力极低(结果未显示),菌株Y7不适于低温环境下的水处理。水产养殖厂水温在1 d之中波动较大,温度适应范围宽的好氧反硝化细菌更适于此类水质的处理。这些特性使得菌株Y7在工业废水、养殖废水处理及燃煤电厂烟气中的脱硝过程中,有着广泛的应用前景。
亚硝酸盐不仅对水生动物、哺乳动物等具有致癌、致畸、影响血红蛋白运输氧等较强的毒害作用[1-2];对微生物也有一定的毒害作用,并影响其降解亚硝酸盐的能力。已报道的关于微生物对亚硝酸钠耐受浓度一般在100-200 mg/L[8, 20],菌株Bacillus megaterium S379在560 mg/L亚硝酸盐条件下生长受到严重的抑制[14]。而本研究中的菌株Y7最高可耐受1 100 mg/L亚硝酸钠,当浓度达到1 200 mg/L时,菌株Y7的生长被完全抑制,其降解亚硝酸盐的能力丧失,对菌体产生较大的毒害作用。与已报道的以亚硝酸盐为氮源的反硝化细菌相比,菌株Y7耐受浓度更高,其作用机理及所涉及的酶值得进一步深入的研究和探讨。
4 结论本研究从某水产养殖厂废水中筛选到菌株Y7,经形态观察、生理生化特征分析及16S rRNA基因的序列分析,该菌株鉴定为枯草芽孢杆菌。该菌可产生蛋白酶、淀粉酶及纤维素酶,能一定程度上降解养殖水体中多余饲料或水产生物的排泄物。进一步研究发现菌株Y7在pH 5-9范围内,对亚硝酸盐的去除率差别不大,有较宽的pH适应范围;而该菌株在25-50℃范围内,发酵培养24 h后,对1 100 mg/L亚硝酸钠的降解效率均接近100%,有较宽的温度适应范围;而菌株Y7对亚硝酸钠的耐受性高达1 100 mg/L。
| [1] |
Jensen FB, Hansen MN. Differential uptake and metabolism of nitrite in normoxic and hypoxic goldfish[J]. Aquatic Toxicology, 2011, 101(2): 318-325. DOI:10.1016/j.aquatox.2010.11.007 |
| [2] |
Özen H, Kamber U, Karaman M, et al. Histopathologic, biochemical and genotoxic investigations on chronic sodium nitrite toxicity mice[J]. Experimental and Toxicologic Pathology, 2014, 66(8): 367-375. DOI:10.1016/j.etp.2014.05.003 |
| [3] |
Guo LJ, Zhao B, An Q, et al. Characteristics of a novel aerobic denitrifying bacterium, Enterobacter cloacaestrain HNR[J]. Applied Biochemistry and Biotechnology, 2016, 178: 947-959. DOI:10.1007/s12010-015-1920-8 |
| [4] |
何腾霞, 李振轮, 杨珊. 好氧反硝化细菌及其去除亚硝酸盐的作用机理研究进展[J]. 过程工程学报, 2015, 15(1): 174-180. |
| [5] |
Ji B, Yang K, Zhu L, et al. Aerobic denitrification:a review of important advances of the last 30 years[J]. Biotechnology and Bioprocess Engineering, 2015, 20: 643-651. DOI:10.1007/s12257-015-0009-0 |
| [6] |
Zhao B, Cheng DY, Tan P, et al. Characterization of an aerobic denitrifier Pseudomonas stutzeri strain XL-2 to achieve efficient nitrate removal[J]. Bioresource Technology, 2018, 250: 564-573. DOI:10.1016/j.biortech.2017.11.038 |
| [7] |
郭端强, 刘海龙, 万亚涛, 等. 一株好氧反硝化细菌的分离鉴定及反硝化特性研究[J]. 生物技术通报, 2012, 28(10): 205-209. |
| [8] |
Song ZF, An J, Fu GH, et al. solation and characterization of an aerobic denitrifying Bacillus sp.YX-6 from shrimp culture ponds[J]. Aquaculture, 2011, 319: 188-193. DOI:10.1016/j.aquaculture.2011.06.018 |
| [9] |
Liu Y, Ai GM, Miao LL, et al. Marinobacter strain NNA5, a newly isolated and highly efficient aerobic denitrifier with zero N2O emission[J]. Bioresource Technology, 2016, 206: 9-15. DOI:10.1016/j.biortech.2016.01.066 |
| [10] |
Lei X, Jia YT, Chen YC, et al. Simultaneous nitrification and denitrification without nitrite accumulation by a novel isolated Ochrobactrum anthropic LJ81[J]. Bioresource Technology, 2019, 272: 442-450. DOI:10.1016/j.biortech.2018.10.060 |
| [11] |
张苗, 黄少斌. 高温好氧反硝化菌的分离鉴定及其反硝化性能研究[J]. 环境科学, 2011, 32(1): 259-265. |
| [12] |
赵惊鸿, 黄少斌. 一株耐高温好氧反硝化菌的筛选及特性研究[J]. 环境科学与技术, 2015, 38(1): 6-10. |
| [13] |
郝敏娜, 杨云龙, 葛启隆. 高温短程反硝化菌Brevibacillus sp.XF-03特性及其降解动力学[J]. 生物技术通报, 2014, 30(1): 177-181. |
| [14] |
Gao JQ, Gao D, Liu H, et al. Biopotentiality of high efficient aerobic denitrifier Bacillus megaterium S379 for intensive aquaculture water quality management[J]. Journal of Environmental Management, 2018, 222: 104-111. |
| [15] |
国家环保总局水和废水检测分析方法编委会. 水和废水分析监测方法[M]. 北京: 中国环境科学出版社, 2002.
|
| [16] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [17] |
Zhao B, He YL, Huang J, et al. Heterotrophic nitrogen removal by Providencia rettgeri strain YL[J]. Journal of Industrial Microbiology and Biotechnology, 2010, 37: 609-616. DOI:10.1007/s10295-010-0708-7 |
| [18] |
Zheng HY, Liu Y, Sun GD, et al. Denitrification characteristics of a marine origin psychrophilic aerobic denitrifying bacterium[J]. Journal of Environmental Sciences, 2011, 23(11): 1888-1893. DOI:10.1016/S1001-0742(10)60615-8 |
| [19] |
Chen Q, Ni J. Ammonium removal by Agrobacterium sp.LAD9 capable of heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 2012, 113(5): 619-623. DOI:10.1016/j.jbiosc.2011.12.012 |
| [20] |
何腾霞, 李振轮. 耐冷好氧亚硝酸盐型反硝化细菌的鉴定及脱氮特性研究[J]. 生物技术通报, 2015, 31(10): 191-198. |
| [21] |
李彦芹, 李春青, 管鹏悦, 等. 一株好氧反硝化菌的分离鉴定及脱氮条件研究[J]. 环境科学与技术, 2015, 38(7): 33-37. |
| [22] |
连红民, 邱忠平, 何昆明, 等. 一株好氧反硝化-异养硝化菌的筛选及脱氮特性研究[J]. 生物技术通报, 2015, 31(6): 138-143. |
| [23] |
傅利剑, 郭丹钊, 史春龙, 等. 碳源及碳氮比对异养反硝化微生物异养反硝化作用的影响[J]. 农村生态环境, 2005, 21(2): 42-45. |
| [24] |
He TX, Li ZL, Sun Q, et al. Heterotrophic nitrification and aerobic denitrification by Pseudomonas tolaasii Y-11 without nitrite accumulation during nitrogen conversion[J]. Bioresource Technology, 2016, 200: 493-499. DOI:10.1016/j.biortech.2015.10.064 |




