2. 土肥资源高效利用国家工程实验室,泰安 271000
2. National Engineering Laboratory for Efficient Utilization of Soil and Fertilizer Resources, Tai'an 271000
农业固体废弃物是指在整个农业生产过程中被丢弃的有机类物质,主要包括秸秆、尾菜和畜禽粪便等[1]。中国已经成为农业废弃物产出量最大的国家,而绝大数农业废弃物没有作为一种资源利用,随意丢弃或者通过焚烧排放到环境中,对生态环境造成了极大影响[2]。研究农业固废弃物处理现状及发展路径是解决环境问题、实现可持续发展的重要手段[3]。农业固体废弃物是有机固体废弃物的重要组成部分,目前主要通过填埋、焚烧、热解、沼气工艺和好氧堆肥等方式对其进行资源化处理[4]。
秸秆好氧堆肥是在有氧条件下将有机物质通过微生物的作用分解成腐殖质并形成稳定产品的过程[5]。堆肥是目前一种广泛使用的通过微生物群落降解有机质的方法,从堆肥中获得的堆肥产品含有作物必须的营养物质和有机物质,可作为土壤改良剂改善土壤结构。其中微生物在这个过程中起着至关重要的作用[6]。
虽然堆肥中的土著微生物群落通常能成功进行堆肥,但是因为该过程进行的速率与能够作用于木质纤维素的微生物的比例直接相关,所以木质纤维素的降解成为影响堆肥腐熟时间的主要限速步骤[7]。木质纤维素中的纤维素是一种难以降解的物质,不易被微生物利用。然而有的微生物则可以分泌几种类型的纤维素酶,包括纤维素酶、外切葡聚糖酶(如FPase)和木聚糖酶等[8]。大量研究表明,接种可以分泌纤维素酶的外源微生物,如细菌和真菌,可以加速堆肥过程中纤维素的生物降解[9]。
刘晓梅[10]采用纤维素刚果红水解圈法、滤纸条降解实验和纤维素酶活力测定,在杏鲍菇菌渣中筛选出3株高效降解纤维素的菌株(BC11、BC12、FB7),经分子鉴定FB7为枯草芽孢杆菌(Bacillus subtilis);BC12为丛毛单胞菌属(Comamonas sp.)的一种;BC11为白色链霉菌(Streptomyces albus)。Han[11]以纤维素为唯一碳源从咖啡外果皮分离得到38株细菌和18株放线菌,并对所分离的菌株进行了纤维素酶活的测定,从中优选出了酶活性较高的菌株。目前分离的具有纤维素降解能力的细菌较多,主要有芽孢杆菌属(Bacillus)、假单孢菌属(Pseudomones)、梭菌属(Clostridium)、纤维单孢菌属(Cellulomonas)[6, 12]。目前已知能有效利用纤维素的放线菌主要有纤维放线菌(Actinomyces cellμlosae)、链霉菌属(Streptomyces)、诺卡氏菌属(Nocardia)、热单孢菌属(Thermomonospora)等[10],然而,当前纤维素降解菌株的积累仍然不足,农业固态废弃物依然在世界各地造成一定的污染和资源浪费。为满足现代农业发展中农业固态废弃物无害化、资源化的需要,亟待挖掘更多更为高效的纤维素降解菌株资源。
本研究拟以玉米秸秆为材料进行好氧堆肥,旨在通过堆肥过程有针对性地选择驯化纤维素降解菌株,进一步依此堆肥产物对其中优势纤维素降解菌株进行分离培养,以期筛选获得具有高效纤维素降解能力的菌株。本研究拟丰富纤维素降解菌株资源,并检测菌株活性指标,旨在为下一步菌株在秸秆好氧堆肥过程中的应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 样品来源采集泰安地区玉米秸秆堆肥样品,将其放冰盒运回实验室,4℃冰箱保存备用。
1.1.2 培养基CMC培养基羧甲基纤维素钠(CMC-Na)10.0 g,K2HPO4 1.0 g,NH4NO3 1.0 g,CaCl2 0.02 g,MgSO4·7H2O 0.2 g,FeCl3·6H2O 0.05 g,琼脂20.0 g,蒸馏水1 000 mL;刚果红培养基:CMC-Na 2.0 g,KH2PO4 0.5 g,MgSO4·7H2O 0.25 g,(NH4)2SO4 1.0 g,刚果红0.1 g,琼脂20.0 g,蒸馏水1 000 mL;复筛培养基:CMC-Na 5.0 g,KH2PO4 1.0 g,NaNO3 3.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeCl3·6H2O 0.01 g,蒸馏水1 000 mL;滤纸降解培养基:(NH4)2SO4 1.0 g,MgSO4·7H2O 0.5 g,KH2PO4 1.0 g,酵母膏0.1 g,滤纸条(1 cm×6 cm)3条/三角瓶,蒸馏水1 000 mL;;保藏培养基:LB培养基:蛋白胨10.0 g,NaCl 10.0 g,酵母提取物5.0 g,琼脂20.0 g,蒸馏水1 000 mL;秸秆降解培养基:小麦秸秆烘干剪成1 cm左右的段状,段状秸秆10 g,赫氏奇无机盐培养液1 000 mL。
1.2 方法 1.2.1 菌种的分离与纯化活化菌种 取1 g堆肥样品用无菌水进行梯度稀释,取10-4,10-5,10-6梯度的稀释液100 μL涂布于CMC-Na培养基平板上,每个稀释度3个重复,置于28℃的恒温培养箱培养5-7 d,根据以CMC-Na为唯一碳源的培养基中菌落的直径来初步评估菌株对纤维素的降解利用效果,选取直径较大的菌株进行分离纯化;待生长旺盛后用1 mg/mL刚果红染色剂染色20 min后,弃去染液,加入1 mol/L氯化钠溶液,洗涤1-2 min,保留降解圈较大的纤维素降解菌,测量菌落直径(d)和降解圈直径(D),通过计算D/d的值来确定纤维素降解能力较强的菌株;三区划线纯化并保存。
1.2.2 菌种鉴定菌株形态学观察及生理生化鉴定:将纯化后的菌株活化,用无菌牙签挑取适量菌苔,在CMC-Na平板上,进行三区划线,于28℃下倒置培养3-5 d,至平板上长出清晰菌落,观察菌落形状、大小、边缘、表面、隆起形状透明度及菌落颜色等形态特征。生理生化测定参照东秀珠编《常见细菌系统鉴定手册》[13]。
分子鉴定[14]:将有3株纤维素降解菌进行DNA的提取,以其为模板,以16S rDNA通用引物27F和1 492R引物进行扩增,得到1.5 kb的基因片段,将测序序列在NCBI进行BLAST比对,根据比对结果将所得基因的序列利用MEGA7.0进行多重序列比对并构建系统发育树。
1.2.3 纤维素酶活的定量测定将3株菌的单菌落分别接种于LB液体培养基中培养,然后取出500 μL接种于50 mL的发酵培养基中,28℃恒温摇床振荡培养1 d后,每天定时取样测定发酵液的酶活力,连续测定5 d。
粗酶液制备:将上述产酶培养基中恒温培养的液体发酵液经10 000 r/min离心15 min后,取上清液即为粗酶液。葡萄糖标准曲线:葡萄糖与木聚糖标准曲线的绘制:向7个25 mL具塞试管中分别依次加入1.6 mL、1.5 mL、1.4 mL、1.3 mL、1.2 mL、1.1 mL和l.0 mL,pH5.5的磷酸缓冲液,同样依次加入1 mg/mL的葡萄糖与木聚糖溶液0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL和1.0 mL,最后每个试管中均加入3 mL的DNS,用Excel表格绘制葡萄糖与木聚糖标准曲线。
酶活力按国际单位的定义是:每分钟催化水解生成1 μmol葡萄糖的酶量为一个酶活力单位U。
酶活力的测定:将1 mL的1%CMC-Na、1%木聚糖溶液和2片1×1 cm的滤纸片分别加入到25 mL具塞试管中,37℃水浴10 min,再加入1 mL适当稀释的粗酶液,摇匀,于此温度下准确反映30 min后,迅速加入DNS试剂3 mL,在沸水浴中煮沸5 min,流水冲洗迅速冷却,用蒸馏水定容到25 mL,在540 nm波长测吸光值,对照管中添加热灭活酶液[15]。
1.2.4 滤纸崩解实验使用三角瓶液体发酵的方法研究各菌株的降解效果。每个三角瓶分装100 mL产酶液体培养基并加入3条1×6 cm的滤纸条,以不接菌作为空白对照,其余处理加入待测菌株的菌悬液,混匀后置于恒温培养,定期观察滤纸条的形态变化。
1.2.5 秸秆降解将3株菌株分别按1%的比例接种至小麦秸秆段无机盐液体发酵培养基中,以接种等量无菌水为空白对照,在摇床温度37℃、转速180 r/min条件下液体发酵7 d。液体发酵降解结束后,将稻秆降解残余物在100目的过滤网内用大量清水冲洗,除去附着菌体和可溶性物质,在105℃条件下烘干至恒重,同时称取秸秆剩余物干重,计算降解率。秸秆相对降解率=(m0-m1)/m0×100%(m0为对照组秸秆剩余物干重,m1为处理组秸秆剩余物干重)。
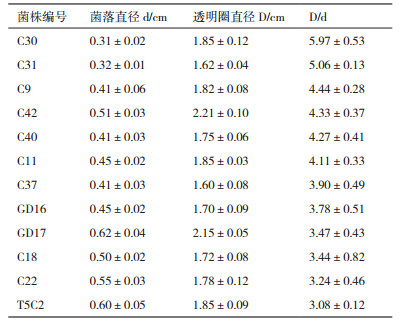
2 结果 2.1 菌种的分离和纯化以玉米秸秆堆肥样品,利用刚果红染色法初步获得43个具有纤维素降解功能的分离物。将分离得到的分离物经刚果红平板实验得到透明圈,通过计算透明圈和菌落直径的比值(D/d)来初步测定降解纤维素能力较强的菌株。通过测量得到12株降解能力较大的菌株(表 1)。
由于菌株的降解纤维素的能力体现在分泌纤维素酶的综合酶活力水平上,所以实验采用滤纸条崩解实验进行进一步的复筛,根据滤纸最终降解的程度来筛选优势菌株,根据实验结果(图 1),在培养3 d条件下,菌株GD16可以完全将滤纸条降解为糊状,菌株C31可将滤纸条崩解为近似糊状,菌株C37可将滤纸崩解为不定形状,菌株C42和T5C2效果稍差,可将滤纸条边缘崩解。与对照相比,这5株菌均具有崩解滤纸的效果,其中菌株菌株GD16和C31的崩解效果十分显著,而且仅3 d就可以将滤纸条完全降解,保存菌株C31、C37和GD16用作接下来的实验。

|
| 图 1 滤纸崩解实验效果图 |
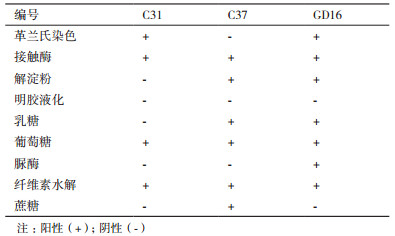
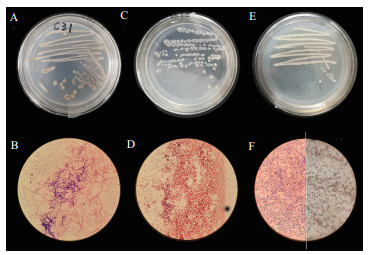
将3株菌株于CMC-Na平板上三区划线,待长出单菌落后,观察菌落形态。经观察发现菌株C31在平板上(图 2-A)呈圆形,表面干燥,菌落为灰色。中央环状凹陷,外缘有同心轮纹,边缘略呈不规则波纹状。革兰氏染色结果为阳性(图 2-B)。生理生化鉴定结果如表 2所示,接触酶、葡萄糖反应为阳性,明胶液化、解淀粉反应为阴性。菌株C37在CMC-Na培养基上单菌落形态(图 2-C)为扁平、圆形,表面干燥,菌落为白色。革兰氏染色结果为阴性(图 2-D)。
|
| A:菌株C31菌落形态;B:菌株C31革兰氏染色;C:菌株C37菌落形态;D:菌株C37革兰氏染色;E:菌株GD16菌落形态;F(左):菌株GD16革兰氏染色;F(右):菌株GD16孔雀绿芽孢染色 图 2 纤维素降解菌的菌落形态和革兰氏染色 |
生理生化鉴定结果如表 2所示,能利用淀粉、乳糖和蔗糖等碳源。菌株GD16在LB平板(图 2-E)上呈白色,革兰氏染色呈阳性(图 2-F),杆菌,接触酶、解淀粉反应呈阳性。孔雀绿染色(图 2-G)显示产芽孢,杆菌,接触酶、解淀粉反应呈阳性。
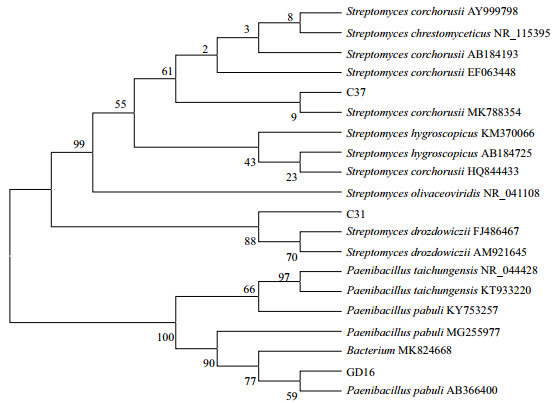
2.3.2 纤维素降解菌的分子生物学鉴定根据比对结果将所得基因的序列利用MEGA7.0进行多重序列比较并构建系统发育树(图 3)发现,C31与放线菌(Streptomyces drozdowiczii)相似性最高,C37与黄麻链霉菌(Streptomyces corchorusii)亲缘关系较近,GD16经鉴定与类芽孢杆菌(Paenibacillus pabuli)亲缘关系较近。
|
| 图 3 纤维素降解菌株16S rRNA基因系统发育树 |
将滤纸条崩解实验得到的3株菌,采用DNS法测定菌株的产木聚糖酶活性、滤纸酶活性和纤维素酶活性(图 4)。由结果可知,C31的3种酶最大酶活性均相对较高分别为8.5 U/mL、4.8 U/mL和3 U/mL,GD16的3种纤维素相关酶活中的木聚酶活性相对较高,高达23 U/mL,而菌株C37的3种纤维素相关酶活均较低,分别为2.5 U/mL、3 U/mL和2.3 U/mL。
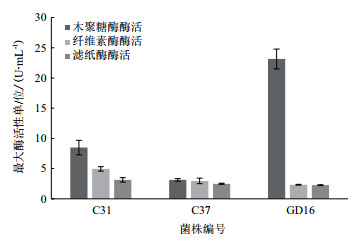
|
| 图 4 不同菌株不同纤维素酶活 |
菌株C31、菌株C37和菌株GD16的纤维素酶活变化趋势呈现先上升后下降的趋势(图 5)。在第4天时3个菌株的纤维素酶活均达到最大,分别为2.3 U/mL、3 U/mL和2.3 U/mL。其中菌株C31纤维素酶活上升速度相对较快,而菌株GD16的纤维素酶活相对于菌株C31和菌株C37较低。
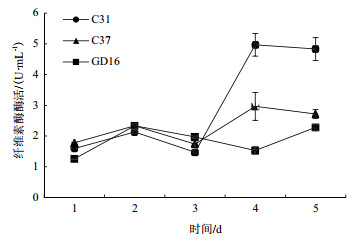
|
| 图 5 不同菌株纤维素酶活变化 |
在整个培养过程中,菌株C31、C37和GD16滤纸酶活性均呈现先上升后下降的趋势(图 6),其中菌株GD16的滤纸酶活性在第3天达到最大值2.3 U/mL,菌株C37和菌株C31的滤纸酶活性在第4天达到最大值,分别为2.5 U/mL和3 U/mL。
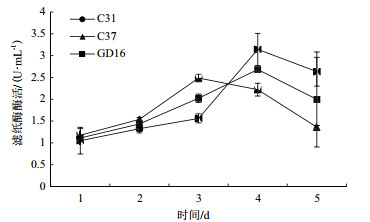
|
| 图 6 不同菌株滤纸酶活变化 |
菌株C31、菌株C37和菌株GD16的木聚糖酶活变化与它们的滤纸酶活性和纤维素酶活变化趋势相似,即先增后降(图 7)。菌株GD16的酶活在第2天达到最大,为23 U/mL,C31和C37分别在第5天和第4天达到最大值分别为8.5 U/mL、3 U/mL。
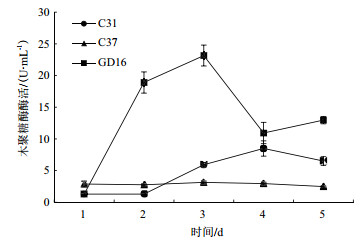
|
| 图 7 不同菌株木聚糖酶活变化 |
为直观评价3株菌对秸秆的降解能力,对3株菌的秸秆降解率测定结果如图 8所示。其中菌株C31的秸秆降解能力在3株菌中表现最优,其在无机盐秸秆发酵培养基中28℃条件下培养7 d后,秸秆降解率达20%;其次为C37,其秸秆相对降解率为9%。GD16的秸秆降解率与C37相近,为8.2%。

|
| 图 8 不同菌株秸秆相对降解率 |
具有纤维素降解功能的微生物在堆肥效率方面起着至关重要的作用,其中放线菌在堆肥过程中的微生物群落中也发挥着重要的作用[16]。尽管放线菌的生长速度比细菌慢,但放线菌可能具有更重要的特性。例如,耐热性和对极端环境的适应性等[17]。本研究从秸秆堆肥样品中筛选得到了3株纤维素降解菌株,其中有2株放线菌和1株类芽孢杆菌。这也证明了放线菌具有降解纤维素的能力。此外,孙晓萌等[18]证实了放线菌将木质纤维素分解成可溶性碳水化合物的能力。并且链霉菌属微生物分泌的纤维素酶与木聚糖酶的pH耐受性和温度稳定性最好,这些酶在碱性、高温环境中仍然具有较高酶活。细菌菌株一般是以大规模的繁殖来表现其自身的生物降解作用,同时是和多种微生物菌株的共同作用,才能实现较好的秸秆降解效果[19]。细菌酶活力较低,但细菌在厌氧条件下产生的纤维素酶在中、碱性环境下发挥作用,正好与有氧条件下真菌产生的偏酸性纤维素酶互补。此外,芽孢杆菌因具有较好的耐碱、耐高温、耐酸能力而受到研究者的普遍关注[20]。本研究筛选得到的GD16是一株可产芽孢的类芽孢杆菌,丰富了纤维素降解菌资源,为纤维素降解菌在秸秆堆肥中的开发利用奠定了基础。
为了提高接种效率,一般用于堆肥的接种物通常选择具有一种或几种酶能力的菌株组成[21]。本研究对这3株菌进行了滤纸酶活性、纤维素酶活性和木聚糖酶活性连续5 d的定量测量。结果显示这3株纤维素降解菌都具有3种纤维素降解酶活,但是在不同酶活的大小却有所差异,在纤维素酶活中,菌株C31的纤维素酶活是最大的,可达到4.8 U/mL;其次是C37和GD16,分别为3.0 U/mL、1.9 U/mL。在滤纸酶活中,C31的滤纸酶酶活是最大的,可达到3 U/mL。在木聚糖酶活中GD16的木聚糖酶酶活性最大,高达23 U/mL。这可能也是菌株GD16在滤纸崩解实验中效果最好的原因。此外,王贤丰等[22]从海水中筛选出高效甘蔗渣纤维素降解地衣芽孢杆菌(Bacillus licheniformis),纤维素酶活力达到2.80 U/mL;陈珊等[23]从长白山森林的土壤中筛选出一株纤维素降解菌,经鉴定为地衣芽孢杆菌,纤维素酶活力为1.82 U/mL。本研究筛选得到的3株菌在纤维素酶活方面均高于这2株地衣芽孢杆菌。表明本研究所筛选的菌株具有一定的应用价值。
本研究中对筛选的纤维素降解菌进行了秸秆相对解率的测定,通过秸秆降解率的测量可以更加直接的观察菌株实际的应用情况,结果显示菌株C31的秸秆降解率均高于菌株C37和菌株GD16,这也与纤维素酶活测定结果相对应。
4 结论针对蔬菜废弃物好氧堆肥的特点从自然界中筛选优良的纤维素降解菌。采用筛选培养基对不同样品进行纤维素降解菌株分离,获得具有纤维素降解能力的菌株。通过羧甲基纤维素钠水解圈法、滤纸条崩解试验和纤维素酶活测定等对获得的菌株复筛,获得3株高效纤维素降解菌株,经鉴定菌株C31为放线菌、菌株C37为黄麻链霉菌,菌株GD16为类芽孢杆菌。
| [1] |
董雪云, 张金流, 郭鹏飞. 农业固体废弃物资源化利用技术研究进展及展望[J]. 安徽农学通报, 2014(18): 86-89. DOI:10.3969/j.issn.1007-7731.2014.18.042 |
| [2] |
孙永明, 李国学, 张夫道, 等. 中国农业废弃物资源化现状与发展战略[J]. 农业工程学报, 2015, 21(8): 169-173. |
| [3] |
曾庆东, 刘孟夫. 好氧堆肥技术与装备在农业废弃物资源化中的应用[J]. 现代农业装备, 2018, 233(2): 55-59. |
| [4] |
Kulcu R, Yaldiz O. Determination of aeration rate and kinetics of composting some agricultural wastes[J]. Bioresource Technology, 2004, 93(1): 49-57. DOI:10.1016/j.biortech.2003.10.007 |
| [5] |
Suárezestrella F, Arcosnievas MA López MJ, et al. Biological control of plant pathogens by microorganisms isolated from agro-industrial composts:theory and applications in pest management[J]. Biological Control, 2013, 67(3): 509-515. DOI:10.1016/j.biocontrol.2013.10.008 |
| [6] |
Zhao Y, Lu Q, Wei Y, et al. Effect of actinobacteria agent inoculation methods on cellulose degradation during composting based on redu-ndancy analysis[J]. Bioresour Technol, 2016, 219: 196-203. DOI:10.1016/j.biortech.2016.07.117 |
| [7] |
López-González JA, Vargas-García MDC, López MJ, et al. Enzymatic characterization of microbial isolates from lignocellulose waste composting:chronological evolution[J]. Journal of Environmental Management, 2014, 145(12): 137-146. |
| [8] |
Zhao Y, et al. Effect of thermo-tolerant actinomycetes inoculation on cellulose degradation and the formation of humic substances during composting[J]. Waste Management, 2017, 68: 64-73. DOI:10.1016/j.wasman.2017.06.022 |
| [9] |
赵晓梅.高温纤维素降解菌的分离筛选及复合腐熟剂的应用研究[D].南京: 南京农业大学, 2016.
|
| [10] |
刘晓梅.杏鲍菇菌渣纤维素降解菌的筛选、复合菌剂构建及应用. [D].北京: 中国农业科学院, 2015.
|
| [11] |
Han BB. Isolation of cellulolytic bacteria, including actinomycetes, from coffee exocarps in coffee-producing areas in vietnam[J]. Int J Recycling Organic Waste Agriculture, 2014, 3(1): 48. DOI:10.1007/s40093-014-0048-0 |
| [12] |
诸葛诚祥.菌糠高效降解菌剂的研发及其在堆肥中的应用[D].杭州: 浙江大学, 2017.
|
| [13] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [14] |
王浩竹, 王正祥. 细菌分子鉴定技术的研究进展[J]. 安徽农业科学, 2008, 36(23): 9880-9881. DOI:10.3969/j.issn.0517-6611.2008.23.033 |
| [15] |
张扬.南极产木质纤维素酶菌株的筛选及转录组的研究[D].济南: 山东大学, 2015.
|
| [16] |
赵晓梅. 高效纤维素降解菌株的筛选及其复合系菌剂在秸秆堆肥中的应用[J]. 才智, 2012(34): 366. |
| [17] |
Budihal SR, Agsar D, Patil SR. Enhanced production and application of acidothermophilic streptomyces cellulase[J]. Bioresource Technology, 2016, 200: 706-712. DOI:10.1016/j.biortech.2015.10.098 |
| [18] |
孙晓萌, 等. 降解木质纤维素放线菌的功能组学分析及工业应用前景[J]. 中国科学:生命科学, 2017(2): 45-54. |
| [19] |
沈大春.秸秆堆肥降解菌株分离及降解稻秆效果研究[D].南京: 南京农业大学, 2016.
|
| [20] |
韩梦颖, 王雨桐, 高丽, 等. 降解秸秆微生物及秸秆腐熟剂的研究进展[J]. 南方农业学报, 2017, 48(6): 1024-1030. DOI:10.3969/j.issn.2095-1191.2017.06.14 |
| [21] |
Wongwilaiwalin S, Rattanachomsri U, et al. Analysis of a thermop-hilic lignocellulose degrading microbial consortium and multi-species lignocellulolytic enzyme system[J]. Enzyme & Microbial Technology, 2010, 47(6): 283-290. |
| [22] |
王贤丰. 从海水环境分离筛选甘蔗渣纤维素降解菌[J]. 微生物学通报, 2015, 42(6): 981-989. |
| [23] |
陈珊, 华梅, 刘迪, 等. 产纤维素酶芽孢杆菌ds1309的分离鉴定及产酶条件研究[J]. 大庆师范学院学报, 2014(6): 66-69. |