2. 天津市海洋资源与化学重点实验室,天津 300457
2. Tianjin Key Laboratory of Marine Resources and Chemistry, Tianjin 300457
在我国水污染控制中,含酚废水被列为重点解决的有害废水之一[1]。其中邻苯二酚作为一种重要的有机化学中间体,大量应用于印染业、石油化工业、造纸业、制药业及化妆品等行业[2],因此与之相关的也伴随着各行各业大量排放含酚废水。目前含酚废水的处理方法[3-4]有物理法包括吸附法、萃取法、离子交换法等;化学法包括湿式空气氧化法、化学氧化法、湿式催化氧化法等;生化法包括生物膜法、厌氧法和活性污泥法等,其中生化法因无二次污染而被广泛应用。
苯甲酸为芳香族化合物代谢过程中的一种中间产物,苯甲酸及其苯甲酸钠广泛应用在食品业、化工业和染料工业,导致其成为工业废水常见的环境污染物。动物实验研究表明,苯甲酸钠能够降低雄性生殖细胞质量,并且有遗传毒性和致突变毒性[5]。此外,苯甲酸钠还能破坏蛋白质的二级结构,使蛋白结构变得更加疏松[6]。生活中苯甲酸钠和邻苯二酚的污染日益严重,严重影响人们生活健康,而微生物修复技术作为一种经济、高效、无二次污染的治理技术,已被广泛应用在水污染处理中,成为目前最具有潜力的治理方法[7]。
本研究前期分离筛选的石油烃降解菌Acinetob-acter sp.Tust-DM21可以高效降解原油中芳香烃组分[8]。此外,还发现其能够利用其他苯类物质如邻苯二酚、苯甲酸钠作为唯一碳源进行生长,为了研究其降解邻苯二酚、苯甲酸钠的能力,本试验测定了其在不同培养条件下的生长情况和对这两种苯类化合物的降解情况,以及邻苯二酚-1,2双加氧酶、苯甲酸1,2-双加氧酶的酶活和邻苯二酚1,2-双加氧酶的动力学反应常数,旨为污水处理苯类物化合物提供备选菌株。
1 材料与方法 1.1 材料LB培养基:酵母浸粉5.0 g,蛋白胨10.0 g,NaCl 10.0 g,蒸馏水1 000 mL,pH调至7.0-7.2。
无机盐培养基:Na2HPO4 1.5 g,KH2PO4 1.5 g,(NH4)2SO4 1.0 g,MgSO4·7H2O 0.2 g,CaCl2 0.01 g,FeSO4·12H2O 0.02 g,加蒸馏水定容至1 L。
上述培养基在高压蒸汽灭菌锅中1×105 Pa灭菌20 min。
菌株:石油烃降解菌Acinetobacter sp. Tust-DM21由本实验室前期分离自渤海湾海洋石油勘探船废油收集区[8],存于40%甘油,-80℃冷藏。该菌株已被中国海洋微生物菌种保藏管理中心(http://mccc.org.cn/)收藏,菌株编号MCCC 1K03249,其16S rRNA序列在GenBank数据库中登录号为KX390866。
1.2 方法 1.2.1 邻苯二酚、苯甲酸钠测定方法的建立[9-10]邻苯二酚和苯甲酸钠浓度的测定采用紫外分光光度法,用蒸馏水分别配置不同底物浓度的溶液,在275 nm和224 nm下分别测定不同浓度邻苯二酚及苯甲酸钠溶液的吸光值,然后以底物浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.2.2 菌悬液的制备活化石油烃降解菌,并培养至生长对数期,然后取1 mL菌液转接到100 mL LB培养基中,培养12 h后,5 000 r/min,离心5 min,弃上清,用无菌蒸馏水重悬菌体,重新离心,反复3次,最后用等量的无机盐培养基悬浮,并使OD600维持在1.0左右。
1.2.3 邻苯二酚、苯甲酸钠降解率的测定[9-10]将制备好的菌悬液分别加入以邻苯二酚或苯甲酸钠为唯一碳源的无机盐培养液中,以不接菌的培养基为空白对照,每个样品设置3个平行,然后30℃,150 r/min震荡培养,分别在不同的时间点取样,8 000 r/min,离心2 min,取上清,在各自波长下测定吸光度,根据吸光度值和标准曲线计算底物含量,底物的降解率计算如下:
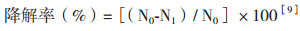 (1)
(1)
其中,N0:初始底物浓度,N1:剩余底物浓度。
1.2.4 不同培养条件下石油烃降解菌对邻苯二酚、苯甲酸钠的降解 1.2.4.1 不同接菌量对石油烃降解菌降解邻苯二酚、苯甲酸钠的影响在邻苯二酚浓度为600 mg/L,苯甲酸钠浓度为1 500 mg/L,培养基初始pH为6.5的条件下,各自分别接入1%、3%、5%、7%和9%的菌液,以不接菌液的培养基为空白对照,每个样品做3个平行,30℃,150 r/min震荡培养,并按照1.2.3的方法测定底物浓度。
1.2.4.2 不同底物浓度对石油烃降解菌降解邻苯二酚、苯甲酸钠的影响在培养基初始pH为6.5,接菌量为5%的条件下,分别配置邻苯二酚浓度为200、400、600、700和800 mg/L;接菌量为3%,苯甲酸钠浓度为1 500、2 500、3 500、4 500和5 500 mg/L的无机盐培养基,以不接菌的培养基为空白对照,每个样品做3个平行,30℃,150 r/min震荡培养,并按照1.2.3的方法测定底物浓度。
1.2.4.3 不同pH值对石油烃降解菌降解邻苯二酚、苯甲酸钠的影响邻苯二酚在碱性环境中容易氧化,当pH值在9.0以上时,菌株对邻苯二酚的利用率远远小于邻苯二酚的氧化速率,且在9 h后邻苯二酚已经氧化变黑,试验指标难以测定。所以在邻苯二酚浓度为600 mg/L,接菌量为5%的条件下,把培养基pH值分别调为4.0、5.0、6.0、7.0和8.0,以不接菌的培养基为空白对照,每个样品做3个平行,30℃,150 r/min震荡培养,并按照1.2.3的方法测定邻苯二酚浓度。
该菌从海洋环境中分离纯化出来,适宜在弱碱性的环境中生长。在苯甲酸钠浓度为1 500 mg/L,接菌量为3%的条件下,把pH值调为7.0、8.0、9.0、10.0和11.0,以不接菌的培养基为空白对照,每个样品做3个平行,30℃,150 r/min震荡培养,并按照1.2.3的方法测定苯甲酸钠浓度。
1.2.4.4 不同温度对石油烃降解菌降解邻苯二酚、苯甲酸钠的影响在邻苯二酚浓度为600 mg/L、接菌量为5%;以及苯甲酸钠浓度为1 500 mg/L、接菌量为3%的条件下,设置不同温度值(20、25、30、35和40℃),以不接菌的培养基为空白对照,每个样品做3个平行,30℃,150 r/min震荡培养,并按照1.2.3的方法测定邻苯二酚浓度和苯甲酸钠浓度。
1.2.5 邻苯二酚1,2-双加氧酶的粗酶特性 1.2.5.1 细胞粗酶液的制备将菌悬液接入以邻苯二酚为唯一碳源的无机盐培养基中,12 h摇床培养,5 000 r/min离心5 min,弃上清,然后用磷酸盐缓冲溶液(pH7.0)洗涤菌体3次,经超声波破碎,最后4℃、12 000 r/min离心15 min,上清液用于酶活测定。酶活力的计算公式为:U/mg=△A×V/(ε×M),其中△A:260nm下每分钟光密度变化值,V:酶活测定体积(L),ε:邻苯二酚在260 nm下的摩尔消光系数1 L/(mmol·cm),M:测定体系中蛋白质量(mg)。
1.2.5.2 温度、pH对酶活力的影响邻苯二酚1,2-双加氧酶的活力以单位时间内反应产物黏康酸在260 nm处的光吸收值测定。酶活力测定总体系为10 mL,内含浓度为20 mg/L的邻苯二酚0.5 mL、粗酶液2.5 mL、磷酸盐缓冲溶液7 mL。通过单位时间内吸光度的变化值和体系中的蛋白含量来计算酶活力[11],其中体系中蛋白的含量测定采用考马斯亮蓝法[12]。
利用不同缓冲溶液的pH缓冲范围,在pH值为6.0-10.0范围内进行试验,探究粗酶的最适pH。
在15-45℃下,分别测定粘康酸在260 nm下吸光度值随时间的变化,探讨粗酶的最适反应温度。
1.2.5.3 粗酶反应动力学的测定在最适温度和最适pH条件下,固定粗酶液加入量,以不同浓度邻苯二酚(50-300 μmol/L)为底物,在1.2.5.2的反应体系中进行,依据底物浓度和相应的酶促反应速率作Lineweaver-Burk双倒数图,得到Km和Vmax。
1.2.6 苯甲酸1,2-双加氧酶酶活测定[13]将菌悬液接种到以苯甲酸钠为唯一碳源的无机盐培养基中,过夜培养,所获得的菌体用于酶活的测定,其中NADH的浓度为30 mmol/L,在1.2.5.2的反应体系中进行,检测波长为340 nm。
2 结果 2.1 邻苯二酚、苯甲酸钠标准曲线的测定用紫外分光光度计分别在275 nm和224 nm下测定邻苯二酚、苯甲酸钠的吸光度。以邻苯二酚、苯甲酸钠浓度为横坐标,吸光度值为纵坐标绘制的标准曲线,如图 1。
|
| 图 1 (A) 邻苯二酚、(B)苯甲酸钠标准曲线 |
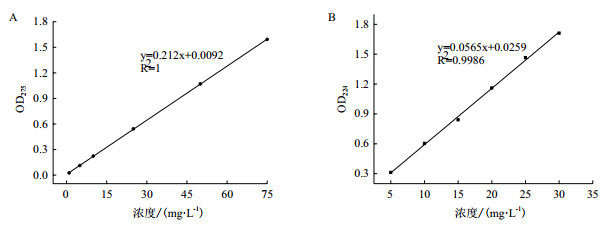
不同接种量对菌株降解邻苯二酚和苯甲酸钠的影响分别如图 2-A、图 2-B所示。从图 2-A中可以看出随着接种量的增加,石油烃降解菌对邻苯二酚的降解速率也逐渐增加,当接种量为1%时,菌株延滞期增长,而邻苯二酚随着延滞期增长的这段时间会发生部分氧化,导致菌株可能受到其氧化产物的毒害作用,不能正常利用邻苯二酚。当接种量为5%以上时,菌株在18 h时对邻苯二酚的降解速率都能达到88%以上,出于节省接菌量和较高的降解速率,确定5%为菌株降解邻苯二酚的最佳接菌量。

|
| 图 2 接种量对菌株降解邻苯二酚(A)、苯甲酸钠(B)的影响 |
在含有1 500 mg/L苯甲酸钠无机盐培养基中,分别以1%、3%、5%、7%和9%的接种量接种,震荡培养36 h,测定苯甲酸钠的降解率,结果如图 2-B,从图中可以看出当接种量为7%、9%时,在各个时间点菌株对苯甲酸钠降解率相差不大。当接种量为3%、5%时,在18 h内菌株对苯甲酸钠的降解率已达80%以上,在21 h时降解率都达到95%以上。当接种量为1%时,菌株达到最高降解率所用时间最长,出于节省接菌量和较高的降解速率,选用3%为最佳接菌量。
2.2.2 不同底物浓度对菌株Tust-DM21降解邻苯二酚、苯甲酸钠的影响在含有不同邻苯二酚浓度的无机盐培养基中加入5%的接种量,30℃,150 r/min震荡培养36 h,邻苯二酚降解率和菌株生长分别如图 3-A、3-B。从图 3-A、3-B可以看出底物浓度不超过700 mg/L时,菌株对邻苯二酚的降解率都达到90%以上,菌株的OD600也随着底物浓度的增加而增加,刺激了菌株的生长。当底物浓度为800 mg/L时,菌株受到邻苯二酚的毒害作用,抑制了菌株的生长,菌株的OD600仅达到0.160左右,导致其对邻苯二酚的降解率急剧下降,仅有30%左右,故700 mg/L为该菌株的最大耐受浓度。当邻苯二酚浓度为600 mg/L时,菌株的生物量较大,在36 h内能够更直观的反应菌株在邻苯二酚中的生长变化情况,相比于700 mg/L,菌株在600 mg/L邻苯二酚中降解效果更好,所以选用底物浓度为600 mg/L的邻苯二酚进行后续试验的研究。
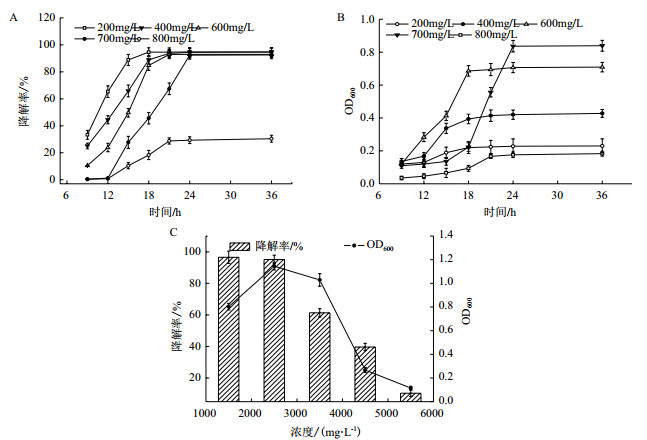
|
| A:不同邻苯二酚浓度对菌株降解邻苯二酚的影响;B:不同邻苯二酚浓度对菌株生长的影响;C:不同苯甲酸钠浓度对菌生长和降解率的影响 图 3 不同底物浓度对菌株降解邻苯二酚、苯甲酸钠的影响 |
以3%的接种量接种到含有不同苯甲酸钠浓度的无机盐培养基中,摇床培养36 h后测定培养基中苯甲酸钠的含量,计算其降解率,菌株生长和对苯甲酸钠的降解率如图 3-C。从图 3-C中可以看出,当苯甲酸钠的浓度小于2 500 mg/L时,菌株对苯甲酸钠有较高的降解率,达95%以上。随着苯甲酸钠浓度的增加,菌株受到其毒害作用,其生长受到抑制。当苯甲酸钠浓度为4 500 mg/L时,菌株对苯甲酸钠的降解率仅有10%,所以菌株对苯甲酸钠的最大耐受浓度为4 500 mg/L。
2.2.3 不同pH值对菌株降解邻苯二酚、苯甲酸钠的影响以5%的接种量接种到不同初始pH值的无机盐液体基中,培养36 h,确定菌株降解邻苯二酚的最适pH,结果如图 4-A所示,在偏酸环境中该菌株的生长受到抑制,导致其在pH值为4.0、5.0中不能更好的利用邻苯二酚。在pH值为6.0时菌株对邻苯二酚的降解达到最高为94.8%,确定最佳pH值为6.0,此外菌株在pH值为6.0-8.0范围内都有较好的降解范围。

|
| A:pH对菌株生长和菌株降解邻苯二酚的影响;B:pH对菌株生长和菌株降解苯甲酸钠的影响 图 4 pH对菌株生长和菌株降解邻苯二酚、苯甲酸钠的影响 |
菌株Tust-DM21是从海洋中分离纯化出来的,适宜在弱碱性的环境中生长,用NaOH或HCl调整培养基的初始pH值为6.0-11.0,菌株对苯甲酸钠的降解率如图 4-B。在pH值7.0-11.0范围内,菌株对苯甲酸钠都有较高的降解率达80%以上,在pH值为8.0时降解率达到最高为97.6%,确定最佳pH值为8.0。
2.2.4 不同温度对菌株降解邻苯二酚、苯甲酸钠的影响不同温度对菌株生长及邻苯二酚、苯甲酸钠降解的影响分别如图 5-A、5-B所示。菌株在25-35℃时对邻苯二酚、苯甲酸钠的降解率较高,达到80%以上,当温度达到40℃时,菌株不能正常生长,说明该菌适宜在中性温度中生长。菌株对邻苯二酚、苯甲酸钠的最佳降解温度为35℃,其降解率分别高达92.7%、95.9%。
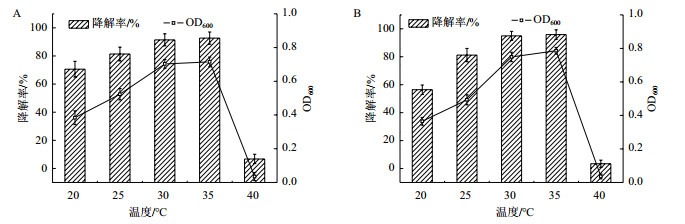
|
| A:温度对菌株生长和菌株降解邻苯二酚的影响;B:温度对菌株生长和菌株降解苯甲酸钠的影响 图 5 温度对菌株生长和菌株降解邻苯二酚、苯甲酸钠的影响 |
pH值是影响酶活力的重要因素之一,pH过高或过低会破坏蛋白酶的稳定性,使酶受到不可逆的破坏。在不同pH值的缓冲溶液中测定邻苯二酚1,2-双加氧酶的活力,结果如图 6-A所示,随着pH值增加,邻苯二酚1,2-双加氧酶的酶活也随之增高,在pH值为8.0时,Tust-DM21粗酶液的酶活达到最高为3.56 U。当pH值继续增加时,邻苯二酚1,2-双加氧酶的活性随之降低,降低到1.16 U,所以在pH值5.0-10.0范围内,粗酶液的最佳pH值为8.0。
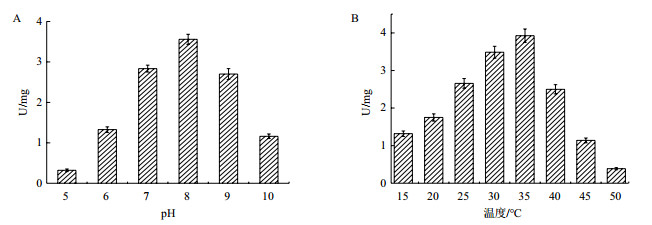
|
| 图 6 pH值(A)、温度(B)对酶活的影响 |
温度是影响酶活力的另一个重要因素,温度过高蛋白酶易变性从而导致酶失活,温度较低时酶活性不高。分别在不同温度下测定粗酶液的酶活力,结果如图 6-B所示,在15-35℃范围内,随着温度升高,邻苯二酚1,2-双加氧酶的活力也逐渐增加,在35℃时达到最大为3.93 U,当温度继续升高时,粗酶液的酶活力逐渐降低到0.39 U,所以邻苯二酚1,2-双加氧酶在35℃时酶活力最高。
2.3.2 粗酶反应动力学的测定固定酶的加入量,分别测定不同邻苯二酚浓度(50-300 μmol/L)的降解速率,依据底物浓度和相应的酶促反应速率作Lineweaver-Burk双倒数图,如图 7所示,得到该酶作用于邻苯二酚的米氏常数为25.68 μmol/L,最大反应速度为0.13 mol/(L·min)。米氏常数的大小反映酶和底物的亲和程度,值越小说明酶和底物的亲和力越好。本实验测定的米氏常数为25.68 μmol/L,说明该酶与底物有较好的亲和力。
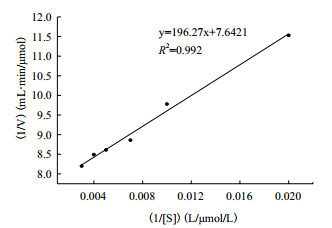
|
| 图 7 邻苯二酚1,2-双加氧酶酶促反应动力学 |
苯甲酸钠1,2-双加氧酶酶活测定如图 8,随着反应时间的加长,粗酶液在340 nm下的吸收值不断减小,在15 min内NADH吸光度的变化值为0.42,说明反应体系中的NADH不断被苯甲酸1,2-双加氧酶氧化。

|
| 图 8 苯甲酸钠1,2-双加氧酶酶活测定 |
邻苯二酚作为一种常见环境激素化合物,具有易富集、难降解的特点,且毒性比苯酚大,同时其毒性能够通过食物链进行传递和放大,对水生生物如水蚤、鲑鱼等产生毒害作用,破坏海洋生态环境。雷忻等[14]研究发现,邻苯二酚在48 h内对模式生物泥鳅的半致死浓度为96.74 mg/L,并且当邻苯二酚在泥鳅体内聚集浓度越大,其毒性也会随之增强。环境中邻苯二酚的污染日益严重,而微生物修复作为一种经济有效的去除有机污染物的手段,成为目前最具有潜力的治理方式[15]。如张云波等[16]分离到一株石油烃降解菌JZ3-21,该菌株在接种量为1%时,30 d内对1 000 mg/L的邻苯二酚降解率达80.9%,其接种量小、底物浓度大,使菌株生长延滞期延长,在第5-10天时菌株生长才进入对数期,在第15天时菌株对邻苯二酚的降解率仅有50%左右。而本研究所用菌株Tust-DM21在底物浓度为700 mg/L,接种量为3%时,菌株的延滞期很短仅有12 h左右,12 h后菌株进入对数生长期,在24 h时进入稳定期,同时降解率也达到最高为90%。说明菌株Tust-DM21具有高效性,能够在较短时间内降解邻苯二酚,并且降解率高达94.8%。Bastos等[17]分离到的酵母菌可降解浓度为1 500 mg/L苯酚。胡忠等[18]从海洋分离出的苯酚降解菌能耐受浓度为1 500 mg/L的苯酚,在3 d内降解率高达95%以上。程珂珂等[9]分离纯化出一株邻苯二酚降解菌,并且能耐受浓度为600 mg/L的邻苯二酚,当邻苯二酚浓度为400 mg/L时,菌株在3 d内对邻苯二酚的降解率仅有45%左右。本菌株最大能够耐受700 mg/L的邻苯二酚,当浓度在700 mg/L以下时,菌株在2 d内对邻苯二酚的降解率高达90%以上,与已经报道的菌株相比,该菌对邻苯二酚耐受浓度为700 mg/L,菌株对邻苯二酚适应性较差,这可能是由于该菌株是从渤海湾海洋石油勘探船废油收集区分离纯化出来,并非专门的酚类物质降解菌,因此耐受性较差。此外,石油中成分复杂含有烷烃、芳香烃及多环芳烃等物质,菌株对这些物质的难易降解程度为烷烃>芳香烃>多环芳烃,因此菌株会优先利用烷烃物质来进行自身的生长代谢,在进一步利用难降解的芳香烃,这也可能导致菌株对邻苯二酚的适应性较差。但本菌株除了具有高效降解石油的能力,如对烷烃的降解率高达98%,对环烃和芳香烃的降解率高达88%[8],也能高效降解邻苯二酚和苯甲酸钠,其降解底物范围广才是本菌株的主要特性。
苯甲酸钠广泛应用于化工、食品和医药工业等领域,是一种常见的环境污染物。对一般微生物的最小抑菌浓度范围为0.05%-0.1%,其毒性作用主要表现在:损害神经系统;可致机体癌变(如苯甲酸钠可以使染色体发生断裂从而使机体癌变);破坏细胞结构等。目前已经报道多种细菌能够降解苯甲酸,如盐单胞菌属、假单胞菌属、不动杆菌属、红假单胞菌属和无色杆菌属[19-23]等。蔡宝立等[24]分离出的不动杆菌BJ1菌株能降解1 000 mg/L苯甲酸钠,降解率达98%以上。方艳芬等[25]筛选的菌株LS01能够耐受浓度为6 000 mg/L的苯甲酸钠,当浓度不超过3 000 mg/L时,降解率能达到80%以上。苗艳芳等[26]分离筛选出来的菌株BJS3对苯甲酸的最大耐受浓度为6 000 mg/L,在苯甲酸浓度为3 000 mg/L时,菌株对苯甲酸的降解率仅有65%左右;当其浓度小于2 000 mg/L时,降解率高达80%以上。本实验室保存的菌株Tust-DM21已鉴定为不动杆菌属[27],其对苯甲酸钠的耐受浓度为4 500 mg/L,但当其浓度小于2 500 mg/L时,该菌株对苯甲酸钠的降解率优于蔡宝立、苗艳芳等分离纯化出来的菌株,其降解率高达95%以上。菌株Tust-DM21对邻苯二酚、苯甲酸钠的降解特性研究表明,其对邻苯二酚、苯甲酸钠的最高降解率可达90%以上,其中邻苯二酚的降解率最高达94.8%,苯甲酸钠的降解率最高达97.6%。因此降解菌谱广,降解能力高是该菌的主要特点。虽然菌株对邻苯二酚、苯甲酸钠的耐受浓度相对较低,但其对底物的适应范围很广,因此可以尝试将该菌株与其他菌株混合,利用微生物之间的相互促进关系进行环境修复,以达到高效降解污染物的目的,弥补该菌株对邻苯二酚、苯甲酸钠耐受性差的缺点。该菌株可处理含酚、苯甲酸钠废水和被石油污染海洋,具有良好的应用前景。
正交试验因其能够快速找到最优的试验方案,而备受科研工作者的青睐。本试验在做完单因素分析后,发现菌株在各个因素的最佳条件下其降解率在36 h内最高能分别达到94.8%、97.6%,具有较高的降解效果,因此通过正交试验探寻菌株降解邻苯二酚、苯甲酸钠的最优条件以及降解率增加的空间已不大,出于成本考虑并未进行正交试验。
本试验所用的菌株Tust-DM21已完成基因组测序,发现含有邻苯二酚1,2-双加氧酶和苯甲酸1,2-双加氧酶[27],有较高的酶活。其中邻苯二酚代谢途径可能是先通过邻苯二酚1,2-双加氧酶邻位途径开环形成乙酰辅酶A和琥珀酰辅酶A[28],再进入TCA循环。而苯甲酸钠在其苯甲酸1,2-双加氧酶的作用下先生成中间产物龙胆酸(2,5-Dihydroxy benzoic acid,DHB),然后在DHB脱氢酶的作用下在生成邻苯二酚[29-30],然后经邻位开环形成乙酰辅酶A和琥珀酰辅酶A进入TCA循环中。C12O在苯甲酸钠和邻苯二酚这两个降解途径中都发挥了重要作用,因此本研究只需测定C12O的米氏常数,Km的测定多以纯酶为主[31],但也有相关文献用粗酶液测定Km,如艾芳芳等[32]测定粗酶液中C13O的Km为10.93 μmol/L。本研究测定菌株Tust-DM21的C12O为胞内酶,其米氏常数为25.68 μmol/L,说明酶和底物的亲和性较好,酶促反应容易进行。
4 结论本实验室分离纯化出来的菌株Tust-DM21能够高效的降解邻苯二酚和苯甲酸钠,可以耐受700 mg/L的邻苯二酚和4 500 mg/L的苯甲酸钠。菌株降解邻苯二酚的最佳条件为:接种量5%、pH6.0、温度35℃,在24 h内对600 mg/L邻苯二酚降解率达92%以上。菌株降解苯甲酸钠的最佳条件为接种量3%、pH8.0、温度35℃,在24 h内对1 500 mg/L苯甲酸钠的降解率达95%以上。通过测定邻苯二酚1,2-双加氧酶酶活,确定该酶的最适pH为8.0,最适温度为35℃,其动力学参数为Km=25.68 μmol/L,Vmax=0.131 mol/(L·min)。
| [1] |
沈齐英, 刘录, 申林波. 紫外线诱变选育高效降酚微生物[J]. 环境科学与技术, 2004, 27(1): 82-84. DOI:10.3969/j.issn.1003-6504.2004.01.036 |
| [2] |
Chen H, Yao J, Wang F, et al. Toxicity of three phenolic compounds and their mixtures on the gram-positive bacteria Bacillus subtilis in the aquatic environment[J]. Sci Total Environ, 2009, 5: 1043-1049. |
| [3] |
Li XY, Cui YH, Feng YJ, et al. Pathways and mechanisms of the electrochemical degradation of phenol on different electrodes[J]. Water Research, 2005, 39(10): 1972-1981. DOI:10.1016/j.watres.2005.02.021 |
| [4] |
蒋展鹏. 环境工程学[M]. 第2版. 北京: 高等教育出版社, 2005: 188-194.
|
| [5] |
OlsenR H, Kukor JJ, Kaphammer B. A novel toluene-3-monooxygenase pathway cloned from Pseudomonas pickettii PKO1[J]. Journal of Bacteriology, 1994, 176(12): 3749-3756. DOI:10.1128/jb.176.12.3749-3756.1994 |
| [6] |
牟悦.苯甲酸钠毒性作用的分子水平研究[D].济南: 山东大学, 2012.
|
| [7] |
罗红君, 王绪远, 赵骞, 等. 石油污染土壤生物修复技术的研究进展[J]. 四川环境, 2007, 26(3): 104-109. DOI:10.3969/j.issn.1001-3644.2007.03.027 |
| [8] |
邸富荣, 宋东辉, 刘凤路, 等. 分离海洋不动杆菌及其对石油烃降解性能研究[J]. 海洋环境科学, 2017, 36(6): 898-904. |
| [9] |
程珂珂, 刘雯, 卫亚红. 邻苯二酚降解菌筛选及其降解特性[J]. 中国农学通报, 2014, 30(26): 165-169. DOI:10.11924/j.issn.1000-6850.2013-3061 |
| [10] |
毛宁薛, 泉宏, 唐明. 2株放线菌对土壤中苯甲酸和对羟基苯甲酸的降解作用[J]. 西北农林科技大学学报:自然科学版, 2010, 38(5): 143-148. |
| [11] |
关晓燕.苯酚降解菌的分离鉴定及其特性研究[D].大连: 大连理工大学, 2008.
|
| [12] |
Sedmak JJ, EGrossberg S. Arapid, sensitive, and versatile assay for protein using Coomassie Brilliant Blue G[J]. Analytical Biochemistry, 1977, 79(1-2): 544-552. DOI:10.1016/0003-2697(77)90428-6 |
| [13] |
Yamaguchi M, Fujisawa H. Purification and characterization of an oxygenase component in benzoate1, 2-dioxygenase system from Pseudomonas arvilla C-1[J]. Biol Chem, 1990, 11: 5058-5063. |
| [14] |
雷忻, 陈超, 王文强, 等. 间苯二酚与邻苯二酚对泥鳅的急性毒性效应[J]. 西北农林科技大学学报, 2012(4): 175-179. |
| [15] |
吴凡, 刘调理. 石油污染土壤的生物修复研究进展[J]. 土壤, 2007(5): 701-707. DOI:10.3321/j.issn:0253-9829.2007.05.005 |
| [16] |
张云波, 吴伟林, 薛蓉蓉. 一株石油烃降解菌的筛选、鉴定及对石油烃模式物的降解特性研究[J]. 环境工程学报, 2011, 5(8): 1887-1892. |
| [17] |
Bastos AER, Moon DH, RossiA, et al. Salt-tolerant phenol-degradion microorganisms isolated from Amazonian soil samples[J]. Arch Microbiol, 2000, 174(5): 346-352. DOI:10.1007/s002030000216 |
| [18] |
胡忠, 等. 海洋苯酚降解菌Candida sp. P5的分离鉴定及其降解[J]. 应用与环境生物学报, 2007, 13(2): 243-246. DOI:10.3321/j.issn:1006-687X.2007.02.022 |
| [19] |
Oie CS I, Albaugh CE, Peyton BM. Benzoate and salicylate degradation by Halomonas campisalis, an alkaliphilic and moderately halophilic microorganism[J]. Water Research, 2007, 41(6): 1235-1242. DOI:10.1016/j.watres.2006.12.029 |
| [20] |
Parsek MR, Shinabarger DL, Rothmel RK, et al. Roles of CatR and cis, cismuconate in activation of the catBC operon, which is involved in benzoate degradation in Pseudomonas putida[J]. Journal of Bacteriology, 1992, 174(23): 7798-7806. DOI:10.1128/jb.174.23.7798-7806.1992 |
| [21] |
Kim SI, Song SY, Kim DI, et al. Proteomic analysis of the benzoate degradation pathway in Acinetobacter sp. KS-1[J]. Res Microbiol, 2003, 154(10): 697-703. DOI:10.1016/j.resmic.2003.09.003 |
| [22] |
Geissler JF, Harwood CS, Gibson J. Purification and properties of benzoatecoenzyme A ligase, a Rhodopseudomonas palustris enzyme involved in the anaerobic degradation of benzoate[J]. Journal of Bacteriology, 1988, 170(4): 1709-1714. DOI:10.1128/jb.170.4.1709-1714.1988 |
| [23] |
叶淑红, 等. 辽东湾北岸滨海湿地降解苯甲酸类化合物的微生物研究[J]. 海洋环境科学, 2005, 24(2): 47-50. DOI:10.3969/j.issn.1007-6336.2005.02.014 |
| [24] |
蔡宝立, 张富国, 张心平, 等. 苯甲酸类化合物的微生物降解研究[J]. 应用与环境生物学报, 1998, 4(3): 286-289. DOI:10.3321/j.issn:1006-687X.1998.03.019 |
| [25] |
方艳芬, 黄应平, 苏静, 等. 苯甲酸和苯胺的微生物降解研究[J]. 环境科学与技术, 2008, 31(4): 68-71. DOI:10.3969/j.issn.1003-6504.2008.04.019 |
| [26] |
苗艳芳, 王忠彦, 胡承, 等. 防腐剂—苯甲酸的微生物降解研究[J]. 酿酒, 2003, 30(2): 21-23. DOI:10.3969/j.issn.1002-8110.2003.02.010 |
| [27] |
邸富荣.渤海石油烃降解菌的分离鉴定及基因组学分析[D].天津: 天津科技大学, 2016.
|
| [28] |
Arai H, Akahira S, Ohishi T, et al. Adaptation of Comamonas testosteroni TA441 to utilize phenol:organization and regulation of the genes involved in phenol degradation[J]. Microbiol, 1998, 10: 2895-2903. |
| [29] |
Ame F, Lindley ND. Flux limitations in the ortho pathway of benzoate degradation of Alcaligenes eutrophus:metabolite overflow and induction of the meta pathway at high substrate concentrations[J]. Microbiology, 1996, 142(7): 1807-1817. DOI:10.1099/13500872-142-7-1807 |
| [30] |
Neidle EL, et al. Nucleotide sequences of the Acinetobacter calcoaceticus benABC genes for benzoate 1, 2-dioxygenase reveal evolutionary relationships amomg multicomponent oxygenases[J]. J Bateriol, 1991, 173(17): 5385-5395. |
| [31] |
邓梦, 杨正凤, 黄遵锡, 等. 粪便微生物宏基因组来源的热稳定性邻苯二酚1, 2-双加氧酶异源表达及酶学性质[J]. 微生物学通报, 2016, 36(2): 1947-1957. |
| [32] |
艾芳芳, 曲媛媛, 周集体, 等. 菲降解菌株的分离鉴定及降解特性研究[J]. 环境科学, 2008, 29(4): 1065-1071. |




