2. 中国水产科学研究院,北京 100141;
3. 中国农业科学院农业资源与农业区划研究所,北京 100081;
4. 巴彦淖尔市第一中学,巴彦淖尔 015002
2. Chinese Academy of Fishery Sciences, Beijing 100141;
3. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081;
4. Bayannaoer No. 1 Middle School, Bayannaoer 015002
孔雀石绿是一种常见的三苯甲烷类染料,广泛的运用在纺织印染工业中,又由于其对鱼类水霉病等病害具有良好控制效果,在我国的水产养殖业中曾长期作为渔药使用[1-2]。20世纪70年代以来,大量的报道证实孔雀石绿具有潜在的致畸、致癌和致突变作用,在水产品中的残留会对人体健康构成威胁。鉴于孔雀石绿的危害性,我国明确将孔雀石绿列为禁用药[3-4]。但由于价格低廉、杀菌效果好等原因,仍有少量不法商贩使用。加之孔雀石绿在自然环境中残留期长、不易降解,因此,开发一种孔雀石绿高效降解方法具有十分重要的意义[5]。
微生物降解是目前公认的处理难降解有机物最有效的办法之一,也被证实是处理孔雀石绿污染的有效方式。房桂华等[6]分离到一株能以孔雀石绿为唯一碳源进行生长的菌株Arthrobacter sp.M6.该菌12 h内对20 mg/L的孔雀石绿降解率高于80%。梅嬛等[7]报道了一株孔雀石绿降解菌Raoultella sp. K4-W在48 h内对20 mg/L的孔雀石绿降解率为82.5%。吴永利等[8]研究报道在LB培养基中,菌株Pseudomonas sp. KL-1在6 h内,可以使100 mg/L的孔雀石绿几乎完全脱色,降解最适温度为30℃,菌株在pH为7-14范围能很好地降解孔雀石绿,脱色率均能达到72%以上。综上所述,目前已有一些高效孔雀石绿降解菌,但高降解率均是在LB培养基中实现的,LB培养基碳氮源丰富,无法代表菌株的实际降解效果。为了进一步分离到高效降解菌,本研究采用未培养结合可培养筛选的方法,以期获得以孔雀石绿为唯一碳源的高效的孔雀石绿降解菌,为该类化合物在环境中的修复提供优良的微生物资源。
1 材料与方法 1.1 材料 1.1.1 样品采集供试样品采自浙江省杭州市某化工厂废水处理池的活性污泥,采集后装入无菌样品瓶中带回实验室,用于孔雀石绿降解菌的分离。
1.1.2 主要试剂供试孔雀石绿标准品购自Sigma-Aldrich,纯度为≥98.5%;甲醇和乙腈等为色谱纯,购自赛默飞世尔公司。实验用水为高纯水与蒸馏水。
1.1.3 培养基MSM培养基(g/L):K2HPO4 1.5,KH2PO4 0.5,NH4Cl 1,NaCl 1,MgSO4·7H2O 0.2,pH 7。Luria-Bertani LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,pH 7.2。
1.2 方法 1.2.1 降解菌群的富集将10 g活性泥样品加入乘有100 mL的无机盐培养基的三角瓶中,以100 mg/L孔雀石绿为唯一碳源,在转速150 r/min,30℃摇床上振荡30 min培养7 d,后按10%(V/W)接入新鲜无机盐培养基,并调整孔雀石绿浓度至200 mg/L,连续传代直至富集物中的孔雀石绿浓度达到300 mg/L,将每个代次的富集培养物分别命名为JW1、JW2和JW3[9]。
1.2.2 富集培养物微生物群落组成和区系变化分析对活性污泥样品和3个代次的富集培养物进行了总DNA提取,方法参照MOBIO Power Soil土壤总DNA试剂盒说明书步骤进行。采用16S rRNA V4-V5区通用引物515F(5'-GTGCCAGCMGCCGCGGTAA-3'),806R(5'-GGACTACHVGGGTWTCTAAT-3')对总DNA进行了扩增。PCR体系(50 μL)为:上下游引物(10 mmol)各2 μL,DNA(20 ng/μL)3 μL,2×Premix Taq 25 μL,Nuclease-free water 20 μL。PCR反应条件:94℃ 5 min;94℃ 30 s,52℃ 30 s,72℃ 40 s,共25个循环;72℃ 10 min;4℃终止。PCR产物纯化回收后,采用DNA Library Prep Kit for Illumina(NEB)进行文库构建,后交(美格基因科技公司)对构建的扩增子文库进行PE2500测序。获得测序结果后进行运算分类单位(Operational taxonomic units,OTU)物种注释,从而得到每个样品的群落组成信息,结合物种丰度信息,通过PCoA、NMDS等排序分析,比较不同样品和分组的群落结构差异。
1.2.3 孔雀石绿降解菌的分离根据富集培养高通量测序获得的菌种信息,选择第三代富集样品进行稀释涂布于含有50 mg/L孔雀石绿的MSM固体平板上,挑选形态不一样的菌落进行划线,并且以同样的平板多次划线纯化。
1.2.4 孔雀石绿降解菌的初步鉴定采用细菌基因组提取试剂盒(Omega)提取菌株的基因组DNA,并以此为PCR扩增模板,采用细菌16S rRNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3'),1492R(5'-ACGGHTACCTTGTTTACGACTT-3')进行扩增。PCR扩增体系(25 μL)为:上下引物各0.5 μL,模板2 μL,Taq PCR Mix12.5 μL,ddH2O 9.5 μL。PCR反应条件:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s,共30个循环;72℃延伸5 min。1.0%的琼脂糖凝胶电泳检测,预计产物大小为1 500 bp左右。将PCR产物送于博迈德有限公司进行测序。
1.2.5 孔雀石绿降解菌的能力测定将分离到的菌株接种于MSM培养基中,于30℃、150 r/min的恒温振荡器培养12-24 h后,将富集培养的菌液,在8 000 r/min的转速下离心6 min后,弃上清液,菌体用0.9% NaCl生理盐水,洗涤3次,以1%接种量加入含有50 mg/L孔雀石绿的MSM培养基中,研究降解菌对孔雀石绿的降解效果。检测采用高效液相色谱方法,具体检测条件为:色谱柱Eclipse Plus C18(4.6 mm×150 mm,5 μm);紫外波长600 nm;进样量20 μL;流动相:乙腈/乙酸铵缓冲溶液(85:15,V:V);流速0.6 mL/min,柱温35℃[10-11]。依据检测波长为600 nm处孔雀石绿的峰面积结果,通过标准曲线换算出培养液中孔雀石绿浓度,再根据降解率计算公式(降解率=(初始浓度-终浓度)/初始浓度×100%)计算降解能力[12]。
1.2.6 菌株生长量的测定通过可见分光光度计测定,以波长λ=600 nm处的吸光度表示,将培养好菌液离心后用无菌水洗涤1-2次,然后悬浮于等量的生理盐水中测定OD600nm值[13]。
1.2.7 降解特性研究设置不同温度(15、20、25、30、35、40和45),pH(4、5、6、7、8和9),不同接种量(1×107、2×107、3×107、5×107、8×107和10×107CFU/mL),研究不同条件对菌株JW3-6降解50 mg/L孔雀石绿能力的影响。
2 结果 2.1 孔雀石绿降解菌群多样性和区系变化分析经过连续传代2次,富集物中的孔雀石绿浓度达到了300 mg/L,将每个代次的富集培养物分别命名为JW1、JW2和JW3,污泥样品命名为JWY,分别提取了4个样品的总DNA并进行了16S rRNA V4-V5区扩增,运用Illumina Hiseq2500平台对构建的扩增子文库进行测序和OTU(Operational taxonomic units)物种注释。结果(图 1)表明JWY样品中的序列聚类到1 568个OTUs,属水平上菌群主要分属于Flavobacterium、Pseudomonas、Arenimo-nas、Methylotenera、Dechloromonas、Geobacter、La-brys,分别占总OTUs的27.37%、9.39%、4.7%、3.2%、1.64%、1.51%和0.16%(图 1)。经过1次传代的富集培养物JW1中序列聚类到967个OTUs。在属水平上菌群主要分属于Pseudomonas、Methylotenera、Methylobacillus、Acinetobacter和Labrys,分别占51.14%、33.17%、2.43%、1.46%和0.3%。2次传代样品JW2序列聚类到576个OTUs,在属水平上菌群主要分属于Pseudomonas、Labrys、Acinetobacter、Achromobacter和Cupriavidus,分别占总OTUs的54.7%、21.5%、10.4%、2.67%和1.6%。3次传代JW3样品78 458个16S rDNA序列聚类到396个OTUs。在属水平上,菌群主要分属于Pseudomonas、Labrys、Acinetobacter、Cupriavidus、Achromobacter、Mesorhizobium和Methylobacillus,分别占总OTUs的67.8%、14.6%、7.9%、2.7%、1.7%、0.09%和0.71%。
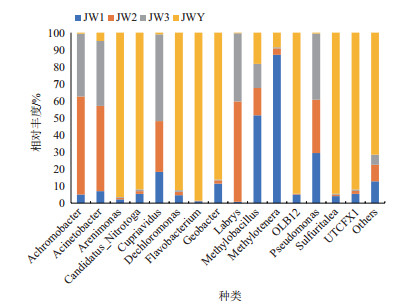
|
| 图 1 属水平物种相对丰度分布图 |
从结果(图 2)中可以看出,随着富集代次的增加和孔雀石绿浓度的提高,富集培养中的微生物多样性逐渐降低,从原始样品的1 568个OTUs降至396个,群落组成也发生了明显的变化。优势菌属从初始的Flavobacterium变为Pseudomonas,经2次传代后OTUs总数占比达67.8%,说明Pseudomonas菌属与孔雀石绿的降解密切相关,Flavobacterium菌属经1次传代后OTUs占比就降低至0.1%以下。而原本占总OTUs比仅为0.16%的Labrys,OTUs上升至14.6%,说明Labrys也是参与孔雀石绿降解的主要菌群。此外,Acinetobacter、Cupriavidus、Achromobacter菌属经2次传代后OTUs占比逐渐升高,也很可能与孔雀石绿的降解相关。
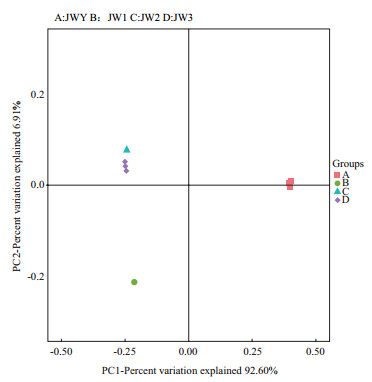
|
| 图 2 样品PCoA分析图 |
经连续划线纯化,从富集培养物JW3中分离到13株对孔雀石绿具有降解效果的菌株,其中JW3-6和JW3-5效果较好,降解率分别为91.2%和67.8%,显著高于其他菌株,最终选择降解效果最好的JW3-6进行后续研究。菌株JW3-6在LB平板上菌落呈乳白色,表面光滑,边缘整齐。在显微镜下,菌体形状为杆状,革兰氏染色阴性。将菌株JW3-6的16S rRNA基因序列提交GenBank数据库,序列登录号为MK494181,BLAST结果表明,JW3-6与Pseudomonas veronii 16S rRNA基因的相似性为99.69%,根据构建的系统发育树如图 3可以看出,菌株JW3-6与假单胞菌数的菌株汇聚在一起,因此初步将JW3-6鉴定为Pseudomonas veronii。

|
| 图 3 JW3-6 16S rRNA序列构建的系统发育进化树 |
菌株JW3-6能以孔雀石绿为唯一碳源生长,从降解实验的结果中可以看出,如图 4,孔雀石绿的降解率与菌株JW3-6的菌体浓度呈正相关,主要的降解发生在1-3 d,4 d后降解效率逐渐降低,菌体生长到达平稳期,经过7 d后,JW3-6对初始浓度为50 mg/L的孔雀石绿降解达到了91.2%。

|
| 图 4 孔雀石绿降解率与菌株JW3-6菌体浓度正相关图 |
从图 5中可以看出菌株JW3-6具有良好的温度适应范围,可以在15-45℃的区间内降解孔雀石绿,其中30℃降解效率最高,达到了92.3%,当温度为45℃时,降解率为42.2%。当温度降低至15℃时,降解率为50.2%。由此可见,菌株JW3-6具有较好的温度适应范围。
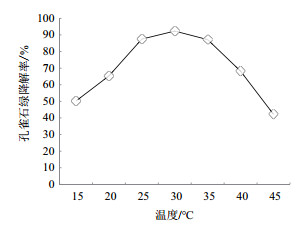
|
| 图 5 温度对JW3-6降解效率的影响 |
菌株JW3-6可以在pH为4-9的范围内降解孔雀石绿,如图 6所示,在pH为5-7的范围内降解效率均超过80%,pH为7时降解效率最高,为92.5%。菌株JW3-6在偏碱性的条件下降解效率较低,当pH升高至8时,降解效率即下降至65.5%,在pH为9时,降解效率为34.5%,说明菌株在偏酸性条件下降解效果较好。

|
| 图 6 pH对JW3-6降解效率的影响 |
研究了不同初始接种量对菌株降解孔雀石绿的影响,如图 7所示,初始接种量1-5×107 CFU/mL的范围内降解效率均超过80%,接种量为5×107CFU/mL时降解效率最高,为92.8%。菌株JW3-6在接种量增加的条件下降解效率无明显变化,当接种量增加为8×107 CFU/mL时降解效率为85%,10×107 CFU/mL时降解效率为76.5%。由此可见,初始接种量对菌株JW3-6降解孔雀石绿的影响较小。

|
| 图 7 接种量对JW3-6降解效率的影响 |
近年来,研究人员已从土壤、湖泊及废水处理池等各类环境样品中分离到可脱色或降解孔雀石绿的微生物,涉及细菌、放线菌及真菌中不同的属种。已报道的细菌和放线菌如库特氏菌属(Kurthia)[14]、芽孢杆菌属(Brevibacillus)[15]、肠杆菌属(Enterobacter)[16]、拉乌尔菌属(Raoultella)[17]及假单胞菌属(Pseudomonas)[18-19]。吴永利等[8]研究报道在LB培养基中,菌株Pseudomonas sp. KL-1在6 h内,可以使得100 mg/L的孔雀石绿几乎完全被脱色。Tao等[20]研究中筛选到Pseudomonas sp. YB2甚至能够将1 000 mg/L的孔雀石绿,12 h内完全降解脱色,但该2个菌株的降解率均是在LB培养基条件下实现的,在实际环境中很难达到同等效果。本研究以孔雀石绿为唯一碳源,在无机盐培养基当中筛选的JW3-6菌体可以对50 mg/L孔雀石绿的降解效率达到92.8%,为孔雀石绿污染环境的微生物修复提供了优良的菌株。
以往有关孔雀石绿降解菌的报道中,大多采用传统的分离筛选方法,通常对样品直接富集驯化和定向分离降解微生物,本研究结合未培养与可培养的方法,首先对样品进行高通量测序,获得样品当中主要的微生物组成信息,分析了不同代次孔雀石绿降解富集物中微生物群落变化发现,可能与孔雀石绿降解相关的菌株,如Labrys菌属原本占总OTUs升至14.6%,说明Labrys很可能参与了孔雀石绿降解;菌种Acinetobacter、Cupriavidus、Achromobacter在两次传代中OTUs占比呈升高趋势,推测也与孔雀石绿降解有关系。运用高通量测序的方法获得降解菌群群落组成,直接获得可能与降解孔雀石绿相关的微生物菌种,有目的地筛选,最终得到13株可能具有降解孔雀石绿高效的降解菌株,其中以假单胞菌降解效率最高,结合可培养的方式得到目的菌株JW3-6。此方法更具有高效性和针对性,为其他环境污染物降解过程中微生物分离提供参考。
4 结论通过高通量测序分析了不同代次孔雀石绿降解富集物中微生物群落变化,确定了优势菌群为假单胞菌,进一步分离到了高效孔雀石绿降解菌,经初步鉴定为Pseudomonas veronii JW3-6,7 d内对孔雀石绿降解效率最高为92.8%。通过单因素试验确定了该菌最适的降解条件为30℃,pH 7,初始接种量5.0×107 CFU/mL。
| [1] |
Singhal RN, Jeet S, Davies RW. Chemotherapy of six ectoparasitic diseases of cultured fish[J]. Aquaculture, 1986, 3: 165-171. |
| [2] |
Clifton-Hadley RS, Alderman DJ. The effects of malachite green upon proliferative kidney disease[J]. Journal of Fish Diseases, 1987, 10(2): 101-107. DOI:10.1111/j.1365-2761.1987.tb00725.x |
| [3] |
Culp SJ, Beland FA. Malachite green:A toxicological review[J]. Int J Toxicol, 1996, 15(3): 219-238. |
| [4] |
Srivastava S, Sinha R, Roy D. Toxicological effects of malachite green[J]. Aquat Toxicol, 2004, 66(3): 319-329. DOI:10.1016/j.aquatox.2003.09.008 |
| [5] |
宋金龙, 穆迎春, 阮志勇, 等. 微生物降解三苯甲烷类染料的研究进展[J]. 中国渔业质量与标准, 2017, 7(6): 10-16. DOI:10.3969/j.issn.2095-1833.2017.06.002 |
| [6] |
房桂华, 等. 孔雀石绿降解菌Arthrobacter sp. M6的分离及降解特性[J]. 应用与环境生物学报, 2010, 16(4): 581-584. |
| [7] |
梅嬛, 洪青, 李顺鹏. 一株孔雀石绿降解菌的分离鉴定及降解特性[J]. 应用与环境生物学报, 2010, 16(3): 390-393. |
| [8] |
吴永利.孔雀石绿降解菌株的分离鉴定、降解特性及其降解机制研究[D].合肥: 安徽建筑大学, 2017.
|
| [9] |
Reis PJ, Reis AC, Ricken B, et al. Biodegradation of sulfamethoxazole and other sulfonamides by Achromobacter denitrificans PR1[J]. J Hazard Mater, 2014, 280: 741-749. DOI:10.1016/j.jhazmat.2014.08.039 |
| [10] |
水产品中孔雀石绿和结晶紫残留量测定[S].GB/T19857-2005.
|
| [11] |
梅光明, 郭远明, 张小军, 等.水产养殖环境水体中孔雀石绿及其代谢含量检测方法: 中国, G01N30/02[P]. 2013-11-13.
|
| [12] |
Cheng W, Zeng BQ. Microbial decoloratiorization of malachite green[J]. Chin J Appl Environ Biol, 2009, 15(4): 370-373. |
| [13] |
Du LN, Wang S, Li G, et al. Biodegradation of malachite green by Pseudomonas sp. strain DY1 under aerobic condition:characteristics, degradation products, enzyme analysis and phytotoxicity[J]. Ecotoxicology, 2011, 20(2): 438-446. DOI:10.1007/s10646-011-0595-3 |
| [14] |
Sharma DK, Saini HS, Singh M, et al. Isolation and characterization of microorganisms capable of decolorizing various triphenylmethane dyes[J]. J Basic Microbiol, 2004, 44(1): 59-65. DOI:10.1002/jobm.200310334 |
| [15] |
Song J, Wang Y, Song Y, et al. Brevibacillus halotolerans sp. nov., isolated from saline soil sample collected from paddy field[J]. Int J Syst Evol Microbiol, 2017, 67(4): 772-777. DOI:10.1099/ijsem.0.001579 |
| [16] |
刘单单, 李春生, 杨贤庆, 等. 孔雀石绿降解菌Enterobacter sp. B-20的分离、鉴定和降解特性研究[J]. 南方水产科学, 2018, 14(1): 50-59. |
| [17] |
梅嬛.孔雀石绿降解菌的分离鉴定、生物学特性研究及三苯甲烷还原酶基因的克隆和表达[D].南京: 南京农业大学, 2010.
|
| [18] |
李联泰.孔雀石绿降解菌的分离筛选及其降解基因的克隆与表达[D].南京: 南京农业大学, 2009.
|
| [19] |
Khan SS, Arunarani A, Chandran P. Biodegradation of basic violet 3 and acid blue 93 by Pseudomonas putida[J]. Clean-Soil Air Water, 2015, 43(1): 67-72. DOI:10.1002/clen.201200676 |
| [20] |
Tao YB, Wang F, Meng LJ, et al. Biological decolorization and degradation of malachite green by Pseudomonas sp. YB2:Process optimization and biodegradation pathway[J]. Curr Microbiol, 2017, 74: 1210-1215. DOI:10.1007/s00284-017-1306-y |




