合理育苗可使所培育幼苗苗壮、根系发达、移栽不缓苗和生长快等而在农业生产中应用广泛。基质是决定育苗成功与否的关键因素。传统的育苗基质只起提供营养、保水和固定支撑等作用[1]。目前,我国育苗基质质量和水平还有待提高,而添加植物生长促生微生物可能是有效措施和途径之一[2]。但相关研究和实践较少。仅有的少量研究表明,添加植物根际促生细菌(Plant growth-promoting rhizobacteria,PGPR)—芽孢杆菌(如解淀粉芽孢杆菌SQR9)等可显著提高番茄等的育苗效果[2-4]。PGPR所包括的细菌类群很多[5],但除芽孢杆菌外其它类群的细菌尚未见用于植物育苗的研究报道。
马西利亚属(Massilia)是在1998年提出的一个新菌属,其模式菌株Massilia timonae为分离自人体血液的Massilia timonae CIP 105350T[6]。而近年来,从许多植物根际也发现了马西利亚属菌种,并且一些菌株在体外表现出与促进植物生长有关的特性,包括IAA的产生[7]、铁孢子的产生[8]和体外对疫霉菌[9]的拮抗作用。但目前对马西利亚菌在植物促生效果方面的研究还相对较少。本研究分离纯化得到的一株马西利亚属的菌株B260,具有多种植物促生性状,且固氮、解磷能力较强,可促进番茄、黄瓜、甘草和黄芪幼苗生长,旨为该菌用于育苗提供理论依据和奠定实践基础。
1 材料与方法 1.1 材料 1.1.1 根际土的采集、供试菌种及种子参考席娇[10]取样方法,采集巴拉贡地区沙冬青的根际土。菌株B260是分离自巴拉贡沙冬青根际的一株植物促生菌。
本研究所用番茄种子为西安市群星种业有限责任公司的上海908,黄瓜种子为山东省德州鲁德种业有限公司的津春四号以及购置于民勤县花果山农林工程有限公司的黄芪和甘草。
1.1.2 主要试剂和仪器及培养基DL2000 DNA Marker、SYBR GreenⅠ荧光染料(北京全式金生物技术有限公司),常规化学试剂均为国产分析纯(国药集团化学试剂有限公司),全自动高温高压灭菌锅(日本Tomy Kogyo Co. Ltd.),生物安全柜(苏州安泰空气技术有限公司),MGC-350BP-2型光照培养箱(上海今有实验设备有限公司),GQ-75RZ型高速管式离心机(辽阳鑫阳光液体分离设备有限公司),Synergy-H4型酶标仪(美国伯腾仪器有限公司)。
无机磷培养基、有机磷(植酸磷)培养基及Ashby培养基[11],DF培养基及ADF培养基、R2A培养基、LB培养基[12]。
改良PVK培养基(g/L):葡萄糖10.0,磷酸钙5.0,硫酸铵0.5,氯化钠0.2,七水合硫酸镁0.1,氯化钾0.2,酵母粉0.5,一水合硫酸锰0.002,七水合硫酸亚铁0.002,0.4%溴酚蓝(pH 6.7)6.0,pH 7.0-7.2。
1.1.3 育苗基质育苗基质的基本组分含秸秆、黏土、磷钾矿粉、营养土,其重量比为30:12:1:15,其中磷钾矿粉为磷矿粉和钾矿粉等重量比混合物。
1.2 方法 1.2.1 根际促生细菌的分离纯化及培养称取1 g根际土壤放入装有99 mL无菌水的三角瓶中,28℃,180 r/min,振荡30 min,静置15 min。吸取上述悬液1 mL,用无菌水稀释,制备10-1-10-5五个梯度稀释液,将稀释液接种涂布于固氮和无机磷固体培养基,划线至无杂菌,选择能力较强的B260用于后续研究。B260液体培养用1/2 R2A,于温度37℃和转速150 r/min下振荡培养36 h。
1.2.2 16S rRNA基因扩增与系统进化分析将菌株活化后提取细菌总DNA为模板,27F(5'-AGAGTTTGATCATGGCTCAG-3')和1492R(5'-TACGGTTACCTTGTTACGACTT-3')为引物,扩增体系和条件参考杨鸿儒[13]扩增16S rRNA基因。PCR产物送生工生物工程(上海)股份有限公司纯化及测序。在Ez-Taxon(http://www.ezbiocloud.net/eztaxon)数据库中与模式菌株进行同源性比对,确定其种属;之后基于Neighbor-Joining法,利用MEGA 7.0软件中相关模块、以默认参数构建系统发育树。B260的16S rRNA基因登录号为MN173846。
1.2.3 PGPR菌株的基本促生能力分析参考杨鸿儒等[13]对菌株固氮能力、解植酸磷(有机磷)能力、解无机磷能力及产铁载体能力进行分析;参考Glickmann等[14]对菌株产IAA能力进行分析;参考Penrose等[15]对菌株ACC脱氨酶活性进行分析。
1.2.4 育苗及实验设置将已灭菌的育苗基质装至距离市售聚苯乙烯育苗盘(规格:穴数50,高4.5 cm,上边长18 cm,下边长8 cm)穴檐1 cm处;挑选完整饱满种子进行春化诱导后播种,之后覆盖基质约1 cm;设2个处理,即添加菌株B260的pB260以及不添加菌的CK,每组处理5个生物学重复;以10 000×g离心力离心B260培养液,对离心所得沉淀物以蒸馏水重悬、再离心进行洗涤,反复3次,最后再以蒸馏水重悬,菌液浓度106 CFU/mL;pB260处理中的育苗穴在播种后每穴浇30 mL重悬菌液,对照CK浇等体积的蒸馏水;将育苗盘置于光照培养架上培养至30 d,期间适当浇灌蒸馏水,使基质处于湿润状态。
1.2.5 幼苗生长性状测定 1.2.5.1 发芽率、株高、根长的测定植物在育苗盘出苗生长至30 d,记录发芽数,计算发芽率。将植株挖出,并将所有幼苗洗净擦干后,平铺于水平台上,用刻度尺量出幼苗的长度,再用镊子将植株根系拉直,测定主根长度,并做记录。
1.2.5.2 生物量的测定将植株表面泥土去除、洗净、用滤纸将水吸干,测其鲜重生物量;再用信封将其包装,置于烘箱,在80℃下烘48 h至恒重,用电子天平测其干重生物量,并做记录。
1.2.5.3 叶绿素含量的测定选取植物顶叶至倒四叶,去除叶脉,混匀后剪碎,称取0.2 g放入25 mL具塞比色管中,25℃避光培养,且多次摇动,待叶片全部变白即可测定,以提取液为空白对照,用分光光度计测定OD663和OD645,重复3次。计算公式为:叶绿素含量(mg/g)=(20.29×OD645+8.05×OD663)×5/40。
1.2.6 数据处理利用Microsoft Excel 2013进行数据处理及图表绘制,采用单因素方差分析[16](One-Way ANOVA)和新复极差法进行多重比较(P < 0.05)。
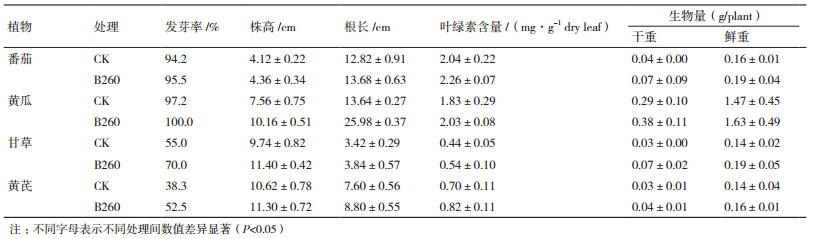
2 结果 2.1 16S rRNA基因序列的系统发育进化树构建测序所得B260的16S rRNA的基因序列长度为1 222 bp,经Ez-Taxon分析表明,该序列与现有模式菌株Massilia plicata 76T的相似性最高,为99.85%。系统发育分析结果(图 1)也表明,B260与M. plicata 76T菌株亲缘关系最近,且其在进化树上与Massilia属模式种处于同一进化支,说明该菌株属于Massilia属。
|
| 括号中的序号代表序列GenBank登录号;分支点处仅显示大于80%的节点值(1 000次重复抽样的百分比);0.005标尺代表序列间分歧度 图 1 B260基于16S rRNA基因的系统发育进化树 |
菌株B260的适宜生长温度为32℃、适宜生长pH 6.0,适宜生长盐度为3%。其还具有固氮、解磷(无机磷-解磷酸钙和有机磷-植酸磷)、产IAA、产ACC脱氨酶和产铁载体的植物促生性状,且固氮和解解无机磷能力较强,而其它能力相对较弱(表 1)。
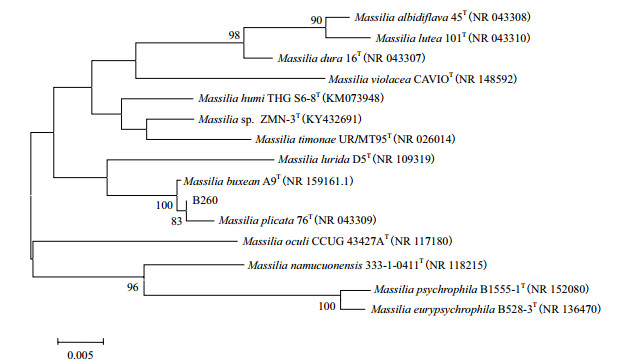
直接观察从育苗盘穴挖出的幼苗形态发现,添加菌株B260的处理pB260相比不添加的处理CK的幼苗更大、更壮,特别是明显促进了番茄和黄瓜幼苗根系的发育。而更发达的根系将育苗基质缠绕得更加紧实、这有利于移苗过程中苗块形态和水分的保持,生长促进效果最为突出(图 2和图 3)。

|
| 图 2 B260处理下黄瓜的育苗形态 |
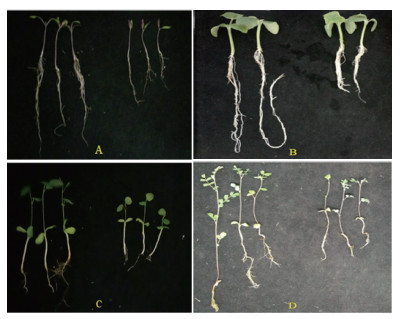
|
| 图中A、B、C和D分别代表番茄、黄瓜、甘草和黄芪的幼苗生长状态,且每图中左和右部分的幼苗分别对于处理B260和CK 图 3 四种植物幼苗生长性状 |
育苗30 d后,pB260较CK处理下的番茄、黄瓜、甘草及黄芪的生长性状均有不同程度的提高。其中,发芽率提高最大的为黄芪(37.08%)、其次为甘草(27.27%);株高提高最大为黄瓜(34.39%)、其次为甘草(17.04%);根长增长最大的为黄瓜(90.47%);叶绿素含量提高最大为甘草(22.73%)、其次为黄芪(14.29%);整株干重提高最大为甘草(133.33%)、其次为番茄(75.00%);整株鲜重提高最大也为甘草(35.71%)、其次为番茄(18.75%)(表 2)。
而且B260对番茄和黄瓜的根系形态影响显著,图 3-A、3-B可见接种菌株的番茄和黄瓜根系发达,主根更长,而对照主根较短,表明这株菌对番茄和黄瓜根系的生长发育具有明显促进作用,可以作为番茄和黄瓜专用微生物肥料的首选菌种。
3 讨论培育健壮幼苗对实现作物早熟增产有重要作用[17]。近年来,育苗逐渐成为现代农业生产中一种使植物快速、稳定生长发育的技术。育苗基质支持着穴盘苗从种子萌发到幼苗移栽的生长过程,基质的优劣是育苗成败的基础和关键[18]。目前的育苗中,大多是使用草炭作为基质的主要成分,其育苗效果较好,但其来源匮乏且不可再生。因此,选取更好的、取材更易的基质来减少草炭使用成为未来育苗的必经之路。任志雨等[19]研究说明,在育苗基质中加入蛭石或草炭可明显改善基质的理化性状。50%秸秆加50%蛭石或草炭处理的黄瓜幼苗的株高、鲜重和叶绿素含量均大于其它处理。而本研究中则以农业废弃物秸秆作为主要成份,以少量营养土和磷钾矿粉复配,有较好保水效果、成本低和容易操作等优点[20]。少量研究表明,基质中添加PGPR可促进育苗。PGPR是一种有益的、自由生活的土生细菌[21-22],PGPR通过生物固氮、植物激素的合成、养分的吸收以及提升寄主植物对生物、非生物胁迫的抗性来促进植物生长[23-24]。在育苗过程中加入植物促生微生物,可明显增加幼苗的成活率,降低土传病的危害。浩折霞[25]研究发现,将具有多种植物促生性状的优化功能菌组合HR69+QL-A6接入基质中,明显提高了番茄幼苗出苗率、植株地上部与地下部干重、根系活力,分别增加9%、47.9%、27.3%、28.7%,茎粗增加28%,使番茄幼苗具有更强的抗倒伏性和环境适应性。朱忠彬等[26]研究发现,短短芽孢杆菌(Brevibacillus brevis)DZQ3能显著促进烟草的生长。岳东霞[27]研究发现,假单胞菌CBT1、CBT6及CBT7对黄瓜枯萎病具有一定的防治效果。王娟等[28]表明,绿针假单胞菌(Pseudomonas chlororaphis)HG28-5浸种处理能显著提高黄瓜的出苗势,提高出苗整齐度;显著增加苗期黄瓜株高、根长、鲜重。梁建根等[29]研究表明,CH1短短芽孢杆菌(Brevibacillus brevis)与CH2枯草芽孢杆菌(Bacillus subtilis)都显著地提高了叶绿素的含量,从而间接地促进了黄瓜的生长。但是对于Massilia在植物促生方面的研究鲜见报道。本研究中菌株B260属于马西利亚菌,其具有多种植物促生性状,其具有的较强固氮和解磷能力可能为植物生长提供较充足的氮和磷营养供应。根长和根系干重的增加还可能与菌株合成IAA能力有关,有利于增加根表面积,有效促进根系的新陈代谢[30]。B260具有的产IAA等激素等性状,也明显促进了所研究植物根形态的建成。特别是甘草和黄芪作为药材,药用部分最主要为根。因此,根系的生长发育对育苗甚为重要[31-32],较好的根系形态有助于移苗成活和后期的生长发育。而存留于育苗基质“微环境”中的所添加的PGPR在移苗后还可能继续发挥植物促生功能和作用。总之,在育苗基质中添加诸如马西利亚菌或芽孢杆菌等PGPR从而促进育苗是可行的。
4 结论Massilia sp. B260具有多种植物促生能力,在育苗方面表现出良好的促生效果,这为未来开发、研究作为育苗基质用菌种提供了理论依据,并奠定了实践基础。
| [1] |
李恩良, 毛云玲, 周江, 等. 不同基质对长蕊甜菜成苗率的影响[J]. 西部林业科学, 2019, 48: 127-132. |
| [2] |
李静, 操一凡, 丁佳兴, 等. 含复合菌群生物育苗基质的研制及其育苗效果[J]. 南京农业大学学报, 2018, 41: 676-684. DOI:10.7685/jnau.201801009 |
| [3] |
文春燕, 高琦, 张杨, 等. 含PGPR菌株LZ-8生物育苗基质的研制与促生效应研究[J]. 土壤, 2016, 48: 414-417. |
| [4] |
张杨, 王甜甜, 孙玉涵, 等. 西瓜根际促生菌筛选及生物育苗基质研制[J]. 土壤学报, 2017, 54(3): 704-714. |
| [5] |
Siyar S, Inayat N, Hussain F. Plant growth promoting rhizobacteria and plants' improvement-a mini-review[J]. PSM Biological Research, 2019, 4: 1-5. |
| [6] |
Scola BL, Birtles RJ, Mallet MN, et al. Massilia timonae gen. nov. sp. nov. isolated from blood of an immunocompromised patient with cerebellar lesions[J]. Journal of Clinical Microbiology, 1998, 36(10): 2847-2852. |
| [7] |
Kuffner M, Maria SD, Puschenreiter M, et al. Culturable bacteria from Zn- and Cd-accumulating Salix caprea with differential effects on plant growth and heavy metal availability[J]. Journal of Applied Microbiology, 2010, 108(4): 1471-1484. DOI:10.1111/j.1365-2672.2010.04670.x |
| [8] |
Hrynkiewicz K, Baum C, Leinweber P. Density, metabolic activity, and identity of cultivable rhizosphere bacteria on Salix viminalis in disturbed arable and landfill soils[J]. Journal of Plant Nutrition and Soil Science, 2010, 173(5): 747-756. DOI:10.1002/jpln.200900286 |
| [9] |
Weinert N, Meincke R, Gottwald C, et al. Effects of genetically modified potatoes with increased zeaxanthin content on the abundance and diversity of rhizobacteria with in vitro antagonistic activity do not exceed natural variability among cultivars[J]. Plant and Soil, 2010, 326(1-2): 437-452. DOI:10.1007/s11104-009-0024-z |
| [10] |
席娇.荒漠植物的多功能PGPR的分离鉴定及其功能特性研究[D].呼和浩特: 内蒙古农业大学, 2017.
|
| [11] |
许芳芳.荒漠植物耐盐碱PGPR的分离筛选及其对盐胁迫下三种植物的促生效应和机理[D].呼和浩特: 内蒙古农业大学, 2017.
|
| [12] |
杨杉杉, 李国光, 张胜男, 等. 假单胞菌BP16的分离鉴定及其植物促生性状和效应[J]. 微生物学通报, 2018, 45(10): 2121-2130. |
| [13] |
杨鸿儒.西鄂尔多斯荒漠灌木根际细菌多样性和群落结构的研究[D].呼和浩特: 内蒙古农业大学, 2016.
|
| [14] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796. |
| [15] |
Penrose DM, Glick BR. Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria[J]. Physiologia Plantarum, 2003, 118(1): 10-15. DOI:10.1034/j.1399-3054.2003.00086.x |
| [16] |
Mutlu HT, Gökpinar F, Gökpinar E, et al. A new computational approach test for one-way ANOVA under heteroscedasticity[J]. Commun Stati-Theor M, 2016, 46: 16, 8236-8256. |
| [17] |
王洛彩.穴盘规格、基质供水状况和生长调节剂对番茄穴盘苗生育的影响[D].泰安: 山东农业大学, 2006.
|
| [18] |
葛婷婷, 李萍萍. 不同基质配比对温室黄瓜生长的影响[J]. 安徽农业科学, 2008(1): 184-185, 199. DOI:10.3969/j.issn.0517-6611.2008.01.069 |
| [19] |
任志雨, 宋艳娜. 秸秆基质的不同配比对黄瓜幼苗生长的影响[J]. 天津农业科学, 2007(4): 15-17. DOI:10.3969/j.issn.1006-6500.2007.04.005 |
| [20] |
冯福应, 唐凯, 梁允刚, 等.具促进植物生长功效的可降解育苗钵及其制备方法与应用[P].内蒙古: CN107242045A, 2017-10-13.
|
| [21] |
Patten CL, Glick BR. Role of Pseudomonas putida indoleacetic acid in development of the host plant root sstem[J]. Applied and Environmental Microbiology, 2002, 68(8): 3795-3801. DOI:10.1128/AEM.68.8.3795-3801.2002 |
| [22] |
Vessey JK. Plant growth promoting rhizobacteria as biofertilizers[J]. Plant Soil, 2003, 255: 571-586. DOI:10.1023/A:1026037216893 |
| [23] |
Kang SM, Joo GJ, Hamayun M., et al. Gibberellin production and phosphate solubilization by new lyisolated strain of Acinetobacter calcoaceticus and its effect on plant growth[J]. Biotechnol Lett, 2009, 31: 277-281. DOI:10.1007/s10529-008-9867-2 |
| [24] |
Richardson AE, Barea JM, McNeillb AM, et al. Acquisition of phosphorous nitrogen in the rhizosphere and plant growth promotion by microorganism[J]. Plant Soil, 2009, 321: 305-339. DOI:10.1007/s11104-009-9895-2 |
| [25] |
浩折霞.功能性复合微生物育苗基质的筛选与应用效果研究[D].南京: 南京农业大学, 2017.
|
| [26] |
朱忠彬, 吴秉奇, 丁延芹, 等. 短短芽孢杆菌DZQ3对烟草的促生及系统抗性诱导作用[J]. 中国烟草科学, 2012, 33(3): 92-96, 106. DOI:10.3969/j.issn.1007-5119.2012.03.019 |
| [27] |
岳东霞, 张要武. 番茄根际促生菌—假单胞菌的生防作用[J]. 华北农学报, 2009, 24(5): 210-213. |
| [28] |
王娟, 刘东平, 丁方丽, 等. 促植物生长根际细菌HG28-5对黄瓜苗期生长及根际土壤微生态的影响[J]. 中国蔬菜, 2016(8): 50-55. DOI:10.3969/j.issn.1000-6346.2016.08.011 |
| [29] |
粱建根, 张炳欣, 喻景权, 等. 植物根围促生细菌(PGPR)对黄瓜生长及生理生化特性的影响[J]. 浙江大学学报:农业与生命科学版, 2007, 33(2): 202-206. |
| [30] |
Vacheron J, Desbrosses G, Bouffaud ML, et al. Plant growth-promoting rhizobacteria and root system functioning[J]. Frontiers in Plant Science, 2013, 4: 356. |
| [31] |
韩文星, 姚拓, 梁启鹏, 等. PGPR菌肥对燕麦根系性状影响的研究[J]. 草原与草坪, 2008(4): 1-4. DOI:10.3969/j.issn.1009-5500.2008.04.001 |
| [32] |
席琳乔, 姚拓, 杨俊基, 等. 联合固氮菌株分泌能力及其对燕麦的促生效应测定[J]. 草原与草坪, 2005(4): 25-29. DOI:10.3969/j.issn.1009-5500.2005.04.005 |